INTRODUCCIÓN
La colitis ulcerosa y la enfermedad de Crohn se caracterizan por la aparición de ulceraciones en la mucosa intestinal junto a un prominente infiltrado inflamatorio, que en el caso de la enfermedad de Crohn puede ser transmural. Este infiltrado está compuesto por linfocitos, neutrófilos, macrófagos y células plasmáticas. El reconocimiento de que los leucocitos circulantes deben primeramente adherirse a las células endoteliales para después migrar hacia el foco inflamatorio y causar daño en la pared intestinal, ha conllevado un intenso esfuerzo para definir los factores que modulan las interacciones leucocito-endotelio. Uno de los principales focos de interés en este contexto ha sido la identificación y caracterización de las moléculas que permiten a los leucocitos adherirse a la pared vascular. El principal objetivo de esta revisión es el aná-
lisis de las moléculas que participan en el proceso de adhesión leucocito-endotelio y la consideración de los elementos moleculares y celulares implicados en esta interacción susceptibles de ser manipulados con una finalidad terapéutica en la enfermedad inflamatoria intestinal.
MOLÉCULAS DE ADHESIÓN
Tanto las moléculas de adhesión de la superficie endotelial como del leucocito participan en el establecimiento de una secuencia ordenada de interacciones que se establecen cuando el leucocito alcanza una vénula poscapilar, donde tiene lugar el proceso de adhesión leucocitaria. Inicialmente, se establece una interacción débil entre el leucocito y el endotelio que se manifiesta como un movimiento de rodamiento (rolling) del leucocito a lo largo de la pared venular. Una proporción de los leucocitos que establecen interacciones de rodamiento se adhieren firmemente a la pared venular, donde tiene lugar el proceso de migración si existe un estímulo quimiotáctico adecuado (fig. 1). Cada uno de los tres estadios del reclutamiento leucocitario, rodamiento, adhesión firme y emigración transendotelial, conlleva la participación de familias diferentes de moléculas de adhesión que incluyen las selectinas y sus ligandos, las integrinas y moléculas de la superfamilia de las inmunoglobulinas (tabla I).
Fig 1. Representación esquemática de la secuencia de interacciones leucocito-endotelio en el proceso de adhesión. Se ilustran también las moléculas de adhesión que participan en cada fase de estas interacciones (rodamiento, adhesión, emigración).
Selectinas
Las selectinas, designadas como L, P y E-selectina representan una familia de receptores expresados en los leucocitos (L), plaquetas y células endoteliales (P) o sólo en el endotelio (E)1. En contraste con las integrinas y con los miembros de la superfamilia de las inmunoglobulinas, la función de las selectinas se restringe únicamente al territorio vascular.
La L-selectina se expresa en los neutrófilos circulantes, monocitos y eosinófilos, y en la mayoría de linfocitos B y linfocitos T vírgenes. La L-selectina ha sido implicada en el proceso de adhesión de los neutrófilos con células endoteliales activadas, pero no con células endoteliales quiescentes, lo que indica que el ligando para L-selectina no se halla presente de forma constitutiva en las células endoteliales2. Las interacciones leucocito-endotelio dependientes de la L-selectina no requieren la activación de los leucocitos, ya que esta molécula se expresa constitutivamente. De hecho, la activación de los leucocitos por mediadores inflamatorios o citoquinas resulta en una disminución en la expresión de L-selectina en la membrana plasmática por desprendimiento (shedding) de esta mo-
lécula3.
La P-selectina se expresa en la superficie de las células endoteliales activadas y en plaquetas. Se almacena en los cuerpos de Weibel-Palade de las células endoteliales y en los gránulos alfa de las plaquetas. La molécula es movilizada en pocos minutos hacia la superficie celular en respuesta a la activación. Posteriormente, puede ser reciclada hacia el interior de la célula o se desprende y libera al plasma1. Las células endoteliales pueden también sintetizar P-selectina tras la estimulación con endotoxina o citoquinas, lo que resulta en un segundo pico de expresión a las 4-5 h de la estimulación4 (fig. 2).
Fig. 2. Cinética de expresión de las moléculas de adhesión endoteliales. A) El rápido incremento en la expresión de P-selectina es inducida por la unión de la histamina a los receptores H1 de las células endoteliales. La elevación más prolongada de la expresión de P-selectina y la expresión de E-selectina está inducida por la exposición a endotoxina. B) Expresión de ICAM-1, VCAM-1 y PECAM-1 tras la estimulación con TNF-*. (Tomada de Eppihimer et al4y Henninger et al28.)
En contraste con la P-selectina, la expresión de E-selectina se halla completamente bajo control transcripcional. La E-selectina no se expresa constitutivamente en las células endoteliales, su síntesis (y expresión) puede ser inducida por citoquinas como la interleuquina (IL)-1 o
el factor de necrosis tumoral (TNF)-*5. La expresión de E-selectina se detecta a las 2 h tras la estimulación con endotoxina y regresa a valores basales a las 8 h4 (fig. 2).
Ligandos de las selectinas
Se trata de una familia de moléculas de adhesión de tipo mucina que ha sido caracterizada recientemente1,6. Las mucinas son proteínas ricas en serina y treonina con un alto grado de O-glicosilación por carbohidratos sulfatados, que son los mediadores de la unión con los ligandos1. Estas proteínas altamente glicosiladas contienen los tetrasacáridos sLex, sLea, o sus formas sulfatadas que tienen actividad de ligando para las tres selectinas7.
Se han aislado dos ligandos de la L-selectina expresados en las células endoteliales: GlyCAM-1 y CD348,9. Un tercer receptor, la MAdCAM-1 (mucosal addresin cell adhesion molecule-1) tiene una función dual ya que también se une a las integrinas *410,11. Se han descrito dos ligandos de la P-selectina que corresponden a sialoproteínas expresadas en la superficie de los leucocitos: el ligando glicoproteico-1 de la P-selectina (PSGL-1)12 y un ligando de 120-kDa13. Se han aislado también ligandos específicos para la E-selectina14.
Integrinas
Las integrinas son proteínas heterodiméricas formadas por la unión no covalente de subunidades * y ß. Aunque se conocen 15 tipos de cadenas * y 8 ß, los leucocitos expresan 13 integrinas que pertenecen únicamente a las subfamilias ß1, ß2 y ß7. Las integrinas de la subfamilia
ß2 están formadas por una subunidad ß común (CD18) unida a una de tres posibles subunidades * designadas, CD11a, CD11b y CD11c. Aunque la expresión de las integrinas ß2 se halla restringida a los leucocitos, la dis tribución de las subclases de integrinas ß2 difiere en-
tre las distintas poblaciones leucocitarias. Los linfocitos periféricos expresan primariamente CD11a/CD18, mientras que los neutrófilos, monocitos y células natural killer expresan los tres tipos de integrinas ß2. La inte grina CD11a/CD18 interacciona con ICAM-1 (interce-
llular adhesion molecule-1) y con ICAM-215, mientras que CD11b/CD18 interacciona primordialmente con ICAM-1; el ligando de CD11c/CD18 no ha sido defi nido16.
Una segunda subfamilia de integrinas combina la cadena ß1 (CD29) con diversas subunidades *. La integrina *4ß1 (VLA-4) interviene en la adhesión de los linfocitos, monocitos, eosinófilos y células natural killer, con células endoteliales activadas17. Los ligandos de VLA-4 inclu-
yen VCAM-1 (vascular cell adhesion molecule-1)18, y componentes de la matriz extravascular como la fibro-
nectina19.
La subfamilia de las integrinas ß7 poseen una interesante función. El heterodímero *4ß7 se expresa en una subpoblación de linfocitos que colonizan el intestino y el tejido linfoide asociado a éste20. Este heterodímero reconoce el ligando endotelial expresado en tejidos del tracto digestivo MAdCAM-121. Además de unirse a MAdCAM-1 la integrina *4ß7 se une también a VCAM-122. Mientras que las interacciones de ß7 con MAdCAM-1 son esenciales para la recirculación de linfocitos en el tejido intestinal en condiciones normales, la unión ß7/VCAM-1 parece tener lugar sólo en condiciones de inflamación.
Superfamilia de las inmunoglobulinas
Este grupo de moléculas de adhesión está constituido por elementos que contienen múltiples dominios tipo inmunoglobulina. Cinco miembros de esta familia intervienen en las interacciones leucocito-endotelio: ICAM-1, ICAM-2, VCAM-1, MAdCAM-1 y PECAM-1 (platelet endothelial cell adhesion molecule-1).
ICAM-1 reconoce a CD11a/CD1823 y CD11b/CD1824. ICAM-1 se expresa en condiciones basales en leucocitos, fibroblastos, células epiteliales y células endoteliales. La activación del endotelio con citoquinas o LPS induce un aumento de expresión de ICAM-125, pero la magnitud
de este incremento varía en distintos territorios vascu lares26-28. Los órganos del tracto gastrointestinal presentan un marcado incremento en la expresión de ICAM-1 tras la estimulación con endotoxina o TNF-*, con un pico de expresión a las 5-9 h y un incremento mantenido más allá de las 24 h tras la estimulación (fig. 2)26,28. La importancia fisiológica del aumento de expresión de ICAM-1 ha quedado patente en diversos estudios que demuestran que dichos aumentos se asocian a valores máximos de adhesión de leucocitos al endotelio29.
ICAM-2 es una forma truncada de la molécula ICAM-130 que posee un lugar de unión para CD11a/CD18. Al igual que ICAM-1, ICAM-2 se expresa basalmente en las células endoteliales, pero la expresión de ICAM-2 no se modifica tras la estimulación del endotelio31. La afinidad de ICAM-2 para CD11a/CD18 es algo menor que la de ICAM-132.
VCAM-1 es un importante modulador de la circulación de linfocitos y monocitos. VCAM-1 es un ligando para las integrinas *4ß1 (VLA-4) y *4ß718,22. VCAM-1 no se expresa en las células endoteliales en condiciones basales, pero su expresión resulta estimulada por citoquinas o endotoxina28, con una cinética parecida a la de ICAM-1 (fig. 2).
La adresina mucosa MAdCAM-1 se expresa principalmente en venas endoteliales altas de las placas de Peyer, y en vénulas del intestino delgado y del colon33. MAdCAM-1 actúa como ligando para L-selectina y para la integrina *4ß7, las cuales se hallan implicadas en el reclutamiento fisiológico de linfocitos hacia las placas de Pe yer y hacia el tejido intestinal en el proceso de inflamación10,22.
PECAM-1 es un mediador de la adhesión de leucocitos y plaquetas a las células endoteliales e interviene también en el subsiguiente paso de migración de los leucocitos hacia el espacio intersticial34. Esta molécula de adhesión se expresa constitutivamente en plaquetas, leucocitos y células endoteliales, y el nivel de expresión no cambia de forma apreciable tras la estimulación con citoquinas35.
REGULACIÓN DE LA EXPRESIÓN DE MOLÉCULAS DE ADHESIÓN
La expresión inducible de genes es un importante mecanismo de regulación de la respuesta celular que requiere la participación de proteínas activadoras cuya unión al ADN y actividad transcripcional son inducidas por estímulos específicos. De los múltiples factores de transcripción que se han descrito, el factor nuclear kappa B (NF-*B) y la proteína de activación 1 (AP-1) desempeñan un papel especialmente relevante en la regulación de los genes implicados en la respuesta inflamatoria. Ambos factores corresponden a familias de polipéptidos con similar capacidad para unirse al ADN pero con distinto potencial transactivador.
El NF-*B es un factor inducible de las células eucariotas, compuesto por dos subunidades correspondientes a miembros de la familia Rel/NF-*B. En condiciones basales, los dímeros de NF-*B se hallan secuestrados en el citoplasma por la unión con proteínas inhibidoras de la clase I*B. Estas proteínas inhibidoras impiden el transporte de NF-*B hacia el núcleo y su unión al ADN. Los estímulos que activan NF-*B (p. ej., endotoxina, TNF-*) inducen una fosforilación de I*B y la conjugación de esta proteína con ubicuitina, que es subsiguientemente degradada por el proteasoma. Todo esto conduce a la liberación de NF-*B y su entrada en el núcleo donde activa la expresión génica36. Se ha observado que los fármacos inhibidores del proteasoma bloquean la degradación de I*B y la consecuente activación de NF-*B en respuesta a la estimulación con TNF-*.
AP-1 es otro factor de transcripción compuesto por homo y heterodímeros de los productos de los proto-oncogenes jun y fos37. La actividad AP-1 se induce en respuesta a muchos estímulos, incluyendo ésteres forbol (que activan la proteincinasa C), hormonas polipeptídicas, citoquinas y peróxido de hidrógeno38.
Se han identificado lugares de unión para NF-*B en la región promotora de los genes de E-selectina, VCAM-1 e ICAM-1. En la región promotora de esta última molécula se ha hallado también un lugar de unión para AP-1. Las mutaciones que disminuyen la unión de NF-*B a los elementos tienen como consecuencia un menor aumento de expresión de E-selectina en respuesta a la estimulaci ón con citoquinas, lo que sugiere que NF-*B desempeña un papel primordial en la inducción del gen de la E-selectina39. Se han hallado también dos elementos funcionales *B en la región promotora de MAdCAM-140. Recientemente, se ha demostrado que los inhibidores de la degradación de I*B por el proteasoma disminuyen la acumulación nuclear de NF-*B e inhiben la expresión de E-selectina, VCAM-1 e ICAM-1 en células endoteliales41. Esta inhibición tiene importantes consecuencias funcionales ya que los inhibidores del proteasoma también bloquean la adhesión de leucocitos a células endoteliales en cultivo.
La presencia de activación de NF-*B ha sido un hallazgo uniforme en diversos modelos experimentales de en fermedad inflamatoria intestinal, incluyendo la colitis inducida por TNBS, la colitis asociada a la deficiencia genética de IL-1042 y la colitis inducida por peptidoglicano/polisacárido43.
Asimismo, se ha demostrado activación de NF-*B en la enfermedad inflamatoria intestinal humana42,44-46. La activación de NF-*B se halla restringida a las áreas con inflamación activa, tanto en la enfermedad de Crohn como en la colitis ulcerosa44,46. En la enfermedad inflamatoria intestinal activa se ha demostrado que la activación de NF-kB se produce en células mononucleares de la lámina propia y en las células epiteliales44,45.
EXPRESIÓN DE MOLÉCULAS DE ADHESIÓN EN LA ENFERMEDAD INFLAMATORIA INTESTINAL
Estudios basados en inmunohistoquímica han demostrado un aumento de expresión de varias moléculas de adhesión endoteliales en tejido intestinal de pacientes con enfermedad inflamatoria intestinal activa. Sin embargo, no existe un acuerdo sobre cuál es este patrón de activación. Algunos estudios han hallado un aumento en la expresión de ICAM-1 y E-selectina47,48, mientras que otros han observado únicamente un incremento en la expresión de E-selectina, sin cambios en los valores de ICAM-1 en relación a los controles49,50. Estos hallazgos contradictorios pueden ser debidos a las limitaciones de la inmunohistoquímica para cuantificar la expresión de moléculas de adhesión. Otra evidencia que implica el incremento en la expresión de E-selectina en la patogenia de la EII se ha obtenido utilizando la gammagrafía; tras la inyección de un anticuerpo monoclonal anti-E-selectina marcado se observa una acumulación del trazador en las áreas con enfermedad activa51. Se ha documentado también un incremento en la expresión de P-selectina en vénulas y capilares de las áreas con inflamación en piezas de resección de pacientes con enfermedad de Crohn o colitis ulcerosa52.
La evaluación por inmunohistoquímica de la mucosa intestinal de pacientes con enfermedad inflamatoria ha demostrado que la expresión de VCAM-1 es similar a la de los controles47,49,50. Un reciente estudio ha demostrado también que la proporción de endotelio venular de la lámina propia que expresa MAdCAM-1 está aumentado en los focos inflamatorios de los pacientes con colitis ulcerosa o enfermedad de Crohn, en comparación con el tejido normal53. La existencia de una activación del endotelio en las áreas de inflamación intestinal en los pacientes con EII se ve confirmada en un estudio reciente que describe un marcado incremento de la capacidad del endotelio de las áreas de mucosa inflamada para inducir una adhesión de los leucocitos, en comparación con el endotelio de individuos normales54. Además, se ha demostrado que los sobrenadantes de los cultivos de mucosa intestinal de pacientes con colitis ulcerosa o enfermedad de Crohn inducen un incremento en la expresión de E-selectina e ICAM-1 de células endoteliales humanas en cultivo55.
Se ha considerado que los valores circulantes de las formas solubles de moléculas de adhesión reflejan el grado de expresión de proteína en la membrana de la célula endotelial, y por ello se han utilizado determinaciones de moléculas de adhesión solubles para monitorizar la actividad inflamatoria, sobre todo en estudios clínicos. En tres de estos estudios se han hallado concentraciones aumentadas de ICAM-1 soluble (sICAM-1) sVCAM-1 y sP-selectina en pacientes con colitis ulcerosa y en la enfermedad de Crohn56-58. En otro estudio se halló un incremento de las concentraciones de ICAM-1 sólo en pacientes con colitis ulcerosa, mientras que en la enfermedad de Crohn activa éstas fueron normales, al tiempo que la concentración plasmática de sVCAM-1 estaba significativamente aumentada59. Los resultados de las determinaciones de valores de sE-selectina han sido discrepantes, aumentados en unos estudios y normales en otros58,59. Recientemente, la utilidad de sICAM-1 como marcador sistémico de la expresión endotelial de ICAM-1 ha sido cuestionada en función de dos observaciones: a) tanto las células endoteliales humanas como murinas poseen ARNm que codifica específicamente sICAM-160,61, y b) la cinética de aparición y desaparición de sICAM-1 en plasma en respuesta a la administración de TNF-* difiere de la cinética de expresión de ICAM-1 en la célula endotelial del pulmón, intestino y otros órganos62.
Por lo que se refiere a las moléculas de adhesión leucocitarias, se ha hallado un aumento en la expresión de CD18 e ICAM-1 en monocitos periféricos de pacientes con enfermedad de Crohn, pero no en la colitis ulcerosa63. Las células mononucleares circulantes de los pacientes con enfermedad de Crohn forman agregados granulomatosos cuando se cultivan in vitro. La formación de estos agregados, que se correlaciona con el grado de actividad clínica, parece depender de la función de CD11b/CD18 e ICAM-164,65. Estudios inmunohistoquímicos de biopsias de mucosa intestinal han demostrado un marcado incremento en la expresión de integrinas ß266, con expresión de CD11a/CD18 en las células mononucleares y CD11b/ CD18 en los neutrófilos; se ha hallado también un incremento de ICAM-1 en los linfocitos, existiendo un paralelismo entre esta expresión y la intensidad de la inflamación48,67.
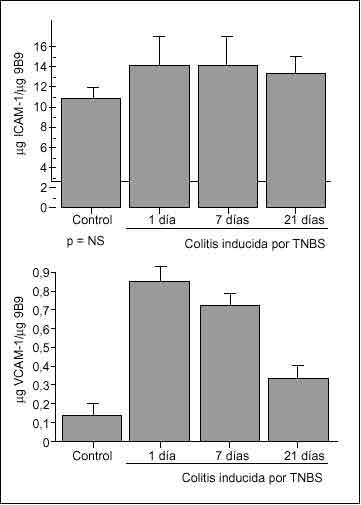
El reciente desarrollo de un método preciso para cuantificar la expresión de moléculas de adhesión endoteliales in vivo, basado en el uso de anticuerpos marcados26, ha permitido caracterizar la expresión de moléculas de adhesión en diversos modelos animales de colitis. De esta forma se ha detectado un marcado incremento de la expresión de VCAM-1 en la colitis inducida por TNBS o por peptidoglicano/polisacárido43,68 (fig. 3), así como en la colitis que aparece en ratones genéticamente deficientes en IL-1069.
En estos modelos experimentales la expresión de ICAM-1 no aumenta de forma apreciable, mientras que se detecta un constante incremento de MAdCAM-1, de magnitud similar al de VCAM-1. El aumento de expresión de MAdCAM-1 en células endoteliales se ha constatado también en ratones deficientes en IL-2, cuando los animales desarrollan colitis a partir de los 35 días de vida70.
Fig. 3. Expresión de ICAM-1 (panel superior) y VCAM-1 (panel inferior) corregido por superficie endotelial en ratas control y colíticas a diferentes tiempos tras la inducción de colitis por TNBS. La superficie endotelial se determinó por la unión del anticuerpo antienzima conversiva de la angiotensina (9B9), la expresión de ICAM-1 por la unión del anticuerpo anti-ICAM-1 1A29, y la de VCAM-1 por la unión del anticuerpo anti-VCAM-1 5F10. Los resultados se expresan como µg ICAM-1/µg 9B9 y µg VCAM-1/µg 9B9. *p < 0,01 frente a control. (Tomada de Sans et al68.)
La discrepancia más destacable en la expresión de moléculas de adhesión entre estos modelos animales y los estudios en pacientes con enfermedad inflamatoria intestinal es el incremento de VCAM-1 en los modelos experimentales. Esta diferencia puede tener importancia en la práctica, ya que estos modelos experimentales están siendo ampliamente utilizados en el estudio de la fisiopatología y el descubrimiento de nuevas alternativas terapéuticas para la enfermedad inflamatoria humana. De todas formas, no se puede excluir la existencia de un incremento en la expresión de VCAM-1 en la enfermedad de Crohn o la colitis ulcerosa hasta que dispongamos de técnicas más sensibles para el estudio de la expresión de moléculas de adhesión endoteliales en la enfermedad humana. En este sentido es de destacar que un estudio reciente realizado en células endoteliales microvasculares intestinales ha demostrado que en condiciones basales existe expresión ICAM-1 y no de VCAM-1, pero se produce un marcado incremento en la expresión de ambas moléculas de adhesión tras la estimulación de estas células endoteliales con IL-1ß, TNF-* o endotoxina71, y los valores de todos estos factores se hallan incrementados en la enfermedad inflamatoria intestinal humana.
MOLÉCULAS DE ADHESIÓN Y TRATAMIENTO DE LA ENFERMEDAD INFLAMATORIA INTESTINAL
Modulación de la síntesis de moléculas de adhesión
Un elemento importante en el tratamiento de la inflamación basado en la modulación de las interacciones leucocito-endotelio es la regulación de la síntesis de moléculas de adhesión. La modulación farmacológica de este proceso tiene el potencial de ejercer un potente efecto inhibitorio en el proceso de reclutamiento leucocitario. Se han utilizado diversas estrategias para inhibir la biosíntesis de moléculas de adhesión endoteliales; algunas de éstas han recibido una considerable atención últimamente y parecen muy prometedoras.
Glucocorticoides y aminosalicilatos
La modulación de la activación de los factores de transcripción AP-1 y NF-*B es uno de los aspectos básicos de la acción de varios de los fármacos más utilizados en el tratamiento de la enfermedad inflamatoria intestinal, incluyendo los corticoides y aminosalicilatos. Los glucocorticoides activan el receptor glucocorticoide (GR) en el citoplasma formándose entonces homodímeros GR-GR que se unen a una secuencia específica del ADN denominada elemento de respuesta a los glucocorticoides (GRE). Esta unión tiene como consecuencia la activación de la transcripción de los genes que poseen un elemento GRE en la región promotora. Además de esta regulación positiva de la expresión génica, los glucocorticoides inhiben la expresión de una amplia gama de genes implicados en la respuesta inflamatoria.
Uno de los principales descubrimientos que ha facilitado la comprensión del mecanismo de acción de los corticoides ha sido la demostración de que el GR activado por su unión específica con el glucocorticoide inhibe la transcripción inducida por AP-1 y NF-*B72. Así, se ha observado que los glucocorticoides inhiben la acción activadora de NF-*B sobre la expresión de ICAM-173, VCAM-174 y E-selectina75. Los glucocorticoides también inhiben la expresión de las colagenasas I y IV dependiente de AP-176. Se han propuesto diversos mecanismos por los que los glucocorticoides pueden antagonizar la acción de NF-*B y AP-1. Uno de los más importantes es la interacción directa proteína-proteína que se establece entre el GR y NF-*B, evitando que tanto GR como NF-*B lleguen a interaccionar con sus respectivos elementos de unión en el ADN77 (fig. 4). De forma similar, la unión de GR a jun y fos produce una inhibición mutua de su unión al ADN78. Los glucocorticoides también inducen la transcripción de I*B. El incremento en la síntesis de esta proteína que se une a NF-*B activada impide que ésta llegue a interaccionar con los elementos *B del ADN. La proteína I*B induce también probablemente una disociación de NF-*B y los elementos *B en los genes, movilizando NF-*B de nuevo hacia el citoplasma79. Un reciente estudio demuestra que en la enfermedad inflamatoria intestinal humana el cese de la actividad inflamatoria en respuesta a los glucocorticoides se asocia a la desaparición de NF-*B de los extractos nucleares, y que el fracaso en suprimir la activación de NF-*B tiene como resultado una persistencia del fenómeno inflamatorio46.
Fig. 4. Modulación de la transactivación génica por los glucocorticoides. 1) El glucocorticoide (GC) se une inicialmente al receptor de glucocorticoide (GR), tras lo cual se establece una inter acción directa proteína-proteína entre el GR y el factor de transcripción (TF) en el citoplasma de la célula que impide la unión del TF a sus elementos de respuesta en el ADN. 2) La unión del GR activado a elementos respondedores a los glucocorticoides modula la transactivación inducida por el TF. 3) La unión del GR al promotor del gen I*B induce su transactivación; la unión de I*B a NF-*B impedirá la unión de este factor al ADN o inducirá el desplazamiento de este factor de los elementos *B en la región promotora de los genes.
Es de destacar que los salicilatos, uno de los fármacos más utilizados en el tratamiento de la enfermedad inflamatoria intestinal activa y en el mantenimiento de la remisión, ejercen un potente efecto inhibidor sobre la activación de NF-*B80. Se ha demostrado que los salicilatos inhiben la activación de NF-*B impidiendo la fosforilación y subsiguiente degradación de I*B, lo que resulta en el bloqueo del incremento de los valores de ARNm de ICAM-1, VCAM-1 y E-selectina en respuesta al TNF, y que producen una inhibición dependiente de la dosis en la expresión de estas moléculas de adhesión en respuesta al TNF81.
Los inhibidores del proteasoma han sido probados en varios modelos experimentales de inflamación con resultados prometedores. En un modelo de colitis en la rata inducido por peptidoglicano/polisacárido, la inhibición del proteasoma con MG-341 inhibe el incremento de expresión de VCAM-1 y de la sintasa del óxido nítrico inducible en el colon, y esto se asocia a una reducción de la inflamación cólica43.
La inhibición sistémica de la activación de NF-*B por períodos prolongados en humanos puede comportar ciertos riesgos, como la inmunosupresión o un aumento de la citotoxicidad de determinadas citoquinas82,83. De todas formas, dado que NF-*B y AP-1 son factores de transcripción inducibles que actúan en respuesta a estímulos ambientales, puede ser posible modular la dosis de los inhibidores de estos factores de transcripción en rangos que alcancen un efecto terapéutico, sin tener efectos tó xicos.
Oligonucleótidos antisentido
Los potenciales efectos secundarios y acción inespecífica de los inhibidores de los factores de transcripción utilizados hasta la actualidad ha llevado a la búsqueda de fármacos que actúen de modo distinto en la vía de la síntesis proteica específicamente relacionada con el proceso de inflamación. Una de estas estrategias que ha proporcio nado ya resultados significativos es el uso de los oligodeoxinucleóticos (ODNs) antisentido84. Los ODNs antisentido son secuencias de ADN de cadena única complementarios de un ARNm. En teoría, los ODNs antisentido, por medio de un apareamiento de bases complementario, se unen de forma específica a un determinado ARNm bloqueando la síntesis de la proteína codificada por éste85.
Se han producido moléculas antisentido capaces de bloquear la síntesis de subunidades específicas de NF-*B. Los ODNs antisentido para p65/p50 reducen la expresión de E-selectina, ICAM-1 y VCAM-1 en células endoteliales humanas en cultivo86. Se ha observado que la administración de un ODN antisentido para p65 a ratones con colitis disminuye los signos clínicos e histológicos de colitis en una forma incluso más eficaz que los corticoides42.
El ODN antisentido para el ICAM-1 humano ISIS 2302 inhibe de forma selectiva la expresión de ICAM-1 inducido por citoquinas en diversos tipos celulares in vivo e in vitro87,88. Además, un reciente estudio piloto en pacientes con enfermedad de Crohn demostró que la administración de este fármaco reduce la expresión de ICAM-1 en la mucosa intestinal y disminuye de forma significativa la dosis de corticoide requerida para el control de la enfermedad, en comparación con placebo88. Un análogo murino (ISIS 3082) se ha revelado eficaz en el tratamiento de diversos modelos de inflamación, incluyendo la colitis inducida por dextrano89; el tratamiento con ISIS 3082 reduce los signos clínicos de colitis en forma dependiente de la dosis y elimina la inmunodetección de ICAM-1 que habitualmente se observa en ratones con colitis.
Bloqueo funcional de las moléculas de adhesión
La metodología experimental que ha sido más empleada en la modulación de las interacciones leucocito-endotelio es el bloqueo de la función de las moléculas de adhesión. Esta estrategia ha resultado efectiva en el control de la inflamación en modelos experimentales agudos y crónicos, pero ha sido poco explorada clínicamente. En la mayoría de estudios el bloqueo funcional de las moléculas de adhesión se realiza mediante inmunoneutralización con anticuerpos monoclonales dirigidos contra glucoproteínas específicas.
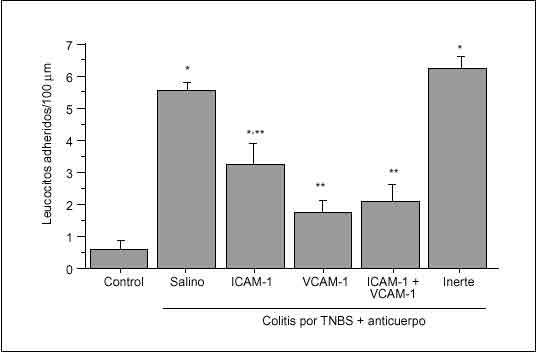
Se ha observado que el tratamiento con un anticuerpo monoclonal anti-ICAM-1 en ratas con colitis inducida por ácido acético atenúa de forma significativa los signos de inflamación macro y microscópicos, así como la formación de radicales libres90. Se ha obtenido una protección similar con anticuerpos monoclonales anti-CD1891 o anti-CD11b92 en un modelo de colitis por TNBS en el conejo, y con un factor inhibidor de los neutrófilos recombinante, un antagonista de CD11b/CD18, en la colitis inducida por inmunocomplejos en el conejo93. Dos estudios han demostrado un potente efecto terapéutico de los anticuerpos monoclonales dirigidos contra la integrina *4 en la coli tis que aparece de forma espontánea en el cotton-top tamarin94,95. Asimismo, se ha demostrado que los anticuerpos dirigidos contra MAdCAM-1 o su ligando *4ß7 bloquean el reclutamiento de linfocitos y reducen la gravedad de la inflamación cólica en ratones con inmunodeficiencia grave combinada (SCID) reconstituidos con células CD4+ T ricas en la subpoblación CD45RBhigh96. En un modelo de colitis inducido por TNBS en la rata en el que se ha evaluado las interacciones leucocito-endotelio en vénulas de colon mediante microscopia intravital, se ha observado que la adhesión de leucocitos resulta atenuada por la inmunoneutralización de ICAM-1, y completamente inhibida por la inmunoneutralización de VCAM-1 (fig. 5). Además, en este modelo la administración crónica de anticuerpo anti-VCAM-1 reduce significativamente los signos clínicos e histológicos de colitis68.
Fig. 5. Efectos de la inmunoneutralización de ICAM-1 y VCAM-1 sobre la adhesión leucocitaria en ratas con colitis inducida por TNBS. La inmunoneutralización de ICAM-1 atenúa significativamente la adhesión leucocitaria, mientras que el anticuerpo anti-VCAM-1 bloquea por comple to la adhesión de leucocitos a las vénulas del colon en ratas colíticas. El tratamiento con un anticuerpo inerte no tiene ningún efecto. *p < 0,05 frente a control; **p < 0,05 frente a colitis + vehículo. (Tomada de Sans et al68.)
No existen hasta la actualidad estudios clínicos publicados en los que se empleen anticuerpos dirigidos contra las moléculas de adhesión para el tratamiento de la enfermedad inflamatoria intestinal humana. La aplicación de esta estrategia terapéutica a otras enfermedades inmunes como la artritis reumatoide97 y el trasplante de médula ósea98 o renal99, ha tenido una eficacia variable. Una limitación en la interpretación de los resultados negativos en estudios que emplean anticuerpos es la falta de seguridad de que la dosis empleada sea realmente bloqueante. Los valores que se recomiendan se basan en la mínima concentración de anticuerpo requerida para lograr una máxima inhibición de la adhesión leucocitaria in vitro. La experiencia de algunos estudios clínicos abiertos indica que las dosis bloqueantes son más difíciles de alcanzar in vivo de lo que se predice a partir de estudios de adhesión in vitro. Otra limitación potencial del uso prolongado de anticuerpos monoclonales, al menos en modelos crónicos de inflamación, es la inmunogenicidad.
COROLARIO
La intervención sobre los mecanismos iniciales del proceso inflamatorio, como es la adhesión de los leucocitos al endotelio venular y la migración hacia el tejido, representa una nueva y atractiva aproximación terapéutica para la enfermedad inflamatoria intestinal. Aunque se conocen muchos detalles de las moléculas implicadas en el proceso de adhesión entre estos dos tipos celulares en modelos experimentales de enfermedad inflamatoria intestinal, tenemos mucha menos información del papel que cada una de estas moléculas desempeña en la fisiopatología de la inflamación en el ser humano. Son diversas las etapas del proceso de reclutamiento de leucocitos hacia un tejido que son susceptibles de ser moduladas farmacológicamente, pero las limitaciones derivadas de una alteración del proceso fisiológico de recirculación leucocitaria en el intestino o de la inmunosupresión son significativas. Estas limitaciones podrían ser superadas si la investigación logra identificar mecanismos del proceso de adhesión leucocito-endotelio que se activen de forma exclusiva en la enfermedad inflamatoria, ya sea por activación de receptores, síntesis o función de las moléculas de adhesión. El desarrollo de fármacos eficaces y seguros que modulen estos componentes moleculares de la respuesta inflamatoria puede conllevar el desarrollo de nuevas formas de tratamiento con mayor potencial curativo y menores efectos secundarios que las actualmente utilizadas.
Correspondencia: Dr. J. Panés. Servicio de Gastroenterología. Institut Clínic de Malalties Digestives. Hospital Clínic. Villarroel, 170. 08036 Barcelona.