En 1976, Lindström publicó el caso de una mujer de 48 años con diarrea crónica acuosa y dolor abdominal de 2 años y medio de evolución, que presentaba un importante depósito de colágeno subepitelial en la biopsia rectal. Consideró que se trataba de una entidad nueva que denominó colitis colágena (CC)1. Con sólo este caso, Lindström describió todos los hallazgos clínicos y biológicos que, hoy en día, sabemos que caracterizan a esta enfermedad: mujeres de mediana edad con diarrea crónica acuosa sin sangre y dolor abdominal, analítica de sangre normal, ausencia de signos de malabsorción, pruebas microbiológicas de heces negativas y estudios radiológicos y endoscópicos normales. Este autor propuso que la banda de colágeno subepitelial engrosada era la causa de la diarrea en la CC, al originar una barrera a la difusión de agua y electrólitos a través de la mucosa colónica, e hipotetizó que la enfermedad era de origen inmunológico. Hoy día, ninguna de estas posibles explicaciones ha sido rechazada.
Desde entonces el interés por la CC ha aumentado. Sin embargo, los estudios sobre la enfermedad se han visto limitados por el escaso número de pacientes diagnosticados en cada hospital. Por ello, fue importante la iniciativa de un grupo de investigadores del Johns Hopkins Hospital en los Estados Unidos de crear un registro nacional de pacientes con CC. Este registro permitió realizar destacados estudios morfológicos y patofisiológicos, así como revisiones clínicas2-5. Asimismo, este grupo introdujo el término de colitis linfocítica (CL) basado en estudios comparativos entre la CC y la colitis microscópica, nombre inicial que se utilizó para denominar la CL6,7. Posteriormente, el término colitis microscópica se ha utilizado como un término general que incluye a un grupo heterogéneo de enfermedades caracterizadas por la presencia de diarrea crónica, estudios radiológicos y endoscópicos normales y una inflamación microscópica en el colon8. En esta definición se incluyen la enfermedad inflamatoria intestinal idiopática, la colitis eosinofílica, la colitis colágena, la colitis linfocítica y, probablemente, otras entidades relacionadas con la ingesta de AINE y con el sida9.
Posteriormente, otros grupos han presentado interesantes revisiones basadas en un número sustancial de pacientes10-12. No obstante, la causa de la CC todavía se desconoce. Se ha sugerido un origen autoinmune ya que los linfocitos predominan en las zonas inflamadas, y existe una asociación con otras enfermedades autoinmunes bien conocidas y un predominio en las mujeres3. Por otro lado, un agente de la luz intestinal podría estar involucrado en la patogénesis de la enfermedad ya que, la derivación quirúrgica del tránsito intestinal provoca la desaparición de la inflamación y de la banda colágena en el intestino afectado13. Asimismo, algún agente microbiológico podría estar implicado, pues la CC responde algunas veces al tratamiento con antibióticos11,12. Recientemente, se ha sugerido que podría existir una alteración de la función de los miofibroblastos subepiteliales en la CC14. Estas células regulan la síntesis de las proteínas de la membrana basal, la síntesis de colágeno y mantienen una estrecha interacción con el epitelio de superficie.
Aunque fue considerada durante muchos años una enfermedad rara, estando muchos clínicos y patólogos poco familiarizados con este diagnóstico, la CC hoy en día está considerada como una entidad propia, y el interés por la misma y otras formas de colitis microscópica está aumentando. De todas maneras no existen estudios controlados para el tratamiento de la CC que, por tanto, se realiza de forma empírica basado en la experiencia anecdótica proporcionada por series cortas de pacientes.
En estos últimos años, nuestro equipo ha adquirido una experiencia importante en el diagnóstico, tratamiento y seguimiento de estos pacientes. Esto nos ha permitido, conjuntamente con los datos existentes en la bibliografía, desarrollar un enfoque racional en el tratamiento de estos pacientes.
EPIDEMIOLOGIA
Como ya se ha mencionado, la CC se ha considerado una enfermedad poco habitual. Sin embargo, hasta hace poco no existían estudios de incidencia y prevalencia de base poblacional. La mayoría de los estudios previos presentaban problemas metodológicos: sólo se obtenían biopsias rectales, lo que puede no detectar hasta un 40% de los casos con CC15; la población del área de estudio no estaba bien definida16; el período de estudio era demasiado corto para obtener conclusiones válidas17, o se trataba de estudios sin una base poblacional10,18. Hasta la fecha tenemos conocimiento de 3 estudios realizados con una base poblacional. En uno de ellos, realizado en Francia y publicado como un resumen, se describió una incidencia anual de 0,6/105 habitantes en un período de 5 años19. Por otro lado, en el único estudio publicado hasta la actualidad, realizado en Suecia, se observó una incidencia media anual de 1,3/105 habitantes20 y, recientemente, en el área del Hospital Mútua de Terrassa observamos una incidencia media anual de CC de 1,1/105 habitantes21. Por tanto, todos estos estudios sugieren la existencia de cifras de incidencia similares, sin que existan diferencias norte-sur como se ha descrito en la colitis ulcerosa y en la enfermedad de Crohn.
En el estudio realizado por nuestro grupo en el área de Terrassa, se evaluó en la misma población de forma conjunta la incidencia de CL. Ésta fue 3 veces superior que la mencionada para la CC. En ambas enfermedades se observó un pico de incidencia en mujeres de edad avanzada (mayores de 60 años), que fue de 13/105 habitantes para la CC y de 31/105 habitantes para la CL. Estas cifras son muy superiores a las descritas para la colitis ulcerosa y la enfermedad de Crohn en nuestra área geográfica en mujeres de la misma edad22. Por tanto, la colitis microscópica no es una entidad rara en estos pacientes, y debería ser considerada en el diagnóstico diferencial de la diarrea crónica en mujeres ancianas.
En otros estudios se ha valorado la frecuencia de CC por 1.000 colonoscopias, obteniendo cifras de 6,410 y 5,920. En nuestro centro, esta frecuencia fue similar, con cifras de 5,4 CC y 7,5 CL por 1.000 colonoscopias.
Diferentes estudios han sugerido la existencia de un predominio de mujeres en la CC, que en una revisión de la bibliografía realizada en 1991 se cifraba en 9 mujeres por varón23. En el estudio epidemiológico sueco esta proporción fue de 9:1 y en el realizado en nuestro centro de 6:1. Por otro lado, la proporción de mujeres:varones entre los pacientes con diarrea crónica y biopsias de colon normales, evaluados durante la realización del estudio epidemiológico en nuestra área, fue de 1,5:1 (p = 0,02 frente a los pacientes con CC). Todos estos datos permiten concluir la existencia de un predominio claro de mujeres en la CC. En la CL, aunque también existe un predominio de mujeres (3:1), es inferior a la CC, y no es significativamente diferente de las cifras observadas en los pacientes con diarrea crónica y biopsias de colon normales.
CRITERIOS DIAGNÓSTICOS Y DIAGNOSTICO DIFERENCIAL
El diagnóstico de la CC está basado en criterios clínicos e histológicos. Los criterios clínicos son la presencia de diarrea crónica acuosa y la normalidad de la colonoscopia (aunque hasta un 20% de los casos pueden tener alteraciones inespecíficas, en forma de eritema y edema leve de localización focal).
Los criterios histológicos son los siguientes9: a) presencia de una banda colágena subepitelial con un grosor > 10 µm, que engloba capilares superficiales y presenta en su borde inferior un aspecto irregular y festoneado. Se ha considerado que estas alteraciones cualitativas del borde inferior son más importantes que el grosor de la banda en el diagnóstico de la CC16; b) existencia de un infiltrado inflamatorio crónico en la lámina propia constituido por células plasmáticas, linfocitos y algunos eosinófilos. Rara vez se observan neutrófilos; c) presencia de lesión del epitelio de superficie, con aplanamiento y vacualización de las células epiteliales, pérdida epitelial y mínima distorsión de la arquitectura de las criptas, y d) aumento de linfocitos intraepiteliales, en general, por encima de 20 linfocitos por 100 células epiteliales.
Los primeros estudios sugirieron que los cambios inflamatorios en la CC eran parcheados, siendo la histología de la región rectosigmoidea normal en hasta un 40% de los casos24. Estudios recientes, sin embargo, han mostrado que pueden hallarse alteraciones diagnósticas de CC en el área rectosigmoidea en un 90% de los casos25. En el estudio efectuado en nuestro centro, la tasa de detección en el recto fue baja para la CC ya que el 45% de los casos tenían una histología normal, mientras que en el sigma se hallaron cambios diagnósticos en el 95% de los pacientes. Por otro lado, aunque el grado de lesión mucosa en el colon derecho e izquierdo fue similar en la mayoría de los pacientes, en cerca del 25% de los casos fue más grave en el colon derecho. En estos casos, la lesión mucosa en el colon sigmoide fue leve sugiriendo que podrían ser necesarias biopsias múltiples de todo el colon izquierdo para asegurar el diagnóstico. De todas maneras, el estudio diagnóstico de un paciente con diarrea crónica requiere la realización de una colonoscopia total para descartar la neoplasia de colon derecho o una enfermedad de Crohn a este nivel. Por ello, creemos que la obtención de al menos 2 biopsias de colon derecho no es costosa, y en cambio puede ser de ayuda en casos dudosos y obtener el diagnóstico en aquel 5-10% de pacientes con biopsias de colon izquierdo normales.
La membrana subepitelial en los individuos sanos oscila entre 0 y 3 µm26. Sin embargo, en pacientes con adenocarcinoma, pólipos epiteliales, megacolon y enfermedad diverticular se ha descrito, ocasionalmente, la existencia de una banda con un grosor de más de 10 µm26. Por tanto, la existencia de sólo esta alteración no es suficiente para realizar el diagnóstico de CC. Por otro lado, en la CL se observan las mismas alteraciones histológicas que en la CC, excepto la banda de colágeno subepitelial y, en general, el infiltrado linfocitario intraepitelial y la lesión del epitelio de superficie son más prominentes9.
Algunos pacientes con colitis ulcerosa pueden presentarse clínica y endoscópicamente como una colitis microscópica. En estos casos, la histología muestra un infiltrado inflamatorio en la lámina propia con predominio de neutrófilos, algunos abscesos de criptas y distorsión en la arquitectura de las criptas, todo lo cual permite realizar el diagnóstico diferencial con una colitis colágena. Se ha descrito, sin embargo, la aparición metacrónica de colitis ulcerosa y colitis colágena en el mismo paciente27. Por otro lado, la fibrosis y el depósito de colágeno en la colitis ulcerosa de larga evolución, en la colitis por radiación y en la colitis isquémica es difusa en la lámina propia y no limitada a la zona subepitelial. En las tinciones con hematoxilina y eosina el depósito subepitelial de amiloide muestra un aspecto similar al depósito de colágeno, pero la tinción característica con rojo Congo ayuda a distinguir estas entidades con facilidad9.
PATOGENIA
Actualmente, existen 2 hipótesis principales sobre la patogenia de la CC. La primera propone una base inflamatoria, probablemente autoinmune, de la enfermedad, que podría estar desencadenada por fármacos, agentes infecciosos o toxinas3,5. Apoyan esta hipótesis el predominio en las mujeres, la asociación con otras enfermedades autoinmunes y la mejoría clínica tras el tratamiento con fármacos antiinflamatorios como los derivados del 5-ASA o los corticoides. Sin embargo, faltan dos aspectos para cumplir con los criterios de enfermedad autoinmune: la presencia de un autoanticuerpo específico y la asociación con un haplotipo HLA.
La segunda hipótesis propone la existencia de una alteración local del miofibroblasto subepitelial-pericríptico. Las criptas colónicas normales se hallan rodeadas de una capa mesenquimatosa de miofibroblastos que producen una fina capa circunferencial de colágeno que rodea la cripta. Se ha sugerido que estas células pueden modular la transferencia de información entre el epitelio y la lámina propia, ejerciendo un papel importante en la inmunofisiología de la mucosa, y siendo a la vez una fuente importante de moléculas de la matriz extracelular y de la membrana basal28. Recientemente, se ha mostrado que la banda colágena subepitelial en la CC tiene principalmente fibras de colágeno tipo VI y, en menor grado, fibras de colágeno tipos I y III29, mientras que la membrana basal está formada por colágeno tipo IV. Asimismo, se apreció un aumento de tenascina en estas bandas colágenas29. Esta expresión predominante de colágeno tipo VI y tenascina en la banda del colágeno se distingue con claridad de la observada en la fibrosis colónica de la enfermedad de Crohn, donde existe un predominio de colágeno tipo I, III y V30, lo que sugiere que el mecanismo patogénico del depósito de colágeno en la CC no es la lesión tisular inflamatoria y los procesos de reparación y cicatrización. Dado que tanto el colágeno tipo VI y la tenascina pueden ser sintetizados por los miofibroblastos pericrípticos, el hallazgo de ambas proteínas en el interior de las bandas colágenas sugiere la existencia de una acumulación patológica de productos fisiológicos del miofibroblasto subepitelial. Sin embargo, los valores de ARNm de colágeno tipo VI en la mucosa no estaban aumentados en la CC29, sugiriendo que la acumulación de este tipo de colágeno no es debida a un aumento de su síntesis. Por tanto, se ha propuesto la hipótesis de que en la CC podría existir una disminución de la degradación de los componentes de la matriz extracelular.
Por otro lado, se ha propuesto que las citocinas liberadas en el proceso inflamatorio pueden mediar la activación de los miofibroblastos y el depósito de colágeno31-33. Los miofibroblastos activados pueden, a su vez, producir citocinas y expresar receptores de membrana funcionales de diferentes factores de crecimiento y moléculas de adhesión34,35. Muchas de estas sustancias, proteínas o péptidos, tales como la tenascina, factor de crecimiento de hepatocitos (HGF), TGF-ß, factor de crecimiento de fibroblastos (FGF), factor de crecimiento derivado de las plaquetas (PDGF), factores de crecimiento insulínicos (IGF-I, IGF-II), factor de crecimiento epidérmico (EGF), etc., pueden actuar como mediadores paracrinos o autocrinos involucrados en las interacciones epitelio-mesénquima28. Asimismo, varios estudios han demostrado la existencia de interacciones entre los miofibroblastos subepiteliales y los linfocitos de la lámina propia o los linfocitos intraepiteliales36,37, que podrían contribuir a la persistencia y amplificación de los procesos inflamatorios intestinales. Todos estos datos sugieren, por tanto, que la CC es una enfermedad específica que afectaría a la capa de miofibroblastos subepiteliales produciéndose una alteración en la regulación de la matriz extracelular y en las interacciones epitelio-mesénquima en la mucosa colónica.
Por otro lado, se ha sugerido que toxinas bacterianas podrían ser las desencadenantes de todo el proceso. En este sentido, se demostró que las heces de un paciente con CC ejercían un efecto citotóxico in vitro sobre una línea celular. Los síntomas, las alteraciones histológicas y dicha citotoxicidad desaparecieron cuando se instituyó tratamiento con colestiramina38. Esta teoría se vería apoyada por los estudios que han sugerido una respuesta al metronidazol y a otros antibióticos11,12. Recientemente, se ha descrito la remisión clínica e histológica en pacientes con CC tras la derivación del tránsito fecal y la realización de una ileostomía, así como la posterior reaparición de la banda colágena al restaurar la continuidad intestinal13. Este hecho apoya también la hipótesis de un factor intraluminal, probablemente una toxina bacteriana, como desencadenante de esta enfermedad.
MECANISMOS DE LA DIARREA
Algunos autores han sugerido que el engrosamiento de la banda colágena subepitelial es uno de los mecanismos fisiopatológicos que explicarían la aparición de diarrea en la CC1,5, al reducir la permeabilidad del colon para electrólitos y agua e, incluso, aumentar la secreción intestinal. Sin embargo, la presencia de la banda colágena per se difícilmente puede explicar la diarrea, ya que puede estar presente en pacientes asintomáticos. En este sentido se ha sugerido que el componente inflamatorio asociado contribuye a la diarrea secretora. Este punto de vista está apoyado por estudios que han mostrado una correlación entre el peso de las heces y la celularidad de la lámina propia, pero no con el grosor de la banda colágena39. Por otro lado, se ha detectado un aumento de la producción local de prostaglandina E240 y de óxido nítrico41 en pacientes con CC, que pueden actuar como secretagogos en el colon.
Algunos autores han sugerido que puede existir malabsorción de ácidos biliares en la CC y que podría estar implicada en la patofisiología de la diarrea en algunos pacientes5,12,42. Sin embargo, este punto ha sido cuestionado en otro estudio43. En el Hospital Mútua de Terrassa investigamos prospectivamente la presencia de malabsorción de ácidos biliares en pacientes con CC y con CL. Observamos la existencia de malabsorción de los mismos (retención abdominal de SeHCAT al séptimo día inferior al 10%) en 6 de 16 pacientes (37,5%) con CC, un porcentaje similar al descrito previamente en la bibliografía42, y en 8 de 15 (53%) con CL. Los ácidos biliares malabsorbidos pueden ser causa de diarrea colerética debido al efecto irritante de las mismas sobre la mucosa colónica, disminuyendo la absorción de sodio y agua y aumentando su excreción. Recientemente, se ha visto que este efecto puede estar mediado por un aumento en la síntesis local de óxido nítrico y de prostaglandina E243. Para valorar el posible papel patogénico de la malabsorción de ácidos biliares en la diarrea de los pacientes con CC, evaluamos el efecto de la administración de colestiramina, un quelante de las sales biliares. El efecto sobre la diarrea fue espectacular cediendo la misma en 5 de los 6 pacientes con CC y en 7 de los 8 pacientes con CL en una mediana de 5 días (límites = 2 a 10 días), con una dosis media de colestiramina de 4 g/día. Por tanto, la presencia o no de malabsorción de ácidos biliares en la CC podría definir 2 grupos de pacientes en los que la fisiopatología de la diarrea podría ser diferente.
CARACTERISTICAS CLINICAS
Síntomas
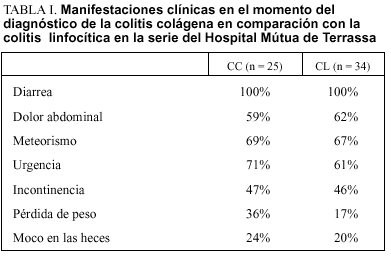
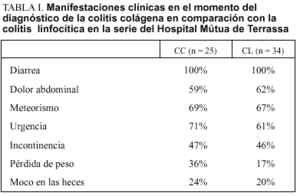
El inicio de la CC normalmente es insidioso, aunque también se ha descrito un inicio brusco. La diarrea acuosa es el principal síntoma de la CC, y con frecuencia se acompaña de urgencia e incontinencia. Existen, a menudo, dolor abdominal y meteorismo asociados. Algunos pacientes presentan pérdida de peso que, en ocasiones, es importante. Puede apreciarse moco con las deposiciones, pero la presencia de sangre es muy rara. En la tabla I se describe la frecuencia de aparición de cada uno de estos síntomas en la serie del Hospital Mútua de Terrassa.
Enfermedades asociadas
Los pacientes con CC presentan, con frecuencia, enfermedades concomitantes de origen autoinmune o inflamatorio. Las enfermedades del tiroides y distintas formas de artritis son las que con más frecuencia se han descrito11,12. La artritis es, normalmente, seronegativa para el factor reumatoide, no destructiva, puede ser oligoarticular o poliarticular y preceder a los síntomas colónicos por muchos años45. Se han descrito otras enfermedades asociadas como iritis recurrente, enfermedad de Sjögren, arteritis de células gigantes, miastenia grave, enfermedad celíaca, esclerodermia, artritis reumatoide, lupus eritematoso sistémico, lupus discoide, diabetes mellitus, sarcoidosis, asma/alergia, psoriasis, anemia perniciosa, colitis ulcerosa y enfermedad de Crohn9-12.
Hallazgos de laboratorio
La analítica general en sangre es normal en la mayoría de los casos. Sin embargo, la VSG puede estar levemente aumentada, y se ha descrito anemia leve y eosinofilia periférica. Sin embargo, la frecuencia con que aparecen estas alteraciones no es conocida. Muchos pacientes, como ya se ha comentado, presentan otras enfermedades autoinmunes asociadas con lo que la analítica puede estar alterada en consecuencia. Los coprocultivos y el examen de parásitos en heces son negativos. En algunas ocasiones puede existir ligera esteatorrea y excreción aumentada de leucocitos en heces.
Estudios radiológicos y endoscópicos
El enema opaco y la colonoscopia son, en general, normales. Se pueden apreciar cambios mínimos en la mucosa colónica, del tipo de edema y/o eritema, entre un 20-30% de los casos.
HISTORIA NATURAL
En el momento del diagnóstico, el tiempo de evolución varía entre pocas semanas hasta 20 años, y los síntomas pueden ser crónicos o intermitentes. La historia natural es benigna en todos los casos, y tiende a seguir un curso variable con remisiones y recidivas, en ocasiones con remisiones espontáneas. Rara vez es necesario un tratamiento quirúrgico en la CC debido a enfermedad refractaria13.
TRATAMIENTO
Algunos pacientes pueden responder al tratamiento sintomático con antidiarreicos y agentes formadores de masa, o mejorar al suspender la ingestión de AINE o secretagogos intestinales como la cafeína.
Cuando estas medidas fallan se requiere el inicio de un tratamiento específico. No se han realizado estudios controlados debido al escaso número de pacientes con CC en cada hospital. Por ello, el tratamiento de la CC es fundamentalmente empírico. En este sentido, los fármacos antiinflamatorios como la salazopirina, los derivados del 5-ASA, los corticoides orales y los corticoides rectales han proporcionado los mejores resultados. En los pacientes que no responden al tratamiento es necesario descartar la existencia concomitante de enfermedad celíaca o de enfermedades del tiroides.
En la bibliografía y en nuestra experiencia, la frecuencia de respuesta a los corticoides es elevada, más del 80% de los casos, sin embargo, la recidiva se suele producir pronto tras cesar este tratamiento11,12. En estos casos, el tratamiento con budesonida de liberación colónica o ileal, que ha mostrado su eficacia en el tratamiento de la CC12,46, podría disminuir los efectos secundarios de la administración continuada de prednisona. La respuesta a la mesalazina y a la salazopirina, aunque inferior a los esteroides, también es elevada, cercana al 60%12,47. La respuesta a la colestiramina es alta en los pacientes con malabsorción de ácidos biliares (80-90% de los casos); sin embargo, también puede ser eficaz en pacientes sin malabsorción de ácidos biliares (alrededor de un 60% de los pacientes42), un efecto atribuido, como ya se ha comentado, a la absorción o eliminación de toxinas bacterianas. Existen datos que sugieren que otros tratamientos pueden ser efectivos en estos pacientes. Destacan por la mayor experiencia en su uso los antibióticos (metronidazol, eritromicina, penicilina G), la mepacrina y el subsalicilato de bismuto12,48.
Se ha considerado que el fármaco de primera elección en el tratamiento de la CC es la mesalazina, a dosis de 3 g/día administrada durante al menos un mes. Parece razonable, sin embargo, que los pacientes en los que se detecta malabsorción de ácidos biliares sean tratados inicialmente con colestiramina (dosis de 2 a 12 g/día, según la respuesta valorada semanalmente), estando indicada la mesalazina en todos los demás pacientes y en aquellos en que la colestiramina sea ineficaz. Si el tratamiento con estos fármacos es efectivo debería mantenerse durante al menos 3 meses, y en este momento intentar suspenderlos. Si se observa la recurrencia de los síntomas será necesario iniciar un tratamiento de mantenimiento, con las mínimas dosis de los mismos para mantener la remisión. En los pacientes que no responden a las dosis más elevadas de estos fármacos debería iniciarse tratamiento con prednisona oral a dosis de 1 mg/kg/día, y al obtener la respuesta disminuir las dosis de forma progresiva.
En caso de síntomas refractarios a estos tratamientos, y si se comprueba que la CC es el único origen de los mismos, está indicada la utilización de los fármacos alternativos que se han enumerado anteriormente. Si no existe mejoría, podría estar indicada la realización de una intervención quirúrgica con derivación del tránsito intestinal mediante una ileostomía o la proctocolectomía total con ileostomía. Alternativamente, podría considerarse el tratamiento inmunosupresor con azatioprina aunque la experiencia con este fármaco para esta indicación es mínima11.
RELACION ENTRE COLITIS COLAGENA Y COLITIS LINFOCITICA
Si la CC y la CL forman parte del espectro de la misma enfermedad o si son entidades distintas es todavía origen de debate11. Los autores que sugieren que se trata de la misma enfermedad mencionan: a) la similitud en los hallazgos clínicos, de laboratorio e histológicos; b) la aparición de ambas enfermedades en un mismo paciente en diferentes momentos del curso de la enfermedad, y c) la respuesta similar al tratamiento antiinflamatorio.
Hoy en día, sin embargo, la opinión de la mayoría de los autores coincide en la hipótesis de que se trata de enfermedades distintas. En una revisión reciente del grupo del Johns Hopkins Hospital, se describe la conversión de CL a CC en sólo 2 casos entre 109 pacientes con CC y 75 con CL, concluyendo que se trata de dos enfermedades separadas aunque similares4. Apoyando esta hipótesis, se han mencionado las diferencias en la proporción mujeres:varones, la ausencia de la banda colágena en la CL, y diferencias en el haplotipo HLA. En la CL se describió un aumento de HLA A1 y una disminución de HLA A3, mientras que en la CC no se observaron diferencias entre pacientes y controles49. La observación, en el estudio epidemiológico realizado en el área de Terrassa21, de que el pico de incidencia de la CL se produce una década después que en la CC también sugiere que se trata de enfermedades separadas, y que la CC no es un estadio más avanzado de la CL.
Correspondencia: Dr. F. Fernández-Bañares. Servicio de Aparato Digestivo. Hospital Universitario Mútua de Terrassa. Sant Antoni, 14. 08221 Terrassa. Barcelona. Recibido el 12-11-97; aceptado para su publicación el ???