El número de pacientes que se consideran susceptibles de ser trasplantados de hígado aumenta de forma constante y progresiva sobre la base de los excelentes resultados del trasplante. Este hecho hace que año tras año se incremente la discrepancia entre el número de candidatos en lista de espera y el número de donantes, lo que impulsa a los distintos grupos de trasplante a la búsqueda de alternativas para incrementar el número de injertos hepáticos. Por un lado, se ha optado por la utilización de injertos con criterios ampliados procedentes de donantes de edad avanzada, donantes con esteatosis hepática, donantes con serologías positivas para el virus de la hepatitis B y el virus de la hepatitis C, donantes con neoplasia o con enfermedad benigna subyacente. Por otro lado, se ha recurrido a la realización de trasplantes no convencionales con injertos procedentes de bipartición hepática, donante vivo, trasplante secuencial o dominó y donante a corazón parado. Otras opciones, como el xenotrasplante y el trasplante de hepatocitos, en la actualidad carecen de aplicabilidad clínica.
The number of patients suitable for liver transplantation is progressively increasing due to the excellent results achieved with this procedure, giving rise to a growing imbalance in the number of candidates on the waiting list and the number of donors. This situation has prompted transplant teams to search for alternatives to increase the number of liver grafts. On the one hand, the criteria for donation have been broadened to include donors with advanced age, liver steatosis, hepatitis B and C viruses, neoplasms, and benign underlying diseases. On the other hand, new transplant techniques have been used with grafts from split livers, living donors, sequential or domino transplants and non-heart-beating donors. Other options such as xenotransplantation and hepatocyte transplants currently lack clinical applicability.
Transcurridos más de 40 años tras la realización del primer trasplante hepático (TH) ortotópico1, este procedimiento se ha convertido en la opción terapéutica de elección para aquellos pacientes con insuficiencia hepática terminal. Los factores que han determinado este hecho están relacionados con la constante evolución, el perfeccionamiento de las técnicas quirúrgicas y anestésicas y los avances en materia de inmunosupresión y en el tratamiento clínico del paciente trasplantado. Todo esto ha determinado un significativo aumento en las tasas de supervivencia. En España, según datos del Registro Español de Trasplante Hepático (RETH), la supervivencia actuarial al año del trasplante de paciente e injerto se sitúa en el 86,2 y el 81,5%, respectivamente2.
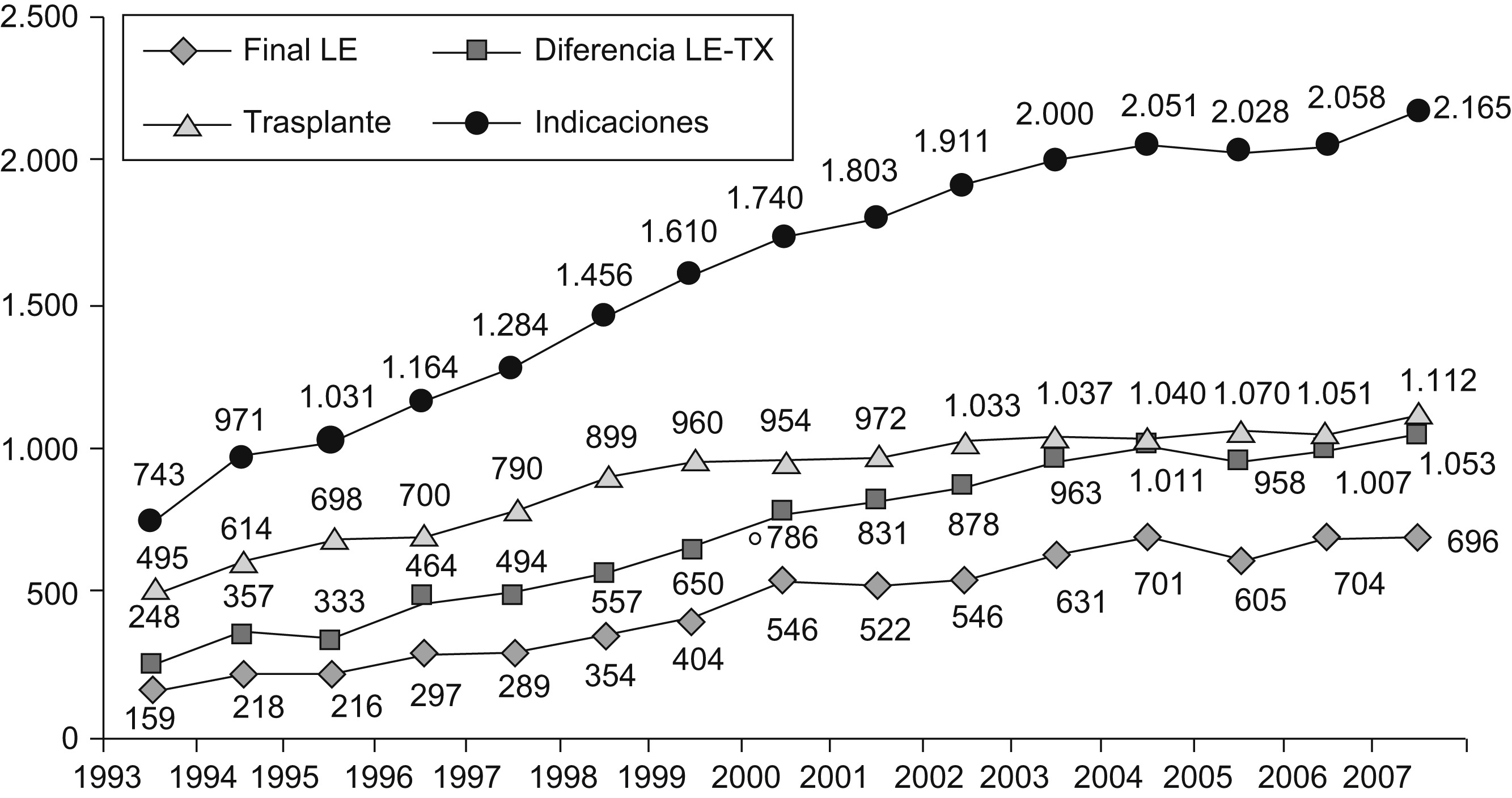
En las últimas décadas también se ha incrementado el número de indicaciones para TH y la discrepancia entre el número de candidatos en lista de espera y el número de donantes. Así, al finalizar el año 2007, 696 enfermos continuaban en las listas de espera de los centros españoles para ser trasplantados (figura 1).
Figura 1. Evolución de la lista de espera (LE) para trasplante hepático en España.
La estrategia más importante para aumentar la aplicabilidad del trasplante es el ejercicio de una política adecuada para la detección de los donantes potenciales. El modelo español de trasplante ha conseguido que el número total de donaciones en España crezca de forma progresiva: pasó de una tasa de 22,6 donantes por millón de habitantes en el año 1993 a 34,3 donantes por millón de habitantes en el año 20073. De forma paralela, se ha observado un descenso mantenido en las negativas familiares a la donación de órganos: pasó del 27,6% en el año 1992 al 16,8% en el año 20073. Ambas circunstancias sitúan a España a la cabeza de la donación en el mundo, lo que permitió la realización de 1.112 TH en el año 20073 y fue un ejemplo que seguir para todos los países del entorno.
Sin embargo, incluso en este entorno, hay un importante desequilibrio entre el número de pacientes incluidos en lista de espera y el número de TH realizados. Esto trae consigo un incremento del tiempo medio en lista de espera, lo que condiciona una progresión de la enfermedad (que en el caso del hepatocarcinoma puede llegar a contraindicar el trasplante), así como un incremento de la mortalidad en lista de espera, que se situó en el 8,2% el pasado año3.
Las estrategias más importantes desarrolladas en las últimas 2 décadas para incrementar el número de trasplantes son la utilización de injertos convencionales con criterios ampliados y la realización de trasplantes con injertos no convencionales. Se consideran injertos convencionales los injertos completos procedentes de donantes en muerte encefálica (DME) y se consideran injertos no convencionales los procedentes de donante vivo, bipartición hepática (split), trasplante secuencial (dominó) y donante a corazón parado (DCP).
Trasplante con injertos convencionales con criterios ampliadosLa utilización de injertos con criterios ampliados, también denominados subóptimos o marginales, hace referencia a la utilización de órganos que, sin ceñirse estrictamente al concepto de órgano ideal, sí reúnen las características necesarias para poder implantarse. Si bien no hay unanimidad en cuanto a qué donantes deben considerarse como marginales o de riesgo, la mayoría de los grupos considera como tales los siguientes: donantes de edad avanzada, donantes con esteatosis hepática (EH), donantes con serologías positivas para el virus de la hepatitis C (VHC) y con anticuerpos contra el HBcAg (hepatitis B core antigen ‘antígeno del core del virus de la hepatitis B’), donantes con neoplasia y donantes con enfermedad benigna hepática subyacente (tumores benignos, traumatismos e injertos reutilizados).
En la última década, la utilización de este tipo de órganos se ha incrementado significativamente, tanto en España como en el resto de Europa y América. De forma paralela al incremento de implantes de hígados con criterios ampliados, ha aumentado la preocupación y la incertidumbre en el seno de los distintos equipos acerca de los resultados a largo plazo obtenidos con TH realizados mediante la utilización de este tipo de injertos. En este sentido, en los últimos años son muchos los trabajos aparecidos en la literatura médica que hacen referencia a la utilización de donantes con criterios ampliados4. Asimismo, se han publicado guías de actuación que han elaborado distintos grupos de trabajo5 e índices de riesgo (donor risk index)6 con objeto de valorar las ventajas y los inconvenientes de ealizar un TH con este tipo de órganos frente a la permanencia en lista de espera por un tiempo indeterminado aguardando un donante con características que se desconocen. Estos trabajos coinciden en señalar que, en última instancia, la decisión de implantar un órgano procedente de un donante con criterios ampliados deberá valorarse en función de las características del órgano en cuestión, del receptor al que estaría destinado y de la situación de la lista de espera.
Donantes de edad avanzadaTanto nacional como internacionalmente la edad del donante se ha ido alejando de la considerada inicialmente como límite por los diferentes grupos. En España, la edad media de los donantes hepáticos se ha incrementado en la última década: pasó de 30 a 55,4 años, entre 1991 y 20073. Sin embargo, este incremento en la edad del donante no puede ser ilimitado. No se debe olvidar que el hígado experimenta con el paso del tiempo un proceso de envejecimiento paralelo al del organismo en su conjunto, en el que se identifica una serie de cambios7 morfológicos, hemodinámicos, histológicos y en la función de síntesis, que pueden condicionar su viabilidad en el receptor del TH. De tal forma que a medida que se incrementa la edad del donante, aumenta la prevalencia de EH; se ha comunicado un impacto negativo en la supervivencia del injerto a corto plazo cuando ambas condiciones, edad avanzada y esteatosis moderada o grave, están presentes8.
Junto con estos cambios hepáticos, el incremento de la edad del donante se asocia a una mayor prevalencia de arteriosclerosis, diabetes mellitus e hipertensión. La presencia de lesiones arteriales, como placas calcificadas en la arteria hepática, puede ser una fuente de complicaciones en el receptor del TH9. Sin embargo, la presencia de hipertensión y diabetes en el donante no ha demostrado tener un efecto negativo en los resultados10.
Otro punto que tener en cuenta en los donantes de edad avanzada es la mayor presencia de neoplasias no conocidas previamente, fundamentalmente originadas en la próstata y el riñón, lo que obliga a realizar una meticulosa exploración intraoperatoria por parte del cirujano que realiza la extracción.
La controversia generada inicialmente acerca del límite de edad para la donación hepática parece haber quedado superada tras la publicación de varias series, en las que la evolución y los resultados del TH no estaban influenciados por la edad del donante9,11. Cuando se limita el tiempo de isquemia fría a un máximo de 8h, los resultados con donantes por encima de 50 años son equivalentes a los obtenidos al utilizar donantes por debajo de esta edad.
El análisis de los datos del RETH12 demuestra que la supervivencia actuarial a 1 año mediante la utilización de injertos procedentes de donantes entre 60 y 90 años es tan sólo ligeramente inferior a la obtenida cuando se compara con el implante de hígados procedentes de donantes de entre 15 y 60 años. A los 5 años, estas diferencias se incrementan; no obstante, es importante señalar que los receptores de estos injertos tienen una mayor prevalencia de hepatocarcinoma, VHC y recidiva de la enfermedad primaria. En este sentido, la utilización de injertos procedentes de donantes de edad avanzada parece tener un efecto particularmente deletéreo en pacientes con cirrosis por VHC, lo que condiciona una recidiva más temprana y grave13.
En la actualidad, la edad avanzada no se considera una barrera para la donación y se debe valorar cada órgano de forma individualizada de acuerdo con el estado funcional y estructural del órgano que va a implantarse14, prestando especial atención a la existencia de otros factores de riesgo, como esteatosis y tiempo de isquemia fría prolongado15.
Injertos con esteatosis hepáticaOtro de los parámetros con límites inicialmente fijados que se sobrepasaron de cara a aumentar el número de órganos disponibles para TH es el grado de EH del donante. El aumento de donantes con EH se ha producido de forma paralela al ya comentado incremento en la edad de éstos así como a una mayor prevalencia de donantes con hipertensión arterial, diabetes mellitus y obesidad, todos estos factores asociados a la presencia de esteatosis16. La prevalencia de EH en DME en el mundo occidental puede representar hasta un 26%17.
Hay 2 tipos de EH: macrovesicular y microvesicular, aunque en la mayor parte de los casos aparecen ambas combinadas en diferentes proporciones. La EH macrovesicular es la más deletérea para el injerto al producir alteraciones en la microcirculación intrahepática que producen importantes alteraciones durante el proceso de preservación y reperfusión del injerto. Cuantitativamente, la EH se clasifica como leve si el porcentaje de hepatocitos grasos es inferior al 30%, como moderada si oscila entre el 30 y el 60% o como grave si más del 60% de los hepatocitos están afectados18.
De forma global, se acepta que la EH microvesicular no es una contraindicación para la donación, pero sí la macrovesicular, especialmente la grave. De hecho, la utilización de injertos con EH grave se asocia a una mayor incidencia de fallo primario del injerto, a una recidiva de VHC más agresiva y precoz, a una menor supervivencia del injerto y, probablemente, a una menor supervivencia del paciente19,20.
Los injertos que plantean dudas en cuanto a su viabilidad para la realización de un TH son los que presentan EH moderada. De tal forma que, aunque el empleo de órganos con EH moderada suele asociarse a similares tasas de supervivencia del paciente, se han reportado tasas superiores de fallo primario del injerto (el 13 frente al 3%)21,22. Por esto, su utilización debe valorarse junto con la existencia de otros factores de riesgo del donante o del receptor, entre los que se encuentran tiempos de isquemia fría prolongados, donantes de edad avanzada y receptores de VHC+.
La utilización de sustancias citoprotectoras (antioxidantes, pentoxifilina, interleucina 6, factor de crecimiento hepático humano recombinante y N-acetilcisteína) y el precondicionamiento isquémico han demostrado tener un efecto beneficioso en la recuperación funcional postrasplante de hígados esteatósicos tras períodos de preservación más o menos prolongados. Sin embargo, su utilidad en la práctica clínica en este contexto está aún por demostrarse.
Donante con serología positiva para el virus de la hepatitis CEl número de donantes con serología positiva para VHC continúa siendo reducido. En el pasado año 2007 la prevalencia de positividad para anticuerpos contra el VHC con respecto al total de donantes de hígado en España fue del 1,5%. De éstos, tan sólo el 50% se implantó y el resto se descartó, lo que representó un total de 10 TH con este tipo de injertos3.
La utilización de órganos procedentes de donantes VHC+ en receptores VHC+ se sustenta fundamentalmente en 2 hechos unánimemente aceptados por la comunidad científica: por un lado, la cirrosis hepática asociada a VHC es la principal indicación de trasplante y, por otro lado, la reinfección del hígado implantado por el VHC es universal y su evolución a cirrosis es más rápida. Además, la incertidumbre inicial acerca del posible efecto deletéreo de la discordancia de genotipos entre donante y receptor se ha disipado debido a que se ha comprobado que los receptores en los que el genotipo del donante se vuelve dominante asocian una recidiva de la enfermedad más leve23. Además, siempre que el genotipo 1 esté presente, ya sea en el donante o en el receptor, se vuelve dominante23,24.
Aunque en la mayoría de las series publicadas el número de pacientes es escaso, no se encuentran diferencias a corto plazo en la evolución de los receptores de injertos VHC+ frente a los receptores de injertos VHC−. El análisis de datos del registro americano de trasplante hepático (UNOS [United Network for Organ Sharing]), que incluye 96 donantes VHC+, demuestra que el estado de la serología del donante frente al VHC no influye en la supervivencia del receptor VHC+ de uno a 5 años24.
Los injertos hepáticos provenientes de donantes VHC+ únicamente se deben utilizar en receptores VHC+ y es necesario realizar una biopsia hepática durante el proceso de donación para descartar hígados con fibrosis o hepatitis25. También es recomendable realizar un protocolo de seguimiento que incluya la realización de biopsias seriadas para monitorizar la posible progresión de la enfermedad vírica en el injerto. Con todo esto, los buenos resultados obtenidos permiten sumar esta fuente de órganos al resto de estrategias desarrolladas para aumentar el número de órganos disponibles para trasplante.
Donante con anticuerpos frente al antígeno del core del virus de la hepatitis BSegún datos de la Organización Nacional de Trasplantes (ONT)3, el 11,1% del total de donantes presenta anticuerpos contra el HBcAg+: el 4,9%, anticuerpo contra el antígeno de superficie del virus de la hepatitis B (anti-HBs) negativo y el 6,2% anti-HBs+. De tal forma que si estos donantes se descartaran inicialmente se estima que se perdería del 12 al 18% de los donantes en España.
El principal riesgo asociado a la utilización de injertos HBcAg+ es el desarrollo de hepatitis B de novo en el receptor, que puede alcanzar el 70% si el receptor no tiene anticuerpos frente al virus de la hepatitis B (VHB), pero es del 0 al 18% si el receptor tiene anti-HBs o HBcAg26. Por tanto, se contraindica la realización de un TH ante la presencia de ácido desoxirribonucleico y VHB+ determinado por la reacción en cadena de la polimerasa en el donante cuando se asocia a una serología anti-HBs– y HBcAg– (naive) del receptor en el momento del trasplante.
No obstante, se ha observado que la administración profiláctica de lamivudina de forma aislada o asociada a inmunoglobulina contra el virus B (IGHB) puede llegar a eliminar el riesgo de transmisión de la infección por VHB. Incluso algunos autores defienden la utilización combinada de injertos VHC+ y HBcAg+, y destacan que la profilaxis con lamivudina o IGHB ofrece un sustancial beneficio en la supervivencia.
De forma general y de acuerdo con la bibliografía publicada, los injertos HBcAg+ deben implantarse en receptores con anticuerpos frente al VHB y asociar profilaxis a lamivudina o a inmunoglubulina específica en función del riesgo. Los resultados del TH mediante la utilización de órganos procedentes de donantes HBcAg+ en receptores con cirrosis VHB no afectan a la supervivencia de paciente e injerto, sin embargo, sin tratamiento profiláctico el riesgo de recidiva de la enfermedad es 2,5 veces superior27,28,29. Los receptores ideales para un órgano de HBcAg+ son aquellos pacientes con cirrosis VHB en los que se ha iniciado tratamiento frente al VHB antes de recibir el injerto y que éste será mantenido en el postrasplante.
Las estrategias encaminadas a la optimización de los resultados mediante la utilización de este tipo de hígados exigen la vacunación de los pacientes en lista de espera para TH y un adecuado emparejamiento entre donante y receptor que permita unas mejores tasas de supervivencia de injerto y paciente.
Donante con neoplasiaLa utilización como donantes de pacientes con historia previa de enfermedad neoplásica se ha regulado mediante documentos de consenso editados por la ONT y la Comisión de Trasplantes del Consejo de Europa con objeto de evitar la transmisión tumoral con el trasplante30.
En el momento actual se considera que los pacientes con antecedentes de neoplasias malignas pueden ser donantes de órganos siempre que hayan transcurrido al menos 10 años desde que se trató el tumor con intención curativa. Sin embargo, pacientes afectados de cáncer de mama, melanoma cutáneo y sarcoma de partes blandas se excluyen, ya que estas neoplasias pueden presentar progresiones lentas y recidivar después de 10 años de tratarse.
Hay una serie de tumores de crecimiento local y bajo riesgo de metástasis que no contraindican la donación. Entre éstos se encuentran los carcinomas cutáneos (basocelular y espinocelular de pequeño tamaño), el carcinoma in situ de cuello uterino, los tumores del sistema nervioso central (excepto glioblastoma y meduloblastoma) y el carcinoma de células renales inferior a 4cm.
Ante situaciones en las que el hallazgo de la neoplasia se produzca de forma casual durante la evaluación del donante o durante la extracción del hígado, la utilización del injerto estará supeditada a la posibilidad de obtener un diagnóstico histopatológico certero que corrobore la naturaleza de la neoplasia. El análisis patológico de las lesiones halladas debe ser exhaustivo y la aceptación del donante debe someterse a los anteriores criterios de aceptación.
Injerto con enfermedad benigna subyacenteLas referencias a la utilización de injertos con tumoraciones hepáticas benignas son escasas y recogen comunicaciones de casos aislados.
Los quistes simples hepáticos se presentan en un 5% de la población y suelen ser lesiones únicas que por sí solas no contraindican la donación. Deben valorarse en función de su tamaño y su localización. Cabe la posibilidad de realizar fenestraciones de éstos antes del implante del injerto. Aunque no hay datos al respecto, la poliquistosis hepática múltiple bilobular con quistes superiores a 5cm de diámetro podría contraindicar la aceptación del injerto.
La presencia de hemangiomas hepáticos en principio no contraindica la aceptación del hígado para trasplante. Por lo general, suelen ser únicos y de un tamaño inferior a 4cm. No se debe realizar maniobra alguna sobre la lesión, salvo que se presente una rotura espontánea de ésta, en este caso debe enuclearse.
Ante la presencia de lesiones hepáticas indicativas de adenomas o hiperplasia nodular focal, debe procederse de forma sistemática a su extirpación y posteriormente al estudio histológico de la pieza, antes de la aceptación del injerto. El tipo y la extensión de la resección que debe realizarse y la presencia de un cirujano experimentado son factores que determinarán la posibilidad de utilización del injerto.
Los pacientes con lesiones hepáticas traumáticas susceptibles de considerarse como donantes son aquellos que presentan lesiones de menor magnitud, fundamentalmente las lesiones grado I y II, según la clasificación de la AAST (American Association for the Surgery of Trauma31. Durante el proceso de evaluación del injerto se ha de prestar especial interés en conseguir la hemostasia del parénquima hepático lesionado y evaluar y reparar la posible presencia de fugas biliares. También se debe valorar la existencia de áreas desvascularizadas que pueden condicionar la aparición de zonas de isquemia en el parénquima hepático tras el implante, lo que puede condicionar la aceptación de éste.
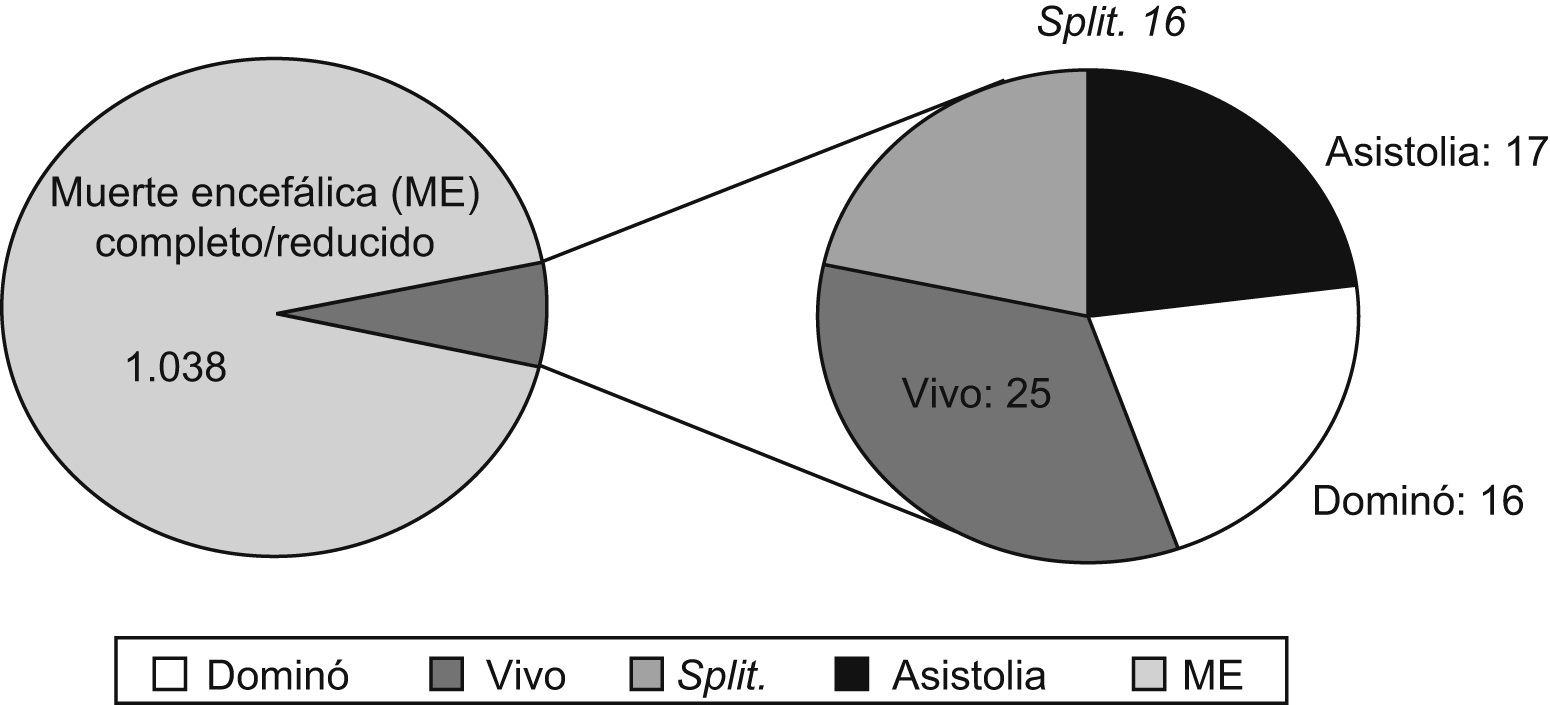
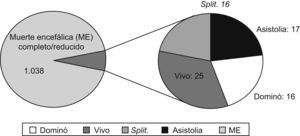
Trasplante con injertos no convencionalesLos injertos no convencionales son, según la clasificación de la ONT3, aquellos que no obedecen a una ampliación de los criterios de selección de donantes cadavéricos en muerte encefálica. Este tipo de trasplantes representaron el 6,7% del total de implantes realizados en el año 2007 en España (figura 2). Entre éstos se incluyen:
Figura 2. Trasplantes hepáticos realizados en España en 2007.
TH con injerto procedente de bipartición hepática o split;
TH con injerto procedente de donante vivo;
TH secuencial o en dominó, y
TH con injerto procedente de DCP.
El estudio anatómico de hígado iniciado por Couinaud en 1957 permitió reconocer la naturaleza segmentaria del hígado tal y como se concibe en la actualidad, lo que posibilita obtener 2 injertos hepáticos válidos a partir de un único donante. Por otro lado, la gran reserva funcional del hígado sano hace que entre un 30 y un 40% de la masa hepática sea suficiente para suplir las necesidades del organismo. Estos 2 hechos junto con la enorme capacidad regenerativa que posee el hígado, que lleva a un crecimiento del injerto implantado hasta alcanzar la masa hepática normal en unas semanas, posibilitan la realización de trasplantes con injertos parciales.
La clave principal de esta técnica es la sección adecuada del parénquima hepático, de manera que se preserven tanto las estructuras vasculares como las biliares, lo que posibilitará el implante posterior y el correcto funcionamiento de cada uno de los injertos. En ambos es preciso garantizar un volumen apropiado y una funcionalidad apropiada.
Se han descrito 2 técnicas para realizar la partición hepática: en la sección ex situ la partición se realiza una vez que el hígado se ha extraído del donante y se lleva a cabo en la cirugía de banco32, mientras que la partición in situ se realiza durante la extracción del injerto que será mantenido con soporte hemodinámico hasta la finalización de la extracción. Tanto una como otra técnica presentan una serie de ventajas y desventajas que las hacen más susceptibles de que las empleen grupos con distinta experiencia, posición geográfica o volumen de procedimientos realizados. No obstante, se ha demostrado que la técnica in situ elimina el prolongado tiempo de isquemia empleado en la partición ex situ y presenta una menor incidencia de complicaciones del tracto biliar, hemorragia postoperatoria e isquemia del segmento iv 33.
En 1988 se publicó el primer caso de TH split, en el que se injertó el lóbulo hepático derecho a un adulto y el lóbulo izquierdo a un receptor pediátrico32. Bismuth, en 1989, realizó por primera vez un trasplante a 2 receptores adultos a partir de un único hígado34. Broelsch, en 199035, publicó las primeras series de TH split. En estas series iniciales los resultados fueron significativamente inferiores al trasplante de hígado entero: sólo el 67% de los niños y el 20% de los adultos sobrevivieron. Sin embargo, en los últimos años, el refinamiento de la técnica quirúrgica así como la mejor selección de pacientes han permitido mejorar las tasas de supervivencia de paciente e injerto y disminuir el número de complicaciones postoperatorias hasta situarlas en cifras comparables al trasplante de hígado entero. Actualmente, se considera que la bipartición hepática es una opción segura y válida para trasplantar un receptor pediátrico y un adulto36,37,38,39,40,41 (tabla 1).
Tabla 1. Principales series de trasplante hepático split
| Autor | Año | n | Técnica | Supervivencia del paciente a 1 año, % | Supervivencia del injerto a 1 año, % |
| Emond | 1990 | 18 | Ex situ | 67 | 50 |
| De Ville | 1995 | 98 | Ex situ | 68 | 62 |
| Otte | 1995 | 29 | Ex situ | 71 | 67 |
| Rela | 1998 | 41 | Ex situ | 90 | 88 |
| Broering | 2001 | 49 | Ambas | 82 | 76 |
| Ghobrial | 2000 | 110 | In situ | 79 | – |
| Spada | 2000 | 39 | In situ | 84 | 76 |
| Yersiz | 2003 | 92 | In situ | 78 (3 años) | 68 (3 años) |
| Cardillo | 2006 | 323 | In situ | 79,4 (3 años) | 72,2 (3 años) |
Aunque hay algunas discrepancias entre grupos de trasplante, las condiciones más aceptadas para determinar si es posible realizar un trasplante tipo split son las siguientes:
Variables dependientes del donante: edad inferior a 50 años, mínima comorbilidad asociada, sin antecedentes de enfermedad ni daño hepático, perfil hepático normal o mínimamente alterado, estancia en unidad de cuidados intensivos inferior a 5 días, estabilidad hemodinámica sin requerimiento de fármacos vasoactivos e hígado de aspecto macroscópico normal.
Variables dependientes del receptor: receptor del lóbulo izquierdo de bajo peso (<60kg), relación entre peso del injerto y peso del receptor próxima al 1%, trasplante en situación no urgente y trasplante primario.
El principal problema para la expansión del trasplante tipo split entre 2 adultos es la obtención de injertos con un adecuado tamaño en relación con el peso de ambos receptores. Es difícil encontrar receptores adultos del lóbulo hepático izquierdo que presenten un tamaño suficientemente pequeño para poder realizar con garantías el trasplante. El riesgo del síndrome de small-for-size o fracaso hepático postrasplante por el pequeño volumen hepático trasplantado es especialmente alto en estos casos, sobre todo cuando el grado de hipertensión portal es elevado.
Trasplante hepático con injerto procedente de donante vivoEl TH de donante vivo (THDV) surge como un intento de solucionar la escasez de órganos adecuados para los receptores pediátricos, lo que motivaba una mortalidad en lista de espera del 30 al 40%42,43,44. El primer THDV con éxito lo realizó Strong45 en Australia y la primera serie la publicó Broelsch et al46, con 20 THDV realizados sobre receptor pediátrico.
El éxito obtenido en el receptor infantil permitió la reproducción del THDV en el paciente adulto47,48,49. La expansión de esta técnica en el adulto se impulsó principalmente en Asia, donde por razones culturales no se admite el concepto de muerte cerebral, por lo que la disponibilidad de injertos de cadáver es mínima o inexistente, aunque se extendió rápidamente a Europa y América para tratar de solventar el problema de la mortalidad en la lista de espera. Tras unos primeros resultados desalentadores debidos fundamentalmente al fenómeno de small- for-size, ya que en estos implantes en adultos se utilizaba lóbulo hepático izquierdo, tras el primer THDV, en el que se utilizó lóbulo hepático derecho realizado por el grupo de la Universidad de Kyoto18, el número de procedimientos realizados experimentó un crecimiento exponencial.
Globalmente, se considera que aquellos pacientes candidatos a recibir un THDV deben cumplir los requisitos generales para incluirse en lista de espera para TH. Sin embargo, hay cierta controversia, ya que algunos autores consideran que este tipo de trasplante podría permitir extender las indicaciones de trasplante en determinadas etiologías50.
La implantación del sistema MELD (Model for End-stage Liver Disease) hace que se seleccionen como candidatos al THDV aquellos pacientes con puntuaciones intermedias de la lista de espera, ya que en ellos las posibilidades de recibir un órgano de un donante cadavérico son reducidas, al menos que su estado se deteriore. Este hecho supone una ventaja adicional en la distribución de los injertos, ya que diversos estudios ponen de manifiesto que los resultados del THDV empeoran a medida que aumenta la puntuación MELD51, así como la ausencia de un beneficio claro para los pacientes cuando el MELD se sitúa por debajo de 1552.
Se considerarán como posibles donantes aquellos sujetos que de forma voluntaria soliciten información sobre el procedimiento. Los requisitos mínimos que han de cumplirse para iniciar la evaluación incluyen, en el protocolo del Hospital Clínic de Barcelona, tener una edad entre 18 y 55 años, un grupo sanguíneo idéntico o compatible con el receptor y un estado de salud aparentemente normal, así como la ausencia de enfermedades asociadas. La valoración del potencial donante se realiza bajo la premisa de garantizar al máximo la seguridad del paciente y se lleva a cabo de forma secuencial, ya que se trata de un proceso que asocia un elevado coste económico. Una parte fundamental del estudio es la estimación del volumen hepático, puesto que un volumen insuficiente del injerto puede conllevar la aparición del ya mencionado síndrome de small-for-size, que podría conducir a la pérdida de éste. Actualmente, tanto la tomografía computarizada (TC) helicoidal como los nuevos modelos de resonancia magnética (RM) permiten calcular el volumen total o parcial del hígado con gran fiabilidad53,54,55. Estas pruebas de imagen permiten conocer el volumen total del hígado del potencial donante, la cantidad del parénquima remanente tras la extracción y el tamaño del injerto que, de forma análoga a la bipartición hepática, debe representar entre el 0,8 y el 1% del peso del receptor56. Junto con la estimación del volumen hepático, la TC y la RM son claves para el adecuado conocimiento de la anatomía vascular del hígado del potencial donante, lo que permite asegurar el éxito y la seguridad de la intervención tanto en el donante como en el receptor57,58. La RM añade una eficaz evaluación de la vía biliar, por lo que en la actualidad es la exploración de elección en la evaluación del potencial donante59.
La técnica quirúrgica, tanto en el donante como en el receptor, implica una elevada complejidad técnica, por lo que deben realizarla grupos de trasplante experimentados. No obstante, presenta una serie de ventajas sobre el TH con donante cadáver, ya que el THDV permite programar el procedimiento y reducir el tiempo de isquemia. Por otro lado, se trata de un procedimiento quirúrgico que no está exento de riesgos para el donante, con una morbilidad que varía en función de las series publicadas entre un 25 y un 47%60,61, en el que las complicaciones más frecuentes son las asociadas a problemas de la vía biliar. En cuanto a la mortalidad del procedimiento, si bien es difícil de conocer por la falta de uniformidad en la recogida de datos, la última revisión publicada en la literatura médica a este respecto eleva a 33 los donantes fallecidos en todo el mundo como consecuencia, más o menos directa, de este proceso62.
En cuanto a los resultados obtenidos en el receptor y según datos del UNOS, hasta el momento se han realizado 2.473 THDV en receptores adultos en EE. UU. La supervivencia del injerto (el 82,5% al año, el 72,3% a los 3 años y el 66,0% a los 5 años) y del paciente (el 90,1% al año, el 82,6% a los 3 años y el 77,8% a los 5 años) es similar a la obtenida con injertos procedentes de donantes cadavéricos63. El análisis de la experiencia europea hasta junio de 2007 revela un total de 2.370 THDV en receptores adultos y pediátricos (datos del ELTR [European Liver Transplantation Registry])64, con una supervivencia global del injerto a uno, a 3 y a 5 años del 80, el 73 y el 70%, respectivamente. En España, de acuerdo con los datos del RETH2 se han realizado hasta diciembre del pasado año 110 THDV en adultos, con una supervivencia del injerto del 79,3% al año y del 64% a los 5 años.
Algunas publicaciones indican que en el caso del THDV la recidiva del VHC podría ser más agresiva y temprana en comparación con el TH de un órgano completo procedente de un DME. Sin embargo, hasta el momento ningún estudio ha demostrado que los resultados en términos de supervivencia de injerto o paciente sean inferiores en pacientes VHC+ trasplantados con injertos procedentes de donante vivo65.
Por último, otro de los aspectos que genera cierta controversia es la expansión de los criterios de trasplante en pacientes con carcinoma hepatocelular (CHC). El THDV permite la realización del trasplante tras el diagnóstico sin tiempos de espera que condicionen la progresión o la diseminación de la enfermedad, lo que permite una mejora de los resultados con respecto al TH convencional66,67. Este hecho hace que se plantee la posibilidad de aceptar para el THDV pacientes con CHC en estadios más avanzados que los incluidos en lista de espera para TH de donante cadáver, sin que esto implique un menoscabo de las tasas de supervivencia y recidiva de la enfermedad. Actualmente, queda por dilucidar mediante el desarrollo de protocolos clínicos la ampliación de los criterios de trasplante con donante vivo en pacientes con CHC68.
La supervivencia a corto plazo después del THDV es similar a la obtenida con un donante cadáver. La mayoría de los grupos europeos y americanos refieren una supervivencia global cercana al 90%63.
Considerado por algunos autores como la alternativa más eficaz para solucionar la escasez de órganos, el número máximo de procedimientos en EE. UU. se alcanzó en el año 2001, año en el que se realizó THDV en el 10% del total de los trasplantes realizados ese año. Desde entonces y tras el auge inicial, el porcentaje ha disminuido de forma progresiva hasta situarse alrededor del 5% del total, como recoge el informe de 2007 de la ASTS (American Society of Transplant Surgeons)69.
Trasplante hepático secuencial o dominóEl TH dominó (THD) es un trasplante secuencial en el que un paciente con una hepatopatía crónica o tumor hepático recibe un órgano completo procedente de un donante vivo que presenta una enfermedad metabólica, el que a su vez recibe un injerto procedente de un donante cadáver.
En la mayoría de los casos descritos en la literatura médica la enfermedad metabólica es una polineuropatía amiloidótica familiar (PAF) tipo I, aunque se han comunicado THD en pacientes con hiperoxaluria70, enfermedad de la orina de jarabe de arce y amiloidosis de cadena α del fibrinógeno.
El paciente afectado de PAF posee un hígado anatómicamente normal, que produce una variante anómala de una proteína sérica denominada transtirretina, que al depositarse en los tejidos da lugar a la formación de una sustancia amiloide. Las manifestaciones clínicas consisten en una polineuropatía periférica y del sistema vegetativo que tras su inicio en la tercera o la cuarta década de la vida causan la muerte del paciente al cabo de 10 a 12 años tras el inicio de la sintomatología71. En estos pacientes el TH interrumpe el curso de la enfermedad, estabiliza el deterioro e incluso permite cierta mejoría clínica.
El injerto obtenido de un donante afectado por PAF continúa produciendo transtirretina anómala; sin embargo, dado que la historia natural de la enfermedad exige varias décadas para el inicio de las manifestaciones clínicas neurológicas, el riesgo que éstas se presenten en receptores de edad avanzada es muy bajo. Tan sólo se han descrito 2 casos aislados de desarrollo de polineuropatía antes de 10 años en receptores de TH secuencial72,73.
La obtención del injerto afectado de PAF presenta una serie de peculiaridades técnicas, la más relevante de éstas hace referencia al tratamiento de la vena cava retrohepática, que puede extraerse con el injerto y precisar la utilización de un bypass venovenoso, o bien mantenida in situ, lo que condiciona la calidad del injerto.
El primer trasplante de este tipo se realizó en 1995, desde entonces y hasta el año 2006 se han recogido en el FAPWTR (Familial Amyloidotic Polineuropathy World Transplant Registry) un total de 570 TH secuenciales74. En el año 2007 se realizaron en España 16 THD, lo que representa el 1,4% de los trasplantes realizados en España en este período de tiempo3.
Los estudios publicados confirman que el TH ofrece excelentes resultados a aquellos pacientes diagnosticados de PAF tipo I, sin que la donación hepática presente una influencia negativa en términos de supervivencia, ya que la supervivencia de los donantes al año y a los 5 años es similar a la de los pacientes con PAF que no fueron donantes (el 91,8 y el 88,4% frente al 90,5 y el 84,2%)31. En España, según datos del RETH2 se han realizado hasta la fecha 81 TH secuenciales la supervivencia del injerto obtenido de un paciente con PAF fue del 90,7 y del 66,2% a uno y a 5 años, respectivamente. Del mismo modo, se evidencia una excelente calidad de los injertos hepáticos obtenidos de estos pacientes, por lo que dada la escasez de órganos, estaría indicada su utilización sistemática en pacientes de más de 60 años, cualquiera que sea la indicación del trasplante75.
Trasplante hepático con injerto procedente de donante a corazón paradoSe denomina DCP a aquél en el que el diagnóstico de muerte se realiza sobre la base del cese de la función cardíaca y no cerebral, como sucede en los DME. En España, la definición de muerte según criterios cardíacos está recogida en el Artículo 10.5 del Real Decreto 2070/1999 del 30 de diciembre de 1999, según el cual el diagnóstico de muerte por criterios cardiorrespiratorios se basará en la constatación inequívoca de la ausencia de latido cardíaco (demostrado por la ausencia de pulso central o por trazado electrocardiográfico) y de la ausencia de respiración espontánea, ambas situaciones durante un período no inferior a 5 min76.
Los primeros TH clínicos se llevaron a cabo utilizando DCP, pero tras la definición de muerte encefálica por la Universidad de Harvard en 1968 el uso de este tipo de donantes fue abandonado de manera progresiva a favor de los DME. Durante los últimos 10 años y debido al incremento, ya mencionado, de la cifra de pacientes en lista de espera y de la mortalidad de éstos, se ha recobrado el interés por este tipo de donantes en todo el mundo. De hecho, algunos autores afirman que la instauración de este tipo de programa en las diferentes ciudades podría aumentar el número de órganos disponibles hasta de un 25 a un 42%77,78, lo que quizá no solvente definitivamente el problema, pero en el caso del trasplante de hígado contribuiría de manera significativa a la reducción de las listas de espera. A pesar de estas ilusionantes previsiones, en la actualidad las cifras se sitúan muy por debajo del supuesto potencial del DCP. En España, parece intuirse cierto incremento desde el año 2000. Sin embargo, hasta el momento tan sólo se han realizado 75 TH mediante la utilización de este tipo de injertos, 17 de éstos se realizaron el pasado año 20073.
Los DCP experimentan un período de parada cardiorrespiratoria previo a la extracción hepática y según las circunstancias en las que ésta ocurre se han clasificado clásicamente de acuerdo con la clasificación de Maastricth79 en: tipo I, muerto a la llegada; tipo II, resucitación infructuosa; tipo III, parada cardíaca controlada, y tipo IV, parada cardíaca tras el diagnóstico de muerte cerebral.
La experiencia clínica es limitada y probablemente el principal obstáculo para la implantación de programas de DCP lo representa el hecho de que históricamente en la literatura médica se le han atribuido a estos donantes peores resultados en comparación con los observados en los DME, ya que se han comunicado peores tasas de supervivencia tanto de injerto como de receptor y una mayor incidencia de complicaciones biliares80, trombosis arterial81, rechazo y colestasis temprana. Sin embargo, estos estudios recogen DCP no controlados, lo que no es representativo de España, y están realizados sobre la base de un escaso número de pacientes, por lo que no cuentan con suficiente poder estadístico como para obtener conclusiones generalizables.
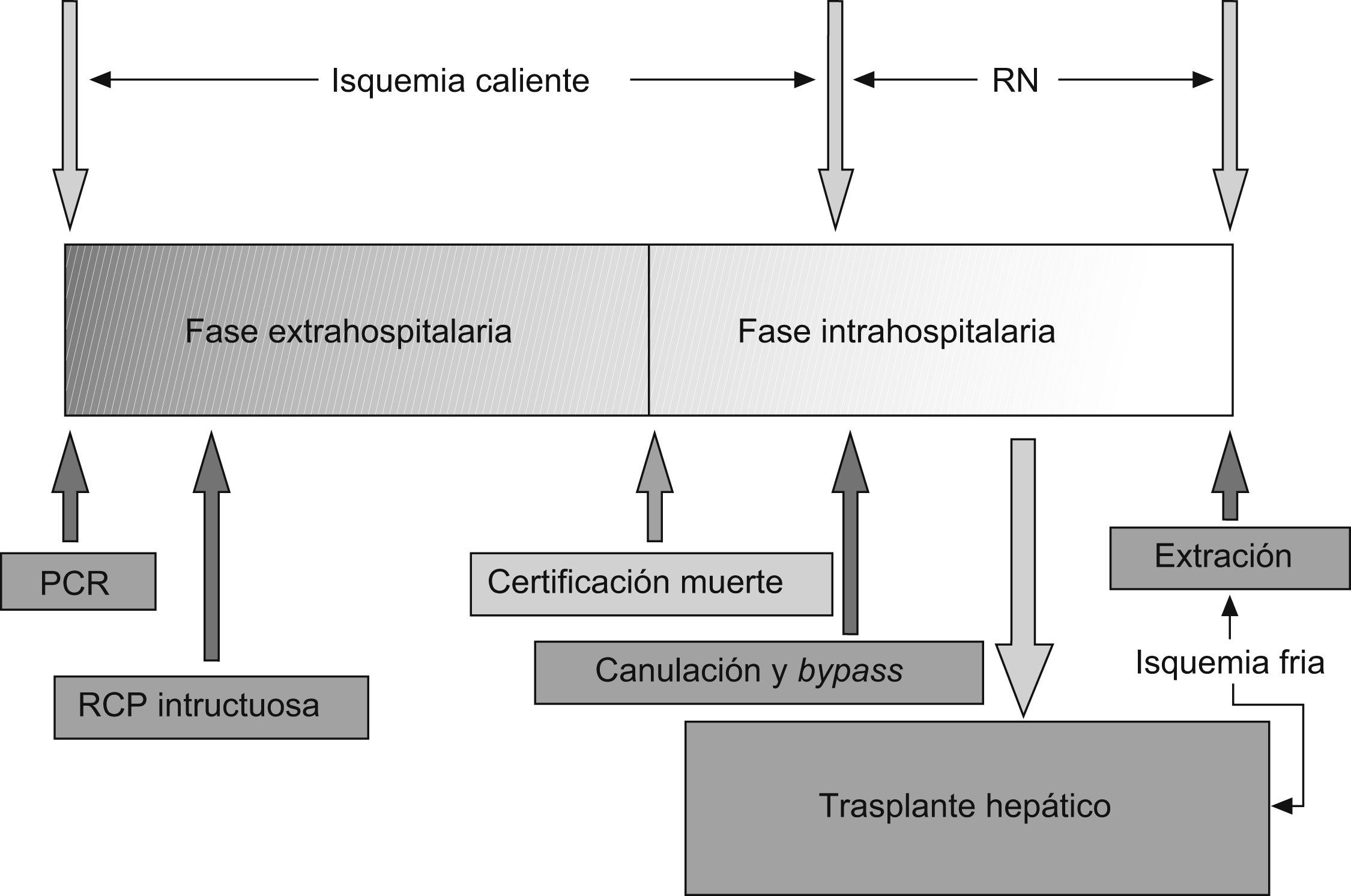
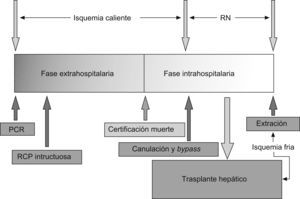
En España, los protocolos desarrollados por los distintos grupos de trasplante se centran en la obtención de injertos procedentes de donantes tipo II (figura 3). El DCP exige un apropiado mantenimiento que permita una adecuada perfusión hística del órgano previa a su enfriamiento antes del trasplante. En este sentido, los trabajos desarrollados por este grupo en el ámbito de la recirculación normotérmica (RN) han puesto de manifiesto que la conexión a un sistema de circulación extracorpórea reduce la lesión por isquemia, reperfusión en los hígados procedentes de estos donantes82,83,84,85. Parece claro que el uso de la RN y una exhaustiva selección de los donantes son la clave para mejorar los resultados obtenidos hasta el momento con el DCP.
Figura 3. Cronograma del procedimiento de donación en donante a corazón parado tipo II. PCR: parada cardiorrespiratoria; RCP: reanimación cardiopulmonar; RN: recirculación normotérmica.
Un adecuado mantenimiento del donante mediante RN unido a un exhaustivo conocimiento de las distintas fases de la donación y a un estricto seguimiento de los criterios de selección del donante son indispensables para minimizar las complicaciones y optimizar los resultados. Los criterios utilizados se basan en la actividad experimental y la clínica desarrollada en el Hospital Clínic, otros grupos nacionales los han adoptado y hacen referencia a distintos aspectos del proceso de donación86,87 (tabla 2).
Tabla 2. Criterios de aceptación de donante a corazón parado tipo II
| Características del donante | Características del procedimiento | Características evolutivas | Características de la extracción |
| • Edad inferior a 55 años • Serologías víricas negativas • Ausencia de contraindicación absoluta, criminalidad y traumatismo abdominal o femoral | • PCR sin RCP <15 min • RCP avanzada <150 min • RN <4 h | • Flujos en bomba > 1,7 l/min • GOT y GPT al inicio <3 veces el valor normal • GOT y GPT antes de la extracción <4 veces el valor normal | • RN hasta la extracción • Irrigación adecuada de los órganos intraabdominales • Aspecto macroscópico del injerto adecuado antes y después de la perfusión |
GOT: glutamic oxaloacetic transaminase ‘aminotransferasa glutamicoxalacética’; GPT: glutamic pyruvic transaminase ‘aminotransferasa glutámico pirúvica’; PCR: parada cardiorrespiratoria; RCP: reanimación cardiopulmonar; RN: recirculación normotérmica.
El cumplimiento de estos criterios puede asegurar una adecuada vialidad de los injertos obtenidos, lo que permite minimizar la incidencia de fallo primario del injerto, trombosis arterial y colangiopatía isquémica. Los prometedores resultados obtenidos por los distintos grupos de TH en España87,88 con la implantación de programas de DCP podrían verse mejorados en el futuro con el desarrollo de nuevas técnicas de preservación, como la perfusión normotérmica del injerto aislado previa al implante.
Otras alternativas terapéuticasXenotrasplanteEl concepto de xenotrasplante hace referencia al implante de órganos procedentes de animales en receptores humanos. La posibilidad de trasplantar hígados entre especies filogenéticamente distintas se indicó desde el comienzo de la propia historia del trasplante de órganos en humanos. Se realizó el primero de éstos en el año 1966, en el que se recurrió a la utilización de un chimpancé como donante89.
Por tanto, aunque la técnica quirúrgica está ampliamente desarrollada desde los inicios del xenotrasplante clínico, los obstáculos en el ámbito inmunológico, fisiológico e infeccioso son hoy en día insalvables. De este modo, a pesar de que cada vez es mayor el número de autores que reivindican el uso de xenoinjertos, su utilidad clínica es muy limitada. En la literatura médica90 tan sólo se recogen 12 casos de xenotrasplante clínico con injertos procedentes de chimpancé (n=4), babuino (n=7) y cerdo (n=1), el último de éstos en 1993. Los resultados obtenidos fueron desalentadores, ya que todos los pacientes fallecieron a corto plazo, la mayoría durante la primera semana tras el trasplante.
Actualmente, el xenotrasplante hepático es una opción terapéutica en fase experimental. El desarrollo de animales transgénicos y politransgénicos junto con la aplicación de nuevos protocolos de inmunosupresión podría permitir la superación de los impedimentos inmunológicos y fisiológicos. No obstante, los riesgos derivados de la transmisión de enfermedades interespecies hacen que, a corto y a medio plazo, el xenotrasplante carezca de aplicabilidad en la práctica clínica diaria91.
Trasplante de hepatocitosEl depósito de hepatocitos sanos viables en un hígado enfermo tras inocularse en el bazo, la arteria esplénica o la vena porta es un procedimiento innovador que ofrece importantes aplicaciones y que, al menos teóricamente, podría contribuir a disminuir el número de pacientes en lista de espera para TH. La base fisiológica de esta opción terapéutica radica en la capacidad de los hepatocitos diferenciados para proliferar, inducidos por estímulos que aún no se han caracterizado bien. Los hepatocitos se aíslan mediante técnicas de digestión enzimática con colagenasa, criopreservados y posteriormente cultivados. Tras el implante, los hepatocitos trasplantados pueden desarrollar, en teoría, todas las funciones del hígado sano.
El primer trasplante experimental de hepatocitos data de 196768, desde entonces esta técnica se ha utilizado con éxito en diferentes modelos experimentales y, hasta la fecha, la experiencia clínica recoge aproximadamente 50 trasplantes de hepatocitos tanto en situaciones de insuficiencia hepática aguda (n=26) y crónica (n=18) como en determinadas metabolopatías (n=6)92. Los resultados obtenidos en este reducido número de procedimientos son dispares y, al tratarse de un grupo heterogéneo en cuanto a las técnicas utilizadas y a las características de los receptores, no permiten extraer conclusión alguna en lo que respecta a su utilidad clínica, más allá de la mera consideración de esta opción como un procedimiento experimental.
La principal limitación para el desarrollo del trasplante de hepatocitos es la escasez de donantes. En la actualidad, la principal fuente son los hígados marginales no utilizados para TH y los segmentos hepáticos procedentes de injertos reducidos. Algunos autores indican que la investigación en células madre podría ser una nueva fuente de hepatocitos para trasplante.
Al mismo tiempo, la obtención de hígados mediante ingeniería de tejidos, que ya ha demostrado cierta viabilidad experimentalmente, podría situar el TH en un escenario completamente distinto al actual, pero que, sin embargo, tan sólo se vislumbra en el horizonte.
ConclusiónLa escasez de órganos para trasplante impulsa a los distintos equipos en busca de nuevas fuentes de donantes. El principal incremento debe sustentarse en un óptimo aprovechamiento del donante convencional mediante programas de concienciación social así como mejoras en las estrategias de detección y mantenimiento de donantes.
Entre las distintas alternativas a la donación convencional destacan la bipartición hepática, el THDV y el DCP. Estas opciones presentan una serie de limitaciones y, en la actualidad, representan un exiguo porcentaje dentro del total de TH realizados anualmente en el mundo. En este sentido, la utilización de injertos procedentes de split presenta una aplicabilidad restringida, ya que la bipartición entre 2 adultos no siempre asegura un adecuado volumen del parénquima funcional para cada uno de ellos y, por otro lado, debe realizarse por equipos experimentados. Del mismo modo, el THDV plantea una serie de limitaciones derivadas de la complejidad técnica del procedimiento y de la necesidad de obtener un injerto acorde con los requerimientos del receptor, a lo que se añade el riesgo que supone la intervención quirúrgica para el donante. Por último, el DCP representa probablemente la opción con mayores posibilidades de expansión. Sin embargo, es necesaria una estricta selección y un correcto mantenimiento del donante para garantizar la viabilidad de los órganos obtenidos.
La utilización de donantes no convencionales y la expansión de los criterios habituales deben realizarse con cautela y deben apoyarse en estudios experimentales y clínicos que demuestren la ausencia de deterioro de los resultados obtenidos en el receptor tanto a corto como a largo plazo.