Los sistemas de aféresis se han utilizado en la enfermedad inflamatoria intestinal con la base fisiopatológica racional de la inmunomodulación que se observa tras su aplicación. La técnica utiliza un sistema de extracción, filtrado y adsorción de células de la serie blanca fundamentalmente con 2 sistemas: granulocitoaféresis y leucocitoaféresis. Habitualmente se utiliza una sesión semanal durante 5 a 10 semanas consecutivas para inducir la remisión clínica, y se puede seguir con una sesión mensual si se plantea como tratamiento de mantenimiento. Hay pruebas en ensayo clínico controlado que no avalan su uso en esta pauta en la colitis ulcerosa (CU) activa de moderada a grave. Hay pruebas de menor peso que avalan su uso en la CU dependiente de los corticoides. La técnica es segura, con mínimos efectos adversos. En la siguiente revisión se detalla la bibliografía sobre la eficacia y la seguridad en las distintas situaciones clínicas en las que podría aplicarse.
Apheresis systems have been used in inflammatory bowel disease with a view to immunomodulation. The technique employs a system of white cell extraction, filtration and adsorption mainly with two systems: granulocytapheresis and leukocytapheresis. One session weekly for 5–10 consecutive weeks is usually used to induce clinical remission, while a monthly session can be used as maintenance therapy. Evidence from controlled clinical trials does not support the use of this modality in moderate to severe ulcerative colitis, while a lesser grade of evidence supports its use in corticosteroid-dependent ulcerative colitis. Apheresis is safe, with minimal adverse effects. The present article reviews the literature on the efficacy and safety of this technique in the distinct clinical situations in which it can be applied.
La enfermedad inflamatoria intestinal (EII) engloba una serie de enfermedades crónicas de las que la colitis ulcerosa (CU) y la enfermedad de Crohn (EC) son las más representativas. Su etiología es, hoy por hoy, desconocida y en su patogenia se imbrican factores genéticos y ambientales que acaban condicionando una respuesta inmune anómala en la mucosa intestinal con consecuencias locales y sistémicas. El curso clínico se caracteriza por períodos de exacerbación y remisión de frecuencia imprevisible. Los síntomas que los pacientes presentan están condicionados por la extensión del proceso y por el grado de actividad inflamatoria de la enfermedad.
El objetivo primario del tratamiento médico en la EII persigue la inducción de la remisión en el brote de la actividad inflamatoria y el mantenimiento de esta remisión a largo plazo. La finalidad del tratamiento es conseguir la máxima eficacia terapéutica con la menor toxicidad posible y mejorar la calidad de vida de los pacientes que tienen estas enfermedades. El mantenimiento de la inactividad condiciona la ausencia de progresión de las lesiones morfológicas en la pared intestinal y sus complicaciones: estenosis y fístulas, rectorragia, fenómenos de translocación bacteriana y megacolon.
Los fármacos clásicamente utilizados en la EII han sido los corticoides en los brotes agudos y los aminosalicilatos y los inmunosupresores (azatioprina y 6-mercaptopurina [MP]) como tratamiento de mantenimiento. Aproximadamente un tercio (o más) de los pacientes no responden al tratamiento convencional o presentan efectos adversos que condicionan su retirada. El conocimiento progresivo de los factores etiopatogénicos de la EII ha conllevado la aparición de nuevos fármacos dirigidos de una forma más selectiva hacia las citocinas que magnifican los fenómenos inflamatorios. Los agentes biotecnológicos, con los fármacos anti-TNF (tumor necrosis factor 'factor de necrosis tumoral') como los más conocidos y representativos de este grupo, han supuesto una absoluta revolución en los últimos años en el tratamiento de la enfermedad. Los datos más recientes enfatizan en la importancia de los fenómenos de autofagia, en la alteración del eje de interleucina (IL)-23 e IL-17 y en la implicación en la perpetuación de la inflamación de un nuevo miembro de la familia del TNF: TL1A1, lo que abre nuevas vías potenciales en la aproximación terapéutica a la CU.
Las indicaciones de los fármacos anti-TNF se han extendido desde las indicaciones iniciales en la EC de resistencia a los corticoides o en la enfermedad fistulizante agresiva a su uso cada vez más precoz en esta enfermedad y a su aprobación en la CU. La introducción precoz de fármacos más efectivos que los corticoides y los salicilatos, es decir de inmunosupresores y anti-TNF, en estas enfermedades persigue la curación mucosa y la no progresión de lesiones que condicionen complicaciones. Simultáneamente al desarrollo de los fármacos anti-TNF se evaluaron en Japón distintos sistemas de extracción (aféresis) de sustancias mediadoras de la inflamación del torrente sanguíneo. Las técnicas de aféresis (plasmaféresis, citoaféresis) disponen de la ventaja, frente a los inmunosupresores o a los agentes biotecnológicos, de sus escasos efectos secundarios. En el caso de la EII, la leucocitoaféresis (LCAP) ha sido la técnica más empleada. Los resultados de los primeros estudios publicados en la CU fueron alentadores2,3 y la técnica se introdujo en Europa como forma alternativa de tratamiento en pacientes con EII que no respondían a los tratamientos convencionales o tenían efectos secundarios con éstos.
Sistemas de aféresis. TécnicaLas técnicas de la aféresis leucocítica consisten en la extracción de los leucocitos de la sangre por medio de un sistema extracorpóreo vena–vena. La sangre extraída se hace circular, antes de reinfundirse, a través de una columna o filtro. Actualmente hay en Japón y en Europa 2 sistemas comercializados de citoaféresis para el tratamiento de la EII y otras enfermedades autoinmunitarias: Adacolum® y Cellsorba®. El Adacolum® (Japan Immunoresearch Laboratories, JIMRO, Takasaki, Japan) realiza una aféresis selectiva de granulocitos y monocitos y de una mínima fracción de linfocitos. Esta granulocitoaféresis (GCAP) se obtiene por el paso de la sangre a través de una columna que contiene 35.000 gránulos de diacetato de celulosa de 2mm de diámetro a las que se van a adherir los granulocitos y los monocitos; con este sistema se consigue eliminar el 65% de los primeros y el 55% de los segundos, sin que el número de linfocitos y de plaquetas se vea alterado. El Cellsorba® (Asahi Kasei Medical Co. Ltd, Tokyo, Japan) consiste en un filtro formado por una membrana de fibra de poliéster no tejido que produce la LCAP, atrapa de forma no selectiva el 90% de los leucocitos e incluye un 60% de linfocitos y también un 35% de la mezcla plaquetar.
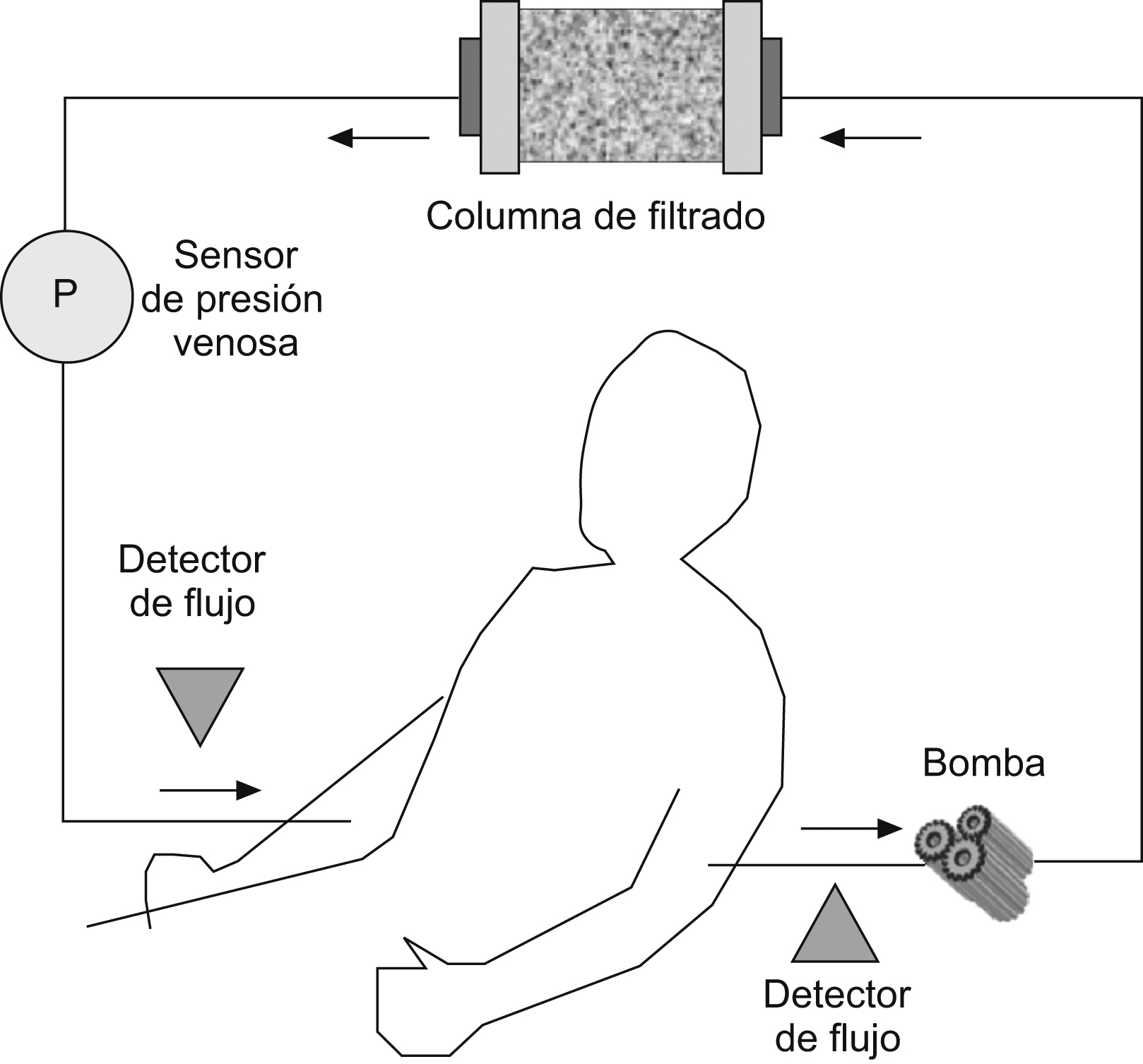
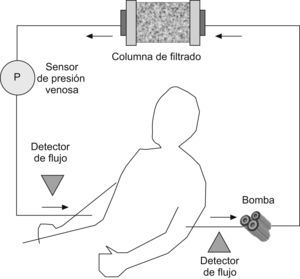
El procedimiento de aféresis dura habitualmente una hora y se realiza en unidades de hemodiálisis o bancos de sangre, aunque tras una formación adecuada se puede realizar en unidades de tratamiento en régimen de hospital de día. La velocidad de extracción de la sangre suele ser de unos 30ml por minuto, con lo que en una sesión se procesan hasta 1.800ml de sangre; este hecho se ha relacionado, al menos teóricamente, con un inicio de acción lento, pues en cada sesión sólo se depura aproximadamente un tercio del volumen sanguíneo. La única limitación práctica para su realización consiste en la mala accesibilidad para la canalización de las vías periféricas, lo que podría exigir la canulación de una vía central; de acuerdo con la duración del tratamiento (mínimo de 5 a 10 semanas) y de que se trate en general de pacientes ambulatorios, la colocación de vías centrales no es recomendable. Durante el procedimiento se utiliza un anticoagulante para evitar la coagulación del sistema extracorpóreo, habitualmente la heparina en el caso de la GCAP y mesilato de nafamostat en el caso de la LCAP. Se ha indicado que el tipo de anticoagulante utilizado podría tener relación con su seguridad. El esquema de la técnica se simplifica en la figura 1.
Figura 1. Esquema general del procedimiento del sistema de la aféresis. La sangre circula en un circuito extracorpóreo y pasa a través de una columna de filtrado.
Fundamentos para el uso de la aféresis en la enfermedad inflamatoria intestinalLa respuesta inmune aberrante en la EII se expresa como una importante infiltración leucocítica en la lámina propia intestinal, sobre todo a expensas de los linfocitos. Los linfocitos migran y recirculan desde el torrente sanguíneo a los tejidos y viceversa, y detectan la llegada de antígenos extraños presentados por las células T naive. Los linfocitos producen como respuesta citocinas proinflamatorias como la IL-2, el interferón-γ, el TNF-α, la IL-23 y la IL-174. El conjunto de leucocitos circulantes, especialmente de granulocitos, es 2 veces superior en los pacientes afectados de EII que en los individuos sanos. Su activación produce además de la respuesta inflamatoria mediada por citocinas, la liberación de proteasas y radicales libres de oxígeno causantes del daño tisular.
El mecanismo por el que las columnas a través de las que se hace circular la sangre en los sistemas de la aféresis podrían ser la causa de su eficacia se fundamenta en la inmunomodulación secundaria a la disminución de citocinas proinflamatorias y al aumento de citocinas antiinflamatorias circulantes. El proceso de aféresis adsorbe selectivamente los leucocitos circulantes activados, lo que se sigue del paso al torrente circulatorio de los leucocitos no activados desde el conjunto medular y también podría inducir cambios funcionales en estas células; esto reduce la producción de citocinas proinflamatorias y la expresión de moléculas de adherencia, como L-selectina, y aumenta los mediadores antiinflamatorios. El mecanismo exacto por el que esto se produce sigue siendo explorado y podría ser la interacción de factores del complemento con las cuentas de diacetato de celulosa, lo que facilita la adherencia de los granulocitos a éstas (en el caso de la GCAP). Recientemente, se ha indicado que se podría producir un cambio funcional en los monocitos activados. Estos monocitos, que expresan marcadores CD14+CD16+, tienen propiedades proinflamatorias, puesto que participan en la liberación del TNF-α, la IL-1 y la IL-6. Se ha demostrado una disminución de estos monocitos activados tras la realización de la GCAP en los pacientes afectados de CU5, lo que podría condicionar una disminución del TNF-α6. También se ha indicado que el tratamiento disminuye la expresión de los toll-like receptors de tipo 2 y esto se asocia a una menor presencia de citocinas proinflamatorias séricas7.
Eficacia de la aféresis en la enfermedad inflamatoria intestinalLa mayoría de los estudios iniciales que investigaron la eficacia de la aféresis en la EII se realizaron en Japón. Los problemas metodológicos de éstos y de los estudios posteriores no dejan de ser relativamente habituales en los ensayos clínicos realizados en la EII y consisten en la falta de criterios homogéneos en cuanto a la definición de la corticorrefractariedad, la resistencia a los corticoides, la remisión y la eficacia. Además, estos estudios se han realizado en poblaciones heterogéneas y los índices utilizados para cuantificar la inflamación no siempre han sido los mismos. La pauta terapéutica a utilizar tampoco ha sido universalmente definida y aunque lo habitual ha sido programar una sesión semanal de aféresis durante 5 semanas, fueron varios los regímenes ensayados. Todo lo anteriormente comentado hace que estos estudios sean difícilmente comparables. El Grupo Español de Trabajo en la Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) consciente de las escasas pruebas disponibles acerca del procedimiento publicó en el año 2006 un documento de consenso sobre el uso de la GCAP en pacientes con EII en el que se realiza una extensa revisión de toda la información disponible hasta el momento de su publicación8. Las recomendaciones finales de este documento siguen prácticamente vigentes.
Colitis ulcerosaPacientes naive. Tratamiento de primera líneaHay varios estudios no controlados en los que se ha valorado la eficacia de la aféresis como primera opción de tratamiento en la CU, todos éstos realizados por investigadores japoneses en series con muy escaso número de pacientes y no controlados. El porcentaje de respuesta en este grupo es superior al obtenido en el grupo de pacientes dependientes de corticoides o con resistencia a éstos. La media ponderada de respuesta es del 86% (intervalo de confianza [IC] del 95%: 76 a 96)9. El estudio que más pacientes incluyó (n=30) se realizó en formas de afectación distal (proctosigmoiditis y colitis izquierda) y presentó un porcentaje de remisión del 70%10.
Recientemente, se ha publicado un estudio que investiga el impacto de la GCAP en el grado de infiltración de granulocitos y monocitos en la mucosa intestinal y que diferencia a los pacientes que nunca han recibido corticoides (n=26) de los pacientes dependientes de los corticoides (n=19)11. Se valoraron los datos de 400 biopsias cólicas que revelaron una infiltración masiva por granulocitos que disminuyó marcadamente con el tratamiento. El porcentaje de respuesta global fue del 73% y fue significativamente mayor en los pacientes naive de corticoides que en los que habían recibido previamente corticoides (el 84,6 frente al 57,9%).
Dependencia a los corticoides y refractariedadLa eficacia clínica de los sistemas de aféresis se ha valorado en varios estudios no controlados y en algunos estudios controlados en situaciones de falta de respuesta al tratamiento convencional y en situaciones de dependencia y resistencia a los corticoides. Las poblaciones estudiadas han sido muy heterogéneas, incluso se han valorado pacientes pediátricos. Algunos de estos estudios han incluido conjuntamente pacientes dependientes de los corticoides y corticorrefractarios o refractarios a tratamiento habitual (que puede no incluir corticoides). Una breve descripción de éstos con sus características más relevantes se detalla en la tabla 1.
Tabla 1. Eficacia de la aféresis en pacientes con colitis ulcerosa dependientes de los corticoides o refractarios al tratamiento convencional
| Autor, año y tipo de estudio | Número de pacientes | Indicación | Técnica y protocolo | Eficacia |
| Shimoyama, 2001 12 , prospectivo controlado | 105 (53 con aféresis frente a 52 con otros tratamientos) | Refractariedad al tratamiento convencional | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Remisión: del 58,5 (AP) frente al 44,2% (NS) |
| Sawada, 2003 13 , prospectivo controlado | 76 (39 con aféresis frente a 37 con corticoides) | CD | LCAP: 5 sesiones/semana durante 5 semanas consecutivas | Remisión: del 74 (AP) frente al 38% (p=0,005) |
| Tomomasa, 2003 14 , retrospectivo, descriptivo | 12 | Población pediátrica. Corticorrefractariedad | GCAP: 5 a 10 sesiones/semana durante 5 semanas consecutivas | Mejoría: 75% |
| Hanai, 2003 15 , prospectivo no controlado | 31 | Corticorrefractariedad | LCAP: 10 a 11 sesiones durante 11 semanas | Remisión: 81%. Mejoría: 87% |
| Hanai, 2004 16 , prospectivo controlado | 69 (46 con aféresis frente a 23 con corticoides) | CD | GCAP: 11 sesiones durante 11 semanas | Remisión: el 83 (AP) frente al 65% (NS) |
| Naganuma, 2004 17 , prospectivo no controlado | 44 | CD (n=10). Corticorrefractariedad (n=20). Actividad (n=14) | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Remisión: 90% (CD). Remisión: 20 (CRG) y 70% (CRM). Remisión del 80% en actividad |
| Domènech, 2004 18 , prospectivo no controlado | 14 | CD | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Remisión: 62%. Mejoría: 77% |
| Kanke, 2004 19 , prospectivo no controlado | 60 | CD (n=28). Corticorrefractariedad (n=14). Actividad (n=12). Corticoides sin tratamiento previo (n=6) | GCAP: >10 sesiones durante 12 semanas | Remisión: 83 (CD) y 23% (CR) |
| Kim, 2005 20 , prospectivo no controlado | 27 | Refractariedad al tratamiento convencional | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Mejoría: 70% |
| Kruis, 2005 21 , prospectivo no controlado | 35 | CD | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Remisión: 37%. Mejoría: 43% |
| Sawada, 2005 22 , prospectivo controlado frente al placebo | 19 (9 con aféresis frente a 10 con placebo) | Refractariedad al tratamiento convencional | GCAP: 5 sesiones/semana durante 5 semanas consecutivas + 2 sesiones a las 2 y a las 4 semanas | Mejoría: el 80 (AP) frente al 33% con placebo (p<0,05) |
| Giampaolo, 2006 23 , prospectivo no controlado | 8 | Corticorrefractariedad | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Remisión: 100% |
| Fernández-Pérez, 2007 24 | 10 | CD y corticorrefractariedad | GCAP: 5 sesiones/semana durante 5 semanas consecutivas | Mejoría: 87,5% (en los que completaron la inducción) |
| Ljung, 2007 25 , prospectivo no controlado | 52 | CD y corticorrefractariedad * | GCAP: al menos 5 sesiones/semana | Remisión: 48%. Mejoría: 75% |
| Sands, 2008 26 , prospectivo controlado frente al placebo | 168 (112 con aféresis frente a 52 con placebo) | Refractariedad al tratamiento convencional | GCAP: 10 sesiones en 9 semanas consecutivas. Dos sesiones a la semana | Remisión: el 17 (AP) frente al 11% con placebo (p=NS) |
AP: aféresis; CD: dependencia a los corticoides; CRG: corticorrefractariedad en brote grave; CRM: corticorrefractariedad en brote moderado; GCAP: granulocitoaféresis; LCAP: leucocitoaféresis; NS: no significativo.
* Datos conjuntos.
Los ensayos clínicos existentes parecen mostrar que la aféresis es un tratamiento que podría ser eficaz para reducir la dosis de corticoides en situaciones de dependencia a éstos. En el momento actual, promovido por el GETECCU, se ha iniciado un estudio multicéntrico internacional que pretende dilucidar la eficacia de la técnica en esta situación clínica.
Hay solamente 2 ensayos clínicos controlados que han intentado evaluar el efecto del placebo de la aféresis en la CU22,25. En el primero de éstos, realizado en un grupo muy reducido de pacientes, los resultados fueron esperanzadores puesto que a las 10 semanas el 80% del grupo activo había presentado respuesta frente al 33% del grupo tratado con columnas de las aféresis ficticias (placebo)22. El estudio pivotal multicéntrico publicado en el año 2008 en una muestra de 168 pacientes no ha refrendado estos resultados26. En este ensayo clínico se incluyen los pacientes con CU de moderada a grave, definida como una puntuación en el índice de Mayo (también conocido como DAI [Disease Activity Index]) de 6 a 11, pese al tratamiento con uno o más de los siguientes fármacos: 5-aminosalicilatos, corticoides (20mg/día de prednisona) o azatioprina o 6-MP durante > 12 semanas. Los pacientes se aleatorizan para recibir el tratamiento durante 9 semanas con 10 sesiones de GCAP (n=112) o con columnas ficticias (n=56). La primera semana se realizan 2 sesiones y después una sesión semanal. El porcentaje de remisión clínica (índice de Mayo de 0 a 2) fue del 17% en el grupo tratado frente al 11% en el grupo placebo. La remisión endoscópica en la semana 12 no presentó diferencias entre los grupos: el 12 frente al 11%. Sólo en un subgrupo de pacientes con mayor gravedad histológica parece tener una ventaja para la aféresis. Con los resultados de este estudio no parece que la técnica deba utilizarse, al menos con la pauta descrita en este estudio, para el tratamiento de la CU activa de moderada a grave puesto que no ofrece ventajas frente al placebo. De hecho, en la CU activa de moderada a grave se exige respuesta clínica y biológica tras 3 días de tratamiento cuando se prescriben esteroides sistémicos; por esta razón, y dado el inicio de acción terapéutica demorado de la aféresis, esta modalidad terapéutica no es adecuada en esta situación clínica.
Recientemente se ha indicado por parte de grupos de investigadores japoneses que podría haber una cierta ventaja en cuanto a un menor tiempo de respuesta en la inducción de la remisión con el denominado tratamiento «intensivo». Esta pauta consiste en la realización de 3 sesiones semanales de aféresis durante las 2 primeras semanas de tratamiento27,28 y parece tan segura como el clásico procedimiento de realizar una sesión semanal; en un estudio piloto realizado en 30 pacientes ha mostrado un porcentaje de remisión del 80% en la CU moderada27.
Otros estudios en colitis ulcerosaEn el año 2007 se publicó un estudio preliminar en el que se incluyeron 40 pacientes que fueron aleatorizadamente distribuidos en 2 grupos para recibir GCAP o corticoides29. La particularidad de este estudio es que los pacientes no eran ni dependientes ni resistentes a los corticoides, el tiempo de evolución de la enfermedad era inferior a un año y no respondían a un tratamiento con salicilatos. Se utilizó el índice de Rachmilewitz, también conocido como CAI (Clinical Activity Index) y se consideró remisión clínica un CAI inferior a 6. Una semana después de finalizar el tratamiento la eficacia en los pacientes tratados con aféresis fue del 70 frente al 60% de los pacientes tratados con corticoides (p=no significativo [NS]). Había un menor porcentaje significativo de efectos adversos en los pacientes tratados con aféresis: el 10 frente al 50%. Se trata de un estudio con un número de pacientes limitado, en el que se indica la equivalencia con el tratamiento convencional con corticoides y la mejor tolerabilidad de la aféresis.
Se ha publicado un estudio que investiga los factores que predicen la eficacia de la ciclosporina y la aféresis (GCAP o LCAP) en la CU refractaria30. Aunque con limitaciones por la heterogenicidad de los pacientes, la respuesta clínica (cuantificada con el índice DAI) es similar en los 26 pacientes tratados con ciclosporina y en los 19 pacientes tratados con aféresis (el 63,2 frente al 65,6%).
Entre los estudios que evalúan diferentes protocolos de aféresis se ha publicado, además de los referidos de tratamiento «intensivo», otro ensayo en CU realizado en España y que compara la eficacia y la seguridad de 5 o 10 sesiones de GCAP en la dependencia a los corticoides, sin que hayan diferencias en la eficacia en la semana 17 (el 37,5% para 5 sesiones frente al 45,5% para 10 sesiones)31. Los datos actuales no son suficientes para apoyar las ventajas de 10 sesiones frente a 5 sesiones. Con respecto al tipo de procedimiento, hasta el momento actual se ha publicado un solo estudio que compara ambas técnicas: la LCAP y la GCAP32. En éste, 39 pacientes con CU de moderada a grave se aleatorizaron para recibir la LCAP (n=21) o la GCAP (n=17). La primera semana se realizan 2 sesiones de la aféresis y las siguientes 4 semanas, una sesión semanal. El porcentaje de mejoría clínica, cuantificado como una disminución de al menos 5 puntos en el índice CAI, fue similar con ambos procedimientos (el 66,6% para la LCAP frente al 76,4% para la GCAP; p=NS). En el estudio se observó una peor respuesta en los pacientes más graves, con puntuaciones en el índice CAI superiores o iguales a 16.
Mantenimiento de la remisión en la colitis ulcerosaLas pruebas sobre el tratamiento de mantenimiento son muy pocas. Los datos preliminares de las series no controladas indican que la proporción de los pacientes que mantienen la remisión a los 6 meses es del 62 al 76% y a los 12 meses es del 33 al 71% con una media ponderada del 61% (IC del 95%: del 45 al 77%)9. Estos buenos resultados no se han refrendado en series más recientes33. La pauta de tratamiento más habitual es la de una sesión mensual.
En un estudio reciente se han incluido 20 pacientes dependientes de los corticoides, resistentes a la azatioprina y con un índice CAI de 6 a 1034. Los pacientes reciben 5 sesiones semanales de LCAP además de 10mg de prednisolona al día. Los pacientes que entran en remisión (n=14; 70%) se aleatorizan en 2 grupos: uno (n=9) recibe sesiones mensuales como tratamiento de mantenimiento durante 5 meses y el otro (n=5) no recibe tratamiento de mantenimiento. La remisión clínica al finalizar el tratamiento es del 63% en el grupo con aféresis frente al 20% en el grupo control. El estudio, aunque en un número de pacientes muy reducido, indica las ventajas de mantener el tratamiento en el grupo que responde a éste. Por otra parte, en los 2 estudios prospectivos españoles publicados hasta el momento18,31 los pacientes con CU dependientes de los corticoides que responden de 5 a 10 sesiones de GCAP mantenían la remisión sin nuevas sesiones de aféresis y sin añadir tratamientos de rescate en más del 70% de los casos al año de seguimiento.
Enfermedad de CrohnLas pruebas sobre la eficacia de la aféresis en la EC son aún más escasas y las características de los pacientes incluidos en los estudios no controlados, pautas de la aféresis, cotratamientos, definiciones de eficacia, etc. siguen criterios muy heterogéneos18,24,25,36,37. Las características de estos estudios se resumen en la tabla 2. En un estudio realizado en España18 se incluye un grupo de pacientes homogéneos dependientes de los corticoides; todos se trataron con prednisona en dosis de 1mg/kg/día además de la GCAP. Se consiguió la retirada completa de los corticoides en 7 de 10 pacientes tras las 5 sesiones; sin embargo, sólo un paciente mantenía la remisión en un seguimiento de 12 meses. Estos resultados en seguimiento a largo plazo son distintos en otro de los estudios que valora la situación de refractariedad35. Así, 6 de los 7 pacientes incluidos habían recibido infliximab sin éxito; la media de CDAI disminuyó desde un valor basal de 290 (semana 1) hasta 184 en la semana 7 (p=0,031) y a 128,5 tras 12 meses de seguimiento (p==0,0156). El número de pacientes incluidos en todos estos estudios es insuficiente para extraer conclusiones definitivas.
Tabla 2. Eficacia de la aféresis en pacientes con enfermedad de Crohn dependientes de los corticoides o refractarios al tratamiento convencional
| Autor y año | Número de pacientes | Indicación | Técnica y protocolo | Eficacia |
| Matsui, 2003 34 | 7 | Refractariedad al tratamiento convencional | GCAP: 5 a 6 sesiones en 5 a 6 semanas | Remisión clínica: 71% |
| Cuenca, 2004 35 | 3 | Corticorrefractarios + dependientes de los corticoides | GCAP: 5 sesiones en 5 semanas | Remisión y retirada de los corticoides: 100% |
| Domènech, 2004 18 | 3 | Dependientes de los corticoides | GCAP: 5 sesiones en 5 semanas | Remisión y retirada de los corticoides: 70% |
| Fernández-Pérez, 2007 24 | 8 | Corticorrefractarios + dependientes de los corticoides | GCAP: 7 sesiones en 7 semanas | Mejoría: 71,4% (en los que completaron la inducción) |
| Ljung, 2007 25 | 44 | Corticorrefractarios + dependientes de los corticoides | GCAP: 10 a 11 sesiones durante 11 semanas | Remisión: 41%. Mejoría: 64% |
Estudios no controlados.
GCAP: granulocitoaféresis.
Se ha publicado un único ensayo clínico controlado en la EC realizado con una técnica de linfocitoaféresis38; en ésta, los linfocitos se obtienen por centrifugación tras la extracción de un importante volumen de plasma. En este estudio, los pacientes con EC que habían conseguido la remisión con corticoides se aleatorizaron para seguir el descenso habitual de corticoides con o sin tratamiento complementario con linfocitoaféresis. La retirada completa sin recidiva se consiguió con más frecuencia en el grupo en el que se añadió la aféresis (el 100 frente al 62%) y aunque se mantuvieron sesiones mensuales durante 9 meses, a los 18 meses el porcentaje de recidivas no presentaba diferencias estadísticamente significativas (el 82 frente al 62%).
Tratamiento en pacientes asintomáticosLas causas de las reactivaciones de la EII se desconocen en un porcentaje elevado de los casos, pero se conoce que hay un aumento en la actividad inflamatoria intestinal que precede a la aparición de los síntomas y que puede identificarse con determinados marcadores de laboratorio, entre éstos la calprotectina fecal39. En un estudio publicado recientemente se ha investigado el papel de la GCAP en el mantenimiento de la remisión en los pacientes con EII con un alto riesgo de recidiva, definido por la detección de valores de calprotectina fecal de al menos 5 veces su valor normal40. En este estudio abierto, prospectivo, aleatorizado y controlado se incluyeron 60 pacientes asintomáticos, 37 pacientes afectados de CU y 23 pacientes afectados de EC, con valores de calprotectina fecal superiores a 250μg/g. De todos éstos, 29 pacientes recibieron 5 sesiones de GCAP (uno por semana). El porcentaje de los pacientes en remisión clínica, cuantificada como CDAI inferior a 150 o índice CAI inferior a 6, es superior en los pacientes tratados que en los controles (el 72,4 frente al 32,3%; p=0,0023). El intervalo de tiempo transcurrido hasta la recidiva fue también significativamente mayor en los pacientes tratados (161 ± 44 días) que en el grupo control (99 ± 73 días). El estudio representa una nueva aproximación en el tratamiento de los pacientes con EII, dirigida a aquéllos con un alto riesgo de recidiva que podrían controlar así el componente inflamatorio y evitar tanto la morbilidad asociada a la recidiva clínica como los efectos adversos secundarios a la intensificación del tratamiento.
Tolerabilidad y seguridadEl tipo y la gravedad de los efectos secundarios que produce condicionan la tolerabilidad de un tratamiento. Los estudios realizados con las técnicas de la aféresis han reportado efectos adversos menores: náuseas, cefalea, parestesias, fiebre transitoria, etc., y que acontecen en un 10% de los pacientes tratados. Se han descrito como efectos secundarios graves la trombosis venosa profunda21 y el neumotórax al intentar el acceso venoso central41, ambos son más bien complicaciones asociadas a la técnica que efectos secundarios de ésta. Se ha valorado la diferencia en la eficacia y en la incidencia de los efectos adversos en función del anticoagulante utilizado en el procedimiento42. En un estudio no aleatorizado ni ciego se comparan los efectos adversos de la LCAP según el tipo de anticoagulante usado, se documenta que la eficacia de la aféresis es prácticamente la misma al utilizar uno u otro anticoagulante, pero que el tratamiento de la dalteparina sódica no tiene efectos adversos, mientras que con el mesilato de nafamostat se registran 4 episodios de reacciones alérgicas (con erupción y urticaria), 2 episodios adversos digestivos (náuseas, vómitos y dolor abdominal) y un episodio de reacción adversa cardiopulmonar. Se ha publicado un caso de alteración transitoria y autolimitada de las pruebas de función hepática también relacionado con este anticoagulante10.
Los efectos adversos relacionados con la aféresis son menos frecuentes y graves que los documentados con el tratamiento convencional con corticoides. En el ensayo clínico comparativo de ambos tratamientos29 se observaron 3 efectos adversos graves en los pacientes tratados con prednisolona (en un caso úlcera gástrica y en 2 casos trastornos mentales), mientras que no hubo ningún efecto adverso grave en el grupo tratado con aféresis.
La mayor parte de los pacientes suelen completar el tratamiento, pues éste suele ser bien tolerado. El principal problema de la aféresis lo conforma la necesidad de obtener 2 accesos venosos adecuados, si esto no fuera posible sería necesario el acceso de una vía central con los riesgos que esto conlleva. Por su mecanismo de acción no es previsible que se produzca la pérdida de la eficacia o los fenómenos de dependencia de éste. La aféresis está contraindicada en los casos de anemia grave, enfermedad cardíaca y renal y en los pacientes alérgicos a la heparina. Sus escasos efectos secundarios la sitúan como una importante opción terapéutica en el tratamiento de la CU en pediatría. Se han publicado varios trabajos en este grupo de pacientes, lo que demuestra que la técnica es segura y útil para el control del brote y el descenso de la dosis de los esteroides14,43. Recientemente se ha publicado un caso en el que se ha mostrado eficaz y segura en una paciente embarazada, sin daños en el feto ni en la evolución de la gestación44.
Estudios farmacoeconómicosSe ha publicado como artículo completo un único estudio que realiza un análisis de coste efectividad45. En éste se valora el incremento del coste que supone el tratamiento de la CU de moderada a grave dependiente de los corticoides en un año para que se obtenga la remisión clínica. El coste es de 23.898 euros sin que el paciente reciba un ciclo adicional de corticoides ni sea intervenido. El estudio, promovido por la empresa que comercializa la GCAP en España, concluye que la incorporación de la aféresis en el tratamiento de estos pacientes conlleva un coste adicional razonable e indica que, con los datos bibliográficos y económicos documentados, la aféresis puede asumirse en la CU dependiente de los corticoides en el Sistema Nacional de Salud de España.
Por su seguridad y uso actual, la aféresis es un tratamiento óptimo para monitorizarse como una nueva tecnología sanitaria, aunque para esto es fundamental la implicación de los profesionales y de los hospitales y servicios sanitarios. En el momento actual, se ha realizado un documento en el marco de colaboración previsto en el Plan de Calidad para el Sistema Nacional de Salud, al amparo del convenio de colaboración suscrito por el Instituto de Salud Carlos III y el Departamento de Sanidad del Gobierno Vasco (Servicio de Evaluación de Tecnologías Sanitarias del País Vasco [OSTEBA]) en colaboración con el GETECCU46. Tras una revisión sistemática actualizada, el documento plantea el diseño y el establecimiento de un sistema monitor del uso de la tecnología de la aféresis con un seguimiento nacional de los pacientes que reciban este tratamiento. Los objetivos de este trabajo son: a) establecer los estándares del tratamiento de la CU con sistemas de aféresis; b) establecer un sistema para monitorizar su utilización, y c) analizar la efectividad y la seguridad de su utilización en estos pacientes. En el estudio participan las agencias de evaluación de tecnología sanitaria gallega, vasca y catalana (la Agencia de Evaluación de Tecnologías Sanitarias de Galicia, el OSTEBA y la Agencia de Evaluación de Tecnología e Investigación Médicas). Un grupo de trabajo ha creado y difundido en la última reunión anual del GETECCU la base de datos y el registro en línea que contiene todas las variables necesarias para monitorizar y evaluar la efectividad de este tratamiento en la CU (SiMAC). La aplicación para permitir la recogida de datos está disponible en: URL: http://aferesis.geteccu.org y toda la información sobre el proyecto está disponible tanto en esta dirección como en la web del GETECCU (URL: http://www.geteccu.org) .
Posicionamiento de la aféresis en el tratamiento de la enfermedad inflamatoria intestinalEn el momento actual, las pruebas disponibles que permiten posicionar la aféresis en la EC son muy escasas, se ha indicado su uso en los pacientes activos refractarios a otros tratamientos en series de casos. No hay comparaciones directas con los fármacos utilizados en la actualidad y en un único estudio controlado con un discreto número de pacientes se ha indicado el beneficio de la linfocitoaféresis en la retirada de los corticoides. No hay datos sobre el tratamiento de mantenimiento.
En la CU las indicaciones válidas de la aféresis en la enfermedad activa siguen las recomendaciones publicadas8 y se resumen en la tabla 3. La publicación del estudio pivotal que valora su uso en la colitis de moderada a grave que no responde al tratamiento convencional no muestra diferencias frente al placebo. Con esto, su uso en la enfermedad activa debe restringirse a situaciones muy concretas y hay actualmente un intenso debate que cuestiona su utilidad en esta situación47,48. Se ha indicado una mayor respuesta en la enfermedad activa en pacientes con una duración corta de la enfermedad y en los pacientes que no han tomado nunca previamente corticoides, sin que estos datos se hayan refrendado en ensayos clínicos controlados. Permanece sin esclarecerse el supuesto beneficio de una pauta de la aféresis más intensiva (3 sesiones por semana) en la enfermedad moderada a grave, su papel como tratamiento adyuvante junto con otros tratamientos o su eficacia en la enfermedad leve a moderada. El efecto ahorrador de corticoides en pacientes dependientes de los corticoides podría ser real y hay un ensayo clínico actualmente en desarrollo para posicionar la técnica en esta situación.
Tabla 3. Recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa Sobre el uso de la granulocitoaféresis en la colitis ulcerosa 8
| Inducción de la remisión |
| Depencia a los corticoides |
| Como alternativa al anti-TNF si se precisa tratamiento «puente» hacia IST, |
| Ante contraindicación o toxicidad con IST como alternativa previa a la cirugía |
| Corticorrefractariedad |
| No es útil en la enfermedad moderada a grave |
| En enfermedad leve a moderada |
| Como alternativa al anti-TNF (si éste ofrece dudas de seguridad o está contraindicado) y se precisa un tratamiento «puente» hacia IST |
| Si ha fracasado el tratamiento con IST como alternativa a anti-TNF (si este ofrece dudas de seguridad o ante contraindicación) como alternativa previa a la cirugía |
| Ante la falta de respuesta o toxicidad a anti-TNF como alternativa previa a la cirugía |
| Pacientes libres de esteroides |
| Contraindicación para uso de esteroides o con efectos secundarios graves como alternativa a anti-TNF |
| Mantenimiento |
| Alternativa previa a la cirugía y a anti-TNF en los pacientes que no responden o que no toleran IST |
Adaptación con modificaciones tras las pruebas más recientes.
IST: inmunosupresores tiopurínicos (azatioprina, 6-mercaptopurina); TNF: tumor necrosis factor 'factor de necrosis tumoral'.
Los datos del mantenimiento indican su beneficio en los pacientes que responden a la técnica sin que la pauta esté claramente establecida, habitualmente se realiza una sesión mensual. Por último, se ha apuntado su posible efectividad en la prevención de la recidiva en los pacientes de alto riesgo.
Según la opinión de los autores de este estudio, en las situaciones de enfermedad refractaria leve o moderada o en la dependencia a los corticoides, donde el anti-TNF o los inmunosupresores están posicionados, el uso de la aféresis debe limitarse a situaciones clínicas muy concretas, en las que debe primar la seguridad. Entre éstas podrían estar, por ejemplo, los antecedentes de neoplasias, coinfecciones, falta de protección para la infección por virus de la hepatitis B, Mantoux positivo o protección para tuberculosis dudosa. En estas situaciones, la individualización del tratamiento con un adecuado equilibrio de riesgo beneficio consensuado con el paciente debe ser la norma clínica a seguir. Por último, la aplicación de la aféresis en los pacientes pediátricos también debería conformar un área de interés de este tratamiento, dada la relevancia de los efectos adversos de los esteroides y de los inmunomoduladores en este subgrupo de pacientes con EII.