En esta revisión se evalúa el coste farmacológico del tratamiento de la hepatitis C y se consideran las recomendaciones más eficientes en cuanto a la duración del tratamiento y a la respuesta virológica sostenida (RVS). Para esto, se han analizado las publicaciones más significativas de los últimos 10 años en esta área considerando los genotipos más frecuentes en España. Con este análisis, se ha calculado un coste global para el tratamiento de la hepatitis C de 1.636.524,58 a 1.761.365,73 € al utilizar el pegIFN-α (pegylated interferon alpha ‘interferón pegilado alfa’) 2a y de 1.794.586,39 a 1.917.013,73 € al utilizar el pegIFN-α-2b. La RVS de ambos tratamientos fue del 59,18 y del 64,58%, respectivamente, sin mostrarse una diferencia significativa entre ambas formulaciones. Adicionalmente, se justifica el coste económico de la introducción de altas dosis de pegIFN-α-2a y de ribavirina para los pacientes con genotipo 1 difíciles de tratar (con ácido ribonucleico del virus de la hepatitis C basal superior a 800.000U/ml, que no logran una respuesta virológica precoz en la semana 12 y con un peso superior a 85kg).
In this study we evaluated the pharmacologic costs of hepatitis C treatment, considering recommendations on both the duration of therapy and sustained virological response. With this aim, we analyzed relevant scientific articles published in the previous 10 years, considering the most common genotypes present in Spain. In this analysis, we estimated overall costs to be 1,636,524.58–1,761,365.73 € and 1,794.586.39–1,917,013.73 € with the use of pegylated interferon (PegIFN)-alpha-2a and PegIFN-alpha-2b, respectively. Sustained virological response was 59.18% and 64.58% respectively, with no significant difference between the two formulations. Finally, we assess the economic costs of the use of high-dose PegIFN-alpha-2a and ribavirin in patients with genotype 1 and treatment resistance (baseline HCV-RNA values >800.000UI/ml, without early viral response at 12 weeks and weight >85kg).
La hepatitis C afecta del 1,6 al 3% de la población española1 y su prevalencia tiende a aumentar. En este artículo se propone analizar el estado actual del tratamiento sobre la base de la amplia literatura médica, que sopesa las diferentes opciones en cuanto a dosis y duración del tratamiento. La prevalencia de la infección es variable según los diferentes estudios, que muestran una distribución similar por genotipos: en el genotipo 1, del 61,4 al 89,9%; en el genotipo 2, del 1,6 al 4,2%; en el genotipo 3, del 3,9 al 18,6%, y en el genotipo 4, del 3,4 al 8,6% (tabla 1).
Tabla 1. Prevalencia de infectados por el virus de la hepatitis C en España
| Estudio | n | Genotipo 1, % | Genotipo 2, % | Genotipo 3, % | Genotipo 4, % |
| Pena, 1998 | 179 | 89,9 | 1,6 | 3,9 | 3,8 |
| León, 1999 | 386 | 85,5 | 4,1 | 4,4 | 3,4 |
| Rubio, 2001 | 302 | 61,4 | 4,2 | 18,6 | 8,6 |
| Pérez, 2006 | 255 | 79,05 | 2,76 | 14,22 | 4,74 |
| Valor medio* | 280 | 80,46 | 3,51 | 10,65 | 5,31 |
* Valor medio ponderado según el peso de cada estudio.
Sobre la base de las probabilidades de progresión de la hepatitis C hacia diferentes estadios, la aplicación del método de Markov-Montecarlo con el fin de comparar las probabilidades de progresión resulta de enorme utilidad y facilita la valoración de costes que supone cada estadio.
Esta revisión se plantea observar las opciones terapéuticas que logran las respuestas virológicas sostenidas (RVS) más significativas, valorar el coste de esas opciones terapéuticas de forma global en España y compararlas con el coste sanitario que genera la enfermedad en sus diferentes estadios.
Material y métodosSe realizó una recopilación bibliográfica en la literatura científica desde el año 1998 hasta el 2008 y se seleccionaron los estudios con mayor población y menor sesgo en la selección y distribución de los pacientes. El estudio está focalizado a los genotipos con mayor prevalencia en España.
Para valorar las respuestas terapéuticas, los autores de este artículo crearon grupos teóricos de 100 pacientes por cada genotipo, emplearon el método de Montecarlo de probabilidades para valorar las probabilidades de respuesta a través de las cadenas de Markov y estimaron las distribuciones con la ayuda de los resultados de los ensayos clínicos publicados. La distribución de los pacientes teóricos permitió cuantificar los períodos y las formulaciones de tratamiento, y asociarlos a una proporción de pacientes en cada genotipo, para posteriormente valorar los costes. Los costes se han calculado con las 2 formulaciones de pegIFN-α (pegylated interferon alpha ‘interferón [IFN] pegilado [peg] alfa’): pegIFN-α-2a (Pegasys, Roche, Alemania) y pegIFN-α-2b (PegIntron, Schering Plough, Bélgica) disponibles en el mercado; mientras que en el caso de la ribavirina se utilizó la formulación más económica disponible en el mercado (Copegus 200mg, 168 comprimidos, Roche, Alemania) (para más detalles ver tabla 2). Paralelamente, se valoraron los costes de progresión de la enfermedad sin tratamiento; asimismo, se computó el gasto global con el fin de evaluar el beneficio de la intervención farmacológica.
Tabla 2. Precios de la ribavirina, interferón pegilado alfa 2a e interferón pegilado alfa 2b
| PegIFN-α-2b (1,5μg/kg/semanas) | ||||||||||||||||||
| Peso | Dosis | 1 | 4 | 12 | 16 | 24 | 36 | 48 | 72 | |||||||||
| <64kg | 80 | 179,33 € | 717,32 € | 2.151,96 € | 2.869,28 € | 4.303,92 € | 6.455,88 € | 8.607,84 € | 12.911,76 € | |||||||||
| 65–74kg | 100 | 212,60 € | 850,40 € | 2.551,20 € | 3.401,60 € | 5.102,40 € | 7.653,60 € | 10.204,80 € | 15.307,20 € | |||||||||
| 75–85kg | 120 | 245,78 € | 983,12 € | 2.949,36 € | 3.932,48 € | 5.898,72 € | 8.848,08 € | 11.797,44 € | 17.696,16 € | |||||||||
| >85kg | 150 | 306,47 € | 1.225,88 € | 3.677,64 € | 4.903,52 € | 7.355,28 € | 11.032,92 € | 14.710,56 € | 22.065,84 € | |||||||||
La dosis de 120μg para los pesos de 75–85kg es la empleada para el interferon pegilado alfa 2b en los calculos de coste.
PegIFN-α: pegylated interferon alpha ‘interferón pegilado alfa’.
La eficacia de los tratamientos se valoró mediante las variaciones en la carga vírica durante el tratamiento:
Respuesta virológica rápida (RVR): ácido ribonucleico (ARN) del virus de la hepatitis C (VHC) (ARN-VHC) indetectable en la semana 4 de tratamiento o disminución de la carga vírica en al menos 2 logaritmos.
Respuesta virológica precoz (RVP): ARN-VHC indetectable en la semana 12 de tratamiento o disminución de la carga vírica en al menos 2 logaritmos.
RVS: ARN-VHC indetectable 24 semanas después de haber concluido el tratamiento (una carga vírica menor a 100 copias/ml se puede considerar como RVS).
Se han identificado 6 genotipos mayores del VHC; son de interés los genotipos 1, 2, 3 y 4 por ser los más habituales en España. Se analiza a continuación la eficacia de los distintos tratamientos en los distintos genotipos:
Genotipo 1: es el grupo de pacientes que más dificultades presenta para lograr una RVS. En un estudio comparativo de la eficacia del tratamiento con IFN frente a pegIFN, Manns et al, en 20012, trataron a un grupo de pacientes con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (800mg/día) durante 48 semanas y obtuvieron una RVS del 42%; mientras que el tratamiento a base de IFN-α-2b (3 MU/3 veces/semana) más ribavirina (1.000 a 1.200mg/día) durante 48 semanas obtuvo una RVS del 33%. Hay que puntualizar que en este estudio se introdujo un sesgo al utilizar distintas dosis de ribavirina junto con las 2 formulaciones de IFN y que se habla de pacientes con baja o alta carga vírica de modo global sin especificar el genotipo. Fried et al, en 20023, publicaron un estudio donde compararon 2 grupos de pacientes que recibían pegIFN-α-2a (180μg/semana) junto con ribavirina (1.000 a 1.200mg/día) durante 48 semanas y obtuvieron una RVS del 46%; mientras que con el tratamiento a base de IFN-α-2b (3 MU/3 veces/semana) más ribavirina (1.000 a 1.200mg/día) durante el mismo período, la RVS fue del 36%. El aumento en un 10% de la RVS (p=0,01) con el nuevo tratamiento justifica el uso de pegIFN-α en los pacientes con genotipo 1; la respuesta es similar en los subtipos de pegIFN-α-2a y pegIFN-α-2b. Es importante reseñar que una dosis mayor de ribavirina (1.000 a 1.200mg/día en lugar de 800mg/día) aumenta la RVS, como demuestra el estudio de Hadziyannis et al de 20044, en el que el tratamiento a base de pegIFN-α-2a (180μg/semana) junto con ribavirina (1.000 a 1.200mg/día) durante 48 semanas condujo a una RVS del 52%.
Se calcula que del 20 al 30% de los pacientes son SR (slow responders ‘respondedores lentos’) que se han considerado como no respondedores; estos pacientes han presentado un ARN vírico detectable en suero en la semana 12, pero lograron una reducción de al menos 2 logaritmos en su carga vírica. En este grupo, un tratamiento de 72 semanas sería eficaz, como se deduce de los estudios de Berg et al5 de 2006, que identificaron como SR del 20 al 23% de los pacientes, y Sánchez Tapias et al6 de 2006, realizado sobre pacientes no respondedores. Con un tratamiento a base de pegIFN-α-2a (180μg/semana) más ribavirina (800mg/día y 1.000 a 1.200mg/día) en 2 grupos durante 48 y 72 semanas obtuvieron una RVS del 29% (p=0,04) y del 44% (p=0,003), respectivamente. Apoyando este resultado, Pearlman et al, en 2007, identificaron como SR al 30% de los pacientes7, repitieron el mismo estudio con un tratamiento con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (800 a 1.400mg/día) en 2 grupos de pacientes con criterios de no respondedores durante 48 y 72 semanas, y obtuvieron una RVS del 18% y del 38%, respectivamente (p=0,03). Sobre la base de estos resultados, se ha propuesto alargar el tratamiento de 48 a 72 semanas en los pacientes que no alcanzan una RVS con 48 semanas de tratamiento. Con el fin de identificar a los pacientes SR, Ferenci et al8, en 2006, publicaron un estudio en el que en la semana 12 de tratamiento separaron a los pacientes en 2 grupos en función de su carga vírica por encima o por debajo de un umbral (50U/ml), y los trataron durante 48 o 72 semanas con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día). En los pacientes con carga vírica baja no se obtuvieron mejores resultados en cuanto a la RVS al alargar el tratamiento; pero en el grupo con carga vírica alta, la RVS se elevó desde el 37% en los tratados durante 48 semanas, hasta el 77% en los tratados durante 72 semanas; lo que permite concluir que a partir de la semana 12 de tratamiento se puede derivar a los pacientes a un tratamiento más largo. El estudio REPEAT, finalizado en noviembre de 20079, plantea la idoneidad de aumentar las dosis en los pacientes no respondedores de 180 a 360μg/semana durante las 12 primeras semanas (dosis de inducción), especialmente en los pacientes con cirrosis o fibrosis avanzada, con lo que se obtienen respuestas positivas que suponen un incremento de la RVS del 45 al 62%, aunque los resultados no se consideran del todo concluyentes a falta de más estudios. En un estudio de Mangia et al10 de 2008 realizado con 696 pacientes se comparó la respuesta al pegIFN-α-2a (180μg/semana) o al pegIFN-α-2b (1,5μg/kg/semana), junto con ribavirina (1.000 a 1.200mg/día) en pacientes con ARN-VHC detectable en la semana 8 e indetectables en la semana 12 de tratamiento, y se establecieron 2 grupos de tratamiento durante 48 semanas y 72 semanas, con una RVS del 38,1 y del 63,5%, respectivamente (p=0,068); la mayoría de los pacientes fueron de genotipo 1b y con viremias iguales o superiores a 400.000U/ml.
En un estudio de Fried et al11 de 2008, que incluía a 188 pacientes, se planteó usar altas dosis de pegIFN-α-2a (180 o 270μg/semana) junto con altas dosis de ribavirina (1.200 o 1.600mg/día) durante 48 semanas; se combinaron en 4 grupos aleatorizados de pacientes con alto riesgo de ser refractarios al tratamiento (genotipo 1, ARN-VHC >800.000U/ml, >85kg de peso). Se obtuvo una RVS del 28,3% (grupo A: 180μg/semana de pegIFN-α-2a más 1.200mg/día de ribavirina), 31,9% (grupo B: 180μg/semana de pegIFN-α-2a más 1.600mg/día de ribavirina), 36,2% (grupo C: 270μg/semana de pegIFN-α-2a más 1.200mg/día de ribavirina) y 46,8% (grupo D: 270μg/semana de pegIFN-α-2a más 1.600mg/día de ribavirina). El porcentaje de recaídas en el grupo A fue del 40%; en el grupo B, del 42%; en el C, del 46%, y en el D, del 19% (grupo A frente al grupo D: p<0,0001). Los episodios adversos que obligaron a la interrupción terapéutica variaron del 11 al 19%. En un estudio de Angelico et al12 en el año 2008 se ensayó un tratamiento con pegIFN-α-2a (180μg/semana) más ribavirina (800mg/día) junto con amantadita (200mg/día) en pacientes que no demostraron RVP en la semana 12, con un tratamiento inicial con pegIFN-α-2a (180μg/semana) en monoterapia, y obtuvieron una RVS del 29,7% frente al 9,4% en los pacientes con el mismo tratamiento, a excepción de la amantadita (p = 0,041). Pese a este resultado, estudios prospectivos aleatorizados en dosis protocolarias de pegIFN y ribavirina durante 24 o 48 semanas con o sin amantadina no han logrado demostrar una mejoría significativa en la respuesta terapéutica.
Hay un subgrupo de pacientes de genotipo 1 con aclaramiento vírico rápido en los que se ha ensayado un recorte en las semanas de tratamiento. Hay 3 estudios que abogan por la conveniencia de esta estrategia, que como requisito exige una carga vírica basal pretratamiento menor a 800.000U/ml. La medida de la carga vírica en la semana 4 para determinar si hay RVR es el segundo requisito y se consideran como límites techo para la inclusión en el tratamiento reducido a 24 semanas (pegIFN-α-2a [180μg/semana] más ribavirina [800 a 1.400mg/día]) cargas víricas en la semana 4 de tratamiento de 29U/ml13 con lo que se obtiene una RVS del 89% frente al límite de 50U/ml14,15 con una RVS del 93% y del 89%, respectivamente. Sobre la base de estos resultados podría sugerirse a los pacientes de genotipo 1 con carga vírica basal pretratamiento menor a 800.000U/ml y carga vírica menor a 50U/ml en la semana 4 acortar el tratamiento a 24 semanas; aunque se excluye a los pacientes con factores de mala respuesta (esteatosis, fibrosis, consumo de alcohol, obesidad, resistencia a la insulina o mayores de 40 años). En el estudio publicado por Jensen et al en 200615 se consideran factores asociados a RVR un ARN-VHC basal inferior a 200.000U/ml en el caso del genotipo 1a, e inferior a 600.000U/ml en el caso del genotipo 1b. Recientemente, Yu et al16 (2008) han ensayado en un grupo de 200 pacientes aleatorizados en 2 grupos tratados durante 24 y 48 semanas con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día), y obtuvieron en los pacientes con carga vírica basal menor a 400.000U/ml y RVR una RVS del 96,4% y del 100%, respectivamente.
Genotipo 2/3: constituye el grupo que mejor responde al tratamiento. Varios estudios han comparado las respuestas del tratamiento con IFN e pegIFN en combinación con ribavirina. Manns et al2 (2001) obtuvieron una RVS del 82% con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (del 79% con dosis inferiores o iguales a 10,6mg/kg y del 88% con dosis superiores a 10,6mg/kg) frente al 79% en el grupo tratado con IFN (3 MU/3 veces/semana) más ribavirina (del 50% con dosis inferiores o iguales a 10,6mg/kg y del 80% con dosis superiores a 10,6mg/kg); la diferencia no fue significativa. Fried et al3 en 2002 obtuvieron en pacientes tratados con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día) o con IFN-α-2b (3 MU/3 veces semana) más ribavirina (1.000 a 1.200mg/día) una RVS del 76% y del 61%, respectivamente, con una diferencia estadísticamente significativa. Estos autores particularizaron estos datos valorando la carga vírica: en pacientes con alta carga vírica (>2 millones de copias/ml) obtuvieron una RVS del 74% y del 58%, respectivamente; mientras que en pacientes con baja carga vírica (inferior o igual a 2 millones de copias/ml) la RVS fue del 81% y del 65%, respectivamente. Hadziyannis et al4, en 2004, al estudiar 2 grupos de pacientes tratados con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (800mg/día) durante 24 y 48 semanas, no vieron diferencias significativas y obtuvieron una RVS del 84% y del 79%, respectivamente. Además, demostraron que aumentar la dosis de ribavirina a 1.000 o 1.200mg/día no aumenta la respuesta y que la mejor dosis es la de 800mg/día.
La amplia respuesta lograda con tratamientos de 24 semanas ha permitido explorar las reducciones en los períodos terapéuticos. Dalgard et al, en 200417, evaluaron un tratamiento de pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (800 a 1.400mg/día) en 122 pacientes y obtuvieron una RVR del 78%; en los pacientes que mostraban RVR se mantenía el tratamiento hasta la semana 14 y obtuvieron una RVS en el 90%, mientras que en los demás se mantenía el tratamiento hasta la semana 24 y obtuvieron una RVS en el 56%. En pacientes con un cumplimiento terapéutico de al menos el 80% de la dosis de ribavirina, 80% de la dosis de pegIFN y 80% de la duración temporal del tratamiento, la RVS fue del 86% frente al 70% en los pacientes que lo incumplieron. Una carga vírica pretratamiento menor a 600.000U/ml es un predictor de RVR en el caso del genotipo 3; la ausencia de puentes de fibrosis parece ser el único factor predictor de RVS. Mangia et al (2005)18 plantearon un estudio con 283 pacientes tratados con pegIFN-α-2b (1,0μg/kg/semana) más ribavirina (1.000 a 1.200mg/día) y separaron un grupo estándar tratado durante 24 semanas sin distinción y otro grupo variable tratado durante 12 o 24 semanas en función de haber presentado RVR o no. Obtuvieron en pacientes con genotipo 2 y RVR una RVS del 87% en el grupo variable y del 89% en el grupo estándar de 12 semanas (diferencia no significativa); mientras que en pacientes con genotipo 3 y RVR la RVS fue del 77% y del 100% en el grupo variable y en el estándar de 12 semanas, respectivamente; hay que indicar que, en este caso, las muestras poblacionales fueron muy pequeñas. Von Wagner et al19, en 2005, confirmaron estos datos al evaluar el uso de pegIFN-α-2a (180μg/semana) más ribavirina (800 a 1.200mg/día) en pacientes con cargas víricas menores a 600U/ml en la semana 4 de tratamiento a los que trataron durante 16 y 24 semanas. Estos autores obtuvieron una RVS del 82% y del 80%, respectivamente. A los pacientes con cargas víricas superiores a 600U/ml (sólo el 7% de su muestra) los trataron durante 24 semanas y obtuvieron una RVS en el 36%. Para el genotipo 3 se comparó la respuesta en pacientes con alta o baja carga vírica (punto de corte de 800.000U/ml) y se obtuvo una RVS del 59% en alta carga vírica y del 85% en baja carga vírica. En el estudio prospectivo multicéntrico de Shiffman et al20 de 2007, los 1.469 pacientes se dividieron en 2 grupos tratados durante 16 y 24 semanas con pegIFN-α-2a (180μg/semana) más ribavirina (800mg/día) y se obtuvo una RVS en el genotipo 2 del 62% y del 75%, respectivamente (p<0,001), y en el genotipo 3 del 62% y del 66% (p = 0,23); se produjo RVR en el 67% (16 semanas) y en el 64% (24 semanas) de los pacientes, y se obtuvo una RVS del 79% (16 semanas: del 78% en el genotipo 2 y del 80% en el genotipo 3) y del 85% (24 semanas: del 85% tanto en el genotipo 2 como en el genotipo 3) (p = 0,02). En pacientes con viremia menor o igual a 400.000U/ml, tanto de genotipo 2 como de genotipo 3, no hay diferencia significativa entre tratarlos durante 16 o 24 semanas (genotipo 2: 83% frente al 82%; genotipo 3: 81% frente al 81%). En los pacientes de genotipo 2 sin RVR, la RVS fue del 26% y del 53% para 16 y 24 semanas, respectivamente, mientras que en los de genotipo 3 fue del 26% y del 39%. En este estudio los pacientes tenían un alto índice de masa corporal (IMC) (de 26,6 a 28,7 kg/m2), alta incidencia de fibrosis en puente o cirrosis (23 al 28%) y alta carga vírica (del 60 al 78% de los pacientes con más de 800.000U/ml). La RVS en pacientes con alta carga vírica tratados durante 16 semanas fue del 55% (del 58% en el genotipo 2 y del 52% en el genotipo 3) y en los tratados durante 24 semanas fue del 67% (del 73% en el genotipo 2 y del 59% en el genotipo 3). La alta proporción de pacientes con factores de mala respuesta supone un sesgo parcial, más aún si se tiene en cuenta que la dosis de ribavirina fue fija y no ajustada al peso, por lo que los datos tienen un interés limitado. Powis et al21 (2008) han demostrado recientemente la peor respuesta del genotipo 3, especialmente en pacientes con estadios avanzados de fibrosis (3 a 4 según la gradación METAVIR). En este estudio obtuvieron unos valores de RVS del 17% en el genotipo 3 y del 78% en el genotipo 2 (p<0,001) al tratar con pegIFN-α-2a (180μg/semana) más ribavirina 800mg/día durante 24 semanas a los pacientes con cirrosis. En cualquier caso, faltan estudios que demuestren diferencias significativas en cuanto a la RVS al tratar a estos pacientes durante 48 semanas. Ming-Lung et al22, en 2007, publicaron su experiencia en pacientes con genotipo 2 tratados con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día) durante 16 o 24 semanas. Obtuvieron una RVR del 86% y del 87%, y una RVS del 94% y del 95%, ambas respectivamente; la probabilidad de lograr una RVS fue significativamente mayor si había RVR (en 16 semanas de tratamiento: 100% frente al 57% [p = 0,015]; en 24 semanas: 98% frente al 77% [p = 0,002]). A este respecto, un estudio reciente de Weiland et al (2008)23 planteó el tratamiento con pegIFN-α-2a (135μg/semana) más ribavirina (11mg/kg/día) durante 24 semanas y obtuvo una RVR en el 70% de los casos con genotipo 2 (RVS del 96% frente al 66% en los pacientes sin RVR; p = 0,009) y en el 71% de los pacientes con genotipo 3 (RVS del 95% frente al 65% en los pacientes sin RVR; p = 0,002).
Genotipo 4: las respuestas en este grupo de pacientes son similares a las obtenidas en el genotipo 1. Kamal et al24, en 2005, publicaron un estudio con 287 pacientes divididos en 3 grupos a los que se trataba con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (1.000 a 1.200mg/día) durante 24, 36 y 48 semanas; obtuvieron RVS del 29, 66 y 69%, respectivamente (no hubo diferencia significativa entre 36 y 48 semanas). En los pacientes con carga vírica superior a 2 millones de copias/ml la RVS fue del 35% y del 65% en los grupos tratados durante 36 y 48 semanas; en los pacientes que en cada grupo obtuvieron RVP —del 69 , 68 y 69%, respectivamente— se obtuvieron RVS del 38, 97 y 100% (24, 36 y 48 semanas), respectivamente. De cualquier modo, la ausencia de RVP no parece justificar la interrupción del tratamiento. Derbala et al25, en 2006, evaluaron en 73 pacientes el tratamiento con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (1.200mg/día) o con IFN-α-2a (3 MU/3 veces/semana) más ribavirina (1.200mg/día) y obtuvieron una RVS del 65,8% y del 25,7%, respectivamente. En un estudio reciente publicado por López-Alonso et al26 (2008) se evaluó la respuesta de 26 enfermos tratados con pegIFN-α-2a (180μg/semana) frente a 4 pacientes tratados con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (1,5mg/kg/día) durante 48 semanas y se obtuvo una RVS global del 33,3%. Probablemente, esta pobre respuesta sea debido a los 18 casos que presentaban una viremia mayor a 500.000U/ml. Otro estudio reciente de Ferenci et al27 (2008) mostró que en los pacientes en los que se logró una RVR (especialmente en los que tenían una carga vírica pretratamiento inferior a 400.000U/ml), se obtiene una RVS del 86,7% cuando se los trata con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día).
Comparativa de la eficacia de pegIFN-α-2a frente a pegIFN-α-2b: los diferentes estudios que han comparado la respuesta a los 2 pegIFN, por lo general, no han logrado demostrar diferencias significativas en cuanto a la eficacia terapéutica. En el estudio realizado por Di Bisceglie et al en 200728, se evaluaron ambos tratamientos en 380 pacientes de genotipo 1 y con alta carga vírica, y se mostró que la RVP en la semana 12 era menor en los pacientes tratados con pegIFN-α-2b (63% frente al 66%), aunque esta diferencia no fue estadísticamente significativa. Por otra parte, el porcentaje de interrupciones del tratamiento por razones médicas fue mayor con el pegIFN-α-2b (6% frente al 1%). Escudero et al29 (2008), en un estudio prospectivo sobre 183 pacientes, han obtenido resultados diferentes: RVS del 65,9% con pegIFN-α-2a frente al 62% con pegIFN-α-2b, y mayores efectos adversos con el pegIFN-α-2a (13,2% frente al 10,9%); si bien todas estas diferencias no fueron estadísticamente significativas. Silva et al30, en 2006, demostraron que el pegIFN-α-2b inducía una regulación al alza de los genes reguladores del IFN más marcada que la ejercida por el pegIFN-α-2a, lo que se traduce en la clínica en una aparente mayor reducción de la carga vírica en la semana 8 (72% frente al 44%; p = 0,09). En un estudio de coste-eficacia realizado por Malone et al31 en 2003, se planteó que había una mayor respuesta al pegIFN-α-2b cuando la ribavirina asociada se administraba ajustada al peso. A pesar de que el pegIFN-α-2a logró mayores tasas de RVP en la semana 12 (77 al 85% frente al 66 al 82%), estos autores justificaron esa postura en el mayor valor predictivo positivo de las RVP que se producen en los pacientes tratados con pegIFN-α-2b.
Idoneidad del tratamiento en los distintos genotiposGlobalmente, la RVS normalizada a la distribución genotípica en la población española es del 59,18 al 64,58%. Se consideran los resultados de los estudios anteriormente descritos y se indica a continuación la optimización de los tratamientos en los distintos genotipos.
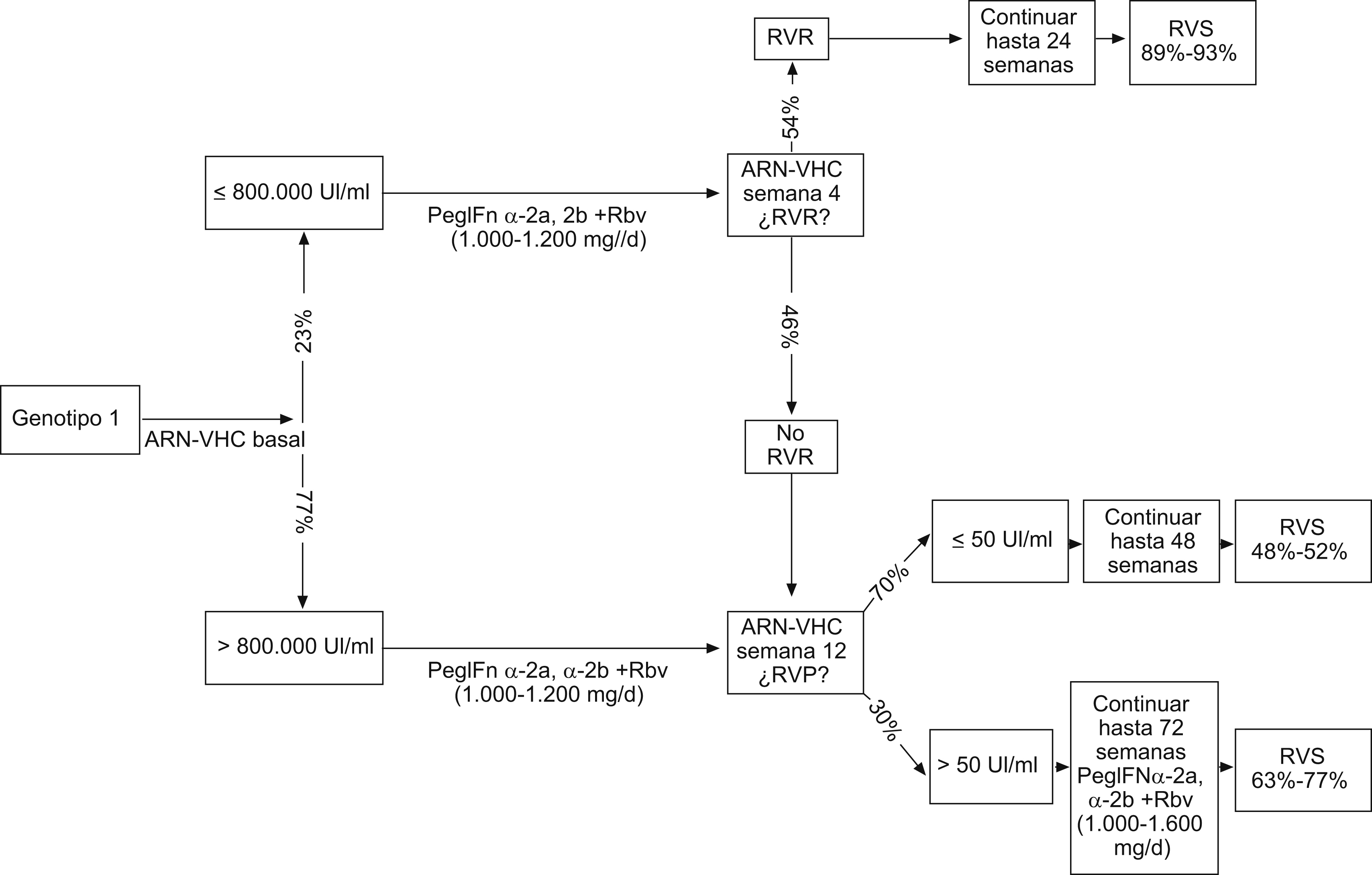
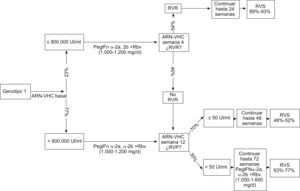
En pacientes con genotipo 1 (figura 1) el tratamiento de los que presentaban alta carga vírica (>800.000U/ml) permite similares respuestas con ambos pegIFN asociados a altas dosis de ribavirina (1.000 a 1.200mg/día). En este subgrupo, la carga vírica en la semana 12 orientará hacia pacientes que hayan logrado una RVP y que deberían continuar con el mismo tratamiento hasta completar 48 semanas. En los que no se logra una RVP puede plantearse un tratamiento intensivo con altas dosis de pegIFN-α-2a (270μg/semana) más ribavirina (1.600mg/día). En pacientes con carga vírica basal inferior o igual a 800.000U/ml, tanto el pegIFN-α-2a (180μg/semana) más la ribavirina (1.000 a 1.200mg/día) como el pegIFN-α-2b (1,5μg/kg/semana) más la ribavirina (1.000 a 1.200mg/día) son buenas opciones terapéuticas. En la semana 4 de tratamiento se monitorizará la carga vírica para demostrar una RVR y acortar el programa terapéutico a 24 semanas, y, si no es así, se continuará el mismo tratamiento hasta la semana 12 para valorar la carga vírica de nuevo y decidirse por un tratamiento de 48 o 72 semanas. Por medio del cálculo del porcentaje de pacientes derivados a cada grupo terapéutico, se obtiene una RVS en el 56,67 al 63,22% de los pacientes con genotipo 1.
Figura 1. Genotipo 1: evolución de los pacientes y RVS. Las RVS son variables en función de los interferones pegilados empleados y las dosis de ribavirina. RVS: respuesta virológica sostenida.
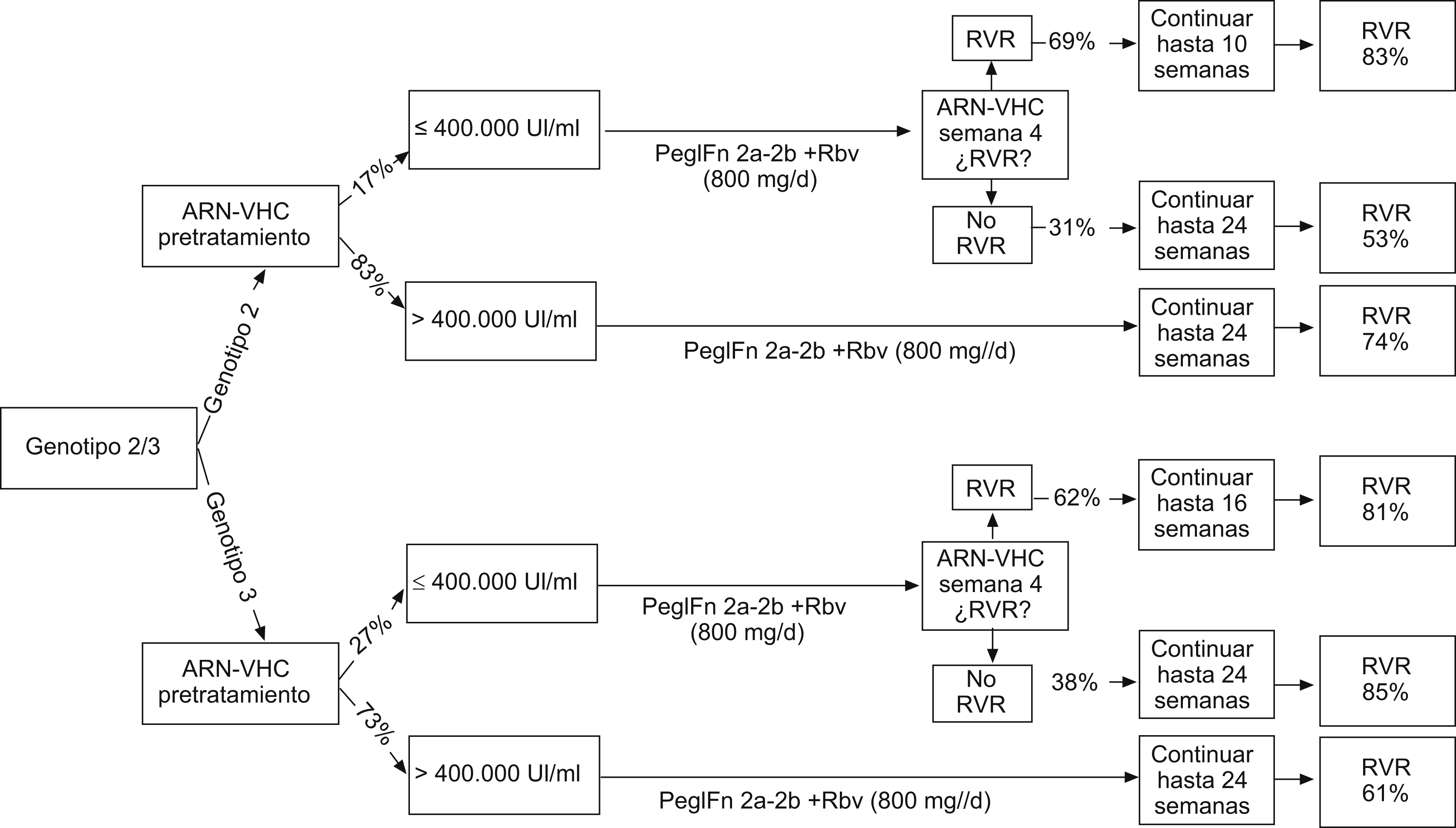
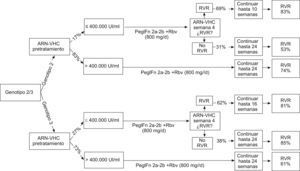
En los pacientes con genotipo 2 y 3 (figura 2), en caso de tener una carga vírica superior a 400.000U/ml, se aplica un tratamiento de 24 semanas con cualquiera de los 2 pegIFN en las dosis habituales más ribavirina (800mg/día); mientras que, si la carga vírica es inferior, se pueden tratar durante 16 semanas con el mismo tratamiento siempre y cuando se alcance una RVR; en caso contrario, se mantendrá el tratamiento hasta completar 24 semanas. En este modelo se obtiene una RVS en el genotipo 2 del 73,95% y en el genotipo 3 del 66,81%.
Figura 2. Genotipos 2 y 3: evolución de los pacientes y respuestas virológicas sostenidas.
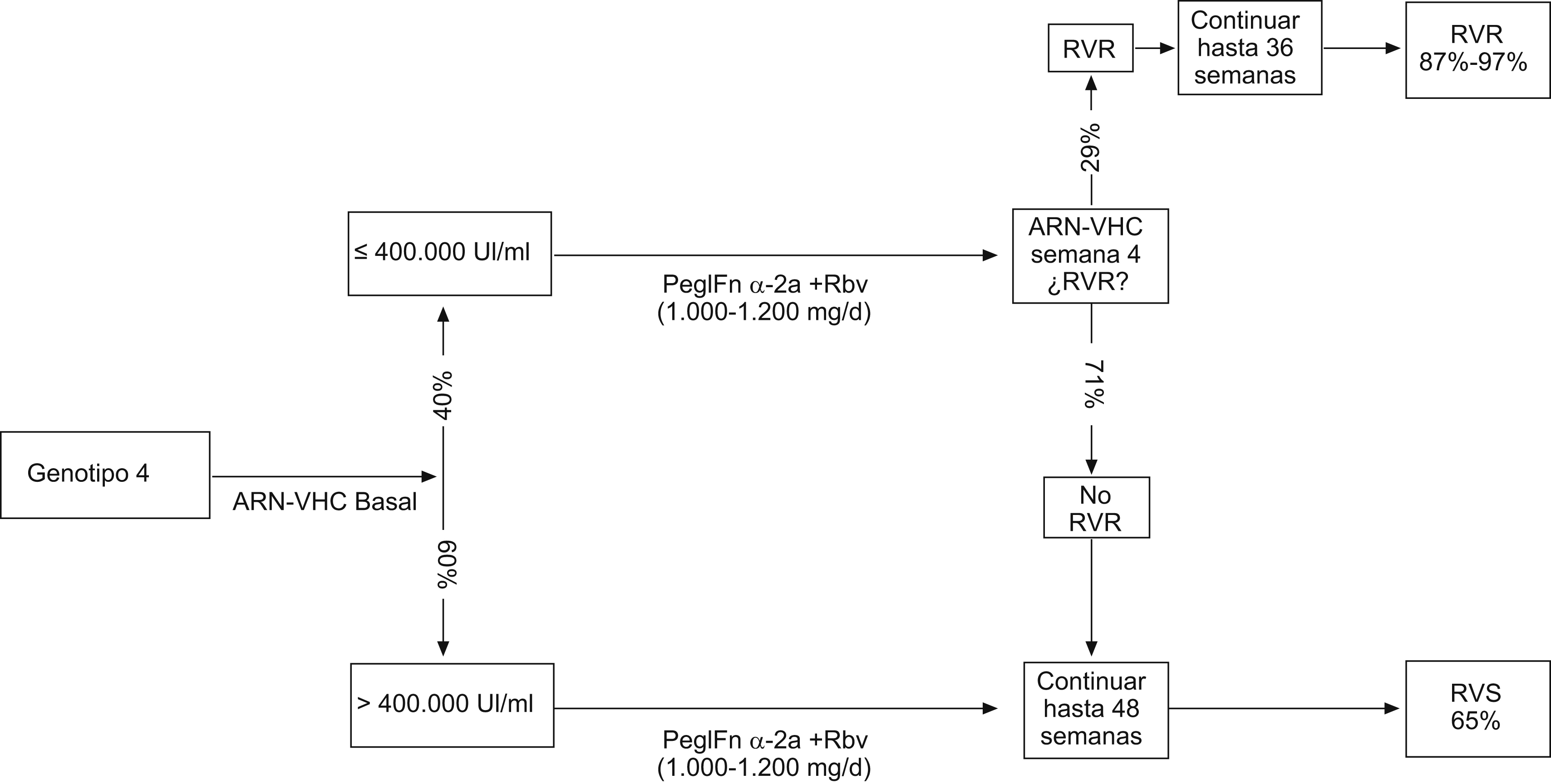
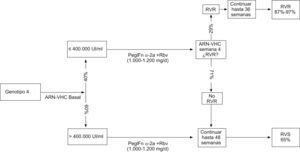
En el caso del genotipo 4 (figura 3), las mejores respuestas terapéuticas en los estudios de la literatura médica se han producido con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día); la medida de la carga vírica basal es un predictor de RVR que permite derivar a los pacientes hacia el tratamiento de 36 semanas o, en el caso de no lograrse RVR o en sujetos con cargas víricas altas (>400.000U/ml), hacia tratamientos de 48 semanas. Se obtiene así una RVS en el 67,55 al 68,71% de los pacientes con genotipo 4.
Figura 3. Genotipo 4: evolución de los pacientes y respuestas virológicas sostenidas.
Valoración económica de los tratamientosEl gasto farmacológico que supone tratar a 100 pacientes del genotipo 1 con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día) está en el rango de 1.796.542 a 1.943.098 €; mientras que si se utiliza pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (1.000 a 1.200mg/día) el gasto se eleva hasta 1.979.295 a 2.122.851 €; se trata de un aumento porcentual del 8,47 al 9,23%. El uso de altas dosis de pegIFN-α-2a (270μg/semana) más ribavirina (1.600mg/día) desde la semana 12 en el subgrupo de pacientes con genotipo 1 sin RVP hasta completar 72 semanas supone un gasto de 912.672 € y, en comparación con la opción de un tratamiento en dosis habituales durante 72 semanas, se obtiene un incremento del 28,5 al 33,4% en el gasto de ese grupo terapéutico.
En el grupo de 100 pacientes de genotipo 2 se obtiene un gasto de 751.721 € con pegIFN-α-2a (180μg/semana) más ribavirina (800mg/día) y de 824.844 con pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (800mg/día), lo que supone un aumento en el gasto del 8,8%.
En el grupo de pacientes con genotipo 3, el coste de tratar a 100 individuos es de 731.145 € con pegIFN-α-2a (180μg/semana) más ribavirina (800mg/día) y de 810.508 € al utilizar pegIFN-α-2b (1,5μg/kg/semana) más ribavirina (800mg/día). El incremento de gasto es del 9,8% al utilizar pegIFN-α-2b.
Al tratar a 100 pacientes del genotipo 4 con pegIFN-α-2a (180μg/semana) más ribavirina (1.000 a 1.200mg/día) se obtiene un gasto de 1.634.158 a 1.764.520 €.
Al normalizar los datos de los gastos de acuerdo con la distribución de genotipos en la población española con hepatitis C, se obtiene un gasto global de 1.636.524 a 1.761.365 € mediante la utilización de pegIFN-α-2a y de 1.794.586 a 1.917.013 € mediante la utilización de pegIFN-α-2b, lo que supone un gasto incremental del 8,1 al 8,8% al emplear el pegIFN-α-2b (utilizando dosis calculadas para pacientes con un peso comprendido ente los 75 y los 85kg).
Requiere un análisis individual la utilización de altas dosis de pegIFN-α-2a (270μg/semana) más ribavirina (1.600mg/día) que logra elevar la RVS del 56,5 al 68,1%, con un coste incremental de 260.640 a 304.733 €, de modo que al valorar la intervención con un análisis de coste-eficiencia a través de la fórmula ACE=(costealtas dosis−costedosis estándares) / (eficienciaaltas dosis−eficienciadosis estándares) se obtenga un ACE de 22.469 a 26.270 €. Resulta de interés valorar el número necesario de pacientes por tratar (NNT) para producir una unidad adicional de eficacia que oriente tanto sobre la eficacia del fármaco como acerca de la cantidad de recursos necesarios que se tienen que invertir para conseguir un resultado positivo en un paciente. Este valor se calcula a través de la fórmula NNT=100 / (a − b), donde a es el porcentaje de RVS en pacientes tratados con altas dosis y b es el porcentaje de RVS en pacientes tratados con dosis estándares. En este estudio se obtuvo un NNT de 8,62, valor que representa el número de pacientes por tratar con altas dosis de pegIFN-α-2a y ribavirina para obtener una respuesta positiva adicional, es decir, un paciente con RVS. Si se tiene en cuenta que en esta población global de 100 pacientes normalizados de acuerdo con la distribución poblacional española, el 18,6% son de genotipo 1 derivados a un tratamiento de 72 semanas, la opción de tratarlos con altas dosis de pegIFN-α-2a (270μg/semana) más ribavirina (1.600mg/día) supone 2,15 respuestas positivas adicionales. Así, el coste de respuesta en un paciente de ese grupo es de 121.228 a 141.736 €. Si se tiene en cuenta que el tratamiento farmacológico en este grupo de pacientes difíciles de tratar aumenta los años de vida ajustados por calidad (AVAC) de 4,37 a 6,21 años (Health Technology Assessment, National Health Service [NHS], Reino Unido)32 respecto a la opción de no tratar, se tendrá que el coste de un AVAC es de 19.521 a 32.434 €. La esperanza de vida experimentará un incremento de 5,76 a 8,16 años, con lo que el coste de años de vida ganados (AVG) sería de 14.856 a 24.607 €.
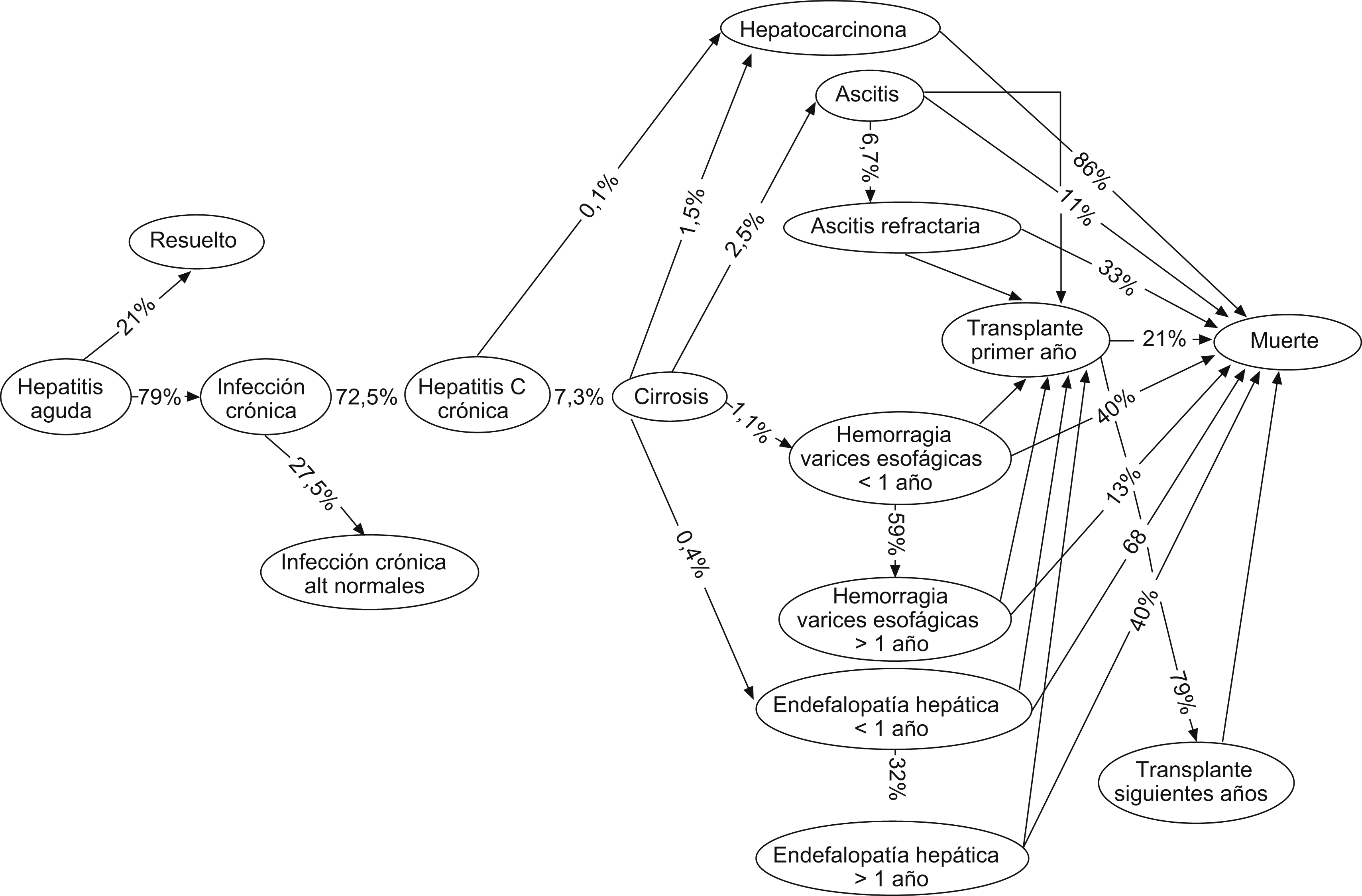
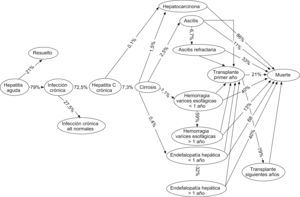
En contraste con esto, la historia natural de la enfermedad describe intrínsecamente unas probabilidades de desarrollo de episodios (cirrosis, ascitis, várices sangrantes, encefalopatía hepática, hepatocarcinoma, trasplante hepático) cuantificadas a través del modelo de Markov (figura 4) que implican unos costes sanitarios específicos (tabla 3). Cuando se conjugan ambas series de datos, se obtiene que el gasto total por complicaciones en 100 pacientes es de 89.945 €, sin cuantificar el gasto por defunción.
Figura 4. Modelo de transición de estadios en la historia natural de la infección por el virus de la hepatitis C. Porcentajes ilustrados entre los estadios. La probabilidad de evolución a cirrosis es anual. Adaptado de Davis et al, Projecting future complications of chronic hepatitis C in the United States. Liver Transplantation. 2003;9:331–8.
Tabla 3. Coste de las complicaciones de la hepatitis C crónica
| Complicación | Coste, € |
| Hepatitis C crónica por virus C | 215,92 |
| Cirrosis | 387,01 |
| Ascitis | 1.246,40 |
| Ascitis refractaria | 9.633,82 |
| Hemorragia de várices | 1.342,23–4.408,56 |
| Encefalopatía hepática | 1.366,84–5.356,07 |
| Trasplante hepático | 13.664,06–123.727,09 |
| Hepatocarcinoma | 6.045,80 |
Datos procedentes de Casado Gómez, MA: Coste-efectividad de interferón pegilado alfa en el tratamiento de la hepatitis crónica por virus C. Gastroenterología y Hepatología. 2006;29:200–5.
En la comparación de los distintos trabajos analizados no se han apreciado diferencias significativas en cuanto a la respuesta terapéutica a ambos pegIFN; si bien hay apreciaciones en cuanto a la respuesta en las semanas 8 y 12 de tratamiento que se inclinan por una mejor respuesta del pegIFN-α-2b30, la RVS es equivalente en ambos casos. Algunos ensayos hablan de mayor proporción de retiradas del tratamiento por efectos adversos o anormalidades de laboratorio en el caso del pegIFN-α-2b (6% frente al 1%), especialmente en pacientes con genotipo 128 en los que la duración del tratamiento es más prolongada, otros autores indican que el pegIFN-α-2a provoca mayor proporción de retiradas (13% frente al 10%)29. Scotto et al33 publicaron un ensayo en el que compararon ambas formulaciones en pacientes no respondedores y obtuvieron que en los genotipos 2 y 3 el pegIFN-α-2b parece ser más eficaz, pero el reducido grupo de pacientes no permitió sacar conclusiones del estudio. Los autores de este artículo opinan que está aún por demostrarse que hay diferencias en las respuestas de ambos peg, si bien puede decirse que, en general, en pacientes con sobrepeso u obesidad la respuesta parece mantenerse al utilizar pegIFN-α-2b, no así con el pegIFN-α-2a, probablemente debido a la posología de aquél en el que la dosis es dependiente del peso. Una valoración del IMC previo al tratamiento sería ventajosa y podría permitir un ajuste, a través de dietas, a valores en el rango de 20 a 25kg/m2 y una dosificación menor incluso durante del tratamiento tanto del pegIFN-α-2b como de la ribavirina; por otro lado, su implementación reduciría la resistencia a la insulina que ya hay de por sí en muchos pacientes con hepatitis C.
Pese a que se considera que los pacientes que no han logrado una RVP en la semana 12 de tratamiento no lograrán una RVS con un valor predictivo positivo del 97%, gran parte de estos pacientes, como demuestran los estudios de Pearlman et al7 (2007) y de Fried et al11 (2008), obtendrán respuestas positivas con un tratamiento prolongado a 72 semanas con altas dosis, por lo que se plantea continuar su tratamiento. Estos llamados SR (con carga vírica detectable en la semana 12, pero que han logrado descensos de al menos 2 logaritmos en su carga vírica y en los que en la semana 24 su carga vírica ya es indetectable) se han estimado en un 25% de los pacientes considerados antes como no respondedores. Estas consideraciones están aplicadas a tratamientos con dosis estándares de pegIFN y ribavirina; se desconoce su validez al emplear altas dosis, por lo que se plantea tratar a todos los pacientes que inicialmente se consideran como no respondedores con altas dosis de pegIFN y ribavirina durante 72 semanas. En la intervención de estos pacientes más resistentes al tratamiento con altas dosis de pegIFN-α-2a (270μg/semana) más ribavirina (1.600mg/día), estos resultados tienen un coste por AVAC y por AVG aceptable dentro del sistema sanitario español si se los compara con lo que se considera una tecnología sanitaria eficiente en el estudio de Sacristán et al34 (2002).
El efecto del tratamiento sobre la progresión de la historia natural de la enfermedad parece surtir efecto en aproximadamente la mitad de los pacientes tratados, como publican Davis et al35 (2003) en el estudio en que consideran que el tratamiento sobre el 10, 50 o 70% de los pacientes con hepatitis C crónica logra reducciones en la progresión a cirrosis a los 20 años en el 5, 24 y 34% de los pacientes, respectivamente. En los pacientes con cirrosis, las complicaciones y la muerte por enfermedad hepática se reducen en el 88% a los 5 años. El tratamiento de pacientes con hepatitis crónica moderada parece reducir las descompensaciones hepáticas en un 11% a los 10 años, un 31,9% tras 20 años y en un 58,5% tras 40 años.
Agradecimientos
Los autores muestran su sincero agradecimiento a los Dres. Juan Carlos Porres Cubero y Agustina González Guirado del Servicio de Aparato Digestivo de la Fundación Jiménez Díaz, al Dr. Francisco Abad Santos del Servicio de Farmacología Clínica del Hospital Universitario de La Princesa y al Dr. Ricardo Moreno Otero del Servicio de Aparato Digestivo del Hospital Universitario de La Princesa por sus comentarios y sugerencias durante la redacción del presente trabajo.