GIDEON es un estudio internacional prospectivo, no intervencionista, que evaluó la seguridad de sorafenib en pacientes con carcinoma hepatocelular (CHC) no resecable en la práctica clínica diaria, incluidos pacientes Child-Pugh B.
ObjetivosAnálisis de datos recogidos en España sobre seguridad y efectividad de sorafenib y los patrones de tratamiento.
MétodosSe recogieron los datos demográficos y de la enfermedad, la dosis inicial usada, los acontecimientos adversos emergentes del tratamiento (AA) y las modificaciones de dosis a lo largo del seguimiento. Se valoraron la supervivencia global y el tiempo hasta la progresión de la enfermedad. La eficacia y la seguridad se analizaron en función de la clasificación Child-Pugh y la dosis inicial.
ResultadosSe incluyó a 143 pacientes de 19 hospitales españoles. El 24,5% eran pacientes Child-Pugh B. El 90,9% de los pacientes recibió una dosis inicial de 400mg/12h. En pacientes Child-Pugh A se modificó más frecuentemente la dosis y la duración del tratamiento fue más larga. La incidencia de AA y de aquellos relacionados con el fármaco fue similar en los pacientes Child-Pugh A y B, aunque los AA graves fueron más frecuentes en los pacientes Child-Pugh B. Los más frecuentes fueron diarrea, fatiga y eritrodisestesia palmo-plantar. La mediana de supervivencia global fue de 384 días, y superior en pacientes Child-Pugh A (593 vs. 211 días en Child-Pugh B); la mediana hasta la progresión de la enfermedad fue de 177 días, similar en ambos subgrupos.
ConclusiónEl perfil de seguridad de sorafenib en pacientes españoles con CHC no resecable es independiente de la función hepática. El estado Child-Pugh no parece influir en el enfoque de dosificación de sorafenib ni en el tiempo hasta la progresión, pero sí parece ser un fuerte predictor de la supervivencia.
GIDEON is a non-interventional, prospective, international study that evaluated the safety of sorafenib in patients with unresectable hepatocellular carcinoma (HCC) in daily clinical practice, including Child-Pugh B patients.
ObjectivesTo analyze data collected in Spain on the safety and efficacy of sorafenib and treatment patterns.
MethodsData were collected during follow-up on demographic and disease characteristics, the initial dose used, treatment-emergent adverse events (AEs) and dose modifications. Overall survival was evaluated, as well as time to disease progression. Efficacy and safety were analyzed according to the Child-Pugh classification and the initial dose.
ResultsWe included 143 patients from 19 Spanish hospitals. A total of 24.5% of the patients were Child-Pugh B. An initial dose of 400mg/12h was used in 90.9% of patients. In Child-Pugh A patients, dose modifications occurred more frequently and the treatment duration was longer. The incidence of AEs and drug-related AEs were similar in Child-Pugh A and B patients, although serious AEs were more frequent in Child-Pugh B patients. The most common AEs were diarrhea, fatigue and hand-foot skin reactions. The median overall survival was 384 days and was higher in Child-Pugh A patients (593 vs 211 days in Child-Pugh B). The median time to disease progression was 177 days, similar in both subgroups.
ConclusionThe safety profile of sorafenib in Spanish patients with unresectable HCC is independent of liver function. Child-Pugh status does not seem to influence the approach to sorafenib dosage or time to progression but does seem to be a strong prognostic factor for survival.
El cáncer hepático es, en nuestros días, la segunda causa de muerte por cáncer a nivel mundial1. El carcinoma hepatocelular (CHC) es la neoplasia primaria de hígado más frecuente2. Su incidencia mundial es heterogénea, condicionada por la prevalencia de los factores de riesgo para desarrollar la cirrosis hepática sobre la que asienta el CHC en la mayoría de los casos2. Aunque la incidencia es inferior en los países occidentales, se ha observado un aumento sostenido en las últimas décadas3,4. La incidencia en el sur de Europa (incluida España) es más elevada que en otras zonas de Europa, con 9,8 casos por 100.000 habitantes frente a los 2,6 de Europa del norte y los 5,8 de Europa oriental y occidental5.
Se trata de una enfermedad compleja y con mal pronóstico, dado que más de un 70% de los pacientes son diagnosticados en fases avanzadas6, en las que no es posible aplicar tratamientos con intención curativa, como la resección quirúrgica, el trasplante de hígado o la ablación percutánea. Un estudio multicéntrico realizado en España mostró que únicamente el 49,5% de los pacientes se diagnosticaron en estadios iniciales del BCLC 0 o A7. Aquellos pacientes diagnosticados dentro de programas de cribado presentaron un estadio del BCLC significativamente inferior y una mayor aplicabilidad de tratamientos con intención curativa en comparación con los pacientes en los que el diagnóstico fue un hallazgo casual o se realizó debido a la aparición de síntomas del CHC. Sin embargo, en la mayoría de los pacientes el diagnóstico se realizó fuera de programas de cribado de CHC, con una incidencia global de estadios del BCLC B-D del 69%7.
Sorafenib es un inhibidor multicinasa capaz de reducir la angiogénesis y de enlentecer la proliferación tumoral8,9. Dos estudios fase iii controlados con placebo en pacientes con cirrosis hepática (estudios SHARP [n=602] y Asia-Pacífico [n=226]) han mostrado que sorafenib logra un aumento significativo de la supervivencia en pacientes con CHC avanzado10,11. Sobre la base de estos resultados, sorafenib es el primer agente antitumoral sistémico indicado para el tratamiento de pacientes con CHC avanzado y actualmente es el tratamiento de elección2. Sin embargo, quedan aún aspectos por explorar acerca de su uso potencial en estos pacientes. Se dispone de evidencia científica limitada acerca de su uso en pacientes Child-Pugh B dado que los estudios fase iii evaluaron principalmente a pacientes con función hepática conservada (Child-Pugh A). Por otro lado, es necesario conocer su efectividad y seguridad en la práctica clínica real, normalmente alejada de las condiciones ideales de los ensayos clínicos.
Ambos aspectos han sido abordados en el estudio Global Investigation of therapeutic DEcisions in hepatocellular Carcinoma and Of its Treatment with sorafeNib (GIDEON)12, el mayor estudio prospectivo, no intervencionista, realizado hasta el momento en pacientes con CHC no resecable en los que se ha tomado la decisión de tratar con sorafenib. Inicialmente, fue planteado como un estudio postautorización destinado a aportar evidencia sobre la seguridad de sorafenib en la práctica clínica diaria (objetivo primario), especialmente en pacientes Child-Pugh B, aunque también se han evaluado otros aspectos relevantes como la efectividad y los patrones de tratamiento en función de las características del paciente (objetivos secundarios). El estudio ha analizado la seguridad en un total de 3.202 pacientes procedentes de 39 países. Cerca del 35% de estos pacientes (n=1.113) pertenece a países europeos, 143 de ellos a España. Los resultados de este estudio (2 interinos en 500 y 1.500 pacientes)13,14 y el final (> 3.000 pacientes)15 han confirmado la seguridad de sorafenib observada en los ensayos de registro fase iii, sin observarse acontecimientos adversos inesperados. Por otro lado, ha desvelado diferencias regionales importantes en los aspectos abordados en los objetivos secundarios. En la presente publicación, presentamos los datos correspondientes a los pacientes incluidos en los 19 hospitales españoles participantes con el fin de aportar evidencia acerca del tratamiento de los pacientes con CHC avanzado en nuestra área geográfica.
Material y métodosGIDEON fue un estudio fase iv, internacional, prospectivo, abierto, multicéntrico y no intervencionista realizado en pacientes con CHC no resecable en la práctica clínica diaria (número de identificación en clinicaltrials.org: NCT00812175). El reclutamiento se inició en enero del 2009 y finalizó en abril del 2011. El diseño y la metodología del estudio GIDEON han sido descritos con anterioridad12, por lo que se describen brevemente a continuación. Los pacientes elegibles para el estudio fueron aquellos con CHC no resecable confirmado mediante histología o citología, con esperanza de vida>8 semanas, candidatos a recibir terapia sistémica, en los que se hubiese tomado la decisión de tratar con sorafenib y que hubiesen firmado el consentimiento informado. Los criterios de exclusión se basaron en las contraindicaciones especificadas en la ficha técnica de producto. El estudio constó de una visita de reclutamiento (diagnóstico inicial y valoración del paciente), una visita inicial (de inicio del tratamiento con sorafenib), visitas de seguimiento que continuaron hasta la finalización del estudio (aunque se abandonase el medicamento) y una visita final (o fallecimiento). Su realización siguió la regulación y las recomendaciones de realización de estudios no intervencionistas, las normas de buena práctica clínica y lo establecido por las leyes, regulaciones y organizaciones pertinentes locales. El protocolo fue aprobado por los comités éticos/paneles de revisión institucionales correspondientes12.
Recogida de datos y variables de estudioLos datos del paciente recogidos en la visita de reclutamiento fueron: demográficos (edad y género), estado del paciente (historia médica, enfermedades concomitantes, alteraciones hepáticas [cirrosis, clasificación Child-Pugh], estado funcional valorado mediante la escala del Eastern Cooperative Oncology Group [ECOG])16, estado del CHC (historia, extensión [estadio, características del tumor, presencia de metástasis] y etiología) y tratamientos previos. Se recogió además la especialidad del investigador. El estadio del CHC se valoró mediante el sistema Barcelona Clinic Liver Cancer (BCLC)17 y Tumour Node Metastases (TNM)18. En la visita de inicio de tratamiento, se recogieron los siguientes datos: estadio del CHC, peso, tensión arterial, estadio ECOG y clasificación Child-Pugh. Se anotaron la dosis inicial de sorafenib y el motivo para iniciar el tratamiento. Durante las visitas de seguimiento se recogieron además los acontecimientos adversos emergentes del tratamiento (AA) y los tratamientos concomitantes (para CHC u otros), la evaluación de la respuesta al tratamiento mediante técnicas de imagen, y se evaluó la necesidad de modificación de dosis de sorafenib. En caso de abandono del tratamiento, se recogió además el motivo; en las visitas posteriores, también los tratamientos para el CHC recibidos. En la visita final, se recogieron además el estado de supervivencia y la razón para finalizar la observación del paciente, incluido su posible fallecimiento.
Las variables del estudio fueron: la seguridad (relación de AA, gravedad y grado según la versión 3.0 del Common Terminology Criteriafor Adverse Events [NCI CTC])19, la eficacia (supervivencia global y tiempo hasta la progresión), los datos sobre el tratamiento (dosis y duración del tratamiento con sorafenib, motivos para el abandono, otros tratamientos anteriores o actuales) y la respuesta al tratamiento según los criterios Response Evaluation Criteria in Solid Tumors v 1.0 (RECIST)20. Se consideró «control de la enfermedad» la mejor tasa de respuesta documentada (respuesta completa, respuesta parcial o enfermedad estable) mantenida al menos 28 días.
Análisis estadísticoEl tamaño de muestra global (internacional) se calculó de forma que permitiese la evaluación de la seguridad de sorafenib. La tasa de incidencia de AA de interés observada en los 2 estudios previos fase iii con sorafenib fue del 1-2%10,11, por lo que la población incluida en el estudio global (> 3.000) ofreció un 84% de probabilidad de observar AA, con una incidencia del 1% en al menos 25 pacientes12. La población de seguridad, constituida por los pacientes que recibieron al menos una dosis de sorafenib y que fueron evaluados al menos en una ocasión, fue de 3.202 pacientes. Los análisis de la pauta de administración de sorafenib y de eficacia se realizaron en la población por intención de tratar (ITT), constituida por los pacientes que tomaron al menos una dosis de sorafenib (n=3.213).
En el presente artículo se muestran los análisis de eficacia y seguridad realizados en los 143 pacientes de la muestra global tratados en centros españoles, tanto globales como en función de la clasificación Child-Pugh del paciente y de la dosis inicial de sorafenib. Los datos obtenidos se muestran mediante estadística descriptiva. Los resultados de eficacia se presentan mediante el estimador no paramétrico de la función de supervivencia Kaplan-Meier. En el análisis de eficacia se censuraron los datos de cualquier paciente del que se hubiese perdido el seguimiento, en el que no hubiese progresado la enfermedad o que hubiese fallecido sin progresión confirmada radiológicamente en el último día de evaluación. No se realizaron análisis estadísticos adicionales de subgrupos debido a las características del diseño del estudio y al bajo número de pacientes.
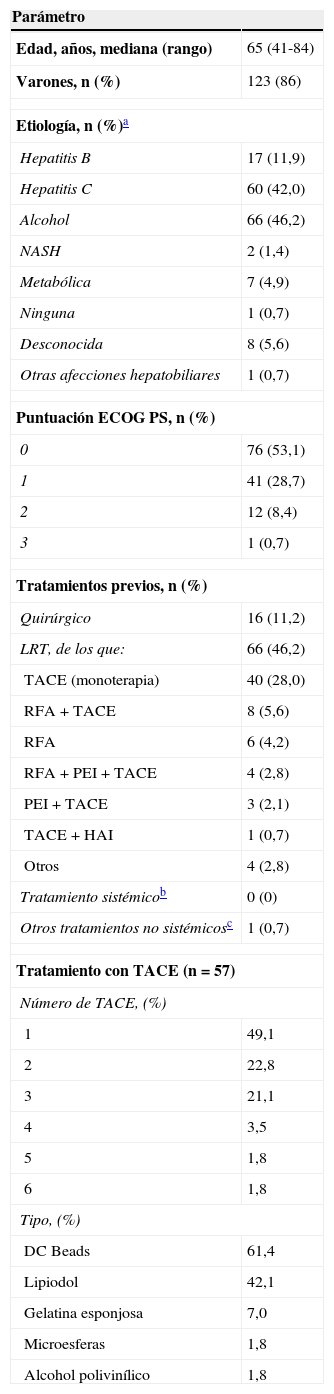
ResultadosPacientes participantes. Características basalesEn España, se reclutó a 144 pacientes, de los que uno no fue considerado válido para el análisis de seguridad ni por ITT por no haber sido tratado con sorafenib. El tamaño de las poblaciones de seguridad e ITT fue de 143 pacientes. La media de edad fue de 65 años; el 86% (n=123) fueron varones. El 83,9% (n=120) de los pacientes fue tratado en el Servicio de Hepatología/Gastroenterología; el 16,1% (n=23) en el Servicio de Oncología Clínica. Las características demográficas y basales de los pacientes se muestran en la tabla 1. Cerca de la mitad de los pacientes (53,1%) presentaba un estadio ECOG 0 y un tercio (28,1%), ECOG 1. Entre los tratamientos previos, los más frecuentes fueron los locorregionales (46,2%, n=66); de estos, el 60,6% (n=40) fue quimioembolización transarterial (TACE) en monoterapia. Al 49,1% de los pacientes se les había aplicado una sola sesión de TACE, a un 22,8% 2 sesiones y a un 21,1% 3 sesiones. En el 61,4% de los casos el agente utilizado fue doxorrubicina cargada en microsferas (DC Beads). La mediana de tiempo entre el diagnóstico del CHC y el inicio del tratamiento con sorafenib fue de 5 meses.
Características demográficas y basales de los pacientes (población ITT; n=143)
| Parámetro | |
|---|---|
| Edad, años, mediana (rango) | 65 (41-84) |
| Varones, n (%) | 123 (86) |
| Etiología, n (%)a | |
| Hepatitis B | 17 (11,9) |
| Hepatitis C | 60 (42,0) |
| Alcohol | 66 (46,2) |
| NASH | 2 (1,4) |
| Metabólica | 7 (4,9) |
| Ninguna | 1 (0,7) |
| Desconocida | 8 (5,6) |
| Otras afecciones hepatobiliares | 1 (0,7) |
| Puntuación ECOG PS, n (%) | |
| 0 | 76 (53,1) |
| 1 | 41 (28,7) |
| 2 | 12 (8,4) |
| 3 | 1 (0,7) |
| Tratamientos previos, n (%) | |
| Quirúrgico | 16 (11,2) |
| LRT, de los que: | 66 (46,2) |
| TACE (monoterapia) | 40 (28,0) |
| RFA+TACE | 8 (5,6) |
| RFA | 6 (4,2) |
| RFA+PEI+TACE | 4 (2,8) |
| PEI+TACE | 3 (2,1) |
| TACE+HAI | 1 (0,7) |
| Otros | 4 (2,8) |
| Tratamiento sistémicob | 0 (0) |
| Otros tratamientos no sistémicosc | 1 (0,7) |
| Tratamiento con TACE (n=57) | |
| Número de TACE, (%) | |
| 1 | 49,1 |
| 2 | 22,8 |
| 3 | 21,1 |
| 4 | 3,5 |
| 5 | 1,8 |
| 6 | 1,8 |
| Tipo, (%) | |
| DC Beads | 61,4 |
| Lipiodol | 42,1 |
| Gelatina esponjosa | 7,0 |
| Microesferas | 1,8 |
| Alcohol polivinílico | 1,8 |
ECOG PS: Eastern Cooperative Oncology Group performance status; HAI: infusión arterial hepática; LRT: tratamiento locorregional; NASH: esteatohepatitis no alcohólica; PEI: alcoholización percutánea; RFA: ablación por radiofrecuencia; TACE: quimioembolización transarterial.
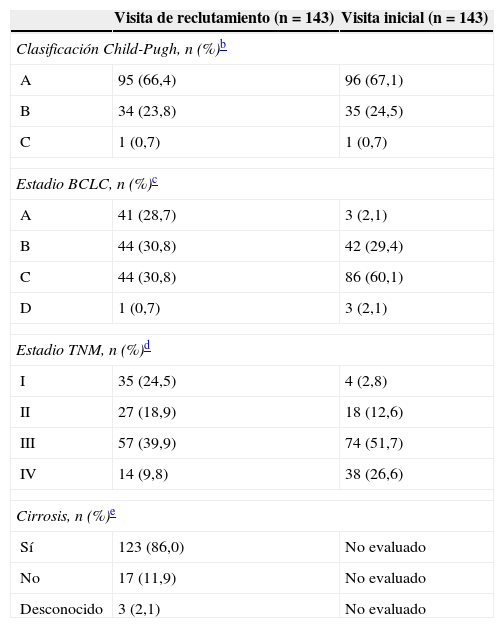
La tabla 2 muestra las características y la extensión de la enfermedad en el momento del reclutamiento y en la visita inicial. En la vista inicial, el 67,1% de los pacientes se clasificó como Child-Pugh A y el 24,5% como Child-Pugh B. El 60,1% de los pacientes presentaba un estadio BCLC C y el 29,4%, un estadio BCLC B. El estadio TNM más frecuente fue el iii (51,7%), seguido del iv (26,6%). El 86% presentaba una cirrosis hepática subyacente confirmada mediante clínica y/o pruebas histológicas y/o radiológicas.
Características de la enfermedad en la visita de reclutamiento e iniciala (población por intención de tratamiento; n=143)
| Visita de reclutamiento (n=143) | Visita inicial (n=143) | |
|---|---|---|
| Clasificación Child-Pugh, n (%)b | ||
| A | 95 (66,4) | 96 (67,1) |
| B | 34 (23,8) | 35 (24,5) |
| C | 1 (0,7) | 1 (0,7) |
| Estadio BCLC, n (%)c | ||
| A | 41 (28,7) | 3 (2,1) |
| B | 44 (30,8) | 42 (29,4) |
| C | 44 (30,8) | 86 (60,1) |
| D | 1 (0,7) | 3 (2,1) |
| Estadio TNM, n (%)d | ||
| I | 35 (24,5) | 4 (2,8) |
| II | 27 (18,9) | 18 (12,6) |
| III | 57 (39,9) | 74 (51,7) |
| IV | 14 (9,8) | 38 (26,6) |
| Cirrosis, n (%)e | ||
| Sí | 123 (86,0) | No evaluado |
| No | 17 (11,9) | No evaluado |
| Desconocido | 3 (2,1) | No evaluado |
BCLC: Barcelona Clinic Liver Cancer; TNM: Tumour Node Metastases.
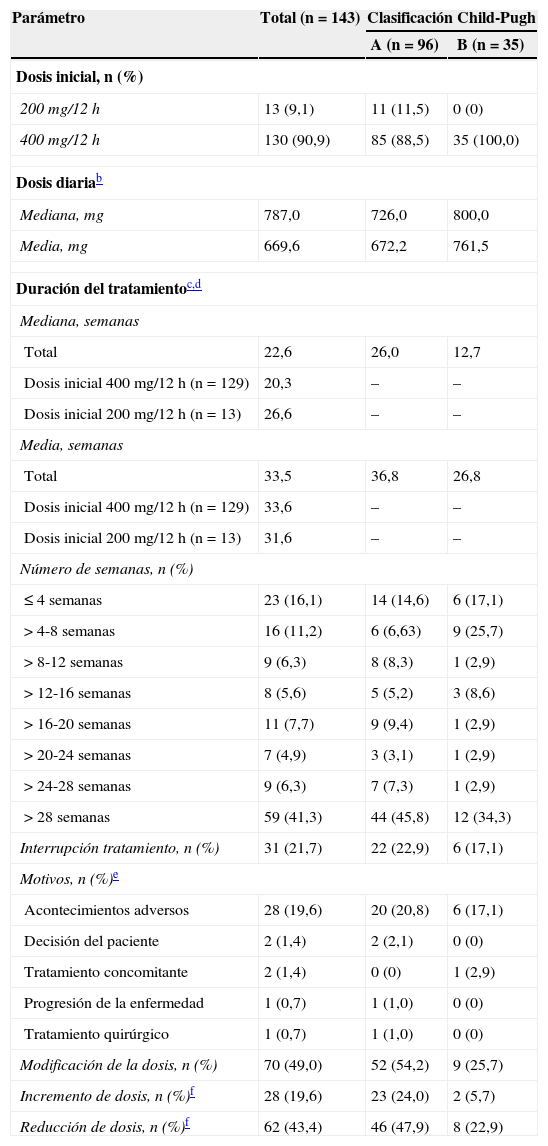
La pauta de administración de sorafenib en la población total y en los pacientes Child-Pugh A y B (n=96 y n=35, respectivamente) se muestra en la tabla 3. El 90,1% de los pacientes recibió una dosis inicial de 400mg/12h, siendo del 100% en los pacientes Child-Pugh B. Los pacientes Child-Pugh B recibieron dosis diarias superiores (mediana: 800,0 vs. 726,0mg en los Child-Pugh A), aunque la duración del tratamiento fue inferior (mediana: 12,7 vs. 26,0 semanas). La duración de tratamiento fue también inferior en aquellos pacientes que recibieron la dosis inicial de 400mg/12h (mediana: 20,3 vs. 26,6 semanas con 200mg/12h). El tratamiento se interrumpió en el 21,7% de los pacientes, con más frecuencia en los pacientes Child-Pugh A que en los B (22,9% vs. 17,1%, respectivamente). El motivo más frecuente de interrupción fue la aparición de AA (19,6%), un motivo que fue algo más frecuente en los pacientes Child-Pugh A (20,8% vs. 17,1% en pacientes Child-Pugh B). Aproximadamente, en la mitad de los pacientes (49,0%) tuvo lugar una modificación de dosis, lo que sucedió más frecuentemente en pacientes Child-Pugh A (54,2% vs. 25,7% en Child-Pugh B). La reducción de dosis fue más frecuente (43,4%) que el aumento de esta (19,6%), independientemente de la función hepática.
Pauta de administración de sorafenib en la población total y por clasificación Child-Pugh en la visita iniciala (población ITT; n=143)
| Parámetro | Total (n=143) | Clasificación Child-Pugh | |
|---|---|---|---|
| A (n=96) | B (n=35) | ||
| Dosis inicial, n (%) | |||
| 200mg/12h | 13 (9,1) | 11 (11,5) | 0 (0) |
| 400mg/12h | 130 (90,9) | 85 (88,5) | 35 (100,0) |
| Dosis diariab | |||
| Mediana, mg | 787,0 | 726,0 | 800,0 |
| Media, mg | 669,6 | 672,2 | 761,5 |
| Duración del tratamientoc,d | |||
| Mediana, semanas | |||
| Total | 22,6 | 26,0 | 12,7 |
| Dosis inicial 400mg/12h (n = 129) | 20,3 | – | – |
| Dosis inicial 200mg/12h (n=13) | 26,6 | – | – |
| Media, semanas | |||
| Total | 33,5 | 36,8 | 26,8 |
| Dosis inicial 400mg/12h (n=129) | 33,6 | – | – |
| Dosis inicial 200mg/12h (n=13) | 31,6 | – | – |
| Número de semanas, n (%) | |||
| ≤ 4 semanas | 23 (16,1) | 14 (14,6) | 6 (17,1) |
| > 4-8 semanas | 16 (11,2) | 6 (6,63) | 9 (25,7) |
| > 8-12 semanas | 9 (6,3) | 8 (8,3) | 1 (2,9) |
| > 12-16 semanas | 8 (5,6) | 5 (5,2) | 3 (8,6) |
| > 16-20 semanas | 11 (7,7) | 9 (9,4) | 1 (2,9) |
| > 20-24 semanas | 7 (4,9) | 3 (3,1) | 1 (2,9) |
| > 24-28 semanas | 9 (6,3) | 7 (7,3) | 1 (2,9) |
| > 28 semanas | 59 (41,3) | 44 (45,8) | 12 (34,3) |
| Interrupción tratamiento, n (%) | 31 (21,7) | 22 (22,9) | 6 (17,1) |
| Motivos, n (%)e | |||
| Acontecimientos adversos | 28 (19,6) | 20 (20,8) | 6 (17,1) |
| Decisión del paciente | 2 (1,4) | 2 (2,1) | 0 (0) |
| Tratamiento concomitante | 2 (1,4) | 0 (0) | 1 (2,9) |
| Progresión de la enfermedad | 1 (0,7) | 1 (1,0) | 0 (0) |
| Tratamiento quirúrgico | 1 (0,7) | 1 (1,0) | 0 (0) |
| Modificación de la dosis, n (%) | 70 (49,0) | 52 (54,2) | 9 (25,7) |
| Incremento de dosis, n (%)f | 28 (19,6) | 23 (24,0) | 2 (5,7) |
| Reducción de dosis, n (%)f | 62 (43,4) | 46 (47,9) | 8 (22,9) |
Visita inicial: visita en la que se inicia el tratamiento con sorafenib. No se pudo evaluar la categoría Child-Pugh en 11 pacientes (no evaluables) y un paciente se clasificó como Child-Pugh C.
n=134; calculada por paciente basándose en los días de toma del fármaco, excluyendo interrupciones.
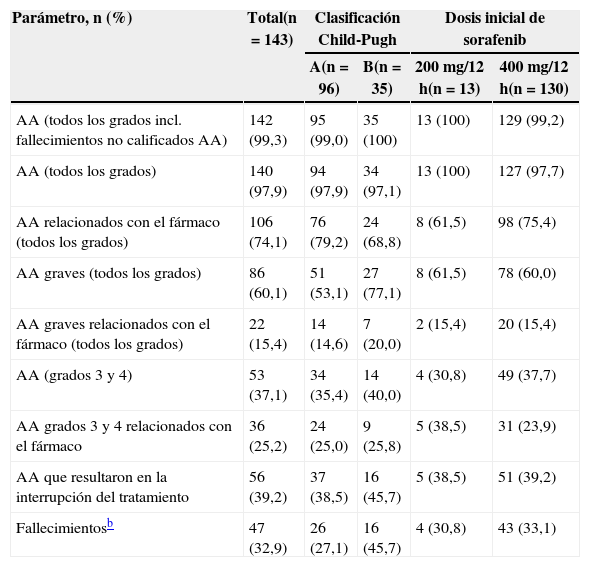
La tabla 4 presenta la incidencia de AA en la población total y en función de la clasificación Child-Pugh y de la dosis inicial. El 97,9% de los pacientes experimentó al menos un AA, independientemente de la clasificación Child-Pugh o de la dosis inicial. El 74,1% de los AA se consideró relacionados con el fármaco y fueron más frecuentes en los pacientes Child-Pugh A (79,2% vs. 68,8% en Child-Pugh B), así como en pacientes con dosis inicial de 400mg/12h (75,4% vs. 61,5% con 200mg/12h). La incidencia de AA graves fue superior en los pacientes Child-Pugh B (77,1% vs. 53,1% en pacientes Child-Pugh A) y fue independiente de la dosis inicial. El mismo patrón se observó con los AA graves relacionados con el fármaco, que presentaron una tasa del 15,4%.
Acontecimientos adversos emergentes del tratamiento (AA) en la población total, por estadio Child-Pugh en la visita iniciala y por dosis inicial de sorafenib (población de seguridad; n=143)
| Parámetro, n (%) | Total(n=143) | Clasificación Child-Pugh | Dosis inicial de sorafenib | ||
|---|---|---|---|---|---|
| A(n=96) | B(n=35) | 200mg/12h(n=13) | 400mg/12h(n=130) | ||
| AA (todos los grados incl. fallecimientos no calificados AA) | 142 (99,3) | 95 (99,0) | 35 (100) | 13 (100) | 129 (99,2) |
| AA (todos los grados) | 140 (97,9) | 94 (97,9) | 34 (97,1) | 13 (100) | 127 (97,7) |
| AA relacionados con el fármaco (todos los grados) | 106 (74,1) | 76 (79,2) | 24 (68,8) | 8 (61,5) | 98 (75,4) |
| AA graves (todos los grados) | 86 (60,1) | 51 (53,1) | 27 (77,1) | 8 (61,5) | 78 (60,0) |
| AA graves relacionados con el fármaco (todos los grados) | 22 (15,4) | 14 (14,6) | 7 (20,0) | 2 (15,4) | 20 (15,4) |
| AA (grados 3 y 4) | 53 (37,1) | 34 (35,4) | 14 (40,0) | 4 (30,8) | 49 (37,7) |
| AA grados 3 y 4 relacionados con el fármaco | 36 (25,2) | 24 (25,0) | 9 (25,8) | 5 (38,5) | 31 (23,9) |
| AA que resultaron en la interrupción del tratamiento | 56 (39,2) | 37 (38,5) | 16 (45,7) | 5 (38,5) | 51 (39,2) |
| Fallecimientosb | 47 (32,9) | 26 (27,1) | 16 (45,7) | 4 (30,8) | 43 (33,1) |
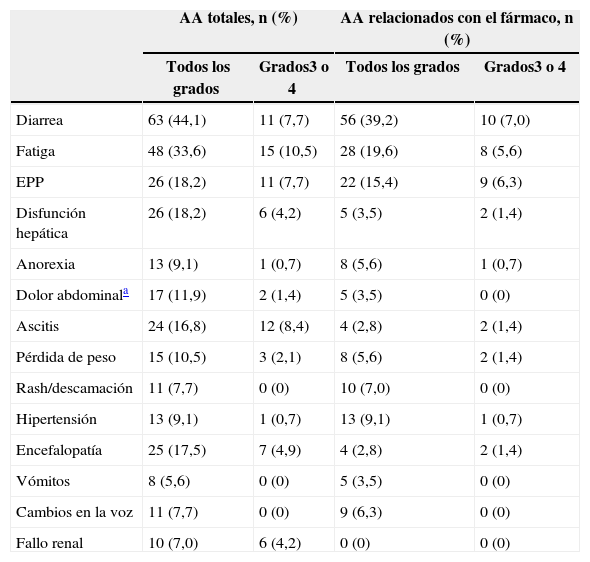
La incidencia de AA relacionados con el fármaco de grado 3 y 4 fue superior en pacientes con dosis inicial de 200mg/12h (30,8% vs. 20,8% y 7,7% vs. 3.1% con 400mg/12h). El 45,7% de los pacientes Child-Pugh B interrumpió permanentemente el tratamiento por aparición de AA, frente al 38,5% de los Child-Pugh A. La tasa de fallecimientos relacionados con el tratamiento fue también superior en los pacientes Child-Pugh B (tabla 4). Los AA relacionados con el fármaco más frecuentes fueron la diarrea, la fatiga, la eritrodisestesia palmo-plantar, la hipertensión y el rash. La tabla 5 muestra la tasa de AA emergentes del tratamiento y los relacionados con el fármaco, señalándose aquellos de grado 3 o 4.
Acontecimientos adversos emergentes del tratamiento (AA) con incidencia ≥ 5% en la población (población de seguridad; n=143) clasificados según NCI CTC v3.0
| AA totales, n (%) | AA relacionados con el fármaco, n (%) | |||
|---|---|---|---|---|
| Todos los grados | Grados3 o 4 | Todos los grados | Grados3 o 4 | |
| Diarrea | 63 (44,1) | 11 (7,7) | 56 (39,2) | 10 (7,0) |
| Fatiga | 48 (33,6) | 15 (10,5) | 28 (19,6) | 8 (5,6) |
| EPP | 26 (18,2) | 11 (7,7) | 22 (15,4) | 9 (6,3) |
| Disfunción hepática | 26 (18,2) | 6 (4,2) | 5 (3,5) | 2 (1,4) |
| Anorexia | 13 (9,1) | 1 (0,7) | 8 (5,6) | 1 (0,7) |
| Dolor abdominala | 17 (11,9) | 2 (1,4) | 5 (3,5) | 0 (0) |
| Ascitis | 24 (16,8) | 12 (8,4) | 4 (2,8) | 2 (1,4) |
| Pérdida de peso | 15 (10,5) | 3 (2,1) | 8 (5,6) | 2 (1,4) |
| Rash/descamación | 11 (7,7) | 0 (0) | 10 (7,0) | 0 (0) |
| Hipertensión | 13 (9,1) | 1 (0,7) | 13 (9,1) | 1 (0,7) |
| Encefalopatía | 25 (17,5) | 7 (4,9) | 4 (2,8) | 2 (1,4) |
| Vómitos | 8 (5,6) | 0 (0) | 5 (3,5) | 0 (0) |
| Cambios en la voz | 11 (7,7) | 0 (0) | 9 (6,3) | 0 (0) |
| Fallo renal | 10 (7,0) | 6 (4,2) | 0 (0) | 0 (0) |
EPP: eritrodisestesia palmo-plantar o síndrome de mano-pie; NCI CTC v3: versión 3 del Common Terminology Criteria for Adverse Events.
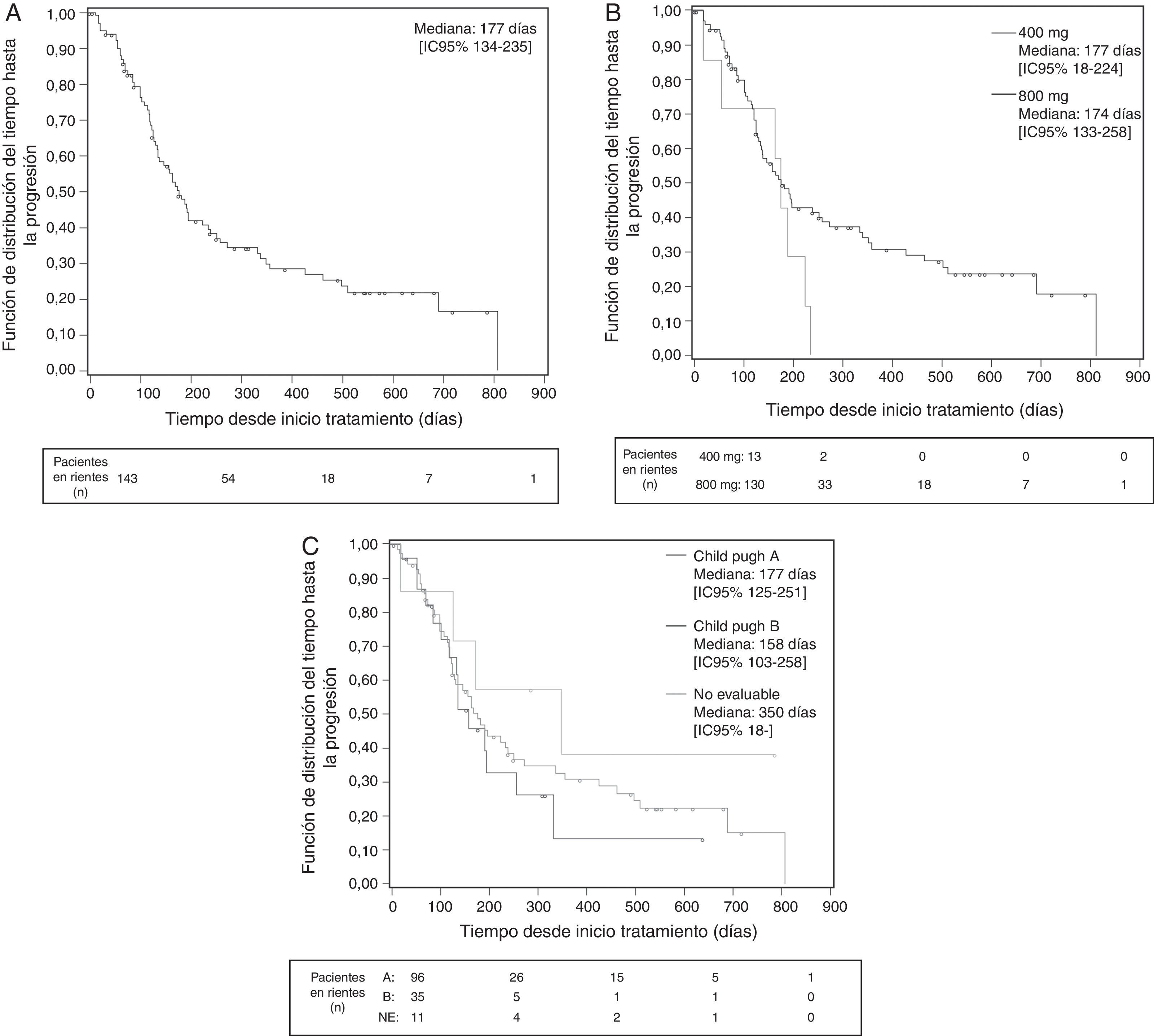
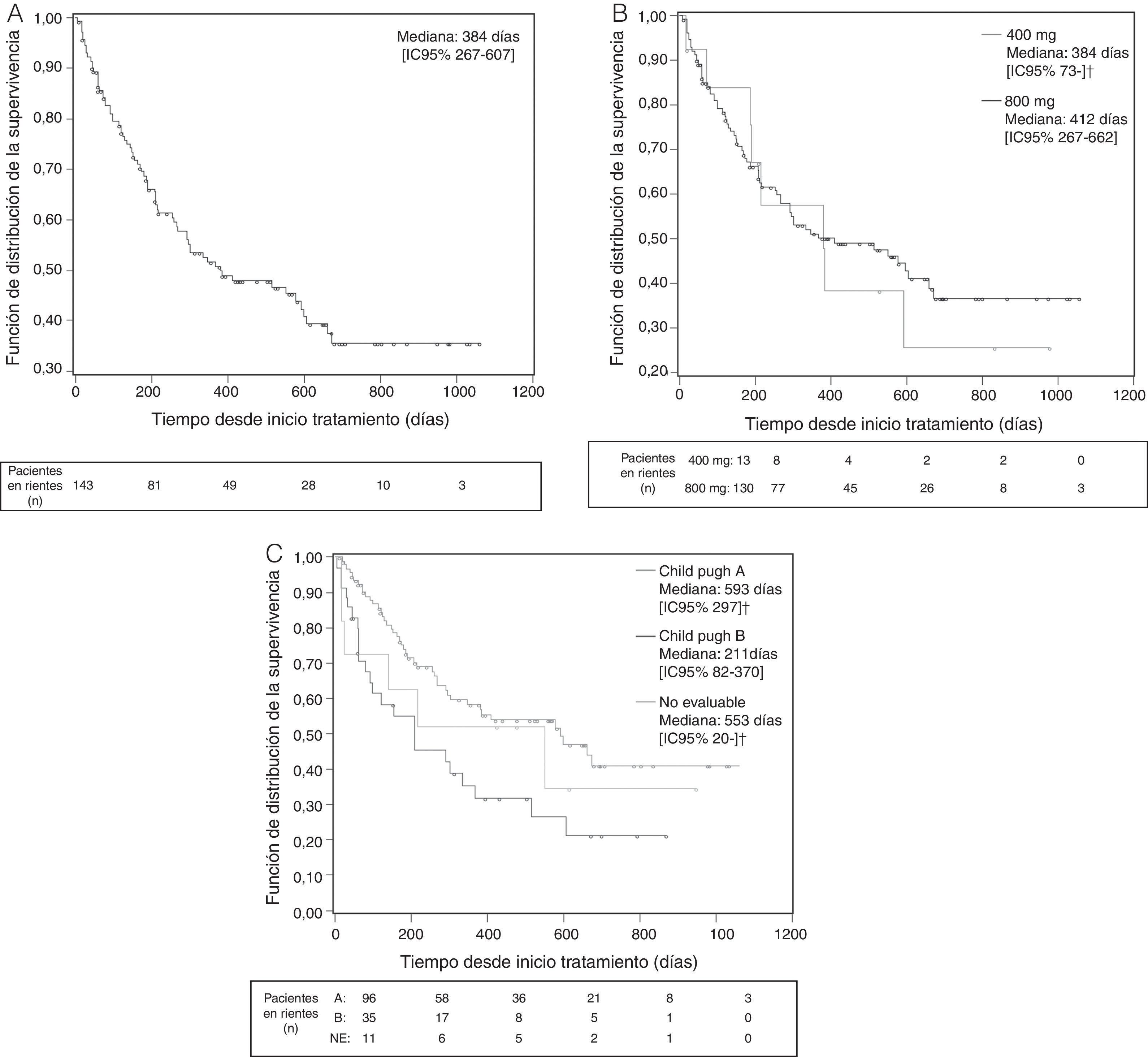
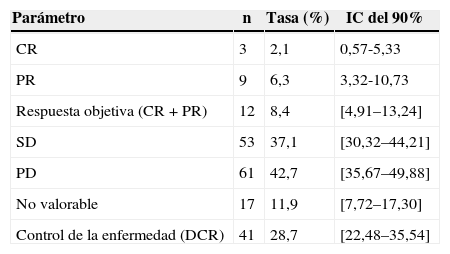
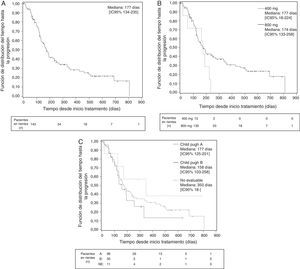
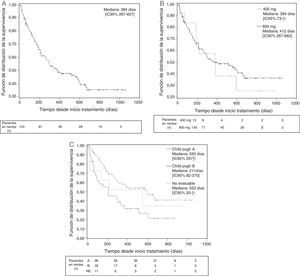
Se consideró que se había conseguido una «tasa de control de la enfermedad» (véase Métodos) en el 28,7% de los pacientes, mientras que en el 42,7% de los pacientes se informó de una progresión de la enfermedad que se especificó solo en 22 de los 61 pacientes (11 como progresión clínica, 3 radiológica y 8 ambas) (tabla 6). La mediana de tiempo hasta la progresión de la enfermedad en la población global fue de 177 días (fig. 1), siendo inferior en los pacientes Child-Pugh B (158 vs. 177 días en los pacientes Child-Pugh A) e independiente de la dosis inicial. La mediana de supervivencia global fue de 384 días en la población global (fig. 2), siendo superior con la dosis inicial de 400/12hmg (412 vs. 384 días con 200mg/12h) y en los pacientes Child-Pugh A (593 vs. 211 días en pacientes Child-Pugh B).
Mejor respuesta según valoración del investigador basada en criterios RECIST v 1.0 (población por intención de tratamiento, ITT; n=143)
| Parámetro | n | Tasa (%) | IC del 90% |
|---|---|---|---|
| CR | 3 | 2,1 | 0,57-5,33 |
| PR | 9 | 6,3 | 3,32-10,73 |
| Respuesta objetiva (CR+PR) | 12 | 8,4 | [4,91–13,24] |
| SD | 53 | 37,1 | [30,32–44,21] |
| PD | 61 | 42,7 | [35,67–49,88] |
| No valorable | 17 | 11,9 | [7,72–17,30] |
| Control de la enfermedad (DCR) | 41 | 28,7 | [22,48–35,54] |
CR: respuesta completa; CR/PR: respondedores confirmados; DCR: proporción de pacientes con la mejor tasa de respuesta documentada (CR, PR o SD) que se mantiene al menos 28 días; SD: enfermedad estable, pacientes con la mejor respuesta global de SD al menos 6 semanas tras la primera dosis de sorafenib; PD: progresión de la enfermedad, pacientes con la mejor respuesta global (radiológica o clínica); PR: respuesta parcial.
Tiempo hasta la progresión de la enfermedad desde la visita inicial (días). Datos globales (A), en función de la dosis inicial (B) y de la función hepática (C) (curva de Kaplan-Meier. Población ITT. Análisis final).
Visita inicial: visita en la que se inicia el tratamiento con sorafenib.
Supervivencia global desde la visita inicial (días). Datos globales (A), en función de la dosis inicial (B) y de la función hepática (C) (curva de Kaplan-Meier. Población ITT. Análisis final).
Visita inicial: visita en la que se inicia el tratamiento con sorafenib.
* No es posible calcular el IC del 95% debido a los datos censurados para el análisis de Kaplan-Meier (véase Métodos).
Los datos del estudio GIDEON recogidos en España, al igual que los resultados de la cohorte de GIDEON internacional13-15, confirman que sorafenib se usa habitualmente en la práctica clínica diaria en un grupo heterogéneo de pacientes, incluyendo aquellos con función hepática alterada (Child-Pugh B). Estos datos aportan también valiosa información acerca del perfil de los pacientes con CHC avanzado en nuestro país, así como de los patrones de tratamiento con sorafenib y de la seguridad y la efectividad de este agente lejos de las condiciones ideales de los ensayos clínicos.
Al igual que en otros países industrializados, el consumo crónico de alcohol y la infección crónica por el virus de la hepatitis C fueron las causas más frecuentes de la cirrosis hepática sobre la que se presentó el CHC (∼45%)2. Cerca del 25% de los pacientes incluidos fueron clasificados como Child-Pugh B, un colectivo del que se disponía de escasa información sobre la eficacia y la seguridad de sorafenib, dado que presentar esta alteración de la función hepática era un criterio de exclusión en los estudios fase iii. Este porcentaje es algo superior al observado en el estudio internacional (20,8%)15 y en un subanálisis realizado en la cohorte de pacientes europeos (19,9%)21. Los resultados observados a nivel europeo tienen el interés de corresponder a un entorno cercano al nuestro, por lo que merece la pena resaltar algunas similitudes y diferencias observadas.
El estadio BCLC C (avanzado) fue el predominante en ambos casos (60% en la cohorte española y 53% en la cohorte europea), lo que refleja el alto porcentaje de pacientes que son diagnosticados de CHC en fases avanzadas. Este hecho parece ser más acusado en nuestro país, dado que el porcentaje de pacientes con estadio BCLC A (temprano) fue muy inferior (2,1% vs. 8,5%). La pauta inicial de sorafenib usada mayoritariamente (90,9% de los casos) fue la dosis plena recomendada en ficha técnica (400mg/12h)22, lo que ocurrió con más frecuencia que a nivel europeo (82,4%), sin observarse en ningún caso diferencias significativas en función del grado de función hepática. En nuestro caso, se inició el tratamiento a dosis plena en el 100% de los pacientes en estadio de Child-Pugh B. Cabe destacar que las modificaciones de dosis durante el seguimiento fueron muy frecuentes, reduciéndose en casi la mitad de los pacientes Child-Pugh A y en un tercio de los pacientes Child-Pugh B. Además, hasta en una cuarta parte de los pacientes Child-Pugh A se produjo un aumento de dosis. Aunque no se informó acerca de los motivos para estos cambios, parece lógico pensar que la aparición de AA haya sido la causa de la mayoría de reducciones de dosis observadas, mientras que una buena tolerabilidad del fármaco tras iniciar el tratamiento con la dosis inferior puede haber facilitado el aumento de dosis diaria. La duración del tratamiento fue casi el doble en los pacientes Child-Pugh A (26,0 vs. 12,7 semanas en los pacientes Child-Pugh B), un patrón que también se observó a nivel europeo21 y a nivel internacional15. Sin embargo, en nuestro país la media de duración del tratamiento fue superior a la observada a nivel internacional (22 vs. 17 semanas). En los centros españoles participantes, hasta un 41,3% de los pacientes recibió tratamiento con sorafenib durante más de 28 semanas, siendo este porcentaje superior en los pacientes Child-Pugh A.
La incidencia y el tipo de AA observados a nivel internacional y en el presente subanálisis fueron consistentes con lo observado en estudios de registro fase iii10,11. El 74,1% de los AA se atribuyeron al fármaco, un porcentaje más elevado que el observado en Europa (69%), lo que puede reflejar una mayor exigencia en la declaración de AA en nuestro país. La incidencia de AA fue algo superior en los pacientes Child-Pugh A, posiblemente por estar expuestos al medicamento durante más tiempo. Con el fin de evaluar el impacto real de los AA relacionados con el fármaco, en la cohorte de GIDEON internacional se calculó la incidencia por paciente y año, observándose una incidencia de AA ajustada similar (1,17 vs. 1,55 por paciente-año en pacientes Child-Pugh A y B, respectivamente)15. Se carece de este cálculo en el subanálisis de datos españoles. La incidencia de AA relacionados con el fármaco también fue superior en los pacientes que recibieron una dosis inicial plena, aunque es difícil extraer conclusiones sobre este aspecto dadas las modificaciones de dosis realizadas. Por el contrario, la incidencia de AA graves relacionados con el fármaco fue superior en los pacientes Child-Pugh B, donde llevó con más frecuencia a la interrupción permanente del tratamiento y se observó una mayor tasa de fallecimientos. Los AA relacionados con el fármaco observados con más frecuencia fueron los ya descritos en los estudios fase iii, como la diarrea, la fatiga, la eritrodisestesia palmo-plantar, la hipertensión y el rash. Los AA fueron la causa de interrupción del tratamiento en el 39,2% de los casos. La disfunción hepática, con una incidencia del 18%, no se relacionó con la administración del fármaco. No se analizaron las diferencias en la incidencia de cada uno de los AA en función del grado de función hepática o de la dosis inicial. La identificación de los factores predictivos para su aparición requeriría de un análisis multivariado.
El tratamiento permitió mantener la enfermedad estable en el 37,1% de los pacientes, mientras que se informó acerca de una progresión de la misma en el 42,7%. La mediana de supervivencia global fue de 12,6 meses y, como era de esperar, fue casi 3 veces superior en los pacientes Child-Pugh A que en los Child-Pugh B (19,4 vs. 6,9 meses). La supervivencia global de los pacientes tratados con sorafenib es similar a la observada en un estudio prospectivo en pacientes tratados con sorafenib realizado recientemente en nuestro país (mediana de 12,5 meses)23 y en el estudio observacional SOFIA, realizado en Italia (mediana de 10,5 meses)24. En este último estudio, los pacientes que recibieron durante>70% del tiempo la mitad de dosis mostraron una supervivencia superior a los que durante el mismo periodo habían recibido la dosis completa. En nuestro caso, aunque la supervivencia fue un 10% superior en pacientes que recibieron una dosis inicial plena, las frecuentes modificaciones de dosis experimentadas durante el periodo de seguimiento imposibilitan analizar el efecto de la dosis sobre la supervivencia. Contrariamente a la supervivencia, el tiempo hasta la progresión de la enfermedad fue similar en los pacientes Child-Pugh A y B (5,8 vs. 5,2 días), e independiente de la dosis inicial.
Los estudios observacionales tienen ciertas limitaciones y, por tanto, los resultados han de ser interpretados con cautela. La falta de aleatorización a tratamientos y de un grupo control con placebo limita la evaluación de los resultados de eficacia y seguridad, pero por el contrario, permiten la evaluación de otros aspectos relacionados con la práctica clínica diaria que influye también en la efectividad de los tratamientos. El bajo número de pacientes reclutados en España no permite el análisis estadístico de algunas diferencias observadas, pero aportan información muy valiosa acerca de la experiencia con sorafenib en un número considerable de pacientes con disfunción hepática moderada (Child-Pugh B). Sin embargo, es importante tener en cuenta que la clasificación Child-Pugh B engloba a un grupo heterogéneo de pacientes dada la diversidad de parámetros usados en esta clasificación (ascitis, bilirrubina, albúmina, tiempo de protrombina y encefalopatía). Se desconoce si algunos de los pacientes englobados en esta categoría presentarían resultados de supervivencia más cercanos a los pacientes Child-Pugh A.
ConclusiónLos pacientes con CHC no resecable son tratados con sorafenib en la práctica clínica diaria, independientemente del grado de disfunción hepática (Child-Pugh A o B). El tratamiento con sorafenib se inicia mayoritariamente a dosis plena en todos los pacientes. La duración del tratamiento es inferior en pacientes Child-Pugh B, donde se observa una mayor incidencia de AA graves relacionados con el fármaco y una mayor interrupción del tratamiento debido a los AA. El perfil de seguridad de sorafenib es consistente con el observado en los ensayos clínicos previos e independiente del grado de disfunción hepática. La clasificación Child-Pugh no influyó en el tiempo hasta la progresión, pero sí parece ser un fuerte predictor de la supervivencia de los pacientes con CHC avanzado en tratamiento con sorafenib.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEl presente estudio ha sido financiado por Bayer Healthcare Pharmaceuticals y Onix Pharmaceuticals.
Los autores agradecen la colaboración de los médicos participantes en el estudio GIDEON en España. También agradecen a Beatriz Viejo, PhD, su contribución en la redacción y edición del manuscrito.