Las dilataciones vasculares intrapulmonares (DVIPu) están consideradas una complicación de la cirrosis. La ecocardiografía con contraste (ETTc) es la técnica de elección para su diagnóstico. El objetivo de este estudio es demostrar que el doppler transcraneal con contraste (DTCc) puede servir para el diagnóstico de las DVIPu.
MétodoSe incluyeron consecutivamente pacientes evaluados para trasplante hepático. Estudio transversal con enmascaramiento de la prueba de referencia (ETTc) para quien interpreta la prueba a valorar (DTCc). Analizamos la exactitud de la prueba diagnóstica mediante los valores de sensibilidad, especificidad, valor predictivo positivo y negativo, y razón de verosimilitud.
ResultadosPor DTCc (n=43) existía shunt derecha-izquierda en 23 pacientes (62,2%): 4 precoces, 2 indeterminados y 17 tardíos. Diecinueve (51,4%) casos fueron clasificados DVIPu. Con ETTc (n=37) 10 estudios (27%) fueron negativos para shunt y 27 (73%) positivos, 21 (56,8%) fueron compatibles con DVIPu. Los pacientes con y sin DVIPu no diferían en edad, sexo, etiología, gravedad o índice de MELD, independientemente del método diagnóstico. En el estudio de validez diagnóstica (n=37) del DTCc frente a la ETTc, el rendimiento diagnóstico fue AUC=0,813% (IC95%: 0,666-0,959; p=0,001), sensibilidad: 76,2% (IC95%: 54,9-89,4) y especificidad: 90% (IC95%: 63,9-96,5). Razón de verosimilitud positiva: 6,095.
ConclusionesDemostramos una alta prevalencia de DVIPu en candidatos a trasplante hepático. La probabilidad que tiene el DTCc en detectar DVIPu cuando se observa shunt derecha-izquierda tardío con recirculación es muy elevada, y con pocos falsos positivos. Al ser una técnica previamente no descrita en este contexto, deben llevarse a cabo estudios similares con fin comparativo.
Intrapulmonary vascular dilatations (IPVD) are considered a complication of cirrhosis. The technique of choice for their diagnosis is contrast-enhanced echocardiography (CEE). The aim of this study was to determine the usefulness of contrast-enhanced transcranial Doppler (CETD) in the diagnosis of IPVD.
MethodWe consecutively included patients evaluated for liver transplantation. A cross-sectional study was conducted. The investigator interpreting CETD was blind to the results of the gold standard (CEE). The accuracy of the diagnostic test was evaluated through sensitivity, specificity, positive and negative predictive values, and likelihood ratio.
ResultsCETD (n=43) showed a right-to-left shunt in 23 patients (62.2%): 4 early, 2 indeterminate and 17 late. Nineteen (51,4%) cases were classified as IPVD. With CEE (n=37), 10 procedures (27%) were negative for shunt, 27 (73%) were positive, and 21 (56.8%) were compatible with IPVD. Patients with and without IPVD showed no differences in age, sex, etiology, severity, or MELD score, independently of the diagnostic test. In the diagnostic validity study (n=37) of CETD versus CEE, the AUC for diagnostic yield was 0.813% (95%CI: 0.666-0.959; P=.001), sensitivity was 76.2% (95%CI: 54.9-89.4) and specificity was 90% (95%CI: 63.9-96.5). The positive likelihood ratio was 6.095.
ConclusionsWe found a high prevalence of IPVD in candidates for liver transplantation. When a late right-to-left shunt with recirculation is observed, CETD has a high probability of detecting IPVD, with few false-positive results. Because this technique has not previously been described in this indication, similar studies are needed for comparison.
La interacción entre el hígado enfermo y el pulmón se conoce desde hace más de 100 años. En 1884 Flückiger describe un caso de enfermedad hepática avanzada, probablemente de origen sifilítico, con cianosis y acropaquías y sin que hubiera evidencia de enfermedad pulmonar1. En el año 1956 los autores Rydell y Hoffbauer describen la fisiopatología de la hipoxemia arterial en la enfermedad hepática complicada2. Los cambios arteriales (dilataciones vasculares) pulmonares que sufren los pacientes cirróticos los demostró Berthelot en estudios autópsicos una década más tarde3.
El capilar pulmonar normal mide en torno a 15μm, encontrándose en la cirrosis hepática capilares pulmonares mayores de 100 y hasta de 500μm, en ocasiones formando verdaderas malformaciones arteriovenosas3. En 1977 Kennedy y Knudson sugieren el término «hepatopulmonar» para describir el trastorno del intercambio gaseoso que sufren los pacientes con cirrosis hepática enólica4. En 1989 Sherlock definió el síndrome hepatopulmonar como la alteración de la oxigenación por dilataciones vasculares intrapulmonares (DVIPu) anormales en pacientes con patología hepática5.
La importancia clínica del síndrome hepatopulmonar radica en las implicaciones pronósticas para la supervivencia del paciente, en el sentido de que el síndrome hepatopulmonar es un factor independiente de mortalidad en la cirrosis hepática y puede llegar a ser una indicación de trasplante hepático5,6.
El diagnóstico de las DVIPu puede realizarse en la actualidad con las siguientes técnicas: ecocardiografía bidimensional con segundo armónico y contraste, escintigrafía de macroagregados de albúmina con tecnecio-99 marcado y mediante arteriografía pulmonar3. El ecocardiograma transtorácico con contraste es el test no invasivo de elección y propuesto como técnica de cribado7. La interpretación fisiológica de la prueba es sencilla: tras una inyección de solución salina agitada en una vena, las microburbujas resultantes (de 60-90μm) son mayores que el lecho capilar pulmonar normal (8-15μm), por lo que solo opacificarán las cavidades derechas en condiciones normales; cuando existen un shunt intracardiaco o intrapulmonar, aparecerá una opacificación de las cavidades izquierdas después de su aparición en cavidades derechas. Esta es la base teórica que utilizamos en nuestra hipótesis de trabajo, sugiriendo que el doppler transcraneal con contraste salino agitado (DTCc) puede ser una técnica diagnóstica válida para la demostración de las DVIPu en el paciente cirrótico. El DTCc es una técnica empleada habitualmente para el estudio de la embolia paradójica por comunicación derecha-izquierda, que se produce cuando existe un foramen oval permeable o una fístula arteriovenosa extracardiaca8.
En el estudio analizamos la prevalencia de las DVIPu en pacientes cirróticos, la caracterización del patrón por DTCc y la validez diagnóstica del DTCc frente a la ecocardiografía con contraste (ETTc). También evaluamos los factores pronósticos asociados con la presencia de las dilataciones vasculares según la técnica de estudio.
Material y métodoSe incluyó consecutivamente y de forma prospectiva, durante un periodo de 6meses, a los pacientes mayores de 18años diagnosticados de cirrosis e ingresados para evaluación protocolizada de trasplante hepático. El diagnóstico de la cirrosis hepática se realizó por criterios clínicos, y en algunos casos estaba confirmado patológicamente. Fueron excluidos los pacientes con diagnóstico de enfermedad pulmonar crónica, inestabilidad hemodinámica, insuficiencia cardiaca, cardiopatía congénita o trastorno cognitivo que impidiera la colaboración o la prestación del consentimiento. Los sujetos fueron informados individualmente sobre los objetivos de la investigación y otorgaron su consentimiento escrito. El protocolo de investigación fue evaluado y aprobado por el Comité Ético de Investigación de la Institución.
Los datos clínicos y analíticos recogidos fueron: edad, sexo, historia de tabaquismo, variables hematológicas (hemoglobina, hematocrito, leucocitos, recuento de plaquetas, tiempo de protrombina); bioquímica sanguínea (bilirrubina total, albúmina, alaninoaminotransferasa (ALT), aspartatoaminotransferasa (AST), coeficiente AST/ALT, creatinina, colesterol y sodio sérico) y gravedad de la enfermedad hepática determinada mediante el grado de Child-Pugh, clasificándola en 3 estadios según la puntuación: A5-6, B7-9 y C10-15. Se clasificó la etiología de la hepatopatía de la siguiente forma: enólica, vírica y otras etiologías (causa autoinmune, CBP, CEP, enfermedad de Wilson, fibrosis hepática congénita y criptogénica). Variables relacionadas con complicaciones de la cirrosis: ascitis (presencia de líquido en la cavidad abdominal por examen físico y/o ultrasonido abdominal; se determinó la presencia de esta complicación si el paciente presentaba ascitis en el momento de la evaluación o si tenía el antecedente de haberla presentado y estaba controlado con diuréticos), encefalopatía hepática (presencia de síntomas y signos neuropsiquiátricos que acontecen en el momento de la evaluación o por los antecedentes del paciente), peritonitis bacteriana espontánea (episodio de infección bacteriana del líquido ascítico en ausencia de foco infeccioso intraabdominal), sangrado digestivo alto (presencia en la evolución de al menos un episodio de hematemesis o melena relacionada con varices esofágicas y/o gastropatía portal). Variables del ultrasonido con doppler esplenoportal: ecoestructura hepática (homogénea o heterogénea), diámetro longitudinal del bazo, diámetro de la porta y flujo de la porta (hepatocéntrico o hepatofugo en dependencia del flujo sanguíneo con relación al transductor). El riesgo de mortalidad de los pacientes se estimó a través del Modelo de Etapa Final de la Enfermedad Hepática (MELD), y el índice fue agrupado en menos de 10, entre 10-15 y mayor de 15.
Estudio ecocardiográficoLa ecocardiografía con imagen armónica y administración de suero fisiológico agitado se realizó con el paciente en posición de decúbito lateral izquierdo por un único ecocardiografista. Los estudios se realizaron con un ecocardiógrafo iE33 (Philips) utilizando un transductor multifrecuencia. Las imágenes se grabaron en formato DICOM (Digital Imaging and Communication in Medicine) para su posterior cuantificación, que realizó un cardiólogo experto en ecocardiografía avanzada, quien desconocía el resultado del estudio doppler transcraneal. Las microburbujas fueron producidas manualmente, mediante la transferencia de 9ml de solución salina estéril y 0,5ml de aire entre 2jeringas conectadas y, a continuación, administrado rápidamente a través de un acceso venoso periférico. El estudio se consideró positivo cuando se detectó la presencia anormal de contraste en las cámaras cardíacas izquierdas, con un retraso del ciclo 4 a 6, después de opacificación inicial de las cámaras cardiacas derechas. Se realizó en situación de reposo y tras maniobras de Valsalva en 3 ocasiones, para confirmar su reproducibilidad. Según la opacificación auricular izquierda, se realizó un análisis semicuantitativo de las microburbujas siguiendo los criterios establecidos por Aller et al.7 y Krowka et al.9 estableciendo la ausencia de microburbujas como el nivel1; el paso de un par de microburbujas aisladas como nivel2; varias microburbujas como nivel3; el paso de varias microburbujas resultantes en un aumento de la ecogenicidad como nivel4; la opacificación izquierda de nivel más bajo en comparación con la aurícula derecha fue considerado como nivel5, y la opacificación izquierda similar a la derecha se consideró nivel6. Para el análisis, los niveles1 y 2 se consideraron normal o ausencia de vasodilataciones pulmonares; el nivel3 como presencia de vasodilataciones pulmonares leves, y, por último, los niveles4-6 vasodilataciones pulmonares significativas o importantes.
Estudio doppler transcranealEl examen con DTC se realizó con un equipo Multi-Dop®X digital, DWL®. El flujo de la arteria cerebral media se monitorizó a través de la ventana temporal con un transductor de 2MHz. El transductor del DTC se fijó a un casco rígido adaptable que permitía una insonación estable a 55-65mm de profundidad. El estudio fue practicado por un neurólogo, especialista en esta técnica, que desconocía los resultados del estudio ecocardiográfico. El test se realizó con contraste salino agitado en situación de reposo y tras maniobras de Valsalva siguiendo las recomendaciones previamente consensuadas10. Las microburbujas fueron producidas manualmente, mediante la transferencia de 9ml de solución salina estéril y 0,5ml de aire entre 2 jeringas conectadas y, a continuación, administrado rápidamente a través de un acceso venoso periférico. El test se realizó, al igual que el ETTc, en 3 ocasiones. Se cuantificó el tiempo de aparición del shunt desde la infusión, su grado (ligero, moderado o severo), se analizó si la maniobra de Valsalva anticipaba y/o aumentaba el shunt y si existía recirculación de microburbujas (persistencia de las microembolias en el DTCc durante más de 2 ciclos cardiacos tras la infusión de la emulsión gaseosa). Se definió el patrón compatible con DVIPu como aquel shunt presente en la fase basal del estudio con recirculación o bien aquel shunt tardío en fase basal con o sin recirculación. Los shunt precoces en basal o con aparición tras la maniobra de Valsalva se clasificaron como shunt de probable origen cardiaco.
Análisis estadísticoLos datos se analizaron mediante el paquete estadístico SPSS (versión 15.0, SPSS Inc., Chicago, IL). Las variables cuantitativas continuas se evaluaron con la prueba t de Student, usando la corrección de Tukey si fue necesario. La comparación de las frecuencias se realizó mediante el test de chi-cuadrado o la prueba exacta de Fisher. Un valor de p menor de 0,05 fue considerado significativo.
Se realizaron comparaciones univariadas y análisis multivariado (análisis de regresión logística por pasos hacia atrás) para identificar los factores independientes asociados con las DVIPu tanto por ETTc como por DTCc. La capacidad discriminativa de cada puntuación pronóstica se evaluó mediante el área bajo la curva ROC (AUC). Para probar la calibración, se utilizó el test de Hosmer-Lemeshow.
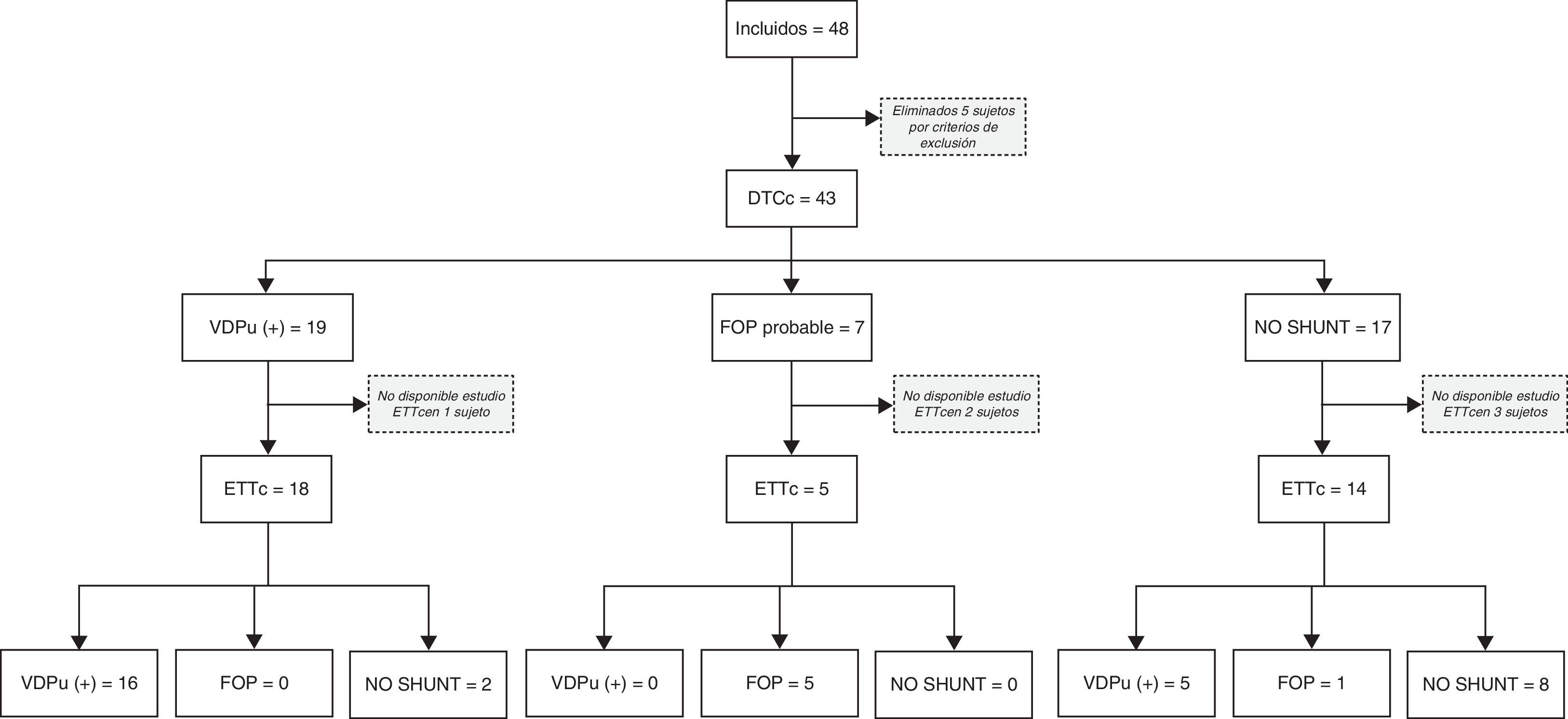
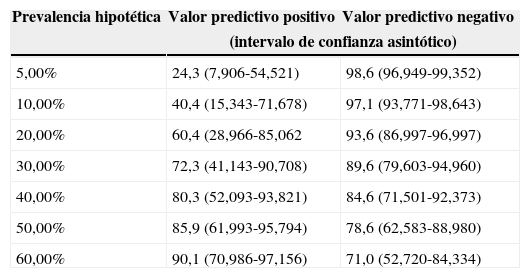
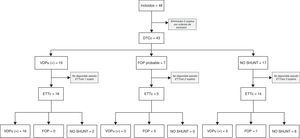
Para el estudio de validez diagnóstica del DTC frente a la ETT se han seguido las directrices para los Estudios de Precisión Diagnóstica (STARD, Standards for Reporting of Diagnostic Accuracy). En la figura 1 se ofrece un diagrama de flujo del estudio. La principal medida de rendimiento diagnóstico en el análisis fue el área bajo la curva ROC (ABC). Para ello usamos un modelo binormal, obteniendo estimaciones de los parámetros que definen la curva ROC, estimaciones del ABC y de su error estándar, que empleamos para construir los intervalos de confianza y efectuar contrastes de significación. Para fines expositivos, analizamos la exactitud de la prueba diagnóstica mediante los valores de sensibilidad (Se), especificidad (Sp), valores predictivos positivo (VPP) y negativo (VPN) y razón de verosimilitud (RV). Se ofrece la estimación de VPP según hipotéticas prevalencias de DVIPu. Para estos análisis, la ETTc y el DTCc fueron clasificados como resultado negativo o positivo para DVIPu.
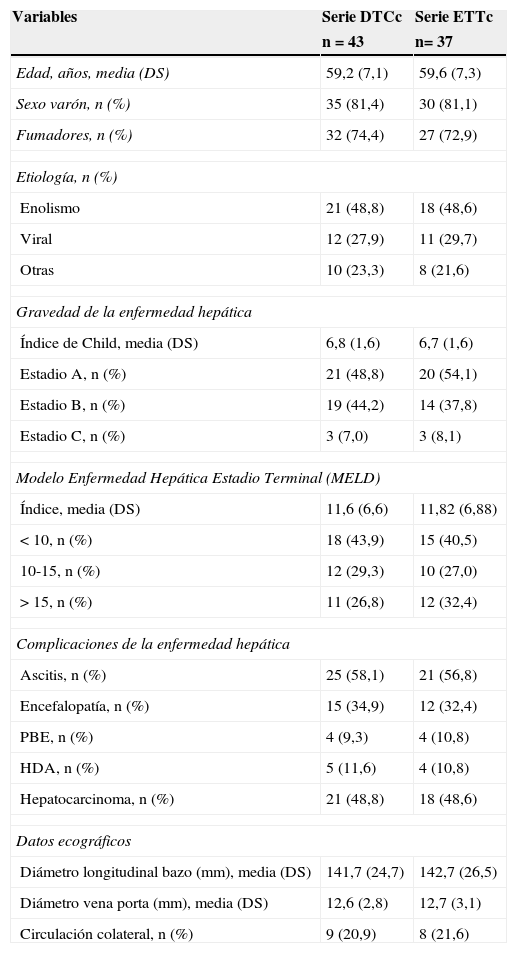
ResultadosCaracterísticas de los pacientesHubo 48 pacientes con cirrosis que fueron ingresados consecutivamente durante el período de estudio, 5 sujetos fueron eliminados por criterios de exclusión y en 6 no se dispuso de estudio ecocardiográfico con contraste. Todos los pacientes habían sido incluidos en lista de espera de trasplante hepático. Las características de los pacientes se muestran en la tabla 1.
Descripción de la cohorte de estudio
| Variables | Serie DTCc | Serie ETTc |
|---|---|---|
| n=43 | n= 37 | |
| Edad, años, media (DS) | 59,2 (7,1) | 59,6 (7,3) |
| Sexo varón, n (%) | 35 (81,4) | 30 (81,1) |
| Fumadores, n (%) | 32 (74,4) | 27 (72,9) |
| Etiología, n (%) | ||
| Enolismo | 21 (48,8) | 18 (48,6) |
| Viral | 12 (27,9) | 11 (29,7) |
| Otras | 10 (23,3) | 8 (21,6) |
| Gravedad de la enfermedad hepática | ||
| Índice de Child, media (DS) | 6,8 (1,6) | 6,7 (1,6) |
| Estadio A, n (%) | 21 (48,8) | 20 (54,1) |
| Estadio B, n (%) | 19 (44,2) | 14 (37,8) |
| Estadio C, n (%) | 3 (7,0) | 3 (8,1) |
| Modelo Enfermedad Hepática Estadio Terminal (MELD) | ||
| Índice, media (DS) | 11,6 (6,6) | 11,82 (6,88) |
| < 10, n (%) | 18 (43,9) | 15 (40,5) |
| 10-15, n (%) | 12 (29,3) | 10 (27,0) |
| > 15, n (%) | 11 (26,8) | 12 (32,4) |
| Complicaciones de la enfermedad hepática | ||
| Ascitis, n (%) | 25 (58,1) | 21 (56,8) |
| Encefalopatía, n (%) | 15 (34,9) | 12 (32,4) |
| PBE, n (%) | 4 (9,3) | 4 (10,8) |
| HDA, n (%) | 5 (11,6) | 4 (10,8) |
| Hepatocarcinoma, n (%) | 21 (48,8) | 18 (48,6) |
| Datos ecográficos | ||
| Diámetro longitudinal bazo (mm), media (DS) | 141,7 (24,7) | 142,7 (26,5) |
| Diámetro vena porta (mm), media (DS) | 12,6 (2,8) | 12,7 (3,1) |
| Circulación colateral, n (%) | 9 (20,9) | 8 (21,6) |
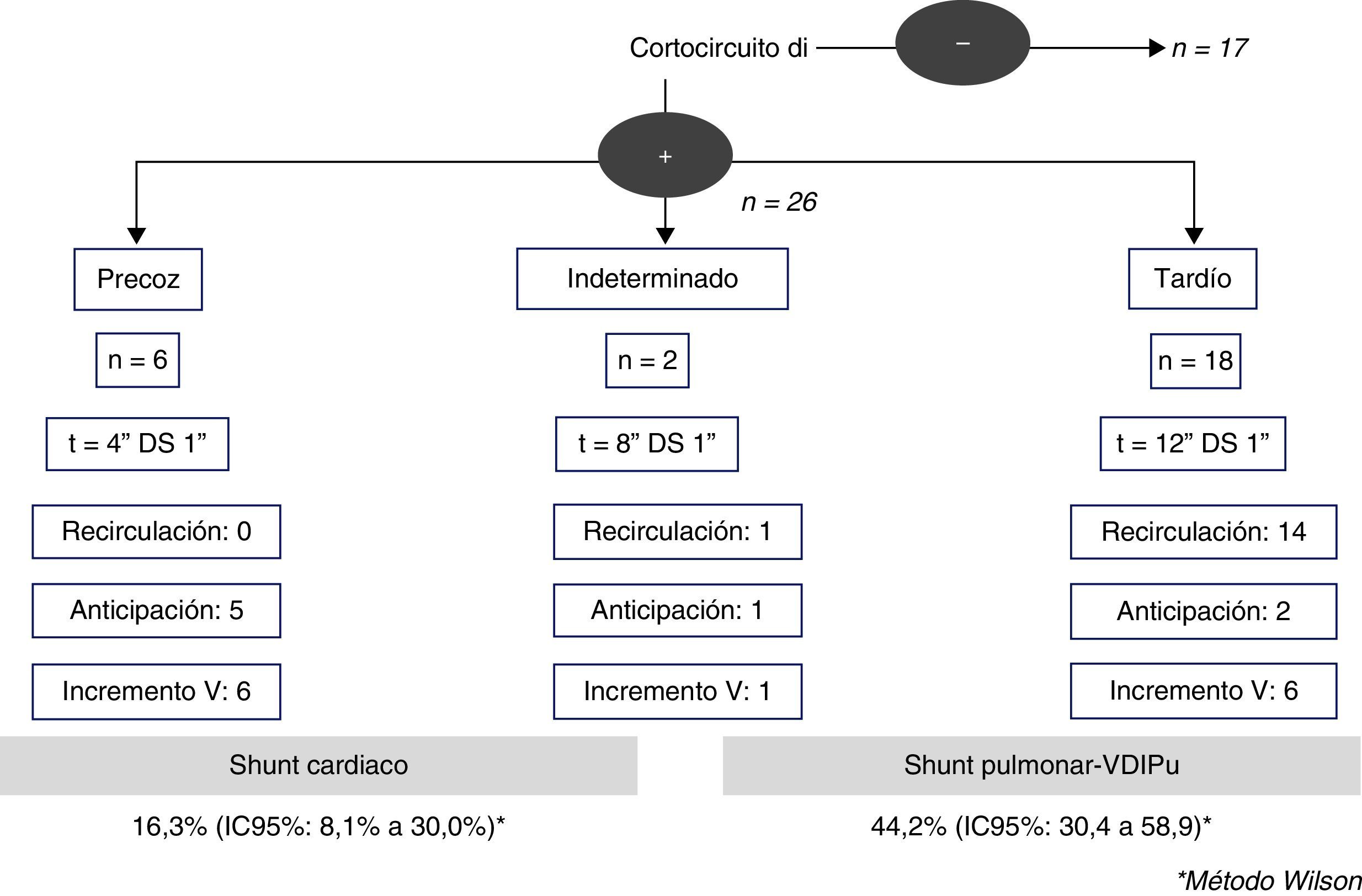
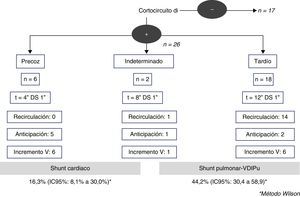
Existía shunt derecha-izquierda en 23 pacientes (62,2%): 4 de ellos eran precoces, 2 indeterminados y 17 fueron tardíos. El grado de shunt de la fase realizada en basal fue ligero en la mayoría de los casos (91,3%). Los 4 casos con shunt derecha-izquierda precoces (tiempo de aparición media 4 [±1]s) se anticipaban y aumentaban tras la maniobra de Valsalva, y en ningún caso existió recirculación de las microburbujas, y fueron catalogados como shunt de origen cardiaco. De los 17 pacientes con shunt derecha-izquierda que se mostraron tardíos (tiempo de aparición media 12 [±1]s), solo 4 aumentaban tras el Valsalva, pero sin anticipación, y existió recirculación en la mayoría de ellos 13 (76,5%). Los 2 casos con shunt derecha-izquierda temporalmente indeterminados (tiempo de aparición media 8 [±1]s) presentaban recirculación en el estudio basal. Un total de 19 (44,2%) casos fueron clasificados finalmente compatibles con la presencia de DVIPu. La prevalencia de las DVIPu por DTCc fue del 44,2% (IC95%: 30,4-58,9), mientras que la prevalencia del shunt de origen cardiaco fue del 16,3% (IC95%: 8,1-30,0) (fig. 2).
Patrones del estudio ecocardiográfico en las DVIPuDiez (27%) estudios fueron negativos para shunt y 27 (73%) resultaron positivos. De estos, 6 (16,2%) fueron compatibles con la presencia de un shunt cardiaco por foramen oval permeable; en todos ellos el shunt aumentaba y se anticipaba con la maniobra de Valsalva. Y en 4 de estos pacientes existía además un aneurisma del septo interauricular. De los 21 (56,8%) casos compatibles con la presencia de DVIPu, 16 casos eran leves (nivel 3) y 5 casos eran de nivel 4-6 (vasodilataciones pulmonares importantes). La prevalencia de DVIPu por ETTc fue del 56,7% (IC95%: 40,9-71,3), siendo la prevalencia del shunt de origen cardiaco del 16,2% (IC95%: 7,6-31,1).
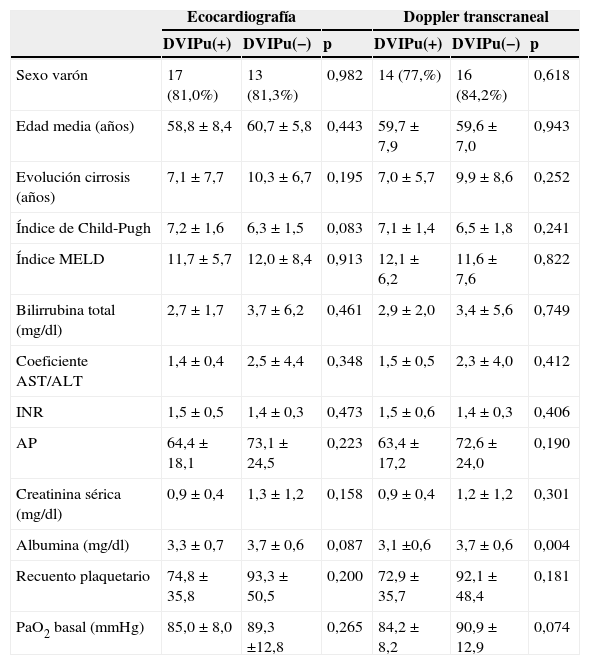
Factores asociados con la presencia de DVIPuLos pacientes con y sin DVIPu no difieren en edad, sexo, etiología de la enfermedad hepática, gravedad de la enfermedad hepática o índice de MELD, independientemente del método de diagnóstico en el análisis univariante (tabla 2). Tampoco hay diferencias significativas con respecto a las variables del estudio ecográfico hepático y doppler esplenoportal. Tan solo los niveles de albúmina son significativamente más bajos en los pacientes con DVIPu. La presión parcial de oxígeno es más baja en los pacientes con DVIPu, pero sin llegar a ser significativo. En el análisis de regresión logística ajustado por tiempo de evolución de la cirrosis e índice de Child no logramos identificar factores independientes asociados con las DVIPu ni por ETTc ni por DTCc, salvo los niveles séricos de albúmina; OR: 3,0 (IC95%: 1,0-9,1), p=0,039, y OR: 6,9 (IC95%: 1,7-27,9), p=0,001, respectivamente.
Características basales de los pacientes según la presencia de dilataciones vasculares intrapulmonares
| Ecocardiografía | Doppler transcraneal | |||||
|---|---|---|---|---|---|---|
| DVIPu(+) | DVIPu(−) | p | DVIPu(+) | DVIPu(−) | p | |
| Sexo varón | 17 (81,0%) | 13 (81,3%) | 0,982 | 14 (77,%) | 16 (84,2%) | 0,618 |
| Edad media (años) | 58,8±8,4 | 60,7±5,8 | 0,443 | 59,7±7,9 | 59,6±7,0 | 0,943 |
| Evolución cirrosis (años) | 7,1±7,7 | 10,3±6,7 | 0,195 | 7,0±5,7 | 9,9±8,6 | 0,252 |
| Índice de Child-Pugh | 7,2±1,6 | 6,3±1,5 | 0,083 | 7,1±1,4 | 6,5±1,8 | 0,241 |
| Índice MELD | 11,7±5,7 | 12,0±8,4 | 0,913 | 12,1±6,2 | 11,6±7,6 | 0,822 |
| Bilirrubina total (mg/dl) | 2,7±1,7 | 3,7±6,2 | 0,461 | 2,9±2,0 | 3,4±5,6 | 0,749 |
| Coeficiente AST/ALT | 1,4±0,4 | 2,5±4,4 | 0,348 | 1,5±0,5 | 2,3±4,0 | 0,412 |
| INR | 1,5±0,5 | 1,4±0,3 | 0,473 | 1,5±0,6 | 1,4±0,3 | 0,406 |
| AP | 64,4±18,1 | 73,1±24,5 | 0,223 | 63,4±17,2 | 72,6±24,0 | 0,190 |
| Creatinina sérica (mg/dl) | 0,9±0,4 | 1,3±1,2 | 0,158 | 0,9±0,4 | 1,2±1,2 | 0,301 |
| Albumina (mg/dl) | 3,3±0,7 | 3,7±0,6 | 0,087 | 3,1 ±0,6 | 3,7±0,6 | 0,004 |
| Recuento plaquetario | 74,8±35,8 | 93,3±50,5 | 0,200 | 72,9±35,7 | 92,1±48,4 | 0,181 |
| PaO2 basal (mmHg) | 85,0±8,0 | 89,3 ±12,8 | 0,265 | 84,2±8,2 | 90,9±12,9 | 0,074 |
El rendimiento diagnóstico de la prueba fue AUC=0,813% (IC95%: 0,666 a 0,959), estadísticamente significativa (p=0,001). El DTCc tiene una sensibilidad del 76,2% (IC95%: 54,9 a 89,4) y una especificidad cercana al 90% (IC95%: 63,9 a 96,5). La probabilidad de acertar cuando el DTCc da un resultado compatible con DVIPu es del 88,9% (IC95%: 67,2 a 96,9) y su valor predictivo negativo es del 73,7% (IC95%: 51,2 a 88,2). En la estimación de estos valores no solo influyen la sensibilidad y la especificidad, sino también la frecuencia de la condición de estudio; así se ofrece en la tabla 3 un listado de los valores predictivos positivos y negativos según diferentes prevalencias hipotéticas. Los resultados indican que manteniendo la sensibilidad y la especificidad constantes el valor predictivo positivo del DTCc mejora cuando la prevalencia es más alta. Y la razón de verosimilitud positiva fue de 6,095; es decir, el resultado positivo es proporcionalmente 6 veces más frecuente en los sujetos con DVIPu. La razón de verosimilitud negativa fue del 0,271.
Valores predictivos positivos y negativos del doppler transcraneal con contraste para detectar dilataciones vasculares intrapulmonares en sujetos cirróticos aplicada en diferentes contextos
| Prevalencia hipotética | Valor predictivo positivo | Valor predictivo negativo |
|---|---|---|
| (intervalo de confianza asintótico) | ||
| 5,00% | 24,3 (7,906-54,521) | 98,6 (96,949-99,352) |
| 10,00% | 40,4 (15,343-71,678) | 97,1 (93,771-98,643) |
| 20,00% | 60,4 (28,966-85,062 | 93,6 (86,997-96,997) |
| 30,00% | 72,3 (41,143-90,708) | 89,6 (79,603-94,960) |
| 40,00% | 80,3 (52,093-93,821) | 84,6 (71,501-92,373) |
| 50,00% | 85,9 (61,993-95,794) | 78,6 (62,583-88,980) |
| 60,00% | 90,1 (70,986-97,156) | 71,0 (52,720-84,334) |
En base a nuestro conocimiento, este es el primer estudio que evalúa el doppler transcraneal con contraste salino agitado como técnica diagnóstica válida para la demostración de las DVIPu en pacientes cirróticos.
Los cambios vasculares pulmonares encontrados en pacientes con enfermedad hepática crónica son vasodilataciones diseminadas con diámetros que van de 15 a 150μm, y que son más prominentes a nivel capilar y cerca de las zonas de intercambio gaseoso3,4. La desviación del flujo sanguíneo pulmonar a los capilares dilatados evita las unidades alveolares, lo que podría afectar a la relación de difusión-perfusión pulmonar con la consiguiente disminución en la saturación arterial de oxígeno2. Estudios con ecocardiografía de contraste en pacientes con cirrosis hepática severa han revelado la existencia de DVIPu en el 13 al 47% de los pacientes, incluso con estudios angiográficos normales11-18.
Las DVIPu son el evento clave en el desarrollo del síndrome hepatopulmonar cuando se asocia con diferencia alveoloarterial de O2 mayor de 15mmHg, y la enfermedad hepática con hipertensión portal13,14,19. La historia natural de DVIPu no ha sido suficientemente comprendida, ya que su mecanismo patogénico exacto no está claro, aunque la hipertensión portal puede ser el estímulo inicial para la vasodilatación. Se sabe que, en pacientes con síndrome hepatopulmonar, la obstrucción al flujo sanguíneo hepático causado por la fibrosis periportal conduce a un aumento de la presión en el sistema venoso portal. Los cambios causados por la hipertensión portal se encuentran entre las principales causas de morbimortalidad en pacientes con cirrosis. La formación de dilataciones vasculares pulmonares podría ser un mecanismo de defensa para evitar el aumento de la presión vascular y el flujo sanguíneo en la circulación pulmonar20,21. El interés clínico por la presencia de DVIPu en pacientes cirróticos es que es un dato de mal pronóstico cuando se asocia a síndrome hepatopulmonar5. Sin embargo, no hay muchos estudios que hayan evaluado el significado clínico y pronóstico de las DVIPu que no han desarrollado síndrome hepatopulmonar2,22,23. La presencia de síndrome hepatopulmonar es una indicación para trasplante de hígado, ya que es la única terapia disponible actualmente para los pacientes con hipoxemia significativa. Con el trasplante se consigue una resolución de las DVIPu, aumentando la supervivencia a los 5años en un 70% o más5.
Los estudios realizados por Vedrinne y Aller demostraron la superioridad de la ecocardiografía transesofágica con contraste para el diagnóstico de las DVIPu en candidatos para trasplante hepático7,24. La calidad subóptima de la imagen por ETTc se ha considerado un factor limitante25. No obstante, con la introducción de la imagen armónica ha mejorado significativamente la calidad de imagen y la detección de las microburbujas del suero agitado. Recientes estudios han señalado que la ETT con imagen armónica y la ETE tienen similar exactitud en la detección del cortocircuito auricular derecha-izquierda26-28, y se acepta que, cuando la calidad de imagen es adecuada, la ETT puede ser suficiente para la detección del cortocircuito. Actualmente el método más utilizado para diagnosticar las DVIPu es la ecocardiografía Doppler transtorácica14,19. De ahí que en nuestro estudio comparemos el DTCc frente a la ETTc, por ser esta técnica no invasiva.
Algunos estudios han sugerido que la gammagrafía con macroagregados de albúmina y tecnecio-99m (GG-Tc-MAA) es una alternativa válida, por ser sensible y específica y porque cuantifica la magnitud de las DVIPu29. Los estudios que comparan la ecocardiografía Doppler transtorácica y la GG-Tc-MAA mostraron resultados contradictorios con respecto a la sensibilidad y la especificidad, sugiriéndose una mayor sensibilidad de la GG-Tc-MAA, la cual es capaz de identificar pequeñas dilataciones en la vasculatura pulmonar incluso antes del desarrollo de hipertensión pulmonar30. Su coste, la posibilidad de efectos adversos y las interacciones por el uso de radiofármacos son limitaciones a la generalización de su uso como técnica de cribado.
Diversos estudios han valorado la utilidad del DTCc8,31,32, la ETTc33-36 y la ETE37 en el diagnóstico del shunt derecha-izquierda de origen cardiaco. Los neurólogos han utilizado el DTCc de forma generalizada para diagnosticarlo, y existe un consenso internacional para su diagnóstico10. En estudios comparativos con la ETE, la sensibilidad se ha considerado superior al 90%8,32,38. El DTCc es una técnica no invasiva que ha demostrado ser tanto o más sensible que el ecocardiograma para la demostración de una comunicación derecha-izquierda8. Obviamente, la ETT ofrece al mismo tiempo una valoración de la función cardiológica en la cirrosis (disfunción diastólica y sistólica, presión estimada de la presión en la arteria valvular, valvulopatías, etc.) que no puede ser evaluada por DTC y, por tanto, no sería sustituible en la evaluación de estos pacientes.
La experiencia diagnóstica por DTCc del shunt derecha-izquierda de origen pulmonar se circunscribe al diagnóstico de las fístulas arteriovenosas pulmonares, donde ha mostrado una evidente capacidad diagnóstica39,40. Aunque no esté claramente demostrado, se han observado algunas características diferenciales entre el shunt de origen cardíaco y el pulmonar. Algunos autores han sugerido que podría sospecharse la localización del shunt considerando que en el primer caso se requiere la maniobra de Valsalva para demostrar la magnitud real del shunt, a diferencia del segundo, en el que el shunt es máximo y espontáneo en situación basal, sin modificarse de forma significativa tras efectuar la maniobra de Valsalva41. Este hecho lo demostramos en nuestro trabajo, ya que de los 17 pacientes con shunt derecha-izquierda que se mostraron tardíos, solo 4 aumentaban tras el Valsalva, pero sin anticipación, y con recirculación en la mayoría de ellos; esta última es una característica que creemos típica en las DVIPu. Hay también quien postula que el tiempo transcurrido entre la inyección de contraste salino por una vena periférica y la aparición de señal en la arteria intracerebral monitorizada permite sospechar la localización del shunt. Así, cuando transcurren menos de 5s se consideraría claro origen cardíaco; en cambio, cuando se excede de los 10s se consideraría pulmonar, y habría un espacio temporal entre los 6-9s de indefinición. Aunque la temporalidad puede ser controvertida según la opinión de expertos10,42, al menos para el estudio de las DVIPu en pacientes cirróticos parece existir una correlación temporal bastante clara y definitoria en este sentido según nuestras observaciones, ya que el tiempo de aparición media fue de 12s. El ámbito de estudio de las DVIPu generalmente es hospitalario y en sujetos candidatos a trasplante hepático, donde la prevalencia de esta condición es más alta, y en este sentido demostramos de forma hipotética que el DTCc funciona mejor cuanto mayor es la prevalencia.
Consistente con otros estudios, no encontramos diferencias en la etiología de la enfermedad hepática, o en el índice de MELD, en los pacientes cirróticos con DVIPu comparados con los que no tienen shunt intrapulmonar. Los factores que se relacionan mejor con el grado de hipertensión portal, como el índice de Child, la presencia de ascitis o la trombocitopenia, se correlacionarían mejor con la incidencia de DVIPu, pero en nuestro estudio no logramos demostrarlo43. En la literatura se señala que el gradiente de albúmina sérica/líquido ascítico es un valor que permite sospechar que la ascitis es secundaria a hipertensión, sin existir correlación con el grado de hipertensión portal44. Esta variable no fue medida en nuestro trabajo. Este estudio tiene algunas limitaciones que es necesario comentar. Los resultados son aplicables solo al grupo poblacional seleccionado. El estudio no ha analizado la variabilidad del observador; dado que la mayor variabilidad se generaría con la administración del contraste y la efectividad de la maniobra de Valsalva, no se consideró ético repetir las pruebas según el diseño aplicado en el estudio. El número de pacientes incluidos en este estudio puede no haber sido suficiente para demostrar diferencias más significativas en marcadores indirectos de hipertensión portal, evolución clínica o parámetros analíticos entre los grupos con y sin DVIPu, aunque este no era nuestro principal objetivo. Este estudio no evalúa la presencia de síndrome hepatopulmonar, lo cual podría tener un mayor interés clínico, pero decidimos centrarlo en el estudio de validez diagnóstica de la presencia de las DVIPu como criterio obligado para el desarrollo del síndrome. En conclusión, nuestro estudio demuestra una alta prevalencia de DVIPu en candidatos a trasplante hepático. La probabilidad que tiene el DTCc en detectar DVIPu en pacientes cirróticos cuando se observa shunt derecha-izquierda tardío con recirculación es muy elevado, y con pocos falsos positivos. El DTCc es una técnica válida, rápida, segura, no invasiva, fiable y de bajo costo para el estudio de esta condición. Al ser una técnica previamente no descrita para el estudio del shunt derecha-izquierda en la cirrosis, deben llevarse a cabo estudios similares en otras regiones y centros con fines de comparación. Adicionalmente, se necesitarían más estudios para determinar la importancia clínica del diagnóstico precoz y la evolución natural de DVIPu en esta población.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.