La mejora de las técnicas de imagen y el uso sistemático de la ecografía Doppler color (DUS) en el seguimiento de los pacientes con cirrosis hepática ha aumentado la tasa diagnóstica de trombosis portal (TP) en estos pacientes. La extensión de la TP debe ser evaluada con una angiografía por resonancia magnética (angio-RM) y la angiografía por tomografía computarizada (angio-TC). La historia natural de la TP en la cirrosis y su impacto sobre la enfermedad hepática es desconocida, pero sí que parece claro que la TP podría aumentar la morbimortalidad asociada al trasplante hepático y puede llegar incluso a contraindicarlo cuando el trombo se extiende a la vena mesentérica superior. La anticoagulación es un tratamiento relativamente seguro y eficaz en lograr la recanalización del eje esplenoportal o en prevenir su progresión y por ello es frecuentemente utilizada. El shunt portosistémico intrahepático transyugular (TIPS) se reserva para fracasos de la anticoagulación o si el paciente presenta complicaciones graves de la hipertensión portal.
Improved imaging techniques and the routine use of color Doppler ultrasound in the follow-up of patients with liver cirrhosis has increased diagnosis of portal vein thrombosis (PVT) in these patients. The extension of PVT should be evaluated with computed tomography angiography or magnetic resonance angiography. The natural history of PVT in cirrhosis and its impact on liver disease is unknown but it seems clear that PVT could increase the morbidity and mortality associated with liver transplantation and can even be a contraindication to this procedure when the thrombus extends to the superior mesenteric vein. Anticoagulation is a relatively safe and effective treatment in achieving recanalization of the splenoportal axis or in preventing progression of thrombosis and is therefore frequently used. The use of transjugular intrahepatic portosystemic shunts (TIPS) is reserved for patients unresponsive to anticoagulation or in those with severe complications of portal hypertension.
La cirrosis ha sido considerada durante mucho tiempo como un estado hipocoagulante en función del hallazgo de un déficit de síntesis hepática de factores procoagulantes, que da como resultado una alteración de las pruebas convencionales de la coagulación (INR y tiempo de protrombina), y en la presencia de trombocitopenia. Sin embargo, en la cirrosis existe también un déficit en la síntesis de factores anticoagulantes, como la proteína C, proteína S y antitrombina y un aumento de factores procoagulantes como el factor VIII o el factor von Willebrand1. La reducción de factores procoagulantes y factores anticoagulantes daría lugar a un nuevo estado de equilibrio2,3. Este equilibrio se volvería precario en determinadas situaciones y condicionaría que existiera una tendencia procoagulante2. Ello explica que diferentes estudios epidemiológicos hayan demostrado un aumento en la incidencia de fenómenos trombóticos en los pacientes con enfermedades hepáticas crónicas, en especial con la cirrosis hepática4.
La trombosis portal (TP) es un evento frecuente en la cirrosis con una prevalencia que oscila entre el 0,6 y el 44%5,6, dependiendo de la técnica de imagen empleada para el diagnóstico y las características clínicas de los pacientes evaluados. La prevalencia es de entre el 10 y el 25% cuando se excluyen los pacientes con hepatocarcinoma y la ecografía (US) es la técnica de imagen empleada para el diagnóstico5,7–9. La prevalencia aumenta a medida que aumenta la gravedad de la enfermedad (1% en pacientes compensados9 vs 8-25% en candidatos a trasplante hepático (TH)7. Estudios recientes han mostrado una incidencia anual para el desarrollo de trombosis portal en pacientes con cirrosis que oscila entre el 7,4 y el 19%7,10–13.
A pesar de que la presencia de TP se asocia generalmente a un mayor deterioro de la función hepática y agravamiento de la hipertensión portal7,9,12,14–16, debido a la ausencia de estudios prospectivos, no es posible saber si la TP es un marcador de un estadio avanzado de la enfermedad o la verdadera causa del empeoramiento de la función hepática y del desarrollo de dichas complicaciones9. Los datos son más claros en el impacto que tiene la TP en el TH. Así, la presencia de TP se ha asociado a un aumento de la morbimortalidad post-TH7,17,18 y a un mayor riesgo de desarrollo de TP en el post-TH precoz19,20. Además la TP puede incluso contraindicar el TH, especialmente si el trombo se extiende a la vena mesentérica superior6,17.
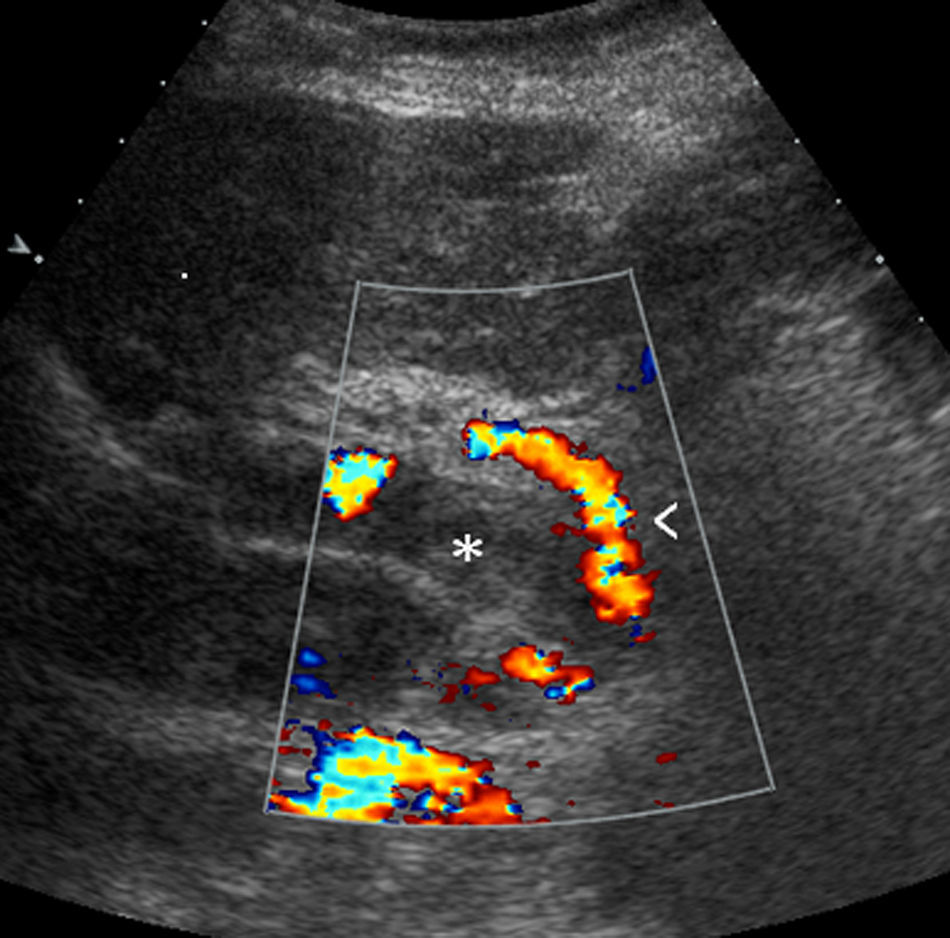
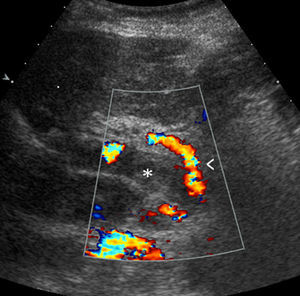
DiagnósticoLa US es la técnica de imagen inicial para evaluar la permeabilidad de la vena porta21,22 (fig. 1). El uso de la DUS mejora la precisión de la US y es imprescindible para explorar la permeabilidad de la vena porta23. La DUS en una serie de 75 pacientes presentaba una sensibilidad global del 89%, especificidad del 92% y una tasa de falsos negativos del 11% en comparación con los hallazgos de la angiografía o la cirugía24. Por lo tanto, la DUS es la técnica de elección inicial en el diagnóstico de la TP. Es importante destacar que los resultados de la DUS están influenciados por la experiencia del operador25 y que en algunos casos, por motivos anatómicos, no se logra la correcta la visualización del sistema venoso portal26 o es difícil distinguir entre TP de origen benigno o maligno, aunque la presencia de señales Doppler de características arteriales en el interior del trombo sugieren malignidad27. Por lo tanto, pueden ser necesarias técnicas de imagen adicionales para confirmar el diagnóstico.
La US con contraste aumenta la tasa de detección de la trombosis en comparación con la DUS y permite diagnosticar origen tumoral cuando se identifica captación de contraste en el trombo28–30. De la misma forma, la captación de contraste por parte del trombo en la angiografía por resonancia magnética (angio-RM) y la angiografía por tomografía computarizada (angio-TC) junto con su aspecto expansivo, permite también establecer el origen tumoral28.
Cuando se realiza el diagnóstico de la TP es importante intentar cuantificar la extensión y el porcentaje de luz que ocupa, en especial para detectar una posible progresión o evaluación de la respuesta a un eventual tratamiento. Debido a su mayor cobertura anatómica, la angio-RM y la angio-TC se han convertido en las técnicas esenciales para evaluar la extensión de la TP. Un estudio prospectivo reciente demostró una gran especificidad y valor predictivo negativo para la DUS y la angio-TC en la evaluación del TP en los pacientes en lista de espera de TH31. La RM ha demostrado tener una precisión diagnóstica similar a la angiografía32,33. Además, la angio-RM y angio-TC son superiores a la DUS en la identificación de colaterales portosistémicas34.
No existe una forma consensuada de gradación de la TP pero en nuestra experiencia consideramos útil señalizar los territorios del eje esplenoportal afectados y el porcentaje de luz de los mismos que están ocupados.
En el momento del diagnóstico es importante también diferenciar entre trombosis aguda y crónica (disminución calibre del vaso, calcificaciones parietales, etc.), aunque esto no siempre es posible.
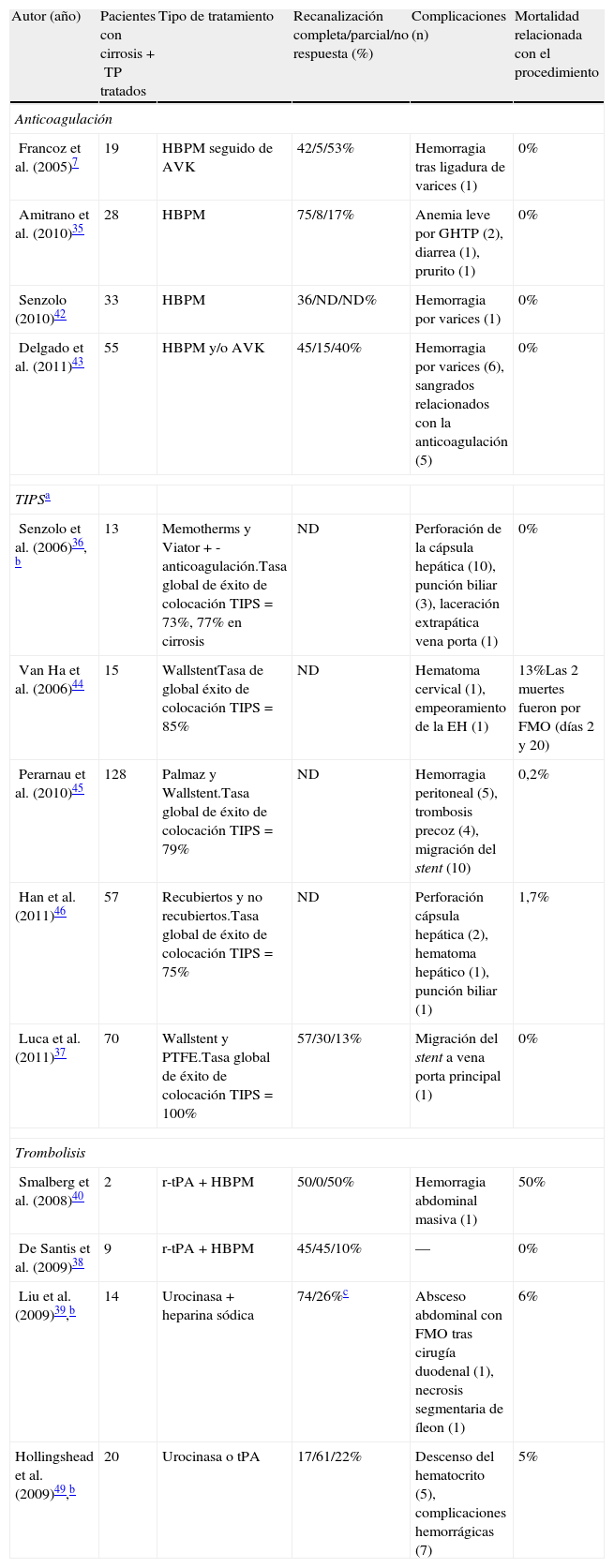
Tratamiento de la trombosis portal en la cirrosisEn la actualidad no existen guías clinicas sobre el manejo de la TP en la cirrosis y como consecuencia de ello se han empleado diferentes tratamientos como la anticoagulación7,35, la derivación portosistémica intrahepática transyugular (TIPS)36,37 o la trombolisis38–40, en diferentes series de casos (tabla 1).
Resumen de los estudios de diferentes tratamientos de la trombosis portal en pacientes con cirrosis
| Autor (año) | Pacientes con cirrosis+TP tratados | Tipo de tratamiento | Recanalización completa/parcial/no respuesta (%) | Complicaciones (n) | Mortalidad relacionada con el procedimiento |
| Anticoagulación | |||||
| Francoz et al. (2005)7 | 19 | HBPM seguido de AVK | 42/5/53% | Hemorragia tras ligadura de varices (1) | 0% |
| Amitrano et al. (2010)35 | 28 | HBPM | 75/8/17% | Anemia leve por GHTP (2), diarrea (1), prurito (1) | 0% |
| Senzolo (2010)42 | 33 | HBPM | 36/ND/ND% | Hemorragia por varices (1) | 0% |
| Delgado et al. (2011)43 | 55 | HBPM y/o AVK | 45/15/40% | Hemorragia por varices (6), sangrados relacionados con la anticoagulación (5) | 0% |
| TIPSa | |||||
| Senzolo et al. (2006)36, b | 13 | Memotherms y Viator+- anticoagulación.Tasa global de éxito de colocación TIPS=73%, 77% en cirrosis | ND | Perforación de la cápsula hepática (10), punción biliar (3), laceración extrapática vena porta (1) | 0% |
| Van Ha et al. (2006)44 | 15 | WallstentTasa de global éxito de colocación TIPS=85% | ND | Hematoma cervical (1), empeoramiento de la EH (1) | 13%Las 2 muertes fueron por FMO (días 2 y 20) |
| Perarnau et al. (2010)45 | 128 | Palmaz y Wallstent.Tasa global de éxito de colocación TIPS=79% | ND | Hemorragia peritoneal (5), trombosis precoz (4), migración del stent (10) | 0,2% |
| Han et al. (2011)46 | 57 | Recubiertos y no recubiertos.Tasa global de éxito de colocación TIPS=75% | ND | Perforación cápsula hepática (2), hematoma hepático (1), punción biliar (1) | 1,7% |
| Luca et al. (2011)37 | 70 | Wallstent y PTFE.Tasa global de éxito de colocación TIPS=100% | 57/30/13% | Migración del stent a vena porta principal (1) | 0% |
| Trombolisis | |||||
| Smalberg et al. (2008)40 | 2 | r-tPA+HBPM | 50/0/50% | Hemorragia abdominal masiva (1) | 50% |
| De Santis et al. (2009)38 | 9 | r-tPA+HBPM | 45/45/10% | — | 0% |
| Liu et al. (2009)39,b | 14 | Urocinasa + heparina sódica | 74/26%c | Absceso abdominal con FMO tras cirugía duodenal (1), necrosis segmentaria de íleon (1) | 6% |
| Hollingshead et al. (2009)49,b | 20 | Urocinasa o tPA | 17/61/22% | Descenso del hematocrito (5), complicaciones hemorrágicas (7) | 5% |
AVK: antagonistas de la vitamina K; EH: encefalopatía hepática; FMO: fallo multiorgánico; GHTP: gastropatía de la hipertensión portal; HBPM: heparinas de bajo peso molecular; ND: no descrito; TP: trombosis portal; VP: vena porta.
El tratamiento de la TP fue la indicación del TIPS en 6 pacientes (4 en el estudio de Luca et al. y 2 en el de Senzolo et al.). Doce pacientes fueron anticoagulados tras el TIPS (10 en el estudio de Senzolo et al. y 2 en el de Van Ha et al.), ninguno de los pacientes de la serie de Luca et al. recibieron anticoagulación tras el TIPS.
Existen 3 grandes cuestiones que surgen ante un paciente con cirrosis y TP: a qué paciente debemos tratar, cuándo debemos tratarle y cuál es el mejor tratamiento. La respuesta a estas preguntas viene dificultada por el hecho de que la historia natural de la TP en la cirrosis no es bien conocida. Así, algunos autores indican que en algunos casos la TP, especialmente si es parcial y afecta a un pequeño segmento del árbol portal, puede resolverse de forma espontánea y por ello no requerir tratamiento9,41. Otros argumentos que apoyan esta actitud son el hecho de no tener una clara demostración de que el desarrollo de TP asintomática tenga un impacto negativo en la enfermedad11,41. Sin embargo, el hecho reconocido de que la cirrosis es per se un estado protrombótico, la asociación de la TP con una peor función hepática y las descompensaciones de la hipertensión portal9 y, en especial, su asociación a una mayor morbimortalidad en el post-TH7,17,19,20 apoyarían el tratamiento de la TP, en especial el uso de la anticoagulación, que además presenta una aceptable tasa de recanalización y una baja tasa de complicaciones en los estudios publicados.
AnticoagulaciónEl objetivo del tratamiento de la TP con anticoagulación es conseguir la recanalización o evitar la progresión de la trombosis, por lo que la detección precoz de la misma es fundamental. El esquema actual de realizar una ecografía semestral para el cribado de hepatocarcinoma en pacientes cirróticos ha facilitado el diagnóstico precoz de la TP. Esta detección precoz es aún más importante en aquellos pacientes candidatos a TH, en los que es imprescindible evitar la extensión al confluente esplenoportomesentérico, lo que podría impedir el TH18. Hasta la fecha tan solo 4 estudios han evaluado en un pequeño número de pacientes el uso de anticoagulación en el tratamiento de la TP en la cirrosis (tabla 1). La tasa de recanalización completa oscila entre el 36 y el 75%7,35,42,43. Estas diferencias pueden ser debidas a que no todos los estudios describen el tipo de trombosis tratada (trombosis aguda o progresión) y el tiempo en el que se ha evaluado la respuesta es diferente. En el estudio de Amitrano et al.35 en los pacientes con recanalización parcial a los 6 meses de tratamiento la anticoagulación se mantuvo hasta los 12 meses, incrementando la tasa global de recanalización completa hasta un 75%35. En dos de los estudios publicados el inicio precoz de la anticoagulación se ha asociado con una mayor probabilidad de recanalización42,43. Dos estudios evaluaron el riesgo de retrombosis tras la suspensión de la anticoagulación mostrando un riesgo elevado de 27 y 38,5%35,43 lo que indicaría que la anticoagulación debería mantenerse indefinidamente o hasta el TH si queremos evitar la retrombosis. De forma interesante, un estudio reciente ha mostrado que los pacientes que lograron la recanalización completa desarrollaron durante el seguimiento menos complicaciones de la hipertensión portal (hemorragia digestiva, ascitis, encefalopatía hepática) que los pacientes que no la lograron, aunque esta diferencia no alcanzó significancia estadística. Si estos datos se confirman pondrían claramente de manifiesto el impacto negativo que ejerce la TP en los pacientes con cirrosis. No se detectaron complicaciones hemorrágicas graves ni mortalidad relacionada con la anticoagulación en ninguno de estos estudios7,35.
Derivación portosistémica intrahepática transyugularLa tasa descrita de eficacia de colocación del TIPS en pacientes con cirrosis y TP es entre el 75 y el 100%36,37,44–46. La ausencia de una rama intrahepática portal visible36 o la presencia de transformación cavernomatosa de la vena porta disminuyen de forma marcada o impiden la realización de un TIPS44,45.
El estudio de Luca et al. mostraba una tasa de recanalización, completa y parcial de la vena porta inmediatamente tras la colocación del TIPS, en el 57 y 30% de los casos, respectivamente. Tras colocar el TIPS, el consiguiente aumento de flujo portal logra mejoras adicionales en las tasas de recanalización aun sin necesidad de utilizar anticoagulación37. Los factores predictores de recanalización completa fueron la presencia de una trombosis menos extensa, una trombosis reciente y la ausencia de varices gastroesofágicas37. Dado el origen retrospectivo de todos estos estudios se desconoce el número de pacientes en los que el TIPS no fue ni tan siquiera considerado dada la presencia de TP por lo que hace difícil estimar la aplicabilidad del TIPS en el manejo de la TP en la cirrosis. Además, debemos tener en cuenta que en la mayoría de pacientes de estos estudios la indicación de TIPS fue el tratamiento de las complicaciones de la hipertensión portal y no la TP en sí misma. El TIPS puede ser una buena alternativa a la anticoagulación en estos pacientes y presenta la ventaja de tratar las complicaciones relacionadas con la hipertensión portal pero son necesarios estudios prospectivos específicamente diseñados antes de realizar ninguna recomendación al respecto.
TrombolisisSe han utilizado la administración del activador del plasminógeno tisular recombinante (r-tPA), estreptocinasa o urocinasa por vía sistémica o local (a través de un catéter en la vena porta, ya sea por vía percutánea o mediante acceso transyugular)38–40. Los estudios publicados hasta la fecha, aunque sugieren que la terapia trombolítica puede ser útil en algunos pacientes, solo incluyen pocos pacientes. Además, se han descrito algunas complicaciones graves. Recientemente, un estudio piloto realizado en 9 pacientes con cirrosis y TP señala que la trombolisis sistémica con dosis bajas de r-tPA podría ser eficaz en la recanalización (45% parcial y 45% completa), sin efectos secundarios graves38. Así, la experiencia de la trombolisis en pacientes con cirrosis y TP es limitada y las complicaciones pueden ser graves. Ello, junto con la anteriormente mencionada eficacia de la anticoagulación y del TIPS hace no recomendar esta alternativa terapéutica en la actualidad.
Trasplante hepáticoActualmente la TP no se considera una contraindicación absoluta para el trasplante de hígado, gracias a los avances técnicos del TH y la mejora en el manejo perioperatorio47. Sin embargo, el impacto de la TP en el TH, en el desarrollo de complicaciones post-TH y en la supervivencia, no ha sido claramente definido.
Estudios retrospectivos han mostrado que la supervivencia global de los pacientes con TP en el momento del TH es inferior en comparación con aquellos sin TP7,17,18. Sin embargo, los pacientes con trombosis parcial tienen una supervivencia al año, a los 2 años y a los 5 años similar a los pacientes sin TP7,17,18. Algunos de estos estudios han mostrado además que la presencia de TP en TH se asocia con complicaciones post-operatorias como insuficiencia renal, disfunción primaria del injerto, mayor mortalidad intrahospitalaria y retrombosis de la vena porta17,19,20. La retrombosis estaba directamente relacionada con la gravedad de la enfermedad hepática pre-TH y con múltiples transfusiones durante la cirugía19. Además, el TP se ha descrito como un predictor independiente de mortalidad en pacientes con cirrosis en el momento de la evaluación TH y en el momento de la inclusión de TH48.
Sin embargo, otros estudios, también retrospectivos, no lograron detectar estas diferencias en la supervivencia17,19,20. Asimismo, un estudio reciente, publicado todavía en forma de resumen, no muestra diferencias en la mortalidad a los 2 y 6 meses post-TH41. Sin embargo, estos estudios no evaluaron por separado si la TP era parcial o completa. Estos mismos autotes no detectaron un incremento en el sangrado gastrointestinal, la peritonitis bacteriana espontánea o la mortalidad en pacientes con o sin TP en lista de espera11. Por ello, lo autores no recomiendan el uso de la anticoagulación en los pacientes con TP en lista de espera de TH11. Tampoco en este estudio se evaluó por separado si la TP era parcial o completa.
Es importante destacar que todos los estudios no han descrito el número de pacientes que no fueron evaluados o no se incluyeron en la lista de espera debido a una trombosis venosa esplácnica extensa. Además, los datos respecto a la mortalidad son contradictorios. Esto podría estar relacionado con el hecho de que la mayoría de los estudios son retrospectivos y no todos ellos evalúan por separado los pacientes con TP completa y parcial.
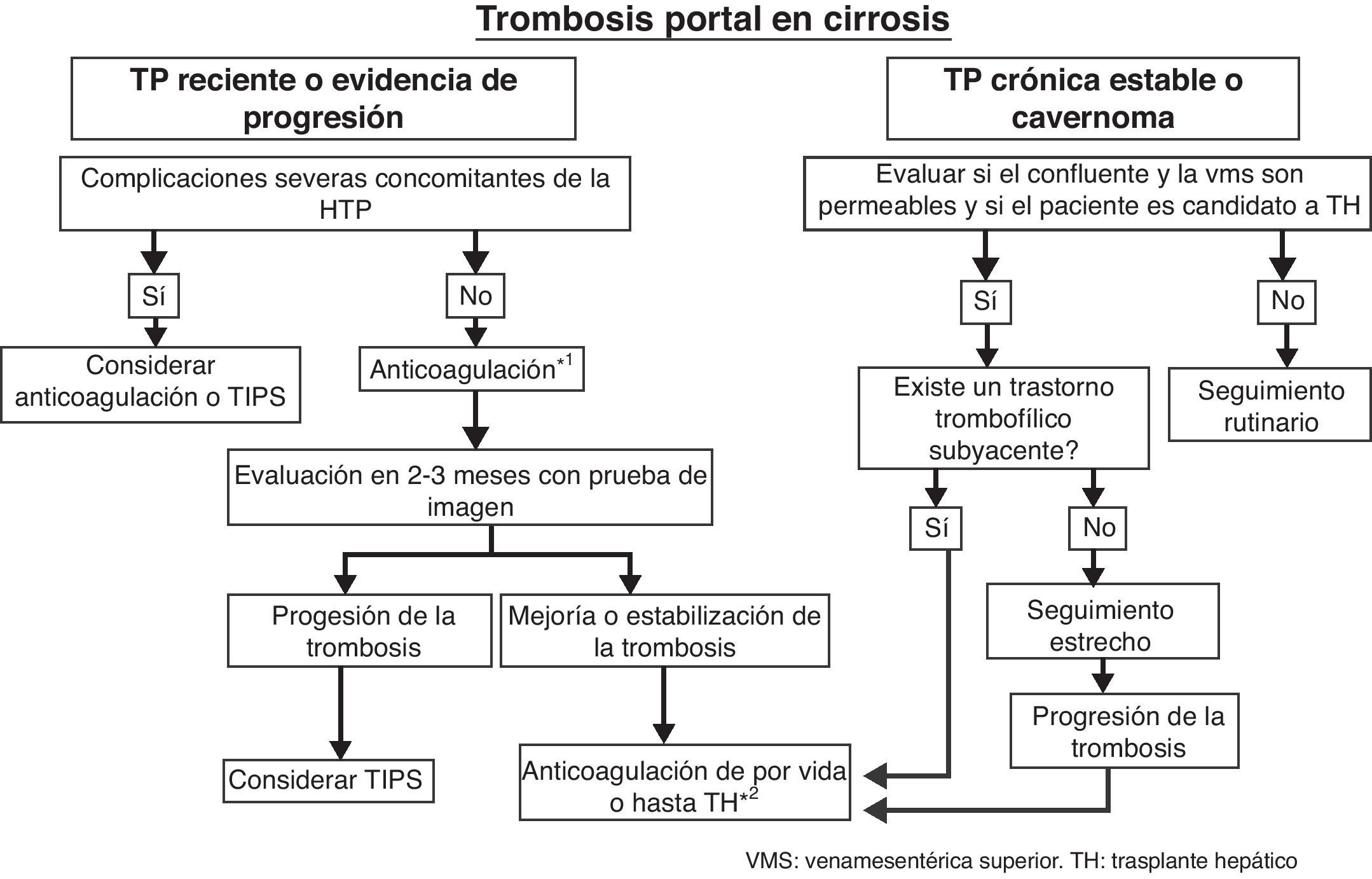
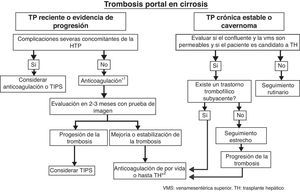
ConclusiónEl uso sistemático de las técnicas de imagen en el seguimiento de los pacientes con cirrosis hepática ha aumentado la tasa diagnóstica de TP. La DUS es la técnica de imagen inicial para el diagnóstico aunque es necesario el uso de técnicas complementarias (angio-TC o angio-RM) para valorar la extensión, obtener un mapa de colaterales portosistémicas y descartar el origen tumoral de la TP. En la actualidad no existen guías clínicas del tratamiento de la TP en la cirrosis ni estudios comparativos entre la anticoagulación y el TIPS. En casos de trombosis reciente, la anticoagulación debe ser considerada en todos los pacientes con el objetivo de conseguir la repermeabilización. La decisión final de iniciar o no el tratamiento se basa en la extensión de la trombosis, el hallarse el paciente en lista de espera de TH o ser potencial candidato al mismo o la evidencia de progresión de la trombosis (fig. 2). Si el trombo se diagnostica en una fase crónica o cuando el cavernoma ya está presente recomendamos la anticoagulación solo en aquellos pacientes con un estado protrombótico subyacente o cuando exista evidencia de extensión de la misma a otros segmentos del eje esplenoportomesentérico, en especial en aquellos pacientes potencialmente candidatos al TH. En todos los casos, antes de comenzar la anticoagulación recomendamos iniciar tratamiento profiláctico adecuado para las varices de alto riesgo (NSBB o ligadura endoscópica de varices, en pacientes intolerantes a NSBB; en este caso consideramos necesario esperar hasta conseguir la erradicación completa de las mismas). El TIPS se reserva para fallos de la anticoagulación o para pacientes con complicaciones graves concomitantes de la hipertensión portal como la hemorragia por varices o la ascitis resistente.
Algoritmo propuesto para el manejo de la TP en pacientes con cirrosis.
*1 Deben considerarse varios factores: la extensión de la trombosis, la evidencia de progresión de la trombosis, el hallarse el paciente en lista de espera de TH o ser potencial candidato al mismo.
*2 Considerar mantener la anticoagulación tras el TH si existe un factor protrombótico de alto riesgo que no se corrige con el TH.
VMS: vena mesentérica superior; TH: trasplante hepático.
Tomada de Gastroenterol Hepatol. 2012;35 (Espec Congr 1):60-8.
Los autores declaran no tener ningún conflicto de intereses.
SS recibe una beca Río Hortega del Instituto de Salud Carlos III. El CIBERehd está financiado por el Instituto de Salud Carlos III.