Los conocimientos sobre la historia natural, manejo y tratamiento de la hepatitis crónica B están cambiando continuamente. El documento de consenso de la Asociación Española para el Estudio del Hígado (AEEH) sobre el tratamiento de las infecciones por los virus de las hepatitis B y C se elaboró en el año 2005 y se publicó en 20061. El objetivo de este documento es actualizar estas recomendaciones para la hepatitis B, debido a la relevancia de los cambios que han tenido lugar en el tratamiento de esta enfermedad. Para ello, la Junta Directiva de la AEEH ha encargado a un panel de expertos la revisión y actualización del documento previo. El nuevo documento ha sido aprobado por la Junta Directiva de la AEEH.
Las recomendaciones de este documento se han basado en lo posible en la evidencia científica existente. Sin embargo, en los casos de información insuficiente o ausente, las recomendaciones se han basado en las opiniones y experiencia personal de los propios expertos. Las recomendaciones se han clasificado de acuerdo a un sistema de evaluación de la recomendación utilizado en diferentes guías y documentos de consenso2. La calidad de la evidencia científica se ha clasificado en 3 niveles: alto (A), moderado (B) o bajo (C). El sistema proporciona 2 niveles de recomendación: sólida (1) o débil (2). Esto significa que a mayor nivel de evidencia más sólida es la recomendación y viceversa.
Epidemiología y carga de la enfermedad en la salud públicaLa Organización Mundial de la Salud estima en 2.000 millones el número de personas infectadas por el virus de la hepatitis B (VHB) en el mundo, con 350-400 millones de infectados crónicamente, lo que supone una prevalencia de algo más del 5% de la población mundial3. El espectro de la enfermedad crónica es muy variable, y abarca desde el portador inactivo a pacientes con hepatitis crónica, cirrosis y carcinoma hepatocelular (CHC).
España tradicionalmente se ha clasificado entre los países de endemicidad intermedia (prevalencia de HBsAg entre el 2 y el 7% de la población general)4. Sin embargo, desde la introducción de la vacuna en el calendario de vacunaciones del Sistema Nacional de Salud en la década de 1990, la incidencia de hepatitis B ha disminuido notablemente. Los datos de un estudio realizado en Cataluña señalan que la prevalencia de anti-HBc y de HBsAg ha descendido del 15,6 y 1,5%, respectivamente, en 1989 al 8,7 y 0,7%, en 2002, situándonos entre los países de baja endemicidad5. En los últimos 10 años el número de inmigrantes en nuestro país ha aumentado, representando en la actualidad el 12,2% de la población total española; un 25% de ellos proceden de áreas geográficas (África subsahariana, Europa del Este y Sudeste asiático) de alta endemicidad (prevalencia de HBsAg igual o superior al 8%).
Otros factores, además de la vacunación, que contribuyen a disminuir la incidencia de la infección aguda son el control sistemático de las donaciones de sangre o el cribado serológico de las gestantes en el tercer trimestre del embarazo, así como otras actividades preventivas, de efectividad variable, dirigidas a evitar o limitar los comportamientos de alto riesgo como el consumo de drogas por vía parenteral con material no desechable, las relaciones sexuales de riesgo sin preservativo, la exposición a tatuajes y piercing en condiciones no higiénicas o las actividades clínicas denominadas «procedimientos invasivos en condiciones no seguras».
No se dispone de una fuente de información fiable sobre la evolución de la prevalencia de la infección por el VHB. El sistema de Enfermedades de Declaración Obligatoria incluye la hepatitis B pero tanto la cobertura como su validez son parciales. Los datos disponibles de 2010 recogen un total de 841 casos notificados, lo que supone una incidencia acumulada de casos sospechosos del orden de 1,8 por 100.000 habitantes y año.
El impacto de la enfermedad sobre la salud, la economía y la sociedad depende de si se trata de una infección aguda o crónica. Las infecciones agudas anictéricas pueden pasar desapercibidas sin provocar consecuencias aparentes, si bien los casos sintomáticos se asocian al menos a pérdida de actividad laboral y llevan consigo un riesgo de fallo hepático agudo. La infección crónica implica, además de la persistencia del reservorio, la eventual presentación de complicaciones graves entre las que destacan la cirrosis hepática y el CHC.
RecomendaciónLa mayoría de las personas infectadas no va a presentar síntomas a lo largo de su evolución, por lo que se recomienda el cribado serológico en las poblaciones de riesgo (A1)
Historia natural de la infeccion crónica por el VHBLa hepatitis aguda B cursa con síntomas en más de la mitad de los casos y el 1% de las formas ictéricas puede evolucionar a hepatitis fulminante. En los niños y jóvenes tiende a ser asintomática. La edad de adquisición de la infección es un factor que predice la evolución a la cronicidad: 90% después de infección perinatal, 30% si se adquiere entre 1 y 5 años, e inferior a 5% en adultos inmunocompetentes.
La hepatitis crónica B es un proceso dinámico, que resulta de la interacción entre la replicación del virus y la respuesta inmunológica del huésped. En su historia natural se pueden diferenciar 5 fases, no necesariamente secuenciales (tabla 1):
- 1.
La fase de tolerancia inmune se caracteriza por HBeAg positivo, niveles muy elevados de ADN-VHB, valores normales o poco elevados de alanina aminotransferasa (ALT), necroinflamación hepática leve o hígado normal y progresión lenta o nula de la fibrosis6. En los pacientes con infección perinatal o adquirida en la infancia precoz esta fase puede durar 20 o 30 años, mientras que en los que adquieren la infección en la adolescencia o en la edad adulta es poco duradera. En esta fase la tasa de seroconversión espontánea, definida como la pérdida de HBeAg con desarrollo de anti-HBe, es muy baja. Estos pacientes son muy contagiosos por presentar niveles muy elevados de carga viral.
- 2.
La fase de actividad inmune se caracteriza por HBeAg positivo, un descenso de los niveles de ADN-VHB, unos valores de ALT elevados o fluctuantes y un aumento de la actividad histológica con progresión de la fibrosis6. Esta fase aparece más rápidamente en personas infectadas en la edad adulta y su duración varía de semanas a años. En ella se produce a menudo la seroconversión espontánea, sobre todo en pacientes de sexo femenino, con niveles bajos de ADN-VHB, valores elevados de ALT y marcada actividad inflamatoria en la biopsia hepática. Los pacientes que permanecen durante años en esta fase, sobre todo si presentan brotes repetidos de necrosis, tienen riesgo de desarrollar cirrosis y CHC.
- 3.
La fase de portador inactivo se define por HBeAg negativo y anti-HBe positivo, niveles bajos de ADN-VHB (generalmente inferiores a 2.000 U/ml) y valores de ALT persistentemente normales. Su pronóstico a largo plazo normalmente es bueno7. En ocasiones se producen reactivaciones de la infección con elevaciones de ADN-VHB y de ALT. La pérdida de HBsAg con desarrollo de anti-HBs puede ocurrir espontáneamente en el 1-3% de casos anuales, generalmente tras varios años de valores indetectables de ADN-VHB8.
- 4.
La fase de hepatitis crónica HBeAg negativo puede surgir tras la seroconversión a anti-HBe en algunos pacientes que mantienen la replicación viral y la actividad de la enfermedad en lugar de pasar a la fase de portador inactivo. Representa una fase más tardía de la enfermedad y se asocia a un predominio de cepas de VHB con mutaciones en las regiones precore o promotor del core, que reducen la expresión del HBeAg. Es la forma más frecuente de hepatitis crónica B en España y su curso clínico es muy variable. En ocasiones se observan episodios de exacerbación con aumento de los valores de ALT, precedidos por una elevación de los valores de ADN-VHB, que se siguen de periodos de remisión de duración variable. Estos episodios se asocian con progresión de la fibrosis. En los periodos de remisión los niveles de ADN-VHB pueden ser bajos (inferiores a 2.000 U/ml) y los valores de ALT normales, simulando la fase de portador inactivo. Es necesario por tanto realizar determinaciones frecuentes (cada 3 meses) de ALT y ADN-VHB durante al menos un año para catalogar bien a estos pacientes.
- 5.
La fase de remisión tras la pérdida de HBsAg se define por HBsAg negativo con o sin anti-HBs y se caracteriza por valores normales de ALT y valores indetectables de ADN-VHB en suero. Puede persistir baja replicación viral con ADN-VHB detectable en el hígado (infección oculta por el VHB)9. Esta fase se asocia con mejoría del pronóstico. La relevancia clínica de la infección oculta no está bien definida.
Clasificación de la hepatitis crónica B
| Fase evolutiva | Características analíticas | Histología hepática |
| Tolerancia inmune | HBeAg positivoADN-VHB muy elevado (106-108 U/ml o superior)ALT normal o poco elevada | Lesiones mínimasHígado normal |
| Actividad inmune | HBeAg positivoADN-VHB elevado (105-107 U/ml o superior)ALT elevada | Hepatitis crónicaCirrosis activa |
| Portador inactivo | HBeAg negativo y anti-HBe positivoADN-VHB bajo (inferior a 2×103 U/ml) o indetectableALT persistentemente normal | Hígado normalCambios mínimosFibrosis residualCirrosis inactiva |
| Hepatitis crónicaHBeAg negativo | HBeAg negativo y anti-HBe positivoADN-VHB elevado fluctuante (104-106 U/ml o superior)ALT elevada fluctuante, normal en algunos periodos | Hepatitis crónicaCirrosis activa |
| Remisión | HBsAg negativo, anti-HBc positivo con o sin anti-HBsADN-VHB indetectable en suero y detectable en hígadoALT normal | Hígado normalFibrosis residualCirrosis inactiva |
La progresión a cirrosis es más frecuente en la hepatitis crónica HBeAg negativo (tasa anual de 8-10%) que en la hepatitis crónica HBeAg positivo (tasa anual de 2-5%). La replicación viral es el principal factor predictor de progresión a cirrosis. Los pacientes con niveles de ADN-VHB inferiores a 2000 UI/mL tienen escaso riesgo de desarrollar cirrosis10. En pacientes con cirrosis compensada la supervivencia a los 5 años es 80-86% frente a 14-35% en pacientes con cirrosis descompensada11,12.
En todos los pacientes con infección crónica por el VHB existe riesgo de desarrollo de CHC, pero la existencia de cirrosis aumenta dicho riesgo con una incidencia anual de 2-5%13. Un nivel de ADN-VHB superior a 2.000 U/ml incrementa el riesgo de CHC14.
Diagnóstico y clasificación de la infección crónica por el VHBLa infección crónica por el VHB se diagnostica por la presencia en el suero de HBsAg durante un período de tiempo superior a 6 meses, asociado o no a valores elevados de transaminasas. La infección crónica por el VHB es un proceso dinámico que comporta cambios de la actividad replicativa del VHB, de la actividad bioquímica y de las lesiones hepáticas, por lo que el espectro clinicopatológico resultante es muy amplio e incluye desde pacientes con lesiones hepáticas mínimas a pacientes con cirrosis o CHC. Por ello la clasificación de la infección crónica por el VHB es compleja y exige un estudio cuidadoso que incluya los datos clínicos, bioquímicos y virales; los que proporcionan las técnicas de imagen y la evaluación no invasiva de la fibrosis hepática. En algunos casos puede ser necesaria la realización de una biopsia hepática. El objetivo de esta clasificación es identificar la fase de la historia natural en que se encuentra la enfermedad hepática y evaluar su gravedad y la capacidad potencial de progresión11,15. Estos datos son necesarios para decidir el tratamiento y para guiar cómo debe controlarse la evolución del paciente.
La clasificación de la infección crónica por el VHB exige valorar de forma global una serie de factores que incluyen:
- 1)
Datos bioquímicos. El nivel de las transaminasas proporciona información acerca de la actividad necroinflamatoria, pero los valores bajos o normales no excluyen la existencia de lesiones hepáticas avanzadas ni los valores muy elevados indican necesariamente una enfermedad grave15,16. El hemograma, la tasa de protrombina, la bilirrubina y la albúmina son útiles para evaluar la gravedad de la afectación hepática.
- 2)
Datos serológicos. Incluyen:
- a)
HBsAg: es imprescindible para reconocer la presencia de infección por el VHB. Habitualmente se realiza mediante técnicas cualitativas (positivo o negativo) pero recientemente se han introducido técnicas cuantitativas que pueden tener interés como marcador pronóstico de la respuesta al tratamiento con interferón pegilado o para el diagnóstico del estado de portador inactivo17–20.
- b)
HBeAg y anti-HBe: su determinación es imprescindible para conocer el tipo de hepatitis crónica (HBeAg positivo o HBeAg negativo, que generalmente cursa con anti-HBe positivo) y para la identificación del estado de portador inactivo21.
- c)
ADN-VHB: su determinación es necesaria para conocer la actividad replicativa del VHB. Debe realizarse mediante una técnica con gran sensibilidad y amplio rango dinámico, preferentemente de PCR en tiempo real. Es imprescindible, para la clasificación del paciente, seguir su evolución, adoptar decisiones terapéuticas y conocer la respuesta al tratamiento22.
- d)
Genotipo del VHB: en general, su determinación proporciona escasa información en casos individuales, pero puede ser útil para decidir el tipo de tratamiento (interferón pegilado o análogos de nucleós[t]ido) en algunos pacientes con hepatitis crónica HBeAg positivo23.
- a)
- 3)
Técnicas de imagen. La ecografía abdominal es útil para identificar la presencia de signos de cirrosis y de hipertensión portal, así como para el diagnóstico del CHC. No obstante, la ausencia de alteraciones ecográficas no excluye la existencia de enfermedad hepática avanzada24.
- 4)
Elastometría hepática. Diversos estudios indican que la medida de la rigidez hepática puede ser útil para excluir o confirmar la presencia de fibrosis hepática significativa o para establecer el diagnóstico de cirrosis en pacientes con infección crónica por el VHB25,26. Sin embargo, la precisión diagnóstica y los valores de corte para definir los diferentes estadios de la fibrosis hepática no están tan bien establecidos como en la hepatitis C y la presencia de necroinflamación hepática con transaminasas muy elevadas puede sobreestimar la puntuación de la fibrosis hepática27,28.
- 5)
Biopsia hepática. En la práctica clínica habitual la biopsia hepática no es imprescindible en la mayoría de los casos para establecer el diagnóstico o para decidir la necesidad de administrar tratamiento. No obstante, su realización es útil en los casos en que los exámenes no invasivos no proporcionan la información necesaria para adoptar decisiones clínicas29,30.
- 1.
La heterogénea presentación de la infección crónica por el VHB exige una evaluación global del paciente con especial atención a las pruebas hepáticas, particularmente las transaminasas, la determinación de HBeAg y anti-HBe, y la cuantificación del ADN-VHB. Esta debe realizarse mediante una técnica apropiada, con amplio rango dinámico, preferentemente de PCR en tiempo real (A1).
- 2.
Una evaluación inicial completa puede ser suficiente para reconocer la situación del paciente con exactitud. Sin embargo, especialmente en los pacientes HBeAg negativo, puede ser necesario realizar un seguimiento estrecho durante algún tiempo antes de tomar decisiones como iniciar un tratamiento o decidir la práctica de una biopsia hepática (A1).
- 3.
La determinación del genotipo del VHB es generalmente innecesaria, pero puede tener interés para decidir el tipo de tratamiento en algunos pacientes HBeAg positivo (B1).
- 4.
La ecografía abdominal puede ser útil para establecer el diagnóstico de cirrosis y es esencial para el diagnóstico precoz del carcinoma hepatocelular (A1).
- 5.
La elastometría hepática puede aportar información adicional, pero su utilidad diagnóstica y los valores de corte para la evaluación de la fibrosis hepática no están tan bien establecidos como en la hepatitis C (B1).
El objetivo final del tratamiento a largo plazo de la hepatitis crónica B es mejorar la supervivencia evitando la progresión a cirrosis e impidiendo el desarrollo de descompensación hepática, CHC y muerte. Este objetivo se consigue suprimiendo la replicación viral de forma mantenida31. La infección por el VHB no puede ser erradicada por la persistencia de ADN circular covalentemente cerrado (ADNccc) en el núcleo de los hepatocitos.
Los objetivos a alcanzar durante el tratamiento son:
- 1.
El objetivo ideal es la pérdida persistente de HBsAg con o sin aparición de anti-HBs. Ello comporta la remisión de la actividad de la enfermedad y mejora el pronóstico a largo plazo.
- 2.
En pacientes HBeAg positivo la seroconversión persistente a anti-HBe es un objetivo satisfactorio.
- 3.
En pacientes HBeAg positivo en los que no se consigue la seroconversión y en los HBeAg negativo el objetivo es mantener niveles indetectables de ADN-VHB.
La indicación de tratamiento es la misma para los pacientes HBeAg positivo y HBeAg negativo, y debe basarse en la combinación de 3 criterios:
- 1.
Valores de ALT.
- 2.
Niveles de ADN-VHB.
- 3.
Lesión hepática valorada por biopsia hepática y/o elastometría.
El tratamiento está indicado si los valores de ALT están elevados, los valores de ADN-VHB son superiores a 2.000 U/ml y existe al menos actividad necroinflamatoria y/o fibrosis moderadas (grado A ≥ 2 o estadio F ≥ 2 en la escala Metavir). En los pacientes con valores normales de ALT y niveles de ADN-VHB superiores a 2.000 U/ml la intensidad de la lesión determinará la indicación de tratamiento. En los pacientes con lesión hepática leve (A1F1 en la escala Metavir) el seguimiento es obligatorio y se puede considerar el tratamiento. En los pacientes en la fase de tolerancia inmunitaria y con una edad inferior a 30 años en los que no existan otros datos de enfermedad hepática y sin historia familiar de CHC, no está indicada la realización de biopsia hepática ni el inicio del tratamiento. Deben ser seguidos periódicamente e indicar la realización de biopsia hepática cuando se eleven los valores de ALT o cuando permaneciendo en fase de tolerancia inmunitaria alcancen los 30 años de edad.
En pacientes con cirrosis compensada se puede considerar el tratamiento si el ADN-VHB es detectable pero inferior a 2.000 U/ml. En los pacientes con cirrosis descompensada es necesario un tratamiento antiviral que asegure una rápida e intensa supresión de la replicación viral y deben ser tratados independientemente de los valores de ADN-VHB y de ALT.
Opciones de tratamientoExisten actualmente 2 tipos de fármacos aprobados para el tratamiento de la hepatitis crónica B: los interferones convencionales α-2a y α-2b y sus formas pegiladas (interferón pegilado alfa-2a), y los análogos de nucleós(t)ido lamivudina, adefovir, entecavir, telbivudina y tenofovir. Los ensayos clínicos en los que se evaluó la eficacia de estos fármacos han utilizado objetivos y metodología diferentes, lo que hace difícil su comparación.
InterferonesEl tratamiento con interferón (IFN) convencional ha demostrado ser superior a la ausencia de tratamiento en pacientes HBeAg positivo y HBeAg negativo. Tras su suspensión la recidiva es frecuente en pacientes HBeAg negativo32–34. La forma pegilada de IFN α-2a (PEG-IFN α-2a) ha sustituido a la convencional por la mayor comodidad de administración (una vez por semana) y mayor eficacia35. El PEG-IFN α-2a es superior a la lamivudina en pacientes HBeAg positivo y HBeAg negativo36,37. La eficacia de PEG-IFN se muestra en las tablas 2 y 3.
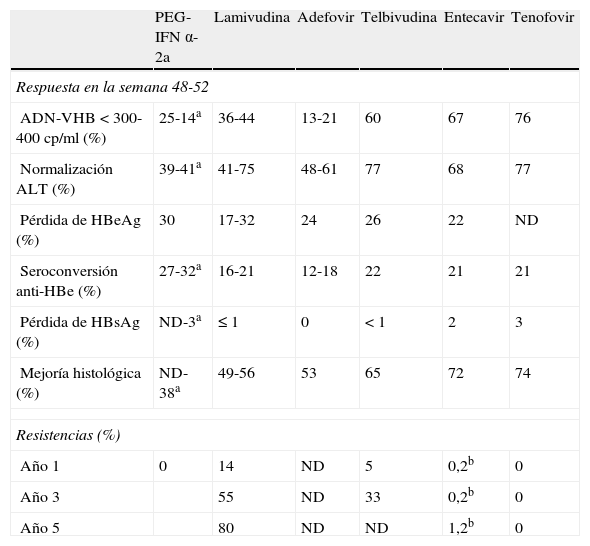
Respuesta y resistencias a tratamientos aprobados en hepatitis crónica B HBeAg positivo
| PEG-IFN α-2a | Lamivudina | Adefovir | Telbivudina | Entecavir | Tenofovir | |
| Respuesta en la semana 48-52 | ||||||
| ADN-VHB < 300-400 cp/ml (%) | 25-14a | 36-44 | 13-21 | 60 | 67 | 76 |
| Normalización ALT (%) | 39-41a | 41-75 | 48-61 | 77 | 68 | 77 |
| Pérdida de HBeAg (%) | 30 | 17-32 | 24 | 26 | 22 | ND |
| Seroconversión anti-HBe (%) | 27-32a | 16-21 | 12-18 | 22 | 21 | 21 |
| Pérdida de HBsAg (%) | ND-3a | ≤ 1 | 0 | < 1 | 2 | 3 |
| Mejoría histológica (%) | ND-38a | 49-56 | 53 | 65 | 72 | 74 |
| Resistencias (%) | ||||||
| Año 1 | 0 | 14 | ND | 5 | 0,2b | 0 |
| Año 3 | 55 | ND | 33 | 0,2b | 0 | |
| Año 5 | 80 | ND | ND | 1,2b | 0 | |
ND: no disponible.
aRespuesta en la semana 72-78.
bHBeAg positivo y negativo.
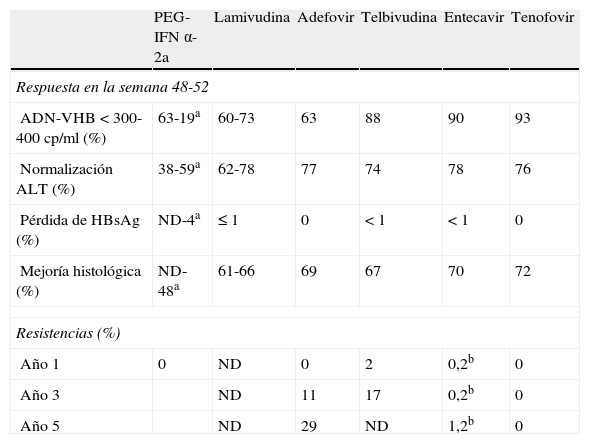
Respuesta y resistencias a tratamientos aprobados en hepatitis crónica B HBeAg negativo
| PEG-IFN α-2a | Lamivudina | Adefovir | Telbivudina | Entecavir | Tenofovir | |
| Respuesta en la semana 48-52 | ||||||
| ADN-VHB < 300-400 cp/ml (%) | 63-19a | 60-73 | 63 | 88 | 90 | 93 |
| Normalización ALT (%) | 38-59a | 62-78 | 77 | 74 | 78 | 76 |
| Pérdida de HBsAg (%) | ND-4a | ≤ 1 | 0 | < 1 | < 1 | 0 |
| Mejoría histológica (%) | ND-48a | 61-66 | 69 | 67 | 70 | 72 |
| Resistencias (%) | ||||||
| Año 1 | 0 | ND | 0 | 2 | 0,2b | 0 |
| Año 3 | ND | 11 | 17 | 0,2b | 0 | |
| Año 5 | ND | 29 | ND | 1,2b | 0 | |
ND: no disponible.
aRespuesta en la semana 72.
bHBeAg positivo y negativo.
El tratamiento con PEG-IFN tiene las ventajas de la duración finita de su administración, la ausencia de resistencias y mayor posibilidad de pérdida de HBsAg. Los principales inconvenientes son su utilización por vía subcutánea y los frecuentes efectos secundarios, que obligan a reducir la dosis en aproximadamente el 25% de los pacientes y a interrumpir el tratamiento de forma precoz en el 5%. El tratamiento con IFN o PEG-IFN está contraindicado en pacientes con enfermedades neurológicas o psiquiátricas graves, enfermedades autoinmunes o citopenias. También está contraindicado en pacientes con cirrosis hepática descompensada y debe utilizarse con precaución en pacientes con cirrosis compensada por el riesgo de aparición de brotes de necroinflamación hepática durante el tratamiento.
LamivudinaLa lamivudina (LAM) es un análogo de nucleósido que se administra por vía oral a la dosis de 100mg/día. La tolerancia y la seguridad de la LAM son muy buenas. Los resultados de eficacia y resistencias se muestran en las tablas 2 y 3. El mayor inconveniente de la LAM es la elevada frecuencia de aparición de variantes resistentes, que aumenta con la prolongación del tratamiento desde el 15-20% al año hasta el 80% a los 5 años38.
La LAM se ha comparado con telbivudina39 y con entecavir40,41, demostrando una menor eficacia y mayor tasa de resistencias, por lo que no debe considerarse como fármaco de primera línea en el tratamiento de la hepatitis crónica HBeAg positivo y HBeAg negativo.
AdefovirEl adefovir (ADV) es un análogo de nucleótido que se administra por vía oral a la dosis de 10mg/día. Una limitación del ADV es el riesgo de toxicidad renal que es dependiente de la dosis. Los resultados de eficacia y resistencias se muestran en las tablas 2 y 3.
El ADV se ha comparado con telbivudina42, entecavir43 y tenofovir44, demostrando en todos los casos una potencia inferior y una tasa de resistencias mayor que las de entecavir y tenofovir, y un riesgo más elevado de nefrotoxicidad, por lo que no puede considerarse como fármaco de primera línea en el tratamiento de la hepatitis crónica HBeAg positivo y HBeAg negativo.
TelbivudinaLa telbivudina (TVD) es un análogo de nucleósido que se administra por vía oral a la dosis de 600mg/día. Su perfil de seguridad es muy bueno y se ha descrito la aparición de miopatía en muy raras ocasiones. Los resultados de eficacia y resistencias se muestran en las tablas 2 y 3.
La TVD se ha comparado con LAM39 y con ADV42 y ha demostrado una eficacia mayor pero con un riesgo apreciable de resistencias, sobre todo en pacientes con carga viral basal elevada y ADN-VHB detectable a las 24 semanas de tratamiento. Aunque la TVD no se ha comparado con entecavir ni tenofovir, su baja barrera genética no conseja su uso como fármaco de primera línea en el tratamiento de la hepatitis crónica HBeAg positivo y HBeAg negativo.
EntecavirEl entecavir (ETV) es un ciclopentano que se administra por vía oral a la dosis de 0,5mg/día. El perfil de seguridad es bueno. Los resultados de eficacia y resistencias se muestran en las tablas 2 y 3. La prolongación del tratamiento con ETV aumenta la respuesta virológica (ADN-VHB indetectable en el 74% de los pacientes HBeAg positivo a los 2 años y en el 95% de los pacientes HBeAg negativo a los 3 años) y la seroconversión anti-HBe45,46 con un riesgo de desarrollo de resistencias muy bajo: la probabilidad acumulada después de 6 años de tratamiento en pacientes no tratados previamente fue de 1,2%47. Por el contrario, la aparición de resistencias es frecuente en pacientes tratados previamente con LAM. El tratamiento a largo plazo con ETV es capaz de revertir la fibrosis incluso en pacientes con cirrosis48.
TenofovirEl tenofovir (TDF) es un análogo de nucleótido que se administra por vía oral a la dosis de 300mg/día. El perfil de seguridad es bueno aunque ocasionalmente se han descrito casos de alteración de la función renal. Los resultados de eficacia y resistencias se muestran en las tablas 2 y 3. La prolongación del tratamiento con TDF durante 5 años aumenta la respuesta virológica (ADN-VHB indetectable en 97% de HBeAg positivo y 99% de HBeAg negativo), la seroconversión a anti-HBe (40%) y la pérdida de HBsAg (11% de los pacientes HBeAg positivo), y consigue la reversión de la fibrosis, con regresión de la cirrosis en 74% de los casos49. No se ha descrito el desarrollo de resistencias en pacientes tratados con TDF durante 5 años50.
Definiciones de respuesta- 1.
No respuesta primaria. Descenso del nivel de ADN-VHB inferior a 1 log10 con respecto al valor basal a las 12 semanas de tratamiento. Este fenómeno es excepcional cuando se utilizan análogos potentes y con alta barrera genética a la resistencia (ETV y TDF). Cuando ocurre es importante comprobar el cumplimiento terapéutico. Esta definición no es aplicable en el caso de tratamiento con PEG-IFN debido a la escasa información disponible.
- 2.
Respuesta virológica. Negativización de ADN-VHB durante el tratamiento:
Respuesta virológica parcial:
- •
Tratamiento con análogos con baja barrera genética a la resistencia (LAM y TVD): ADN-VHB detectable a las 24 semanas de tratamiento.
- •
Tratamiento con análogos con alta barrera genética a la resistencia (ADV, ETV y TDF): ADN-VHB detectable más allá del año de tratamiento.
- •
Rebote virológico. Aumento del nivel de ADN-VHB superior a 1 log10 U/ml con respecto al valor más bajo obtenido o un nivel detectable tras ser indetectable confirmado en 2 determinaciones consecutivas. La causa más frecuente de rebote virológico cuando se utilizan análogos potentes y con alta barrera genética a la resistencia es el mal cumplimiento terapéutico. En pacientes con buen cumplimiento debe investigarse la posibilidad de desarrollo de resistencias.
- •
Respuesta serológica o seroconversión: pérdida de HBeAg y desarrollo de anti-HBe confirmada en 2 determinaciones. Si se administra PEG-IFN esta respuesta puede aparecer hasta 6 meses después de finalizado el tratamiento.
- •
Resolución de la infección. Pérdida de HBsAg, confirmado en una segunda determinación, con o sin desarrollo de anti-HBs.
En pacientes HBeAg positivo los parámetros de mayor importancia para predecir la seroconversión, tanto en los tratados con PEG-IFN como con análogos de nucleós(t)ido, son los valores elevados de ALT y los niveles bajos de ADN-VHB antes de iniciar el tratamiento. Por otra parte, la respuesta al PEG-IFN es mayor en los pacientes infectados por los genotipos A y B que en aquellos infectados por los genotipos C y D36,51, mientras que no existen diferencias en la respuesta entre los diferentes genotipos en pacientes tratados con análogos de nucleós(t)ido. En los pacientes HBeAg negativo no se han identificado factores basales predictores de respuesta.
Durante el tratamientoEn pacientes HBeAg positivo tratados con PEG-IFN, estudios recientes señalan que la cuantificación del HBsAg a las 12 semanas de tratamiento puede ser útil para identificar precozmente a aquellos que no van a obtener respuesta evitando completar el tratamiento. Sin embargo, son necesarios más estudios para definir mejor esta regla de interrupción precoz18,52. En pacientes HBeAg negativo tratados con PEG-IFN, a las 12 semanas se puede suspender el tratamiento si el nivel de HBsAg no desciende y el descenso del nivel de ADN-VHB es inferior a 2 log10 U/ml, ya que la probabilidad de respuesta es muy baja53.
Duración de la respuestaEn pacientes HBeAg positivo la seroconversión obtenida con PEG-IFN se mantiene durante el seguimiento en aproximadamente el 80% de los casos y en ellos la pérdida de HBsAg es más frecuente, especialmente en los infectados el por genotipo A54. En pacientes HBeAg negativo tratados con PEG-IFN la respuesta se mantiene a los 5 años de la suspensión del tratamiento solo en el 20% de los casos, si bien en el 12% de los pacientes se produce pérdida de HBsAg55.
El mantenimiento de la seroconversión en pacientes HBeAg positivo tratados con análogos de nucleós(t)ido es variable según los estudios, pero en general oscila entre el 60 y el 90%. Los 2 factores que tienen mayor influencia en el mantenimiento de la respuesta son los niveles de ADN-VHB en el momento de la seroconversión y el tiempo que se mantiene el tratamiento tras la misma56.
Tratamiento combinadoSe ha ensayado la combinación de PEG-IFN con análogos de nucleós(t)ido como LAM36, ADV57, TVD58 y ETV59, y de diferentes análogos como LAM con ADV60 y ETV con TDF61. De estos ensayos clínicos se puede concluir que a pesar de que la inhibición de la replicación viral es más intensa con el tratamiento combinado, esto no se traduce en un incremento en la respuesta. Por ello actualmente no se recomienda el uso de tratamiento combinado en pacientes no tratados previamente.
Fármacos de primera línea y pautas de tratamientoLos fármacos de elección en el tratamiento de la hepatitis crónica B son el PEG-IFN α-2a, ETV y TDF.
- 1.
PEG-IFN alfa-2a: la dosis recomendada es de 180μg/semana y la duración de 48 semanas.
- 2.
ETV: la dosis recomendada es de 0,5mg/día que debe ajustarse en pacientes con insuficiencia renal. En los pacientes HBeAg positivo el tratamiento se debe mantener durante un año después de confirmar la seroconversión, de forma indefinida en caso de que esta no se produzca o hasta la pérdida del HBsAg. En los pacientes HBeAg negativo, el tratamiento se debe mantener de forma indefinida o hasta la pérdida de HBsAg.
- 3.
TDF: la dosis recomendada es de 300mg/día, que debe ajustarse en pacientes con insuficiencia renal. Las recomendaciones sobre la duración del tratamiento son las mismas que para el ETV.
El interferón pegilado es una buena opción terapéutica en pacientes HBeAg positivo, jóvenes, infectados por el genotipo A, con valores elevados de ALT y valores de ADN-VHB moderadamente elevados. Estos son también los pacientes que consiguen mejores respuestas con análogos de nucleós(t)ido. En el resto de pacientes HBeAg positivo y en los pacientes HBeAg negativo, entecavir o tenofovir se deben considerar los fármacos de elección (A1).
Fallo de tratamientoEs necesario distinguir entre ausencia de respuesta primaria, respuesta virológica parcial y rebote virológico.
- •
Ausencia de respuesta primaria. Debido a su potencia y alta barrera genética a la resistencia la ausencia de respuesta primaria es muy infrecuente con ETV o TDF. Si se produce es muy importante comprobar el cumplimiento del tratamiento.
- •
Respuesta virológica parcial. En pacientes tratados con ETV o TDF la respuesta virológica parcial depende de la carga viral basal y no supera el 30% en pacientes HBeAg positivo y el 10% en pacientes HBeAg negativo al año de tratamiento40,41,44. Debido a que estos pacientes podrían estar en riesgo de desarrollar resistencias si se mantiene el mismo tratamiento, se ha indicado que debería modificarse. Sin embargo, datos recientes indican que si se demuestra un cumplimiento adecuado se debe mantener el mismo tratamiento, sobre todo si el ADN-VHB ha descendido progresivamente y alcanza un nivel inferior a 1.000 U/ml después de un año de tratamiento62,63.
Es infrecuente en pacientes tratados con ETV o TDF y suele deberse a un mal cumplimiento terapéutico, aunque se debe descartar la emergencia de resistencias si persiste tras mejorar la adherencia. En pacientes tratados con LAM, ADV o TVD, una vez comprobado el buen cumplimiento del tratamiento, el rebote se debe al desarrollo de mutaciones resistentes al análogo utilizado. Si es posible, se debe identificar el patrón de mutaciones de resistencia. Es necesario modificar el tratamiento antes de que se produzca un aumento importante de la replicación viral y/o de la ALT. En general, la estrategia más eficaz es asociar un análogo de nucleós(t)ido sin resistencia cruzada.
- •
Resistencia a LAM: cambiar a TDF tiene una eficacia similar a asociar TDF64.
- •
Resistencia a TVD: asociar TDF. La seguridad a largo plazo de esta combinación no se conoce.
- •
Resistencia a ADV: cambiar a TDF y asociar un análogo de nucleósido sin resistencia cruzada. Si está presente la mutación N236T se debe asociar LAM, TVD o ETV. Si está presente la mutación A181T/V se debe añadir ETV. Si no se puede realizar el análisis de las variantes resistentes se recomienda asociar ETV. En pacientes con carga viral inferior a 7 log10 U/ml en el momento del rescate cambiar a TDF puede tener una eficacia similar64.
- •
Resistencia a ETV: se debe asociar TDF.
- •
Resistencia a múltiples tratamientos: cambiar a la asociación ETV y TDF.
- •
Tratamiento con PEG-IFN. A las 12 semanas de tratamiento se deben determinar los valores de ADN-VHB y de HBsAg para suspender el tratamiento si no hay respuesta. Al final del tratamiento y 6 meses después se debe determinar el nivel de ADN-VHB, HBeAg y anti-HBe. En pacientes HBeAg positivo si no hay respuesta se deben repetir las mismas determinaciones cada 6 meses por la posible existencia de una respuesta tardía. Si hay respuesta y, sobre todo, si la carga viral es indetectable, es necesario determinar el HBsAg cada 6 meses para valorar su posible pérdida. Se deben monitorizar los efectos adversos conocidos de PEG-IFN.
- •
Tratamiento con análogos de nucleós(t)ido. Se debe determinar el nivel de ADN-VHB a los 3 meses para valorar la respuesta primaria y posteriormente cada 3 o 6 meses. En pacientes HBeAg positivo se debe determinar el HBeAg y anti-HBe cada 3 o 6 meses. En pacientes HBeAg positivo después de conseguir la seroconversión y en pacientes HBeAg negativo con respuesta viral mantenida se recomienda determinar anualmente el HBsAg para valorar su posible pérdida. En los pacientes tratados con análogos de nucleós(t)ido se deben determinar cada 3 o 6 meses el nivel de creatinina y el filtrado glomerular estimado. En pacientes tratados con TDF se recomienda valorar la función tubular renal. En caso de deterioro renal se debe ajustar la dosis de los fármacos de forma adecuada.
Los pacientes con cirrosis descompensada deben ser tratados sin demora con un análogo de nucleós(t)ido, con independencia de los niveles de transaminasas o de la carga viral. El PEG-IFN está contraindicado en estos pacientes por el riesgo de complicaciones. El tratamiento antiviral puede asociarse con una estabilización clínica que puede llegar a retrasar o a evitar el trasplante hepático (TH)65. Esta mejoría clínica, sin embargo, puede tardar de 3 a 6 meses en observarse. De hecho, la mayoría de los fallecimientos se producen en los primeros 6 meses después de iniciar el tratamiento, sobre todo si la enfermedad hepática está muy avanzada, con independencia del grado de supresión de la replicación viral obtenido66. En consecuencia, estos pacientes deberían ser evaluados en unidades que dispongan de programa de TH para valorar si esta alternativa terapéutica está indicada. Los fármacos de elección en estos pacientes son ETV y TDF. Debe señalarse que en el estudio de registro que dio lugar a la aprobación de ETV en esta población67, la dosis utilizada fue de 1mg/día. Sin embargo, existen datos en la literatura médica que indican que la dosis de 0,5mg/día puede ser suficiente en los pacientes no tratados previamente68,69. En los pacientes con resistencia a LAM, TDF es el fármaco de elección.
Los pacientes con cirrosis descompensada, sobre todo aquellos con enfermedad hepática muy avanzada, son un grupo de difícil manejo, en el que la seguridad de los análogos adquiere un papel muy relevante y en el que los datos a largo plazo son aún limitados67,69. Estos pacientes deben ser monitorizados estrechamente para detectar precozmente la aparición de complicaciones potencialmente graves. La acidosis láctica, que puede ser una manifestación de toxicidad mitocondrial, se ha descrito en individuos con función hepática muy deteriorada (MELD > 20) que estaban recibiendo ETV70, pero puede aparecer con cualquier análogo. Asimismo, en la cirrosis descompensada, la insuficiencia renal es frecuente, lo que obliga al ajuste de la dosis de los análogos.
En los pacientes que finalmente son incluidos en lista de espera de TH, el tratamiento antiviral tiene el objetivo de conseguir llegar al TH con carga viral indetectable, lo que reduce notablemente el riesgo de recidiva de la hepatitis B post-TH71. Si la situación clínica lo permite, es deseable que en los pacientes que están recibiendo tratamiento antiviral, el TH no se realice hasta que la carga viral sea indetectable o al menos inferior a 105 U/ml71.
Profilaxis de la recidiva de la hepatitis B en el trasplante hepáticoEn el pasado, la hepatitis B llegó a ser considerada una contraindicación al TH pues muchos pacientes se trasplantaban con carga viral detectable y, en consecuencia, la reinfección del injerto era universal con el desarrollo de una hepatitis B recurrente con evolución rápidamente progresiva72. Esta situación ha cambiado y hoy en día los resultados del TH en la hepatitis B son similares, e incluso mejores, a los obtenidos en otras etiologías73.
Profilaxis a corto plazoLa profilaxis post-TH a corto plazo se basa en la administración de gammaglobulina hiperinmune antihepatitis B (GGHI) y de análogos de nucleós(t)ido. Aunque ambos se han usado en monoterapia, su administración conjunta ha demostrado ser claramente superior, por lo que esta estrategia es la más utilizada en la actualidad. No existe un protocolo universalmente aceptado sobre la dosis, frecuencia de administración (intervalos fijos frente a intervalos variables según los niveles de anti-HBs previos a la siguiente dosis) y vía de administración (intramuscular o intravenosa) de la GGHI. Sin embargo, existen datos muy convincentes de que, en presencia de un inhibidor potente de la replicación viral capaz de conseguir que el paciente llegue al TH con carga viral indetectable o baja (< 105 U/ml), se pueden utilizar dosis reducidas de GGHI (1.000-2.000 U/mes)74,75.
Respecto al análogo a utilizar, la mayor parte de la experiencia acumulada es con LAM76 y en menor grado con ADV, este último en pacientes con resistencia a LAM77. En la actualidad, LAM y ADV han sido mayoritariamente reemplazados por ETV y TDF (este último de elección en pacientes con resistencia previa a LAM), por su elevada potencia antiviral y baja tasa de resistencias en pacientes no tratados previamente que, por otro lado, la mayoría de ellos estarán recibiendo desde un tiempo variable antes del trasplante (véase cirrosis descompensada). Sin embargo, debe destacarse que en comparación con la gran cantidad de información existente con LAM existen todavía muy pocos estudios que analicen la eficacia y seguridad de la utilización de estos nuevos fármacos asociados a GGHI en la profilaxis de la hepatitis B recurrente78,79.
Actualmente, no existen datos suficientes todavía para recomendar de forma sistemática la utilización de pautas de profilaxis inicial sin GGHI, basadas únicamente en la administración de ETV o TDF, aislados o en combinación80.
Profilaxis a largo plazoDebido a su alto coste e inconvenientes, se ha propuesto la retirada de la GGHI tras un periodo de profilaxis en combinación con LAM. Esta estrategia es segura, con una tasa de hepatitis B recurrente similar a la de la profilaxis en combinación, después de un periodo variable de profilaxis combinada en pacientes con bajo riesgo de hepatitis B recurrente (carga viral indetectable en el momento del trasplante espontáneamente o por tratamiento antiviral y/o ausencia de resistencias pretrasplante)74,81. No existe un protocolo universalmente aceptado sobre el tiempo óptimo de retirada de la GGHI que ha oscilado según los estudios entre un mes74 y varios años82 después del trasplante. La adherencia al tratamiento con LAM parece ser clave en el éxito de estos protocolos de retirada de la GGHI83. Es muy probable que ETV o TDF puedan utilizarse en monoterapia tras un periodo de profilaxis en combinación con GGHI en pacientes con bajo riesgo de hepatitis B recurrente post-TH, pero todavía no hay estudios controlados al respecto.
Una alternativa a la retirada de la GGHI es la utilización de 2 análogos en combinación. Esta práctica ha demostrado ser eficaz utilizando ADV en combinación con LAM en un estudio reciente84. La vacunación antihepatitis B como alternativa a la administración prolongada de GGHI ha demostrado una eficacia muy dispar85,86 y en la actualidad no se recomienda su uso sistemático en la práctica clínica.
La profilaxis de la hepatitis B recurrente debe ser mantenida de por vida ya que el VHB persiste de forma indefinida en el hígado87,88. En un estudio reciente se ha valorado la eficacia y seguridad de la retirada total de la profilaxis de forma programada en una serie de 30 pacientes muy seleccionados y la tasa de reaparición del HBsAg fue del 20%89. Los escasos datos disponibles en la actualidad no permiten recomendar la aplicación sistemática de esta estrategia.
Recomendaciones- 1.
Los pacientes con cirrosis descompensada deben ser tratados sin demora con análogos de nucleós(t)ido potentes y con alta barrera genética a la resistencia como entecavir o tenofovir (A1). En la elección del análogo de nucleós(t)ido a utilizar es muy importante tener en cuenta la posibilidad de resistencias a los fármacos que el paciente haya recibido previamente.
- 2.
La profilaxis de la recurrencia de la hepatitis B en el periodo inmediato postrasplante se basa en la administración combinada de gammaglobulina hiperinmune antihepatitis B y análogos de nucleós(t)ido, por lo general los que el paciente estuviera recibiendo antes del trasplante (A1).
- 3.
Es posible suspender la gammaglobulina hiperinmune tras un periodo variable de profilaxis en combinación con antivirales orales en pacientes considerados de bajo riesgo, definido por carga viral indetectable antes del trasplante, bien espontáneamente o tras la administración de fármacos antivirales, y/o ausencias de resistencias pretrasplante. En esta situación debe continuarse con los antivirales orales indefinidamente (A1).
La infección por VIH ejerce un efecto negativo sobre la evolución de la hepatitis crónica B. Los pacientes coinfectados presentan cifras más elevadas de ADN-VHB y en ellos es más frecuente la detección del HBeAg y un aumento del riesgo de morbilidad y mortalidad por enfermedad hepática crónica en comparación con los pacientes no infectados por el VIH90–92. En los pacientes infectados por el VIH sin infección por el VHB se debe indicar la vacunación frente al VHB si la cifra de linfocitos CD4 está por encima de los 300-350/μl.
Las indicaciones de tratamiento de la hepatitis B en los pacientes coinfectados son las mismas que en los pacientes sin infección por VIH93. La decisión del tratamiento se debe establecer en función de la necesidad de la terapia antirretroviral, puesto que algunos de los medicamentos anti-VIH tienen actividad frente al VHB. En la mayoría de los casos se debe indicar tratamiento para las 2 infecciones de forma simultánea utilizando la combinación de TDF y emtricitabina junto con un tercer agente con actividad antirretroviral94–97. Esta combinación proporciona mayor eficacia antiviral y retrasa la selección de mutantes resistentes que pueden aparecer con la utilización de LAM sin TDF. Por el contrario, si el tratamiento antirretroviral no incluye fármacos con actividad frente al VHB o no existe indicación de tratamiento de la infección por VIH pueden utilizarse el PEG-IFN (particularmente en pacientes HBeAg positivo con cifras de linfocitos CD4 superiores a 500/μl), ADV o ETV. Este último fármaco tiene actividad anti-VIH in vitro y no debe utilizarse fuera de regímenes de combinación de medicamentos antirretrovirales por el riesgo de selección de la mutación 18498,99. El ETV tampoco constituye una buena elección en pacientes con resistencia a LAM. Por su parte, TVD carece de actividad anti-VIH, pero no debe utilizarse en monoterapia en pacientes que no requieran tratamiento antirretroviral por el riesgo de desarrollar resistencias que afecten al uso de LAM100.
Pacientes con coinfección VHB-VHCLos virus de la hepatitis B y C comparten varios mecanismos de transmisión y la coinfección por el virus C se ha descrito en el 7-15% de los pacientes con hepatitis crónica B99,101. Habitualmente, la infección por VHC inhibe la replicación del VHB, pero la presencia de este último virus no compromete la eficacia del tratamiento con PEG-IFN y ribavirina. De hecho, la eficacia de estos fármacos es similar en los pacientes con hepatitis crónica C y en aquellos con hepatitis crónica B y C101,102. Después de la erradicación del VHC tras el tratamiento con PEG-IFN y ribavirina se han comunicado en algunos pacientes incrementos en los valores de ADN-VHB, por lo que es importante su monitorización para detectar posibles candidatos al tratamiento antiviral de la hepatitis crónica B. No existen evidencias de la que la eficacia antiviral de los análogos de nucleós(t)ido para la hepatitis B se vea afectada por la coinfección por VHC. En ausencia de hepatopatía avanzada y/o contraindicaciones al IFN es razonable la utilización de PEG-IFN en estos pacientes103.
Pacientes con coinfección VHB-VHDEl virus de la hepatitis delta (VHD) infecta únicamente a los pacientes HBsAg positivo y ello obliga a realizar el cribado de infección por VHD en todos los pacientes con hepatitis crónica B. Aunque la incidencia del VHD ha disminuido mucho en los últimos años, en algunas áreas geográficas como la cuenca mediterránea o los países del este de Europa entre el 5 y el 10% de los pacientes HBsAg positivo presentan coinfección por VHD104. La hepatitis delta se caracteriza por una mayor gravedad de la enfermedad hepática y una incidencia de cirrosis más elevada que las observadas en pacientes con hepatitis B crónica.
El IFN es el único medicamento aprobado para el tratamiento de la hepatitis crónica delta. En algunas series históricas la utilización de dosis elevadas de IFN α estándar (9-10 MU tres veces por semana) consiguió tasas de respuesta en torno a un 15%, con mejora histológica en el caso de los pacientes respondedores105,106. Más recientemente, el tratamiento con 180μg/semana de PEG-IFN α-2a durante un año obtuvo respuesta sostenida (ARN-VHD indetectable 6 meses después de la finalización del tratamiento) en el 28% de los pacientes107. La adición de ADV al tratamiento con PEG-IFN no mejoró la respuesta, pero produjo un descenso mayor en las concentraciones de HBsAg.
Pacientes con insuficiencia renal crónicaLos pacientes con insuficiencia renal crónica en programa de hemodiálisis constituyen un grupo de riesgo de infección por el VHB. Aunque la respuesta a la vacuna de la hepatitis B es inferior a la de la población general, la prevalencia de infección crónica en este colectivo se ha reducido drásticamente en los últimos años108. Los pacientes en hemodiálisis pueden tratarse con análogos de nucleós(t)ido siguiendo los mismos criterios que en los pacientes inmunocompetentes y ajustando la dosis según el aclaramiento de creatinina. Se deben utilizar fármacos con elevada barrera genética para evitar resistencias y con el mejor perfil de seguridad renal109. En este sentido, ETV puede constituir una buena elección en pacientes sin resistencia a LAM. El tratamiento antiviral con análogos de nucleós(t)ido se ha utilizado también en pacientes con glomerulonefritis asociada con el VHB con remisión clínica y mejoría de la proteinuria en dos terceras partes de los pacientes6. Los pacientes con trasplante renal infectados por VHB no deben ser tratados con PEG-IFN por el peligro de favorecer el rechazo del riñón trasplantado.
Pacientes con hepatitis agudaLa mayoría (95%) de las hepatitis agudas B en adultos inmunocompetentes se resuelven espontáneamente por lo que no existe indicación de tratamiento. Sin embargo, en los casos de hepatitis aguda de curso grave se debe indicar tratamiento antiviral. ETV y TDF constituyen las mejores alternativas por su potencia y elevada barrera genética, especialmente si se considera la opción del trasplante hepático110. En circunstancias en las que se prevé una corta duración del tratamiento se pueden utilizar también LAM y TVD29. El tratamiento con IFN no se recomienda en los pacientes con hepatitis aguda grave.
EmbarazoEl abordaje clínico de la hepatitis B durante el embarazo presenta diversos problemas, entre ellos el tratamiento de la enfermedad en la gestante y la prevención de la transmisión de la infección al recién nacido, cuyo riesgo de desarrollar una hepatitis crónica alcanza el 90%111. Ni el IFN ni los antivirales orales poseen el registro para su uso durante el embarazo, de ahí que se deba evaluar cuidadosamente la indicación de tratamiento en esta situación112,113. TVD y TDF se consideran fármacos de categoría B, que indica que existen datos preclínicos de seguridad e información limitada en humanos, mientras que ETV, LAM y ADV se incluyen en la categoría C, es decir, sin información concluyente de seguridad en modelos animales y seres humanos.
La decisión de tratamiento debe contemplar la gravedad de la enfermedad y el riesgo de la transmisión perinatal114. Si la paciente desea quedarse embarazada en un corto espacio de tiempo, en la mayoría de los casos se debe esperar hasta después del parto para iniciar el tratamiento antiviral con análogos de nucleós(t)ido. Por otro lado, si la paciente tiene factores predictores de respuesta al PEG-IFN puede indicarse este tratamiento, cuya duración limitada a 48 semanas posibilitaría después el embarazo. Ante un embarazo en una paciente en tratamiento antiviral con análogos, no se dispone de información suficiente sobre el riesgo para la madre de interrumpir el tratamiento, ni para el feto de continuarlo, si bien la actitud más prudente parece la de interrumpirlo al menos durante el primer trimestre y efectuar un seguimiento estrecho en las semanas posteriores.
En todos los recién nacidos está indicada la inmunoprofilaxis activa y pasiva con vacuna y gammaglobulina específica, respectivamente. Datos recientes, sin embargo, apoyan el uso concomitante de análogos de categoría B (TVD y TDF) a partir de la semana 26-28 de gestación para prevenir la transmisión, especialmente en pacientes con valores elevados de carga viral (106-107 U/ml)115,116.
NiñosLa mayoría de los niños con hepatitis crónica B se encuentran en la fase de tolerancia inmunitaria (HBeAg positivo, elevados valores de carga viral y mínima o nula actividad de la enfermedad) y por tanto no requieren tratamiento115. La tasa de seroconversión espontánea del HBeAg es muy elevada en niños y por ese motivo se requiere un seguimiento cuidadoso de los que muestran signos de actividad de la enfermedad antes de iniciar el tratamiento e indicarlo únicamente en los niños o adolescentes con enfermedad hepática activa o potencialmente grave (necroinflamación y fibrosis moderada/avanzada). Se han utilizado IFN, LAM y ADV con resultados de eficacia, perfil de seguridad y riesgo de resistencias similares a los observados en pacientes adultos117,118, y no se dispone de datos consistentes con la utilización de PEG-IFN o análogos de última generación (ETV, TVD y TDF).
RecomendacionesLas indicaciones de tratamiento de la hepatitis B en los pacientes VIH positivo son las mismas que en los pacientes sin infección por VIH. En la mayoría de los casos se debe indicar tratamiento para las 2 infecciones de forma simultánea utilizando la combinación de tenofovir y emtricitabina junto con un tercer agente con actividad antirretroviral. En casos seleccionados (pacientes HBeAg positivo sin cirrosis y con buenos predictores de respuesta) se puede utilizar interferón pegilado durante 48 semanas (A1).
- •
Los pacientes en hemodiálisis deben tratarse con análogos de nucleós(t)ido de alta barrera genética ajustando la dosis según el aclaramiento de creatinina. En pacientes sin resistencia a lamivudina el entecavir constituye la primera elección (B1).
- •
Los antivirales orales no son eficaces para el tratamiento de la hepatitis crónica delta. La utilización de interferón pegilado consigue la respuesta viral en aproximadamente el 25% de estos pacientes. En los pacientes con coinfección B y C generalmente la replicación del VHB está suprimida y se debe abordar el tratamiento de la hepatitis C. Cuando está indicado el tratamiento de la hepatitis B la eficacia de los antivirales no se afecta por la infección por VHC. (A1).
- •
En las mujeres embarazadas la decisión del tratamiento debe contemplar la gravedad de la enfermedad y el riesgo de la transmisión perinatal. Además de la inmunoprofilaxis activa y pasiva con vacuna y gammaglobulina específica en todos los recién nacidos, en las pacientes con elevados valores de carga viral (106-107 U/ml) y/o antecedentes de transmisión perinatal se recomienda el tratamiento con análogos de categoría B (telbivudina y tenofovir) a partir de la semana 26-28 de gestación (A1).
Los portadores del VHB con o sin actividad replicativa viral detectable que deben recibir tratamientos antineoplásicos o inmunosupresores están expuestos a una reactivación de la infección cuya gravedad puede ir desde una elevación asintomática y transitoria de las transaminasas hasta una hepatitis fulminante. Aunque puede ocurrir durante el tratamiento, el riesgo de reactivación es mayor cuando, al finalizar dicho tratamiento, el sistema inmunitario recupera su reactividad y detecta el aumento de la replicación viral que ha tenido lugar durante la fase de inmunosupresión119.
La inmunosupresión es inherente a la quimioterapia antineoplásica, pero también a los tratamientos asociados al trasplante de órganos o de progenitores hematopoyéticos, o al tratamiento de enfermedades autoinmunes120–122. También puede ocurrir tras el procedimiento de quimioembolización en pacientes con CHC123.
El riesgo de reactivación depende de la conjunción de varios factores: el estado de la infección por el VHB antes del tratamiento, el tipo de enfermedad y el tipo de tratamiento (tabla 4). En relación con el estado de la infección por el VHB, el riesgo es mucho más elevado en los pacientes con HBsAg positivo basalmente pero, aunque con mucha menor frecuencia, también puede ocurrir en los sujetos HBsAg negativo con positividad para anti-HBc con o sin anti-HBs. El riesgo de reactivación es especialmente elevado en sujetos sometidos a trasplante de progenitores hematopoyéticos o en los que reciben quimioterapia por linfomas, en especial no hodgkinianos, pero también puede ocurrir en muchas otras situaciones como enfermedades autoinmunes del tipo de la artritis reumatoide o de la enfermedad inflamatoria intestinal. En todos los casos el uso de corticoides y/o de anticuerpos antilinfocitarios (rituximab) o anti-TNF aumenta el riesgo de reactivación.
Clasificación del riesgo de reactivación de la hepatitis B
| Patrón serológico | Riesgo por VHB | Riesgo por tratamientoa | Riesgo final |
| HBsAg positivo | Alto | Indistinto | Alto |
| HBsAg negativo | Bajo | Alto | Medio |
| Anti-HBc positivo | Medio | Bajo | |
| Anti-HBc positivo | Bajo | Indistinto | Bajo |
| Anti-HBs positivo | |||
| Anti-HBc negativo | Nulo | Indistinto | Nulo |
| Anti-HBs positivo | |||
| Anti-HBc negativo | Nulo | Indistinto | Nulo |
| Anti-HBs negativo |
Diversos estudios han demostrado que el tratamiento antiviral con análogos de núcleos(t)ido disminuye muy significativamente el riesgo de reactivación del VHB124. La administración de dichos fármacos debe iniciarse al menos una semana antes de iniciar el tratamiento inmunosupresor y mantenerse durante al menos 6 o 12 meses después de haber finalizado dicho tratamiento, o bien durante un tiempo indefinido, dependiendo de la situación basal de la infección por VHB (hepatitis crónica con alta replicación viral). El tratamiento antiviral preventivo es más eficaz que el tratamiento de la reactivación una vez producida125. La LAM se ha mostrado eficaz en esta situación y, por su comprobada seguridad y bajo coste, es el fármaco de elección. No obstante, debido al riesgo de aparición de resistencias en pacientes con elevada replicación viral o en los que se prevé que la duración del tratamiento antiviral va a ser larga, puede ser preferible utilizar análogos más potentes y con elevada barrera genética como ETV o TDF126.
En los pacientes con HBsAg negativo anti-HBc positivo la profilaxis de la reactivación del VHB no está bien establecida y probablemente sea apropiado adecuarla al grado teórico de riesgo individual29. Si el ADN-VHB es positivo (infección oculta) o si se emplean fármacos como corticoides o rituximab se debe administrar tratamiento antiviral profiláctico. En los demás casos se recomienda controlar estrechamente la evolución del paciente, preferentemente mediante la monitorización del ADN-VHB en el suero, con el fin de detectar precozmente la reactivación del VHB, en cuyo caso se debe proceder a la administración inmediata de tratamiento antiviral. Es recomendable que todos los pacientes HBsAg positivo o anti-HBc positivo, candidatos a recibir tratamiento inmunosupresor, sean evaluados y preferentemente controlados por el hepatólogo.
Recomendaciones- 1.
Antes de iniciar cualquier tratamiento con potencial inmunosupresor es obligatorio investigar la presencia de una infección por VHB mediante la determinación de HBsAg, anti-HBs y anti-HBc. En los casos con HBsAg positivo o anti-HBc positivo se debe determinar el ADN-VHB (A1).
- 2.
Es necesario administrar tratamiento antiviral profiláctico si el HBsAg o el ADN-VHB son positivos (A1).
- 3.
En los casos con anti-HBc positivo y ADN-VHB negativo la indicación de tratamiento antiviral profiláctico está en función del riesgo de reactivación inherente a la enfermedad subyacente (trasplante de progenitores hematopoyéticos) y al tipo de tratamiento inmunosupresor (corticoides y/o rituximab). En los demás casos se debe detectar precozmente la aparición de reactivación del VHB mediante la monitorización de las transaminasas, HBsAg y preferentemente de los valores de ADN-VHB (B1).
- 4.
En los pacientes con riesgo alto o medio de reactivación la prevención es claramente preferible al tratamiento de la reactivación una vez iniciada (A1).
- 5.
La lamivudina sigue siendo el fármaco de elección para prevenir la reactivación. No obstante, en los casos con elevada carga viral basal y/o en los que se prevé que la duración del tratamiento antiviral será prolongada debe considerarse la utilización de entecavir o tenofovir (B1).
- 6.
La profilaxis debe iniciarse al menos una semana antes que el tratamiento inmunosupresor y debe mantenerse al menos durante 6 o 12 meses tras la finalización del mismo. Dependiendo de las circunstancias basales puede ser necesario mantener el tratamiento antiviral durante tiempo indefinido (B1).
- 7.
Es aconsejable consultar al hepatólogo acerca de cualquier candidato a tratamiento inmunosupresor con evidencias serológicas de infección por el VHB. Asimismo, se recomienda el control por el hepatólogo de los pacientes con riesgo moderado o alto de reactivación (B1).
Las vacunas comercializadas en España que utilizan HBsAg recombinante como antígeno inmunizante son muy eficaces y seguras. Los valores de anti-HBs superiores a 10 U/ml tras la vacunación garantizan la protección prolongada, posiblemente de por vida, en los sujetos sanos vacunados antes de los 40 años, por lo que en general no es necesario administrar dosis de recuerdo.
La vacuna es menos eficaz en sujetos mayores de 40 años, especialmente si son fumadores, obesos, neumópatas, cardiópatas o hepatópatas crónicos, padecen insuficiencia renal o síndrome de Down y muy especialmente si están inmunodeprimidos. En ellos se recomienda administrar una dosis de recuerdo cuando el título de anti-HBs disminuya por debajo de 10 U/ml. Los pacientes con insuficiencia renal deben ser vacunados antes de su entrada en programa de diálisis127.
Los objetivos de la política de vacunación son los sujetos en riesgo y la población general. Los primeros incluyen: a) niños recién nacidos de madres portadoras del VHB; b) personal con riesgo de exposición personal (profesionales sanitarios y cuidadores de personas infectadas); c) personas expuestas por razones terapéuticas (hemofílicos, pacientes en programa de hemodiálisis), y d) personas con riesgo asociado al estilo de vida (uso de drogas por vía parenteral, promiscuidad sexual). La vacunación de estos colectivos es eficaz a nivel individual pero no mejora el control de la infección en la colectividad.
La vacunación universal puede realizarse en dos momentos de la vida: recién nacidos y preadolescentes. En España el calendario de vacunación vigente en prácticamente todas las comunidades autónomas establece la vacunación en los recién nacidos y también la de los preadolescentes. La vacunación de este grupo de edad debe mantenerse hasta que la primera cohorte de niños vacunados al nacer alcance la edad preadolescente.
Recomendaciones- 1.
En los sujetos vacunados sin enfermedades crónicas no es preciso administrar dosis de recuerdo aunque los valores de anti-HBs disminuyan por debajo de 10 U/ml (A1).
- 2.
En pacientes inmunodeprimidos (infectados por VIH, trasplantados) es recomendable examinar anualmente el título de anti-HBs y administrar dosis de recuerdo si el título disminuye por debajo de 10 U/ml (A1).
- 3.
Deben implementarse programas de vacunación en inmigrantes procedentes de zonas de alta endemicidad (B1).
- 4.
En los enfermos con hepatitis crónica C no inmunes frente al VHB puede ser útil la vacunación frente al mismo (B1).
La exposición accidental al VHB puede ocurrir en el personal sanitario o en la población general. En el primer caso se trata de una exposición accidental plenamente susceptible de ser prevenida mediante la aplicación de las medidas universales de prevención y la vacunación de todo el personal sanitario antes de su incorporación a la actividad laboral. El 10% de los adultos sanos no responde a la vacuna y solo el 40% de los no respondedores responden a una segunda tanda de vacunación, por lo que algunas personas vacunadas no están inmunizadas. La exposición no profesional puede ser perinatal, en niños nacidos de madres portadoras del VHB, o accidental, tanto por pinchazo o corte con objetos contaminados o por relaciones sexuales de riesgo, homo u heterosexuales.
Las personas que han sufrido una posible exposición pero que tienen inmunidad natural o han sido vacunadas y tienen niveles de anti-HBs superiores a 10 U/ml son inmunes a la infección y no precisan de ningún tipo de medida preventiva adicional. En el resto de los casos la conducta es similar y consiste en la doble inmunización: pasiva, con GGHI y activa, con vacuna antihepatitis B.
En niños recién nacidos de madres portadoras del VHB, la administración de GGHI y de la primera dosis de vacuna tiene una eficacia del 95%. La inmunización activa-pasiva puede no ser eficaz en niños nacidos de madres con cargas virales muy elevadas (ADN-VHB en el suero de la madre superior a 107 U/ml), en las que se ha de considerar individualmente la administración de tratamiento antiviral con análogos de núcleos(t)ido a partir del tercer trimestre del embarazo111.
En la profilaxis postexposición se debe extraer una muestra de sangre basal de sangre para constatar el estado de la inmunidad frente al VHB y se administrará una dosis de GGHI, así como la primera dosis de la vacuna. Si se comprueba que el sujeto poseía valores protectores de anti-HBs no es preciso continuar la vacunación127.
Recomendaciones- 1.
La profilaxis postexposición está indicada en todas las personas no inmunizadas o cuyo estado inmunitario se desconoce. Deben determinarse los marcadores serológicos del VHB y administrarse una dosis de gammaglobulina hiperinmune y la primera dosis de vacuna. Si el título de anti-HBs es protector no es necesario continuar con la vacunación (A1).
- 2.
En las gestantes con niveles de ADN-VHB>107 U/ml la administración de un análogo de núcleos(t)ido durante el tercer trimestre de la gestación disminuye el riesgo de transmisión vertical pero no exime de la inmunización activa-pasiva del recién nacido (B1).
Maria Buti es asesor de Gilead Sciences, Bristol Myers Squibb, MSD y Novartis.
Manuel Rodríguez es asesor de Gilead Sciences y Bristol-Myers Squibb.
Martin Prieto es asesor de Gilead Sciences y Bristol-Myers Squibb.
Emilio Suarez es asesor de Gilead Sciences y Bristol-Myers Squibb.
Javier García Samaniego es asesor de Gilead, Roche y Bristol-Myers Squibb.
Rafael Esteban es asesor de Gilead Sciences, Bristol Myers Squibb, MSD y Novartis.