Ustekinumab, anticuerpo monoclonal que bloquea las interleucinas 12/23, ha demostrado en ensayos clínicos su eficacia para inducir y mantener la remisión clínica en la enfermedad de Crohn (EC). Su efectividad y su seguridad en la práctica clínica real es menos conocida y podría diferir respecto a los ensayos.
ObjetivoEvaluar en la práctica clínica su efectividad y seguridad (pauta de inducción intravenosa esencialmente), como inducción y a largo plazo, en pacientes con EC refractarios a tratamiento biológico.
Material y métodosAnálisis retrospectivo multicéntrico (6 hospitales aragoneses), que incluye a todos los pacientes (N=69) con EC en tratamiento con ustekinumab (fuese con inducción intravenosa o subcutánea) que hubiesen alcanzado al menos 16 semanas de seguimiento. La respuesta o remisión clínica se ha evaluado en las semanas 16, 24, 32 y 48 mediante el índice de Harvey-Bradshaw.
ResultadosSe han incluido un total de 69 pacientes, edad media 42 años, 54% hombres. Un 89,86% (IC 95% [0,805, 0,949]) de los pacientes ha presentado mejoría clínica en la semana 16 (15,95% remisión, 73,92% respuesta). En el seguimiento posterior dicha respuesta se ha mantenido. Se han identificado mediante un modelo de regresión ordinal la edad (OR 0,95, p=0.028) y el hábito tabáquico (OR 0,19, p=0,027) como predictores de mala respuesta al tratamiento, mientras que la necesidad de cambio de biológico por efecto adverso (OR 96, p=0,00017) y por pérdida de respuesta secundaria (OR 7,07, p=0,034) han sido factores predictores de buena respuesta. No se han reportado efectos adversos graves que obligasen a interrumpir el tratamiento con ustekinumab.
ConclusiónUstekinumab es efectivo y seguro en la práctica clínica real para lograr la inducción y el mantenimiento de la respuesta en pacientes con EC refractaria. El tabaco y la edad han mostrado ser predictores de mala respuesta, mientras que la indicación por efecto adverso a biológico previo y por pérdida de respuesta secundaria han mostrado ser predictores de buena respuesta.
Ustekinumab, a monoclonal antibody that blocks interleukins 12/23, has proven in clinical trials its efficacy in inducing and maintaining clinical remission of Crohn's disease (CD). Its effectiveness and safety in actual clinical practice is less known and may differ from trials.
ObjectiveTo evaluate its effectiveness and safety in clinical practice (intravenous induction pattern essentially), such as induction and over the long term, in patients with CD refractory to biological treatment.
Material and methodsMulticentre retrospective analysis (6 hospitals in Aragón), which includes all patients (N=69) with CD undergoing treatment with ustekinumab (either with intravenous or subcutaneous induction), who had at least 16 weeks of follow-up. The clinical response or remission has been evaluated at weeks 16, 24, 32 and 48 using the Harvey-Bradshaw index.
ResultsA total of 69 patients have been included, mean age 42 years, 54% men. A percentage of 89.86 (95% CI [0.805, 0.949]) of the patients presented clinical improvement at week 16 (15.95% remission, 73.92% response). In the subsequent follow-up, this response has been maintained. Age (OR 0.95, P=.028) and smoking habits (OR 0.19, P=.027) have been identified by an ordinal regression model as predictors of poor treatment response while the need for biological change due to adverse effect (OR 96, P=.00017) and due to loss of secondary response (OR 7.07, P=.034) have been predictors of good response. No serious adverse effects have been reported that forced them to stop taking ustekinumab.
ConclusionUstekinumab is effective and safe in real clinical practice to achieve induction and maintenance of the response in patients with refractory CD. Tobacco and age have been shown to be predictors of poor response, while the indication for adverse effect to previous biological and for loss of secondary response has been shown to be predictors of good response.
La enfermedad de Crohn (EC) forma parte de las enfermedades inflamatorias intestinales. Este grupo de dolencias, la EC, la colitis ulcerosa y la colitis indeterminada, se caracteriza por su cronicidad y su curso en forma de brotes. Su etiología es desconocida, probablemente multifactorial, e implica factores genéticos, ambientales, relacionados con la microbiota, etc.1–3.
Dentro del arsenal terapéutico disponible para la EC disponemos de múltiples tratamientos: corticoides orales de acción tópica; corticoides sistémicos; inmunomoduladores como azatioprina, mercaptopurina y metotrexato; y fármacos biológicos, donde encontramos los fármacos anti-TNF (infliximab, adalimumab) y, más recientemente, vedolizumab y ustekinumab4.
Además del tratamiento médico, en ocasiones puede ser necesario recurrir a la cirugía. No cura la EC, pero puede ser necesaria tanto para tratar complicaciones como ante la refractariedad al tratamiento médico. También en la enfermedad perianal.
Ustekinumab ha sido uno de los últimos fármacos en estar disponible para el tratamiento de los pacientes con EC (en España, desde julio de 2017). Se trata de un anticuerpo IgG1 monoclonal completamente humano que se une a la subunidad p40, que se encuentra en las citocinas IL-12 e IL-235. Ustekinumab está indicado en pacientes con EC luminal activa, en brote grave o moderado refractario a tratamiento convencional o anti-TNF. La eficacia y seguridad de este fármaco se demostró en los estudios UNITI6.
Los estudios en práctica real son escasos, siguiendo en muchos casos pautas de administración muy variables (generalmente a criterio clínico), usadas antes de la aprobación del fármaco por las agencias reguladoras. Muchos de estos estudios se llevaron a cabo con inducción subcutánea, tal y como se realizaba antes de aprobarse en ficha técnica la inducción intravenosa. Ahora dicha inducción se lleva a cabo mediante una dosis intravenosa ajustada al peso del paciente y posteriormente el tratamiento de mantenimiento se realiza por vía subcutánea, cada 8 o 12 semanas. No obstante, a pesar de las limitaciones, estos estudios parecen confirmar que ustekinumab tiene una alta efectividad en la práctica clínica real7–17.
En cuanto a su seguridad, ustekinumab presentó un muy buen perfil en los ensayos clínicos de aprobación en EC, así como en los 3 grandes estudios realizados en la psoriasis18. A largo plazo, el estudio PSOLAR no demostró un mayor riesgo de infecciones en los pacientes tratados con ustekinumab19. No obstante, los pacientes con EC suelen tener otras causas de inmunosupresión y las dosis en las enfermedades inflamatorias intestinales son mayores que las utilizadas en la psoriasis, por lo que estos datos deben tomarse con cautela.
Nuestro trabajo propone ampliar el conocimiento que tenemos actualmente acerca de la efectividad del tratamiento con ustekinumab en pacientes con EC refractaria a tratamientos biológicos, puesto que existen pocos estudios que evalúen el efecto de ustekinumab desde que se utiliza la inducción intravenosa. Esto nos permitiría analizar también la seguridad del fármaco, así como evaluar la respuesta a más largo plazo, no solo en el periodo de inducción.
El objetivo principal de este estudio es evaluar su eficacia clínica en la inducción: proporción de pacientes que alcanzan respuesta o remisión clínica a la semana 16 de tratamiento. Otros objetivos han sido evaluar la respuesta a largo plazo (semanas 24, 32 y 48), la respuesta y remisión libre de corticoides y la seguridad del fármaco. También se han examinado posibles factores asociados a la respuesta clínica.
Material y métodosSe trata de un estudio observacional, no intervencionista, retrospectivo y multicéntrico, que incluye a los pacientes con EC tratados con ustekinumab en los hospitales aragoneses en los que se realiza seguimiento en consultas de Aparato Digestivo monográficas de enfermedades inflamatorias intestinales. Se han recogido los datos de pacientes provenientes de un total de 6 hospitales aragoneses.
La muestra se compone de todos los pacientes con EC diagnosticados según los criterios habituales2, que han iniciado tratamiento con ustekinumab según práctica clínica de acuerdo con el criterio del facultativo responsable, ya sea con inducción subcutánea o intravenosa, y que hayan cumplido al menos 16 semanas de seguimiento. La inducción intravenosa se ha realizado según ficha técnica, en dosis de 6mg/kg. Todos los pacientes debían estar con enfermedad activa, definida como un índice de Harvey-Bradshaw superior a 4, en el momento de iniciar ustekinumab.
La respuesta clínica se ha valorado a las 16, 24, 32 y 48 semanas, mediante el índice de Harvey-Bradshaw. Se ha definido remisión como un índice de Harvey-Bradshaw inferior o igual a 4 puntos y respuesta como un descenso de al menos 3 puntos en dicho índice sin alcanzar la remisión. La respuesta o la remisión libre de corticoides se ha definido de acuerdo con estos mismo criterios con la retirada completa de los corticoides sistémicos.
Recopilamos a partir de la historia clínica los datos demográficos y sobre la enfermedad inflamatoria, así como el tratamiento previo y los motivos de retirada de los tratamientos biológicos anteriores (fallo primario, efectos adversos, fallo secundario), de acuerdo con las definiciones establecidas20.
El análisis estadístico se ha realizado mediante el paquete estadístico R. El análisis descriptivo se ha llevado a cabo expresando las variables continuas mediante mediana y rango intercuartílico y las variables categóricas mediante su frecuencia absoluta (N) y porcentaje. El análisis inferencial se ha realizado mediante un modelo de regresión logística ordinal (No respuesta-Respuesta clínica-Remisión clínica).
ResultadosCaracterísticas basales de los pacientesSe han recogido datos de un total de 69 pacientes tratados con ustekinumab. Las características demográficas y clínicas de la muestra se resumen en la tabla 1.
Características de la cohorte
| Característica | N=69 |
|---|---|
| Sexo: hombre/mujer | 37 (54)/32 (46) |
| Edad (años) | 42 (32, 57) |
| Evolución de la enfermedad (años) | 9 (6, 14) |
| Fumadores | |
| No fumadores | 46 (66) |
| Exfumadores | 6 (9) |
| Fumadores activos | 17 (25) |
| Localización | |
| Ileal | 39 (57) |
| Cólica | 11 (16) |
| Ileocólica | 18 (26) |
| Tracto digestivo superior | 1 (1) |
| Enfermedad perianal | 27 (40) |
| Fenotipo | |
| Inflamatorio | 48 (70) |
| Estenosante | 12 (17) |
| Fistulizante | 9 (13) |
| Índice de Harvey-Bradshaw basal | 9 (7,10) |
| PCR basal | 2,19 (0,55, 7,17) |
| Calprotectina basal | 324 (141, 609) |
| Manifestaciones extraintestinales | 31 (45) |
| Antecedentes de resección quirúrgica: sí | 35 (51) |
| Medicación concomitante | |
| Corticoides sistémicos | 20 (29) |
| Inmunosupresores | 15 (22) |
| Biológicos previos | |
| 1 | 26 (38) |
| 2 | 25 (36) |
| ≥3 | 18 (26) |
| Tratamiento previo con vedolizumab | 12 (17) |
| Motivo suspensión fármaco previo | |
| Fallo primario | 12 (17) |
| Fallo secundario | 44 (64) |
| Efecto adverso | 13 (19) |
| Intensificación biológico previo: sí/no | 34 (49)/12 (17) |
| Inducción iv: sí | 57 (83) |
| Tiempo en tratamiento con ustekinumab (semanas) | 32 (20, 56) |
| Ustekinumab intensificado (cada 4 semanas): sí | 10 (14) |
Los datos están expresados en mediana (rango intercuartílico) o n (%).
Hombres y mujeres presentan una distribución similar, y la cohorte se caracteriza por un largo tiempo de evolución de la EC (mediana de 9 años), con una enfermedad compleja. Esto se refleja en el alto porcentaje de pacientes con antecedentes de resección quirúrgica (51%), enfermedad perianal (40%) y manifestaciones extraintestinales (45%). Todos los pacientes provenían de un fracaso a biológico previo, habiendo fracasado un 25% de ellos en al menos 3 biológicos (anti-TNF y/o vedolizumab).
En 20 casos (29%) los pacientes seguían tratamiento con corticoides concomitantemente y 15 pacientes (22%) tomaban un inmunomodulador al iniciar ustekinumab.
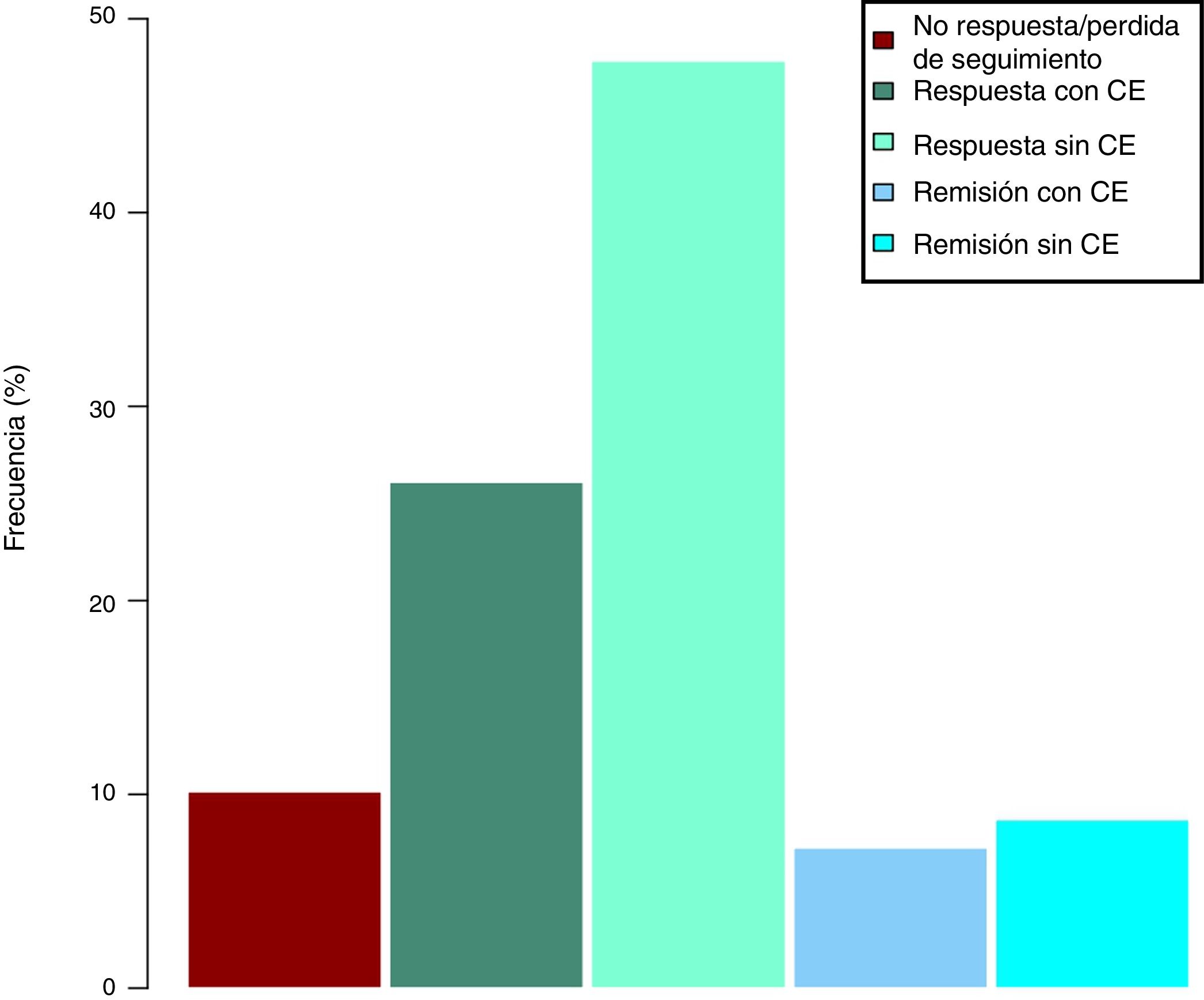
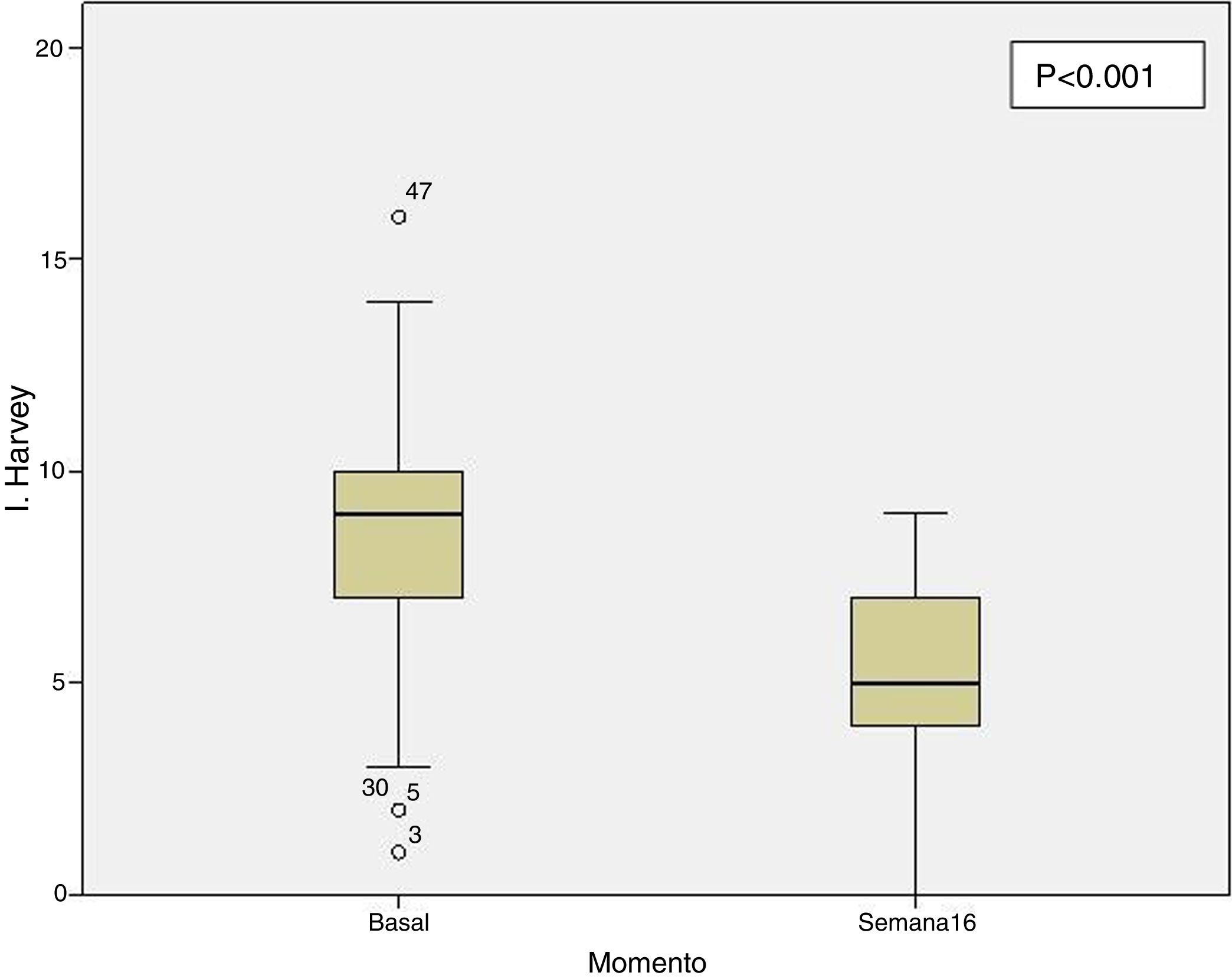
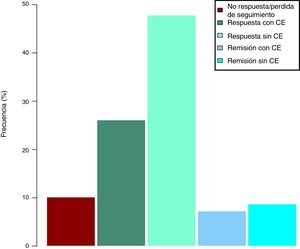
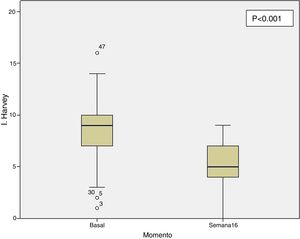
Efectividad clínica en la semana 16Todos los pacientes presentaban en el momento de iniciar el tratamiento con ustekinumab actividad clínica de acuerdo con las definiciones previamente expresadas. De los 69 pacientes estudiados, 62 (89,86% [IC 95% 0,805-0,949]) presentaron algún tipo de respuesta clínica, ya fuese remisión o respuesta parcial, a la semana 16. En función del uso o no de corticoides, 33 pacientes (48%) presentaron respuesta libre de CE, 18 (26%) respuesta con CE, 6 (9%) remisión sin CE y 5 (7%) remisión con CE. Estos resultados pueden verse resumidos en la figura 1. El índice de Harvey-Bradshaw ha presentado un descenso estadísticamente significativo (p<0,001) entre el momento basal y la semana 16, como puede verse en la figura 2. La PCR y la calprotectina no han alcanzado la significación estadística (p=0,323 y p=0,191, respectivamente).
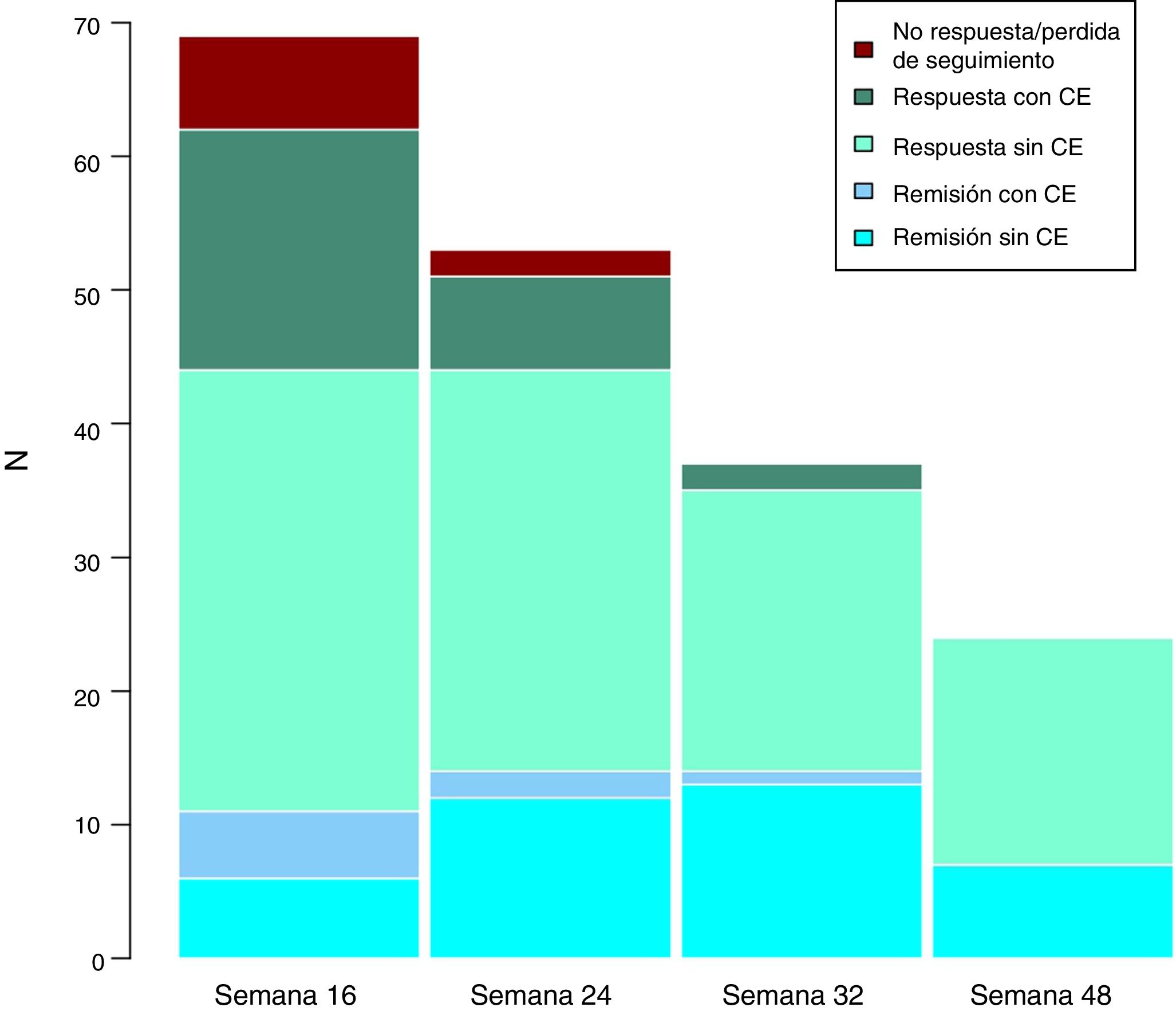
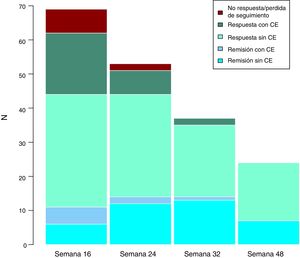
Efectividad clínica a largo plazoLa mediana de seguimiento de los pacientes es de 32 (rango intercuartílico 20,56) semanas. Se evaluó a los pacientes en las semanas 24, 32 y 48. A lo largo del seguimiento, ningún paciente ha presentado fallo secundario a ustekinumab. Estos resultados se exponen en la figura 3.
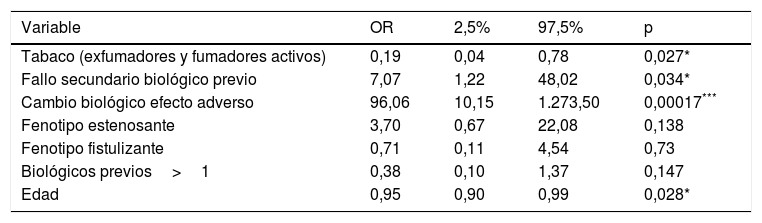
Factores predictores de respuesta en inducciónLa edad avanzada y el hábito tabáquico se han relacionado con la ausencia de respuesta en la semana 16. Por el contrario, el inicio de ustekinumab debido a efecto adverso o fallo secundario al biológico previo se ha asociado a una mejor respuesta. Sin embargo, el uso concomitante de corticoides o inmunomoduladores, el patrón de la enfermedad, el número de biológicos previos, el uso previo de vedolizumab, la vía de inducción o el tiempo de evolución de la enfermedad no han obtenido significación estadística. El ajuste del modelo de regresión ordinal puede verse en la tabla 2.
Factores predictores de respuesta en inducción
| Variable | OR | 2,5% | 97,5% | p |
|---|---|---|---|---|
| Tabaco (exfumadores y fumadores activos) | 0,19 | 0,04 | 0,78 | 0,027* |
| Fallo secundario biológico previo | 7,07 | 1,22 | 48,02 | 0,034* |
| Cambio biológico efecto adverso | 96,06 | 10,15 | 1.273,50 | 0,00017*** |
| Fenotipo estenosante | 3,70 | 0,67 | 22,08 | 0,138 |
| Fenotipo fistulizante | 0,71 | 0,11 | 4,54 | 0,73 |
| Biológicos previos>1 | 0,38 | 0,10 | 1,37 | 0,147 |
| Edad | 0,95 | 0,90 | 0,99 | 0,028* |
p: valores del test de nulidad individual en modelo de regresión logística ordinal.
No se ha notificado ningún efecto adverso en nuestra cohorte que haya provocado una interrupción del tratamiento. Sí que se han reportado efectos adversos menores, consistentes en 2 casos de prurito, un caso de artralgias y otro caso de somnolencia. Un paciente precisó intervención quirúrgica tras el inicio de ustekinumab y otro presentó un empeoramiento de su afección perianal.
DiscusiónExisten pocos estudios acerca de la efectividad en la práctica clínica real de ustekinumab, siendo la mayoría de ellos con inducción subcutánea. En nuestro estudio, si bien no todos los pacientes iniciaron el tratamiento con inducción intravenosa, sí lo hicieron la mayoría (83%). Ustekinumab ha demostrado ser efectivo en pacientes con EC de larga evolución y refractaria a múltiples tratamientos (el 62% habían recibido 2 o más biológicos previos) y todos los pacientes habían fracasado al menos a un biológico previamente. A pesar de ello, el 89,86% (IC 95% [0,80-0,94]) de los pacientes ha presentado respuesta clínica a la semana 16.
Esta respuesta ha sido considerablemente superior a la observada en los ensayos de autorización del fármaco UNITI-1 y UNITI-2, donde la respuesta observada se evaluó a la semana 8, y fue de 20,9 y 40,2%, respectivamente, como ya se había visto en trabajos previos.
En cuanto al estudio de Iborra et al.21, el 58% de los pacientes alcanzaron respuesta clínica en la semana 14, cifras similares a las de Ma et al.13, donde la respuesta fue del 58% igualmente, aunque la inducción en esta cohorte fue subcutánea en el 89% de los casos.
Los estudios en práctica clínica real que evalúan la respuesta más allá del periodo de inducción (evaluado a las 12, 14 o 16 semanas en función del trabajo) son aún más limitados. Nuestros resultados, a pesar del limitado tamaño muestral, indican una muy buena efectividad a medio-largo plazo. No se ha producido ninguna pérdida de respuesta secundaria, y observamos una tendencia a la remisión y a poder prescindir del tratamiento con corticoesteroides.
En cuanto a los factores predictores de respuesta, si bien han sido ampliamente estudiados en el caso de los fármacos anti-TNF, son menos conocidos en las nuevas moléculas. Existen 2 trabajos recientes que aportan información al respecto, en pacientes tratados con ustekinumab. Por un lado, una revisión realizada por Barré et al.22, y por otro, el trabajo antes citado de Iborra et al.21. En estos trabajos se han planteado como factores asociados a la respuesta el tratamiento con inmunomoduladores, la gravedad de la enfermedad, el número de tratamientos biológicos previos, la gravedad de la actividad valorada por endoscopia, los patrones agresivos (estenosante y fiulizante) y la localización de la enfermedad.
En nuestro trabajo hemos evaluado varios factores que pueden condicionar la respuesta al tratamiento, realizando un análisis no solo para predecirla, sino para predecir la mayor probabilidad de remisión frente a respuesta y de respuesta frente a no respuesta. Hemos encontrado significación estadística en el motivo de indicación, en la edad del paciente y el hábito tabáquico, mientras que no la hemos hallado en otros factores indicados en estudios previos, como el número de anti-TNF previos o el fenotipo de la enfermedad.
En cuanto al motivo de la indicación, tanto la indicación por efecto adverso a biológico previo como por pérdida secundaria de respuesta han obtenido significación estadística, lo cual es congruente con la literatura. Esto deja la indicación por fallo primario de biológico previo como la indicación con mayor probabilidad de fracaso en la inducción con ustekinumab.
Por otra parte, hemos encontrado una correlación negativa en el hábito tabáquico, para fumadores activos y exfumadores respecto a aquellos pacientes no fumadores, y para la edad. Ambos factores han mostrado significación estadística prediciendo una peor respuesta al fármaco.
En cuanto a los factores previamente descritos para los cuales no hemos encontrado significación en nuestro modelo, esto puede deberse a varios motivos. Por un lado, nuestro tamaño muestral, más reducido que en otras series, limita nuestra potencia estadística. En cuanto al número de tratamientos biológicos previos, especialmente anti-TNF, descrito en el trabajo de Iborra et al., se encontró significación sobre todo dado que los pacientes naïve a biológicos presentaron una respuesta significativamente superior respecto a aquellos que sí habían recibido tratamiento con biológicos. En nuestra cohorte, todos los pacientes habían recibido previamente tratamiento con biológicos, lo que ha impedido que pudiésemos ver dichas diferencias.
LimitacionesNuestro trabajo es retrospectivo, con las limitaciones que ello conlleva. No se dispone de la PCR ni la calprotectina de todos los pacientes. El tamaño muestral del seguimiento, sobre todo en la semana 48, es limitado.
ConclusionesNuestros datos muestran la efectividad y seguridad de ustekinumab en la práctica clínica real, incluso en pacientes altamente complejos y refractarios a numerosas terapias previas. Nuestros resultados evidencian que la efectividad en la inducción con ustekinumab es mayor en pacientes con indicación de cambio de biológico por efecto adverso o por pérdida de respuesta secundaria, mientras que es menor en los pacientes fumadores o exfumadores y en aquellos de mayor edad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.