La ultrasonografía endoscópica (USE) es una herramienta fundamental en el estudio de la enfermedad pancreática, siendo considerada el métodos de elección en la evaluación de la pancreatitis crónica (PC) y del cáncer de páncreas (CP). Sin embargo la USE presenta ciertas limitaciones, sobre todo en la evaluación de pacientes con tumores sólidos (diagnóstico diferencial entre masas inflamatorias y CP), y la variabilidad que existe a la hora de definir los criterios diagnósticos de la PC. La elastografía guiada por USE emerge como una técnica de gran utilidad. Ha mostrado gran rentabilidad en el diagnóstico diferencial de los tumores sólidos, incluida la diferenciación entre el CP y las masas inflamatorias en el contexto de la PC (campo especialmente complejo para todas las pruebas diagnósticas disponibles). También se muestra útil en el diagnóstico de la PC, pudiendo incluso clasificar a los pacientes en función de la severidad de la misma.
Endoscopic ultrasound (EUS) has become an essential tool in the evaluation of pancreatic disease and can be considered the technique of choice for the diagnosis and staging of chronic pancreatitis (CP) and pancreatic cancer (PC). However, EUS has certain limitations, especially in the evaluation of patients with solid pancreatic masses (in the differential diagnosis of CP and PC). Furthermore there is variability in the EUS diagnostic criteria for CP. EUS-guided elastography is emerging as a highly useful tool in this setting. This modality has shown high diagnostic accuracy in the differential diagnosis of solid pancreatic masses, including differentiation between CP and PC. EUS-guided elastography has also been found to be useful in the diagnosis of CP, and can even classify patients according to the severity of their disease.
La ultrasonografía endoscópica (USE) se ha convertido en una herramienta fundamental en el estudio de la enfermedad pancreática, siendo considerada como uno de los métodos de elección en el diagnóstico y estadiaficación, tanto de la pancreatitis crónica (PC) como del cáncer de páncreas (CP)1–3. Además, la USE también permite la realización de biopsias dirigidas de los tumores pancreáticos, mostrando una elevada eficacia para el diagnóstico citológico e histológico4,5.
Pese a los grandes avances que ha supuesto la USE en la valoración de las enfermedades pancreáticas, todavía existen puntos especialmente complejos. La diferenciación entre una masa inflamatoria en el contexto de una PC y el CP continúa siendo un verdadero reto. En este contexto, la eficacia tanto de la USE como de la punción guiada por USE es algo menor6–8, por lo que este diagnóstico diferencial continúa siendo un reto. Por otra parte, el propio diagnóstico de la PC sigue presentado controversia. A pesar de que la USE se considera como la técnica más sensible para el diagnóstico de la PC, pudiendo detectar alteraciones en estadios muy iniciales de la enfermedad, todavía existe una falta de homogeneidad a la hora de definir los criterios ecoendoscópicos de la PC y cuando realmente se puede establecer el diagnóstico de la enfermedad en función a dichos criterios9–16. Varios estudios han mostrado que existe una importante variabilidad interobservador en la determinación de los criterios17. Recientemente se ha desarrollado la Clasificación de Rosemont, surgida de una reunión de un grupo de expertos, en que la que se trataron de definir claramente los diferentes criterios y su validez, estableciendo también diferentes grupos de pacientes en función de los criterios definidos18. Sin embargo, esta nueva clasificación tampoco ha terminado de asentarse en la práctica clínica, al no haber conseguido mejorar de forma significativa la variabilidad interobservador19. Por todo ello, continúa siendo necesario disponer de herramientas diagnósticas que ayuden a optimizar el diagnóstico y manejo de la PC.
Una de las herramientas de las que disponemos en la actualidad para intentar mejorar el diagnóstico de la PC es la elastografía guiada por USE. La elastografía es un método que permite evaluar en tiempo real la dureza o elasticidad de los tejidos, desarrollándose inicialmente en la valoración de órganos superficiales, como la mama20–23. Las imágenes obtenidas mediante el estudio elastográfico pueden ser consideradas como una aproximación a las características histológicas de los diferentes tejidos analizados24. Esta nueva tecnología está suponiendo un avance significativo en el manejo de la enfermedad pancreática, tanto en el diagnóstico de la pancreatitis crónica como en el diagnóstico diferencial de los tumores pancreáticos, donde se ha mostrado realmente eficaz25–32.
Elastografía guiada por ultrasonografía endoscópicaLa elastografía (desarrollada por Hitachi® Medical Systems Europe, Zug, Suiza) permite estimar la dureza de los tejidos empleando los equipos de ecografía convencionales, mediante la adicción de un programa informático específico. Se basa en la detección de pequeñas deformidades estructurales obtenidas en la imagen basal del modo B que se producen por la compresión del transductor. La clave es que la tensión originada es menor en el tejido duro con respecto al blando23. El grado de deformidad se emplea como un indicador de la dureza del tejido24,33. Los diferentes valores de dureza o elasticidad se representan con diferentes colores, que se corresponden con diferentes patrones de elasticidad. El sistema está programado para emplear un mapa de colores (rojo-verde-azul), donde las zonas de tejido más duro se muestran en color azul, las de tejido de dureza intermedia en color magenta, las intermedias en color amarillo y las más blandas en color rojo34. Durante la realización de la USE, en la pantalla se aprecia una doble imagen, en el lado derecho se identifica la imagen básica en modo B (escala de grises), mientras que en el lado izquierdo se aprecia la imagen obtenida mediante el estudio elastográfico. La elección de la región de estudio se realiza de forma manual, teniendo en cuenta que se debe incluir para el análisis tejido adyacente normal, que servirá como zona de control. Algunos procesos patológicos, como los tumores malignos, con frecuencia inducen cambios en las propiedades mecánicas de los tejidos. La elasticidad de los distintos tejidos suele ser uniforme en lesiones benignas; sin embargo, los tumores malignos suelen crecer de forma desorganizada, presentando una elasticidad heterogénea a lo largo del tumor35.
En la actualidad es posible realizar una valoración cuantitativa del grado de elasticidad, con lo que se evitan los posibles sesgos de una interpretación cualitativa de los colores obtenidos mediante el estudio convencional. Uno de ellos se basa en la realización de una transformación numérica, mediante el análisis del histograma de colores de la región seleccionada para el estudio, que inicialmente se basó en el programa informático Image J, desarrollado por el Instituto Nacional de Salud, Bethesda, Maryland36, y que en la actualidad ya se encuentra incluido en el ecógrafo Hitachi®. El otro, denominada elastografía de segunda generación, ha sido desarrollado por Hitachi®, y se basa en la determinación de un coeficiente de elasticidad entre 2 áreas seleccionadas dentro de la región de estudio, una de ellas la propia lesión o área a estudio, y la otra una zona de referencia, habitualmente de tejido blando normal. Con esto se obtienen 3 valores, uno por cada zona y otro final, cuyo cociente determina el coeficiente de elasticidad fina, resultado del estudio37,38.
Elastografía guiada por ultrasonografía endoscópica en la valoración de las masas inflamatoriasVarios estudios publicados han valorado la eficacia del diagnóstico de la elastografía guiada por USE en el diagnóstico diferencial de los tumores sólidos de páncreas, tanto mediante la elastografía basal o cualitativa como con elastografía cuantitativa. Sin embargo, no en todos ellos se ha valorado de forma concreta, y con un adecuado número de pacientes, su verdadera utilidad en la diferenciación de las masas inflamatorias en contexto de PC y los tumores malignos de páncreas.
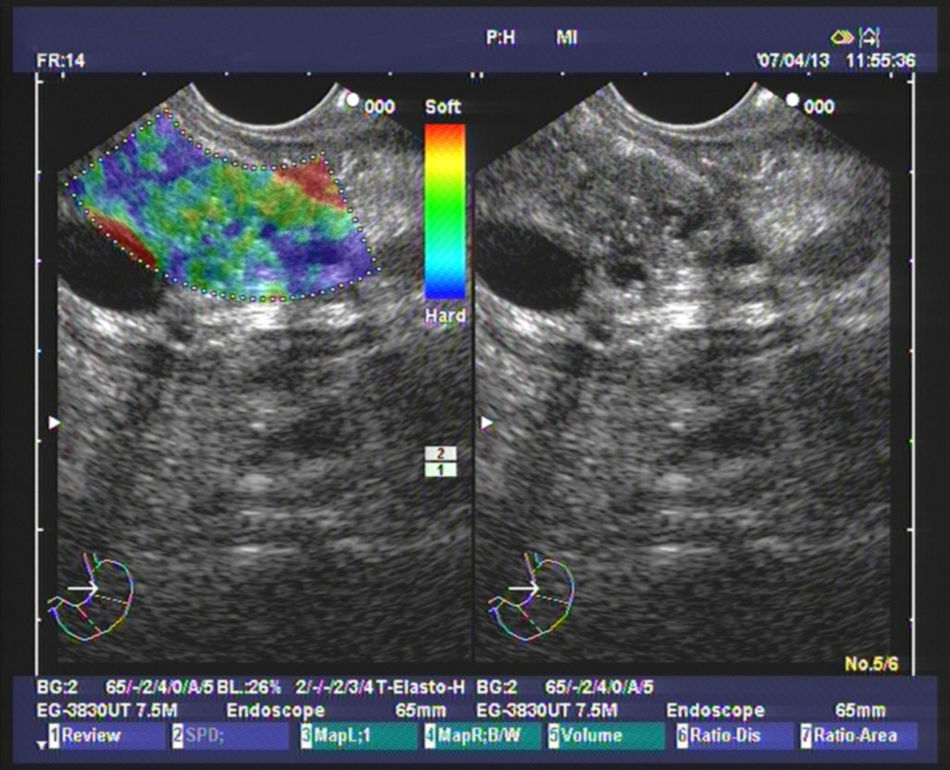
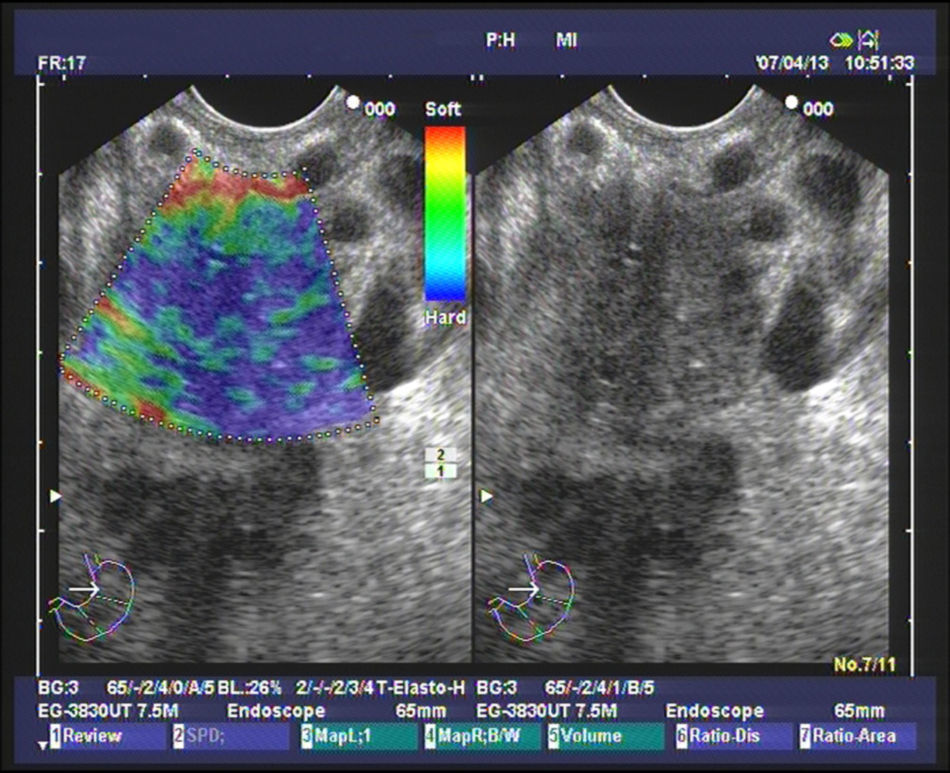
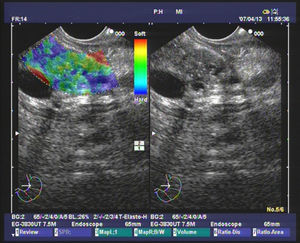
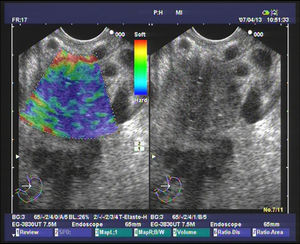
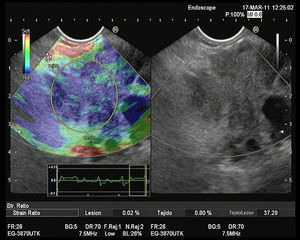
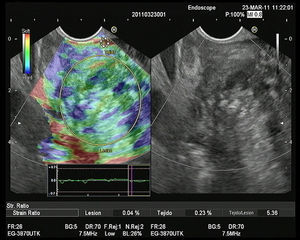
Elastografía cualitativa guiada por ultrasonografía endoscópicaVarios estudios evaluando la elastografía cualitativa han incluido un número significativo de masas inflamatorias en contexto de PC, que permiten evaluar la técnica en el manejo de este tipo de pacientes. El primer estudio fue publicado por Giovannini et al., en el que los autores obtuvieron mediante el análisis elastográfico una sensibilidad diagnóstica del 100% y una especificidad del 67% para la detección de malignidad. Pero lo importante es que propusieron la primera clasificación para diferenciar los tumores pancreáticos. La puntuación 1 correspondía al páncreas normal, con un patrón homogéneo sin distorsiones; la puntuación 2 se asoció a lesiones fibróticas/inflamatorias, con un patrón heterogéneo, pero en el rango de tejido blando y de dureza intermedia (verde, amarillo y rojo); la puntuación 3 se relacionó con adenocarcinomas en fases iniciales, presentándose como una distorsión en el borde de una lesión de predominio azul, mínimamente heterogénea; la puntuación 4 representa las lesiones hipervascularizadas básicamente los tumores endocrinos, con un patrón homogéneo azul; y finalmente la puntuación 5 se asoció con adenocarcinomas avanzados, con un patrón heterogéneo de predominio azul, incluyendo zonas verdes y rojas aisladas25. Recientemente se ha publicado un estudio multicéntrico basado en esta clasificación, en el que la elastografía mostró una diagnóstica del 92,3%, una especificidad del 80% y una eficacia global del 89,2% superior a la encontrada en el modo B (92,3, 68,9 y 71,9%, respectivamente), para la detección de malignidad. Para facilitar el análisis, los autores determinaron como malignos las puntuaciones 3, 4 y 5, y como benignos el 1 y 2. Lo importante a destacar en este estudio es que se incluyeron para el análisis un total de 121 tumores pancreáticos, de los cuales 28 fueron masas inflamatorias en el contexto de una PC, mostrando la elastografía una elevada eficacia en la diferenciación con los tumores pancreáticos malignos26. Nuestro grupo ha realizado un estudio sobre 130 pacientes con tumores pancreáticos (42 de los cuales fueron masas inflamatorias en contexto de PC) y 20 controles sanos. Nosotros definimos 4 patrones elastográficos: uno homogéneo verde, presente solo en controles sanos; otro heterogéneo de predominio verde (fig. 1), presente en 33 masas inflamatorias y en ningún caso en tumores malignos; un tercero heterogéneo de predominio azul, con distribución geográfica irregular (fig. 2), presente en 78 tumores malignos pancreáticos y en 9 masas inflamatorias (todas ellas en casos de PC calcificante, en estadios avanzados); y finalmente un patrón homogéneo azul, asociado solo a los 10 casos de tumores neuroendocrinos. Con estos hallazgos, la elastografía guiada por USE presentó una sensibilidad para la detección de malignidad del 100%, una especificidad del 85,5%, con una eficacia global del 94%. Pero quizá, uno de los puntos clave, en el contexto de la PC, es que la presencia un patrón heterogéneo de predominio verde excluye la probabilidad de un tumor maligno, y que solo un pequeño porcentaje de pacientes con masas inflamatorias en el contexto de una PC presentan un patrón heterogéneo de predominio azul, en concreto un 10,3%27.
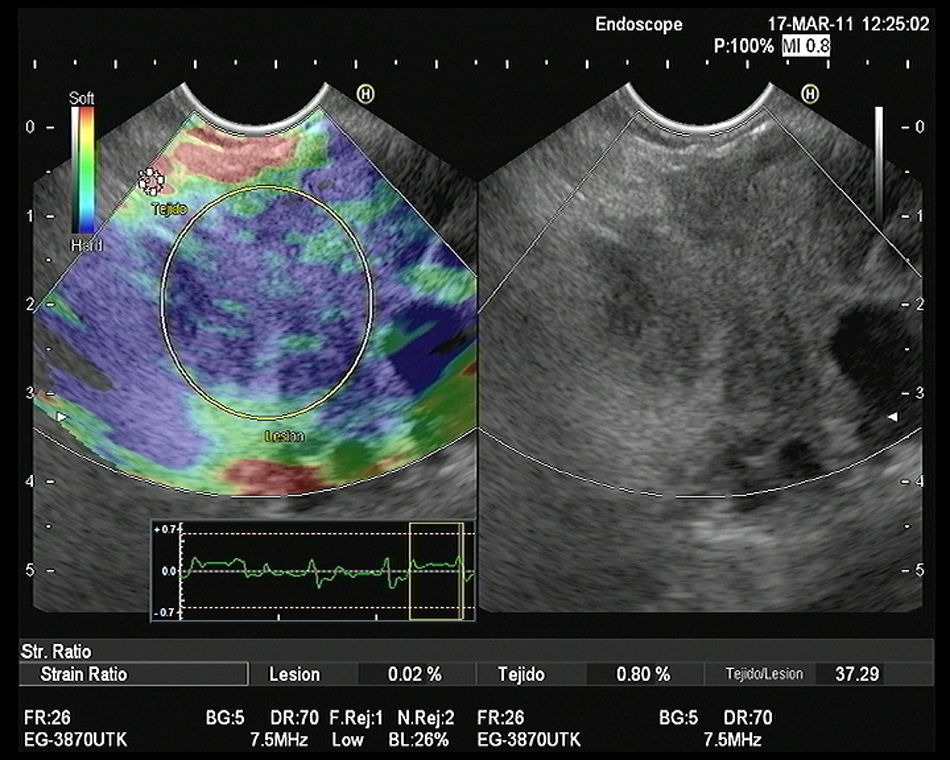
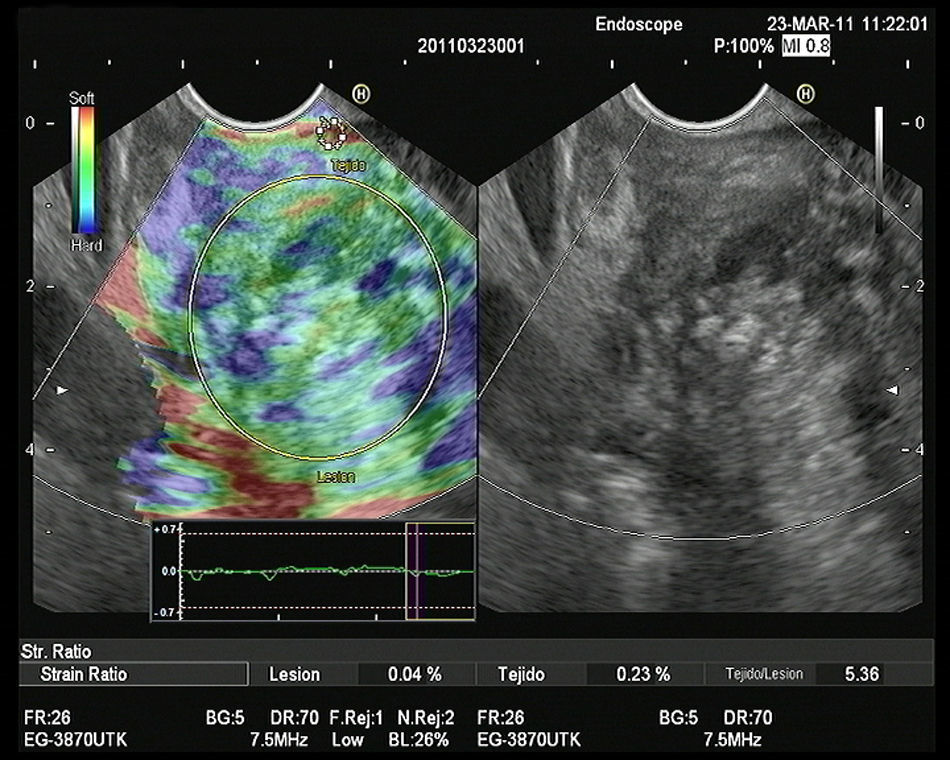
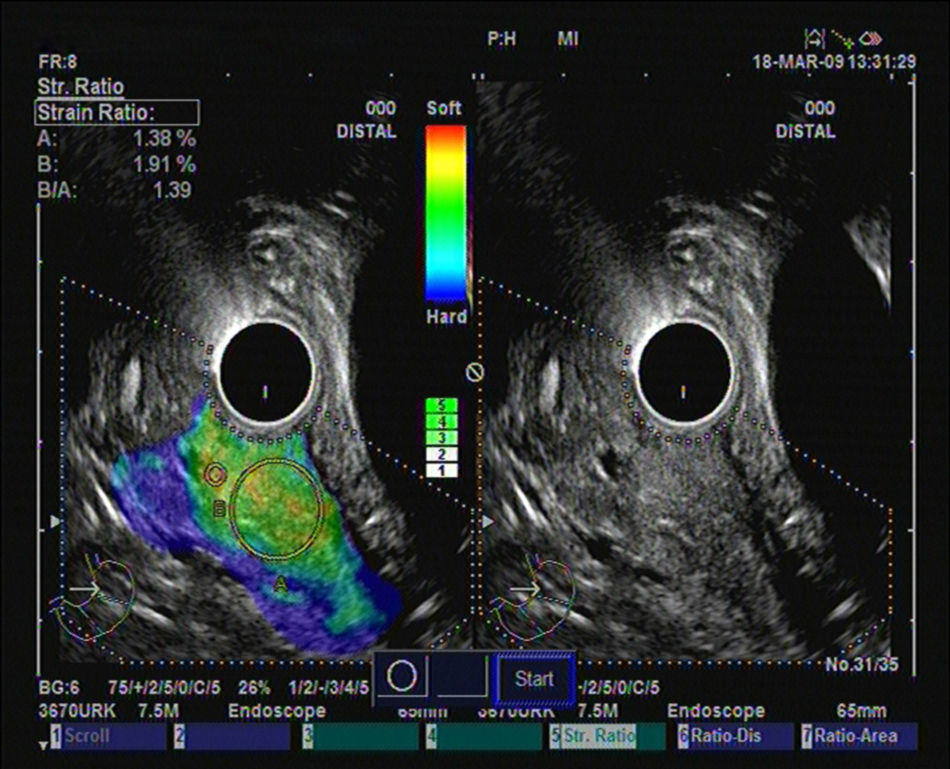
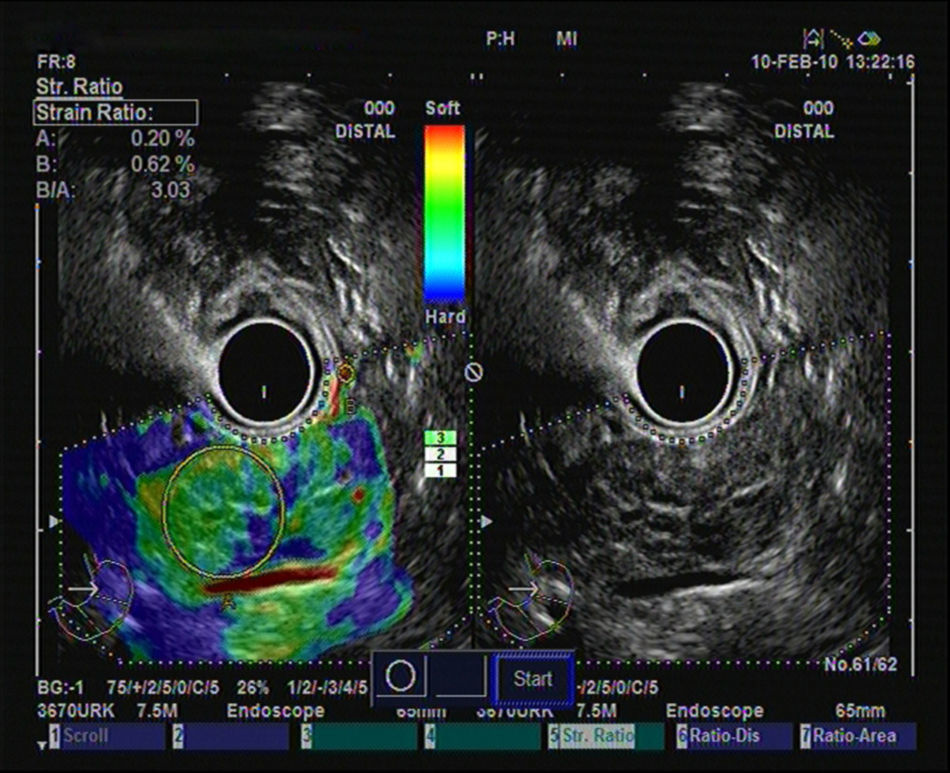
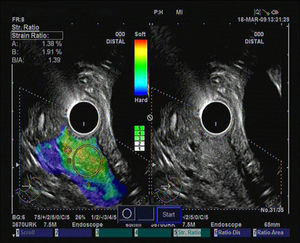
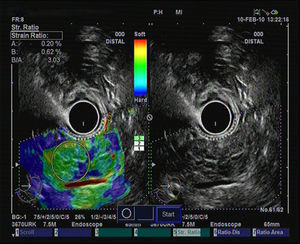
Hasta el momento se han publicado 3 artículos evaluando la elastografía cuantitativa en tumores sólidos de páncreas, y en todos ellos se ha hecho referencia a la diferenciación entre lesiones inflamatorias y tumores malignos. Saftoiu et al. realizaron el análisis mediante la evaluación de los histogramas de colores. Incluyeron 11 masas inflamatorias por PC y 35 tumores malignos (32 adenocarcinomas de páncreas). Con un punto de corte de 175 puntos encontraron para la determinación de malignidad una sensibilidad diagnóstica del 91,4%, una especificidad del 87,9%, con una eficacia global del 89,7%. Pero lo importante es que realizaron un subanálisis, analizando la utilidad de la técnica en el diferenciación entre PC y adenocarcinoma de páncreas, con una sensibilidad diagnóstica del 93,4%, una especificidad del 63,6% y una eficacia global del 86,1%30. Recientemente se han publicado un estudio multicéntrico que evaluó la eficacia de la elastografía guiada por USE con los histogramas de colores en el diagnóstico diferencial entre el adenocarcinoma de páncreas (211 casos) y masas inflamatorias en PC (47 casos). Empleando la misma metodología que en el estudio previo, y con un punto de corte de 175 puntos, la sensibilidad diagnóstica fue del 93,36%, la especificidad del 65,96%, y la eficacia global del 85,36%31. Nuestro grupo ha publicado su experiencia mediante la elastografía cuantitativa de segunda generación de Hitachi®, evaluando el coeficiente de elasticidad. Se incluyeron un total de 86 pacientes con tumores sólidos pancreáticos (49 adenocarcinomas de páncreas, 27 masas inflamatorias, 6 tumores neuroendocrinos, 2 tumores metastásicos, un linfoma pancreático y un tumor sólido seudopapilar). En nuestro análisis, el coeficiente de elasticidad fue significativamente superior en los tumores malignos (fig. 3) con respecto a las masas inflamatorias (fig. 4) en el contexto de la PC (normal 1,68, masa inflamatoria en PC 3,28, CP 18,12 y en tumores neuroendocrinos 52,34), con una sensibilidad diagnóstica del 100% y una especificidad del 92,9% (área bajo la curva ROC de 0,983), para un punto de corte de 6,04. Pero en este estudio también analizamos la eficacia para diferenciar específicamente entre CP y PC, y los resultados mostraron una sensibilidad del 100%, una especificidad del 96,3% y una eficacia global del 98,7%32.
Existen pocos datos hasta el momento sobre la utilidad real de la elastografía guiada por USE en el diagnóstico de la PC. En concreto el punto fundamental en el que parece que podría mostrar una especial utilidad es en el diagnóstico de la PC en sus fases iniciales, Únicamente el trabajo de Jansen muestra datos objetivos sobre el papel de la elastografía en este campo. En su trabajo, el subgrupo de pacientes con pancreatitis crónica presentaron unos patrones con coloración irregular, con áreas verdes, de dureza intermedia, con la presencia de bandas heterogéneas predominantemente duras (azules). Estos cambios eran claramente distintos a los que se pueden apreciar en el grupo control de pacientes sin enfermedad pancreática, los cuales presentaban un patrón homogéneo, de predominio verde y amarillo. Sin embargo, los autores no llegan a analizar de forma concreta la utilidad de la técnica28. En nuestra experiencia los patrones que se pueden observar en los páncreas normales son homogéneos de predominio verde, mientras que en aquellos pacientes con sospecha de pancreatitis crónica, el patrón es heterogéneo e irregular, con predomino verde, y zonas mixtas (amarillas y azules) asociadas. Pero un estudio realmente importante para evaluar la utilidad de la elastografía guiada por USE en el diagnóstico de la PC ha sido desarrollado por nuestro grupo. Se incluyeron un total de 178 pacientes, que fueron clasificados según la clasificación de Rosemont. Empleando la elastografía cuantitativa guiada por USE, el coeficiente de elasticidad fue significativamente diferente en los distintos grupos: 1,80 (IC 95%: 1,73-1,80) en páncreas normal; 2,40 (IC 95%: 2,21-2,56) en indeterminados para PC; 2,85 (IC 95%: 2,69-3,02) en indicativos de PC, y 3,62 (IC 95%: 3,24-3,99) en consistentes con PC (p<0,001) (figs. 5 y 6). También encontramos una excelente correlación entre el número total de criterios USE y el coeficiente de elasticidad (r=0,801; p<0,0001)39.
En el momento actual la USE es la prueba de elección para la valoración de la enfermedad pancreática, fundamentalmente en la evaluación diagnóstica y de estadificación de los tumores pancreáticos, así como en la valoración de pacientes con sospecha de PC. Sin embargo, sigue siendo crucial mejorar su eficacia. En este contexto la elastografía guiada por USE emerge como una técnica de gran utilidad. Ha mostrado una gran rentabilidad en el diagnóstico diferencial de los tumores sólidos de páncreas, e incluso en la diferenciación entre el CP y las masas inflamatorias en el contexto de la PC (campo especialmente complejo para todas las pruebas diagnósticas disponibles). Pero esta técnica también parece mostrarse útil en el diagnóstico de la PC, pudiendo incluso clasificar a los pacientes en función de la severidad de la misma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.