La inmunoterapia es una herramienta cada vez más utilizada en el campo de la oncología. Conviene conocerla debido a sus crecientes usos, entre los que se incluye el tratamiento de tumores del aparato digestivo (hepatocarcinoma1, adenocarcinoma colorrectal con alta inestabilidad en microsatelites2) así como por las reacciones adversas que con elevada frecuencia afectan al tubo digestivo.
Presentamos el caso de un varón de 74 años, con antecedentes personales de enfermedad pulmonar obstructiva crónica (EPOC) y melanoma con metástasis pulmonares. Debido a estas patologías tomaba de manera habitual inhaladores de salbutamol y había estado en tratamiento con nivolumab, suspendido hacía cuatro meses tras conseguir una respuesta radiológica completa de las metástasis pulmonares.
El paciente refería cuadro diarreico de un mes de evolución, consistente en tres a cuadro deposiciones (Bristol 5-6) sin productos patológicos, que afectaban el descanso nocturno, asociaban molestias centroabdominales intermitentes y pérdida de peso de unos 3-4 kg. No había ingerido alimentos crudos, antibióticos o nuevas medicaciones. Tampoco había convivientes con la misma sintomatología ni había realizado viajes al extranjero. Negaba cualquier otra sintomatología y antecedentes familiares de interés. La exploración física era anodina a excepción de unas ligeras molestias a la palpación profunda en mesogastrio.
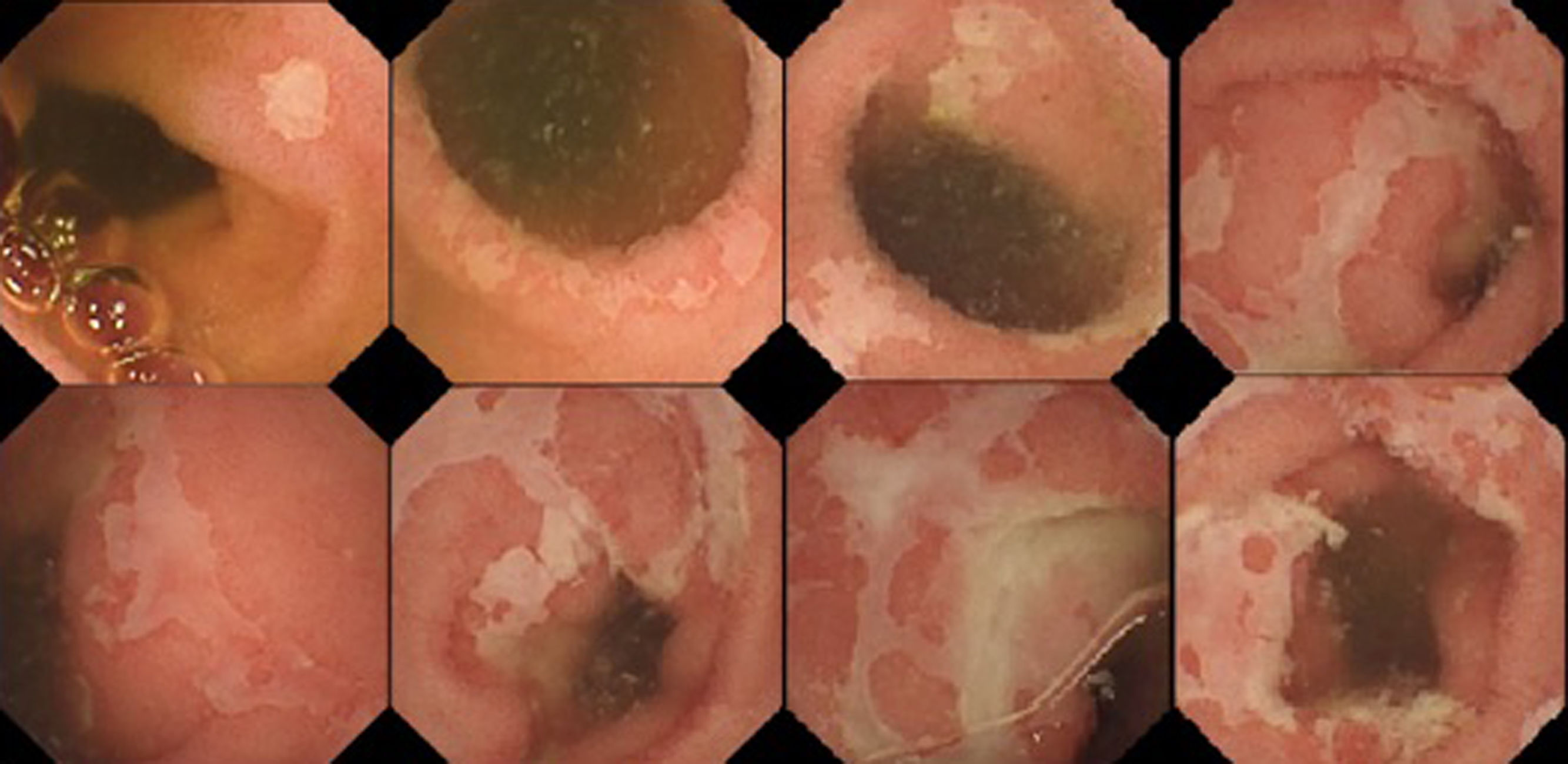
Inicialmente se solicitó una analítica sanguínea que únicamente mostraba un ligero aumento de reactantes de fase aguda (PCR 7,6 mg/dL, VSG 22 mm) y datos de malabsorción leve (proteínas totales 4,54 g/dL, albumina 2,31 g/dL y ferropenia). Los coprocultivos con toxina de Clostridium difficile fueron negativos. Además, como parte del seguimiento por Oncología, se había realizado una tomografía axial computarizada (TAC) tóraco-abdominal hacía dos meses en la que no se visualizaban las metástasis pulmonares y a nivel abdominal no se evidenciaban hallazgos patológicos. Posteriormente se amplió el estudio realizándose una ileocolonoscopia que resultó normal y se tomaron biopsias que descartaron colitis microscópica. Se solicitó serología de celiaquía y prueba de Mantoux que resultaron negativos, así como hormonas tiroideas que fueron normales. Tras cinco días de ingreso el paciente continuaba presentando el cuadro diarreico de manera más o menos fluctuante. Finalmente, obtuvimos el resultado de la calprotectina fecal: 3.351 μg/g que motivó la realización de una cápsula endoscópica (fig. 1) que mostró a partir de 1:31 h la presencia de úlceras de forma dispersa, inicialmente de tamaño pequeño, pero en tramos distales más extensas y de contornos geográficos, no se apreciaban áreas de estenosis significativa ni otros hallazgos patológicos. Con dichos hallazgos y con el antecedente de tratamiento con nivolumab relativamente reciente, a falta de toma de biopsias se diagnosticó al paciente de enteritis probablemente secundaria a nivolumab. Como parte del estudio de extensión se realizó una gastroscopia sin hallazgos patológicos. Se comenzó tratamiento con corticoides a 1 mg/kg/día, el paciente experimentó notable mejoría en los primeros días y pudo ser dado de alta con pauta descendente de corticoides. En la revisión ambulatoria a las seis semanas del alta el paciente seguía en tratamiento con 10 mg/día, se encontraba asintomático y presentaba normalidad analítica. Hoy en día persiste asintomático tras siete meses sin tratamiento corticoideo.
El nivolumab es un anticuerpo IgG4 dirigido contra PD1, una molécula encargada de inhibir la respuesta linfocitaria, al bloquearla se consigue estimular la respuesta inmune con el consecuente beneficio antitumoral, pero del mismo modo se pueden producir reacciones autoinmunes que varían en cuanto a frecuencia de unos estudios a otros, estimándose en alrededor del 20% de los pacientes, siendo la mayoría leves3. Lo más frecuente es que ocurran en las primeras semanas tras el inicio del tratamiento, aunque no es raro que aparezcan tras meses desde el cese de su administración, por lo que en todo paciente que haya sido sometido a dicho tratamiento hay que considerarlo en el diagnóstico diferencial4. Por orden de frecuencia se encuentra la diarrea, la colitis y menos frecuentemente la enteritis. Sin embargo, cualquier órgano puede afectarse por mecanismo autoinmune, pudiendo producir hepatitis, pancreatitis, mucositis5. El tratamiento depende de la gravedad del efecto adverso y se basa en valorar la discontinuación del fármaco, así como la asociación de un inmunosupresor, siendo los corticoides la primera línea de tratamiento, porque la mayoría responden rápidamente. Por su efectividad y uso creciente, es seguro que en un futuro cercano deberemos enfrentarnos a sus efectos adversos, por lo que es importante conocer su existencia y realizar estudios clínicos para mejorar su manejo práctico.