La enfermedad celíaca (EC) se ha asociado con hígado graso no alcohólico (HGNA) y hepatopatías crónicas, como cirrosis biliar primaria (CBP), hepatitis autoinmune (HAI) y colangitis esclerosante primaria (CEP).
ObjetivoEstudiar la frecuencia de marcadores serólogicos de EC en pacientes con las hepatopatías mencionadas y su correlación con la biopsia duodenal.
Pacientes y métodosEn pacientes con HGNA, CBP, HAI y CEP, se estudiaron los anticuerpos IgA antiendomisio (AE) por inmunofluorescencia indirecta, IgA-IgG antigliadina (AG) y anticuerpos antitransglutaminasa tisular humano (h-ATG) mediante ELISA. En los casos positivos para al menos un marcador, se realizó una biopsia duodenal.
ResultadosNueve de 101 pacientes tuvieron marcadores positivos de EC (8,9%): 7 de ellos sólo h-ATG, uno con AE y AG, y uno con los tres marcadores. Los casos positivos fueron 3/38 (7,9%) en HGNA, 3/44 (6,8%) en CBP, 2/16 (12,5%) en HAI y 1/3 en CEP. Cuatro casos con h-ATG positivos tuvieron títulos bajos (20-30 U; valores normales < 20 U) y 4 títulos altos (> 30 U). Se realizó una endoscopia con biopsia duodenal en 8 de ellos, que fue normal en 7 y compatible con EC en etapa I de Marsh en un paciente con HGNA, AG y AE positivos. El caso del único paciente con los tres marcadores positivos no se estudió por fallecer contemporáneamente. Ninguno de ellos tenía clínica sugerente de EC.
ConclusionesLa frecuencia del marcador serológico h-ATG de EC es significativa en las hepatopatías descritas. Sin embargo, debe confirmarse con biopsia duodenal, dada las elevadas tasas de histología normal en nuestro estudio.
Celiac disease (CD) has been associated with non-alcoholic fatty liver disease (NAFLD) and other chronic liver diseases (CLD), such as primary biliary cirrhosis (PBC), autoimmune hepatitis (AIH) and primary sclerosing cholangitis (PSC). AIM: To study the frequency of serological markers of CD in patients with NAFLD and CLD and their correlation with duodenal biopsy.
Patients and methodsIn patients with NAFLD, PBC, AIH and PSC, we studied anti-endomysium (AE) IgA by indirect immunofluorescence and anti-gliadin IgA-IgG (AG) and human anti-tissue transglutaminase (tTG) IgA antibodies by an ELISA technique. Patients with positive serology for at least one marker underwent endoscopy with duodenal biopsies.
ResultsPositive CD markers were found in 9 of 101 patients (8.9%): 7 patients were positive for tTG alone, 1 for AE and AG, and 1 patient for 3 antibodies. Positivity was as follows: 3/38 (7.9%) in NAFLD, 3/44 (6.8%) in PBC, 2/16 (12.5%) in AIH and 1/3 in PSC. Endoscopy was performed in 8 patients, with normal duodenal biopsy in 7 and 1 patient with Marsh stage 1 CD with NAFLD, positive AE and AG. The only patient with 3 positive markers died during the study without undergoing endoscopy. None of the patients had symptoms suggestive of CD.
ConclusionA high prevalence of positive tTG was found in patients with CLD and NAFLD. However, duodenal biopsy should be performed in these patients, given that the results of this procedure were normal in most patients in this study.
En la enfermedad celíaca (EC) puede haber alteraciones hepáticas de diversa magnitud, incluso como única manifestación de esta enfermedad, que corresponden generalmente a una reacción hepática inespecífica o a una esteatosis leve, condición benigna que usualmente se resuelve con el régimen sin gluten1,2.
Se ha observado, además, una asociación de EC con hepatopatías de origen autoinmune, como hepatitis autoinmune (HAI), cirrosis biliar primaria (CBP) y colangitis esclerosante primaria (CEP), comunicada en algunos estudios previos3–5, e incluso con virus de la hepatitis C6. En las hepatopatías inmunológicas se plantea que el paso de gluten o de sus péptidos derivados estimularía una respuesta inmune en individuos susceptibles, aunque no es clara su real asociación estadística ni patogénica, como tampoco la evolución de estas enfermedades con el tratamiento de la EC.
Por otra parte, se ha descrito que la enfermedad por hígado graso no alcohólico (HGNA), enfermedad de reciente reconocimiento y sin tratamiento demostrado, puede ser secundaria a factores nutricionales, metabólicos, fármacos y otros, incluida la EC. Su detección y tratamiento podría revertir la enfermedad hepática y detener su progresión, que en algunos casos puede llegar a la cirrosis1; se han comunicado algunos casos al respecto en nuestro medio7.
Se sabe que la presunción diagnóstica de la EC con anticuerpos antiendomisio (AE) y, más recientemente, con antitransglutaminasa tiene una sensibilidad y una especificidad superior al 95%8; en nuestra sección se dispone de la técnica recombinante humana (h-ATG) IgA, que tiene un mejor rendimiento que los exámenes de origen animal9, lo cual hace planteable el estudio de esta enfermedad en pacientes hepáticos con estos marcadores. Por otro lado, se ha comunicado en algunos trabajos una mayor expresión de h-ATG en las enfermedades hepáticas crónicas, particularmente la cirrosis, sin demostrarse la existencia de EC en la histología duodenal, lo cual hace poco claro su significado en estos pacientes10.
El objetivo de este trabajo es estudiar en nuestro medio, en los pacientes con las hepatopatías crónicas ya mencionadas, la frecuencia de marcadores serológicos de EC, particularmente h-ATG y AE, su expresión clínica y su correlación histológica en la biopsia duodenal.
PACIENTES Y MÉTODOSEn 101 pacientes (el 78% mujeres), conocidos y controlados en nuestro centro, con diagnóstico de HGNA, HAI, CBP y CEP, de entre 15 y 70 años de edad, se estudiaron, previo consentimiento informado de acuerdo con el protocolo de Helsinki, los siguientes anticuerpos marcadores de EC:
- –
AE por técnica de inmunofluorescencia indirecta (IgA).
- –
Antigliadina (AG) por ELISA (IgA, IgG).
- –
H-ATG de INOVA (QUANTA LiteTM h-tTG IgA, ELISA), con puntos de corte con valores entre 20 y 29 U para débilmente positivo y > 30 U para francamente positivo.
En caso de ser positivo al menos uno de ellos, se realizó una endoscopia oral para la toma de biopsias duodenales y correlacionar sus resultados con los hallazgos histológicos, considerando en su análisis los criterios de Marsh, establecidos para documentar el grado de alteración histopatológica de la mucosa11, revisados por Rostami et al12. Se consideran subtipos I a III, desde la linfocitosis intraepitelial (mayor a 25 linfocitos intraepiteliales por 100 células13) a la atrofia vellositaria subtotal. El diagnóstico de las enfermedades hepáticas previamente controladas se había establecido con los marcadores serológicos de autoinmunidad, incluidos los anticuerpos antinucleares, antimúsculo liso y antimitocondriales, recuento de inmunoglobulinas séricas IgA, IgG e IgM, e histología hepática compatible con HAI, CBP y CEP en cada caso. En los casos con HGNA se excluyeron otras etiologías (virales, inmunes, metales), como también el uso de fármacos potencialmente asociados con esta alteración. En los casos con CEP se contaba además con imágenes de la vía biliar extrahepática afectada, característicamente con aspecto «arrosariado».
Se excluyeron a los pacientes con una enfermedad intestinal conocida, otra enfermedad a los que seguieran tratamientos que interfieran con la inmunidad, y a los pacientes con una enfermedad avanzada hepática, renal, cardíaca u otras.
El análisis estadístico se realizó describiendo las variables cualitativas mediante el número absoluto y los porcentajes, y las cuantitativas con la media y la desviación estándar.
RESULTADOSEn un total de 101 pacientes con las enfermedades hepáticas crónicas descritas (HGNA, HAI, CBP y CEP), se detectaron 9 casos con marcadores positivos de EC (8,9%), 7 de ellos con h-ATG, uno con AE y AG, y un caso con los tres marcadores presentes.
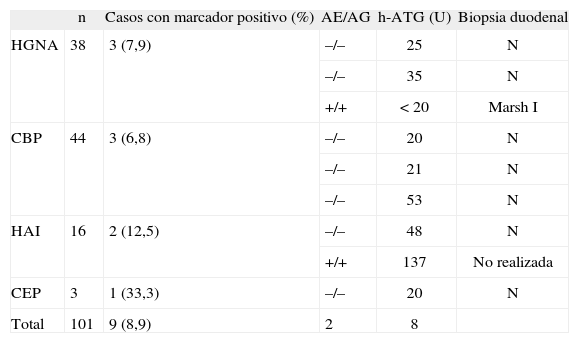
De los 9 casos, 3/38 eran del grupo con HGNA (7,9%), 3/44 del grupo con CBP (6,8%), 2/16 con HAI (12,5%) y 1/3 con CEP. Se realizó una endoscopia con biopsia duodenal en 8 de los 9 casos, encontrándose histología normal en 7 y compatible con EC, etapa I de Marsh, en un caso. Este paciente tenía HGNA y marcadores AG y AE positivos, y la h-ATG presentó un valor no significativo (< 20 U). Al único paciente con los tres marcadores positivos en rango elevado, portador de HAI, no se le efectuó un estudio endoscópico por fallecer contemporáneamente. Ninguno de los 9 pacientes tenía clínica sugerente de EC, expresada como diarrea y/o síndrome de malabsorción. En la tabla I se describen las características de los casos con marcadores serológicos de EC positivos, la hepatopatía asociada y la histología duodenal.
Marcadores de enfermedad celíaca en 101 pacientes con diversas hepatopatías crónicas
| n | Casos con marcador positivo (%) | AE/AG | h-ATG (U) | Biopsia duodenal | |
| HGNA | 38 | 3 (7,9) | –/– | 25 | N |
| –/– | 35 | N | |||
| +/+ | < 20 | Marsh I | |||
| CBP | 44 | 3 (6,8) | –/– | 20 | N |
| –/– | 21 | N | |||
| –/– | 53 | N | |||
| HAI | 16 | 2 (12,5) | –/– | 48 | N |
| +/+ | 137 | No realizada | |||
| CEP | 3 | 1 (33,3) | –/– | 20 | N |
| Total | 101 | 9 (8,9) | 2 | 8 |
AE: anticuerpo antiendomisio IgA; AG: antigliadina IgA-IgG; CBP: cirrosis biliar primaria; CEP: colangitis esclerosante primaria; HAI: hepatitis autoinmune; HGNA: hígado graso no alcohólico; h-ATG de INOVA (QUANTA LiteTM h-tTG IgA, ELISA), valor positivo: débil entre 20 y 30 U, fuerte > 30 U; N: norma
El diagnóstico de EC ha ido aumentando en adultos; cerca del 20% de los casos se hace en mayores de 60 años14, e incluso puede ser una condición asintomática, o en ocasiones sólo manifestarse con síntomas inespecíficos catalogados, entre otros, como colon irritable15. Su prevalencia en la población general occidental se ha descrito en un caso por cada 130-400 individuos8,16.
Se ha observado que los casos de EC sin clínica evidente de diarrea y malabsorción pueden llevar a alteraciones hepáticas en grado variable, con una elevación de las transaminasas en un 15-55% de los casos17,18. Se ha observado una hepatitis leve1,2, una esteatohepatitis significativa7 e incluso una enfermedad hepática grave, en que la detección precoz y el tratamiento de la EC con régimen sin gluten se asocia con una mejoría clínica, lo que evita su progresión y el trasplante hepático19.
Si bien no se ha encontrado una clara asociación de la EC con la malabsorción intestinal, un defecto en la permeabilidad intestinal facilitaría el paso del gluten o sus péptidos derivados, estimulando una respuesta inmunológica, la cual durante un tiempo prolongado «gatillaría» las enfermedades autoinmunes en individuos susceptibles20. En este sentido, se ha observado una relación con enfermedades hepáticas de etiología autoinmune, como la HAI y la CBP, y se ha encontrado EC en el 7% de pacientes con CBP3 y en el 4% con HAI4, respectivamente. En nuestro estudio encontramos una frecuencia del 6,8 y el 12,5% de marcadores positivos, respectivamente (sobre todo h-ATG) en estas enfermedades. Si bien la biopsia duodenal fue normal, salvo en la paciente con HAI en quien no se realizó por fallecer ésta durante el trabajo, podría tratarse de falsos positivos o de una EC silente en el momento del estudio, cuyo seguimiento a largo plazo podría definirlo.
Por otra parte, en la enfermedad por HGNA se requiere descartar otras causas de alteración bioquímica e histopatológica del hígado. Las alteraciones de la permeabilidad intestinal y el papel de las endotoxinas también se han implicado en el HGNA21, si bien faltan estudios al respecto. Esta enfermedad es más frecuente en pacientes obesos, diabéticos tipo 2 y dislipémicos; en la población general se observa hasta en un 25%22, y puede progresar a cirrosis en algunos casos. Sus manifestaciones bioquímicas e histopatológicas pueden ser similares en pacientes con EC y revertir con el tratamiento de ésta, lo cual refuerza la importancia de su detección. En nuestro estudio encontramos un 7,9% de positividad de los marcadores serológicos de EC en los pacientes con HGNA, pero sólo en uno de ellos (el único de todas las biopsias duodenales realizadas) se encontraron alteraciones leves compatibles con EC, en estadio Marsh I con linfocitosis intraepitelial significativa, llamativamente con h-ATG negativo y con los otros 2 marcadores positivos, lo que podría plantear un déficit de IgA asociado, aunque se ha descrito una frecuente negatividad de la serología de EC en estos casos leves que dificulta su diagnóstico23. En un estudio reciente24 se observó que los pacientes con positividad simultánea para IgG e IgA h-ATG tenían una histología compatible con EC, método del que no disponíamos en el momento de realizar nuestro trabajo.
En relación con la frecuencia observada en nuestro estudio de h-ATG recombinante humana, como ya se mencionó, Vecchi et al10 encontraron este anticuerpo en el 17,1% de los pacientes con hepatopatías crónicas, que alcanzaba el 31,6% en el subgrupo con cirrosis y asociado a un mayor grado Child-Pugh. Sin embargo, en este trabajo no se realizó un estudio histológico de los pacientes, y se concluyó que este marcador es particularmente elevado en los cirróticos. En otro estudio reciente, Germenis et al25 también observaron una mayor frecuencia de h-ATG en pacientes hepáticos en relación con controles sanos (5,8 frente a 0,3%), pero su especificidad para la EC fue baja, con una similar prevalencia de EC en la biopsia duodenal de ambos grupos, por lo que los autores plantean su positividad asociada más bien a la presencia de elementos de autoinmunidad, cirrosis y marcadores de colestasia. Respecto a ello, se sabe que h-ATG participa en catalizar las reacciones propias de los procesos de apoptosis26, que están aumentados en la fibrosis hepática27, lo cual llevaría a su sobreexpresión en estos casos; también la hipertensión portal puede alterar la mucosa intestinal y aumentar su permeabilidad, con la consecuente inducción inmunológica hacia autoantígenos potenciales, «gatillando» este marcador28.
Consideramos razonable plantear que si bien la causa de la mayor frecuencia de h-ATG en los pacientes hepáticos crónicos con histología intestinal normal no está aclarada, se podría realizar un seguimiento clínico y serológico más prolongado en estos pacientes, ya que puede tratarse de una enfermedad latente o de un falso positivo del marcador serológico en esta enfermedad.
En conclusión, la frecuencia del marcador de EC h-ATG fue significativa en pacientes con hepatopatías inmunológicas y HGNA en nuestro estudio, lo que concuerda con otras series publicadas. Sin embargo, debe confirmarse con un estudio histológico del duodeno, dada la elevada aparición de histología normal, cuyo significado debe evaluarse en otros estudios con seguimiento prolongado de estos pacientes.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.
Proyecto financiado por OAIC Hospital Clínico Universidad de Chile.