A pesar de la probada eficacia de los programas de vacunación desarrollados frente a esta enfermedad1,2 y de los importantes avances terapéuticos que han tenido lugar en los últimos años, la infección crónica por el virus de la hepatitis B (VHB) todavía constituye un grave problema de salud pública. Se estima que en el mundo hay unos 350 millones de portadores crónicos del VHB, de los que el 15-40% presentará complicaciones graves, como la cirrosis hepática y/o el carcinoma hepatocelular. De hecho, cada año mueren en el mundo más de un millón de personas como consecuencia de las complicaciones de la infección crónica por el VHB3,4. En nuestro medio, la mortalidad en pacientes con infección crónica por el VHB es hasta 5 veces superior a la de la población general5.
La distribución de la infección por el VHB es universal, pero la tasa de portadores crónicos varía entre el 0,1 y el 20% de la población en distintas áreas geográficas6,7. Estas diferencias epidemiológicas se relacionan principalmente con la edad en el momento de la infección. En las zonas del mundo con más prevalencia, la transmisión vertical o bien la transmisión horizontal durante la infancia representan las formas habituales de contagio y ocasionan la cronificación de la infección en el 90% de los recién nacidos y el 30% de los niños menores de 5 años. Por el contrario, la transmisión por vía sexual o parenteral en la adolescencia o la edad adulta son los principales mecanismos de infección en los países con baja prevalencia. En estas personas de más edad, el sistema inmunitario logra resolver la infección en un 95% de los casos.
En el área mediterránea, la prevalencia de la hepatitis B crónica es del 1-8% aproximadamente, lo que representa un rango intermedio que se sitúa por encima de los países del norte de Europa y de América, aunque claramente por debajo de Asia y África, las zonas del mundo con endemicidad más elevada de hepatitis B6,7. En el año 2002 y en España, Solà et al8 observaron que el antígeno de superficie del VHB (HBsAg) puede detectarse en el 1,69% de la población general y que la edad media de los portadores del VHB es de 50,8 años. Estos autores hallaron valores detectables de ácido desoxirribonucleico (ADN) viral en plasma mediante la reacción en cadena de la polimerasa (PCR) (> 1.000 copias/ml) en el 12% de los casos, y valores normales de transaminasas en el 68%. A partir de estos datos, se puede estimar que en España la prevalencia de hepatitis B es media-baja. No obstante, como consecuencia del creciente fenómeno de la inmigración, procedente en muchos casos de zonas con elevada prevalencia de la infección, es probable que en la actualidad estas cifras sean superiores y que el impacto de la enfermedad en España sea mayor.
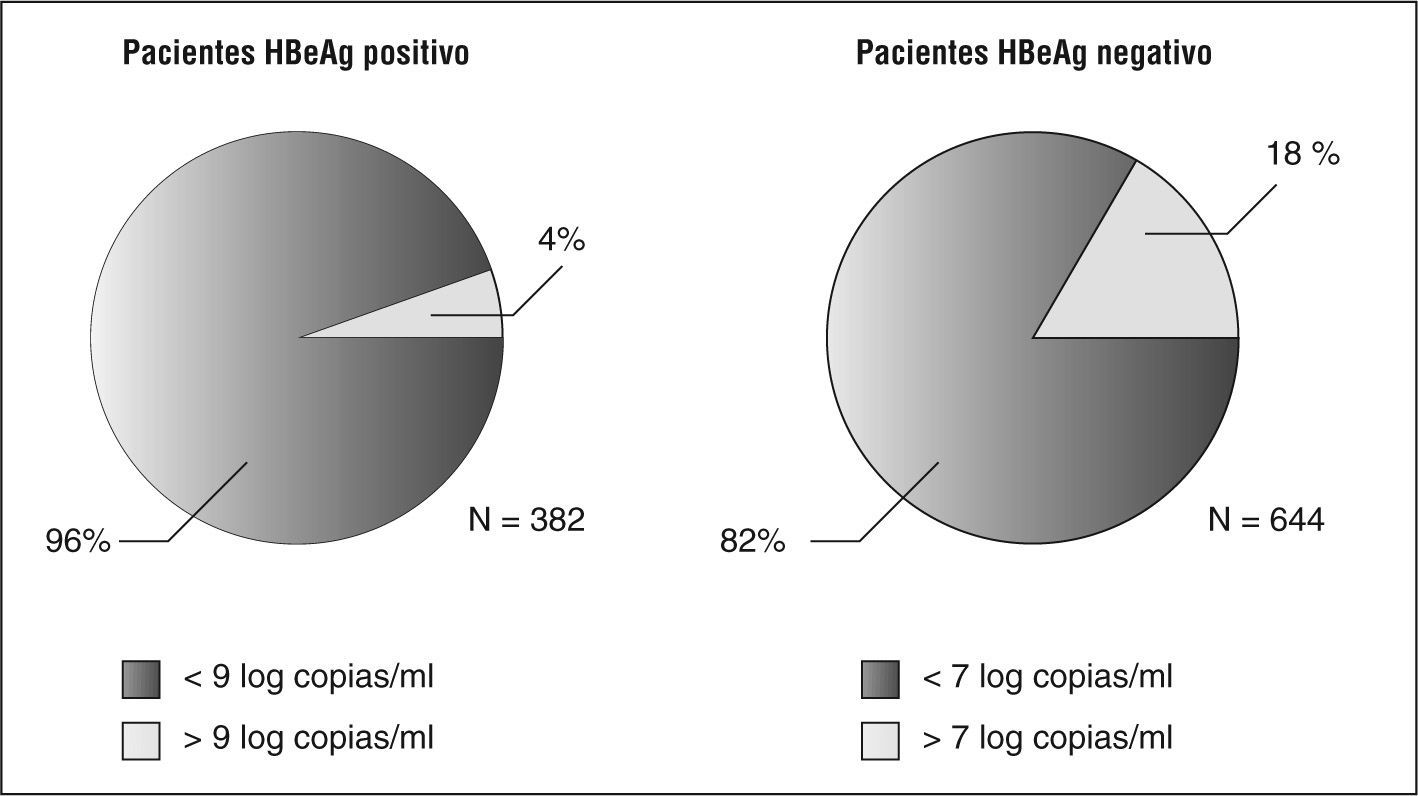
En España, al igual que en otros países del sur de Europa, la hepatitis B crónica con antígeno e de la hepatitis B (HBeAg) negativo es la forma más prevalente9. Recientemente se ha realizado un estudio internacional para investigar cuál es, en términos de carga viral y de valor de transaminasas, el perfil más habitual de los pacientes con hepatitis B en el momento del diagnóstico10. En este estudio, que ha involucrado a más de 500 especialistas seleccionados de forma aleatorizada en Estados Unidos, Europa y Asia, los médicos debían reportar el perfil de un total de 10 pacientes con hepatitis B crónica visitados de manera consecutiva en su consulta. En Europa se contó con una muestra representativa de 1.026 pacientes. El análisis de los datos ha permitido comprobar que en el momento del diagnóstico la viremia es inferior a 9 log/ml en el 96% de los pacientes con HBeAg positivo, e inferior a 7 log/ml en el 82% de los pacientes con HBeAg negativo (fig. 1). A diferencia de lo que se observa en Asia, donde los pacientes presentan con frecuencia unos valores de ADN viral mucho más elevados y cifras de transaminasas normales o cercanas a los valores de normalidad, o, como reflejo de un estado de inmunotolerancia frente al VHB, los pacientes europeos presentan a menudo una carga viral relativamente baja junto con unas transaminasas elevadas, que indican una respuesta inmunitaria activa frente al VHB. Muchos de los estudios acerca de la historia natural de la infección o de su tratamiento se han realizado en China o han incorporado una proporción sustancial de pacientes de origen asiático, por lo que la información que han proporcionado no debe considerarse al pie de la letra para el tratamiento de la hepatitis B crónica en nuestro medio.
HISTORIA NATURAL Y OBJETIVOS DEL TRATAMIENTOSe sabe que hay una asociación entre la persistencia de la actividad de las lesiones hepáticas, promovida por la replicación persistente del virus, y el empeoramiento progresivo de la enfermedad. Se estima que en ausencia de un tratamiento eficaz, hasta el 20% de los pacientes con una infección crónica por el VHB puede evolucionar hacia la cirrosis u otras complicaciones hepáticas11,12 y, en general, un 5-10% de los pacientes que se someten a trasplante hepático presenta hepatitis crónica o fulminante relacionada con el VHB13. La incidencia de cirrosis en los pacientes con HBeAg positivo es del 2-5% anual, mientras que en los pacientes con enfermedad activa y HBeAg negativo esta tasa se sitúa alrededor del 8-9%, probablemente porque este tipo de hepatitis representa una fase más tardía de la historia natural de la enfermedad14,15. El pronóstico de los pacientes con cirrosis compensada es relativamente bueno, con una supervivencia a los 5 años cercana al 85%, pero después de la primera descompensación, que cada año ocurre en el 6% de los pacientes cirróticos, la supervivencia al cabo de un año es menor del 30%16. En relación con el carcinoma hepatocelular, el VHB es el agente etiológico más frecuentemente relacionado con su aparición, con un riesgo 100 veces mayor para los portadores del HBsAg con respecto a la población no infectada17. Se estima que la tasa anual de aparición de carcinoma hepatocelular alcanza el 2-3% de los pacientes con cirrosis, pero es menor del 1% en los pacientes no cirróticos18. Algunos estudios recientes han puesto de manifiesto que la presencia en el suero de valores elevados de ADN viral se asocia estrechamente con un mayor riesgo de que aparezcan complicaciones, aunque por fortuna la proporción de pacientes con viremia elevada es relativamente reducida. En 2003, Mommeja- Marin et al19 observaron que hay un correlación significativa entre los valores de ADN del VHB en plasma y el índice de actividad histológica observado en la biopsia hepática de pacientes con hepatitis B crónica. Asimismo, la reducción de dichos valores mediante tratamiento antiviral se relacionó significativamente con mejorías en los hallazgos histológicos, y la mejoría es tanto mayor cuanto más intensa era la supresión del ADN viral. En otro estudio reciente, que incluyó a 3.774 pacientes con hepatitis B crónica, se observó que la incidencia acumulada de cirrosis al cabo de 13 años era significativamente superior en los pacientes con mayores valores séricos de ADN del VHB, ya que en los pacientes con ≥ 106 copias/ml el riesgo fue hasta 6,5 veces superior al de los pacientes que presentaban cifras < 300 copias/ml20. El valor de viremia también se relaciona con el riesgo de descompensación de la cirrosis, ya que en un estudio en el que se efectuó un seguimiento durante más de 6 años, el 18% de los pacientes cirróticos con HBeAg positivo y con valores detectables de ADN por técnicas de baja sensibilidad se habían descompensado al final del seguimiento, frente a tan sólo el 4% de los pacientes con HBeAg negativo y ADN indetectable16. En relación con el hepatocarcinoma, el estudio REVEAL-HBV ha demostrado que a mayor cantidad de ADN viral en plasma, la probabilidad de que dicho tumor se desarrolle en el futuro esmayor. La incidencia de carcinoma hepatocelular en los pacientes con valores de ADN más elevados (≥ 106 copias/ml) fue de 1.152 casos por 100.000 personas/año, en comparación con los 108 casos por 100.000 personas/año observados en los pacientes con ADN negativo (< 300 copias/ml), de forma que el riesgo relativo del primer grupo fue hasta 11 veces superior21. El tratamiento de la hepatitis B crónica tiene como objetivos a largo plazo evitar la aparición de cirrosis y hepatocarcinoma, reducir la necesidad de trasplante hepático, aumentar la supervivencia y mejorar la calidad de vida. Idealmente, estos propósitos se deberían lograr mediante la erradicación completa de la infección, aunque con los tratamientos disponibles, la eliminación del VHB, reflejada por la pérdida del HBsAg y la seroconversión a anti- HBs, ocurre en menos del 5% de los casos22. Además, la permanencia en el núcleo de los hepatocitos de ADN circular covalentemente cerrado del VHB (especialmente resistente al tratamiento antiviral) hace que la pérdida del HBsAg no se corresponda con la erradicación total del virus, lo que explica la reactivación de la enfermedad en algunos pacientes con HBsAg negativo tras recibir quimioterapia u otros tratamientos inmunodepresores23. Por tanto, en la actualidad, el tratamiento ideal de esta enfermedad no puede ir más allá de conseguir la supresión profunda y mantenida de la replicación del virus, expresada por la reducción de la viremia, para reducir la progresión de la hepatitis hacia estadios más avanzados. En los pacientes con HBeAg positivo, la seroconversión a anti- HBe positivo es otro objetivo importante. En los pacientes en fase inmunoactiva, la tasa de seroconversión espontánea anti-HBe es del 5-16%. La edad adulta, el sexo femenino y los valores de alanina transaminasa (ALT) > 5 × ULN son los principales factores predictivos de la seroconversión22. La reducción de la replicación viral con el tratamiento facilitaría al sistema inmunitario, este proceso cuya importancia radica en el buen pronóstico que generalmente comporta. Tras la seroconversión, hasta el 85% de los pacientes pasa a ser portador inactivo de la infección, que se caracteriza por presentar, de forma sostenida, valores bajos de replicación viral (< 105 copias/ml) y de ALT normales y por la ausencia de lesiones hepáticas activas. En los portadores inactivos el riesgo a largo plazo de desarrollar una enfermedad hepática significativa o un hepatocarcinoma es muy bajo11,12,24.
TRATAMIENTOS DISPONIBLES PARA LA HEPATITIS B CRÓNICAEn la actualidad, el tratamiento de la hepatitis B crónica es todavía un verdadero reto clínico. La supresión sostenida de la replicación del VHB es el objetivo terapéutico primordial, pero para alcanzarlo es necesario administrar tratamiento muy prolongado en la mayoría de los casos. Desafortunadamente, las limitaciones a largo plazo en términos de eficacia o seguridad de los fármacos disponibles pueden dificultar la consecución de este objetivo.
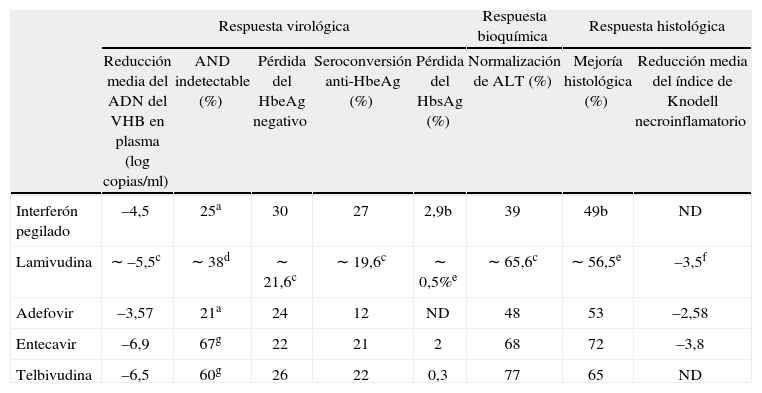
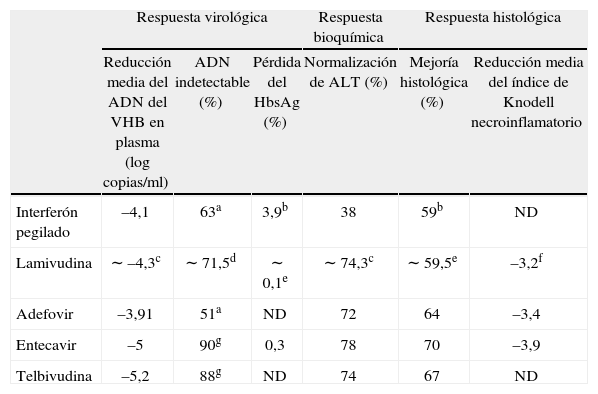
En la actualidad hay 5 fármacos disponibles en España para el tratamiento de la enfermedad: interferones (IFN) alfa convencionales (alfa-2a y 2b), IFN pegilado (PEG-IFN) (alfa-2a y alfa-2b), lamivudina, adefovir dipivoxil y entecavir; próximamente estará disponible también telbivudina. En las tablas I y IIse resumen los principales resultados obtenidos con estos tratamientos a un año en pacientes con HBeAg positivos y negativos. Para juzgar las diferencias en los resultados obtenidos con un fármaco u otro, es importante tener en cuenta la notable variabilidad entre los estudios respecto a su diseño, que incluye diferentes poblaciones de pacientes y distinto fármaco comparador (placebo en unos estudios, lamivudina en otros), el objetivo principal del estudio (virológico en unos e histológico en otros) o en la sensibilidad de los tests utilizados para determinar el ADN viral. También hay diferencias entre los estudios en relación con los criterios de selección de pacientes para recibir tratamientos prolongados. Por este motivo, la comparación de unos fármacos con otros es difícil, particularmente en lo que respecta a los resultados de más de un año de tratamiento25–31.
Tasas de respuesta virológica, bioquímica e histológica de los actuales tratamientos disponibles frente a la hepatitis B crónica en pacientes HBeAg positivo. Resultados a un año
| Respuesta virológica | Respuesta bioquímica | Respuesta histológica | ||||||
| Reducción media del ADN del VHB en plasma (log copias/ml) | AND indetectable (%) | Pérdida del HbeAg negativo | Seroconversión anti-HbeAg (%) | Pérdida del HbsAg (%) | Normalización de ALT (%) | Mejoría histológica (%) | Reducción media del índice de Knodell necroinflamatorio | |
| Interferón pegilado | –4,5 | 25a | 30 | 27 | 2,9b | 39 | 49b | ND |
| Lamivudina | ∼ –5,5c | ∼ 38d | ∼ 21,6c | ∼ 19,6c | ∼ 0,5%e | ∼ 65,6c | ∼ 56,5e | –3,5f |
| Adefovir | –3,57 | 21a | 24 | 12 | ND | 48 | 53 | –2,58 |
| Entecavir | –6,9 | 67g | 22 | 21 | 2 | 68 | 72 | –3,8 |
| Telbivudina | –6,5 | 60g | 26 | 22 | 0,3 | 77 | 65 | ND |
ALT: alanina transaminasa; HBeAg: antígeno e de la hepatitis B; HBsAg: antígeno de superficie del VHB; ND: no disponible; VHB: virus de la hepatitis B. a< 400 copias/ml por reacción en cadena de la polimerasa (PCR)30. bDeterminado a las 24 semanas de interrumpir el tratamiento (semana 72). Brazo de interferón pegilado en monoterapia. cDatos provenientes de los estudios de registro de interferón pegilado25, entecavir27 y telvibudina29. dDatos provenientes de lo estudios de registro de entecafir27 y telbivudina29 (< 300 copias/ml por PCR). eDatos provenientes de los estudios de registro de interferón pegilado25 y entecavir27. fDatos provenientes del estudio de registro de entecavir27. g< 300 copias/ml por PCR. hReducción ≥ 2 puntos en el componente necroinflamatorio del índice de Knodell, sin empeoramiento del componente de fibrosis. En el estudio de reistro del interferón pegilado25 la respuesta histológica se definió como una reducción de ≥ 2 puntos en el índice de actividad histológica modificado con respecto a la biopsia pretratamiento.
Tasas de respuesta virológica, bioquímica e histológica de los actuales tratamientos disponibles frente a la hepatitis B crónica en pacientes con HBeAg negativo. Resultados a un año
| Respuesta virológica | Respuesta bioquímica | Respuesta histológica | ||||
| Reducción media del ADN del VHB en plasma (log copias/ml) | ADN indetectable (%) | Pérdida del HbsAg (%) | Normalización de ALT (%) | Mejoría histológica (%) | Reducción media del índice de Knodell necroinflamatorio | |
| Interferón pegilado | –4,1 | 63a | 3,9b | 38 | 59b | ND |
| Lamivudina | ∼ –4,3c | ∼ 71,5d | ∼ 0,1e | ∼ 74,3c | ∼ 59,5e | –3,2f |
| Adefovir | –3,91 | 51a | ND | 72 | 64 | –3,4 |
| Entecavir | –5 | 90g | 0,3 | 78 | 70 | –3,9 |
| Telbivudina | –5,2 | 88g | ND | 74 | 67 | ND |
ALT: alanina transaminasa; HBeAg: antígeno e de la hepatitis B; ND: no disponible; HBsAg: antígeno de superficie del VHB; VHB: virus de la hepatitis B. a< 400 copias/ml por reacción en cadena de la polimerasa (PCR)30. bDeterminado a las 24 semanas de interrumpir el tratamiento (semana 72). Brazo de interferón pegilado en monoterapia. cDatos provenientes de los estudios de registro de interferón pegilado25, entecavir27 y telvibudina29. dDatos provenientes de lo estudios de registro de entecafir27 y telbivudina29 (< 300 copias/ml por PCR). eDatos provenientes de los estudios de registro de interferón pegilado25 y entecavir27. fDatos provenientes del estudio de registro de entecavir27. g< 300 copias/ml por PCR. hReducción ≥ 2 puntos en el componente necroinflamatorio del índice de Knodell, sin empeoramiento del componente de fibrosis. En el estudio de reistro del interferón pegilado25 la respuesta histológica se definió como una reducción de ≥ 2 puntos en el índice de actividad histológica modificado con respecto a la biopsia pretratamiento.
El IFN convencional, que durante largo tiempo fue el único tratamiento disponible, se ha sustituido por el (PEGIFN) por su mayor eficacia. En un estudio realizado en 194 pacientes con HBeAg positivo, el tratamiento con 180 μg de PEG-IFN alfa-2a a la semana durante 6 meses logró unas tasas de seroconversión HBe y de negativización del ADN del VHB (< 500.000 copias/ml) superiores a las obtenidas con tratamiento con IFN alfa-2a estándar32.
Recientemente, se ha publicado un amplio estudio acerca de la utilización de PEG-IFN alfa-2a en pacientes con hepatitis B crónica y HBeAg positivo25. En el estudio se incluyó a más de 800 pacientes, de los que casi el 90% era de origen asiático, que fueron aleatorizados para recibir tratamiento durante 48 semanas con PEG-IFN alfa-2a, lamivudina o ambos fármacos en combinación. La monoterapia con PEG-IFN alfa-2a demostró ser significativamente superior a la monoterapia con lamivudina en la tasa de seroconversión HBe (el 32 frente al 19%; p < 0,001) y de negativización del ADN viral (< 400 copias/ ml por PCR) (el 14 frente al 5%; p < 0,001). La administración de PEG-IFN alfa-2a determinó la negativización del HBsAg en el 3% de los pacientes, en comparación con ninguno de los que recibieron lamivudina en monoterapia. El tratamiento combinado con ambos fármacos determinó una supresión de la replicación viral más profunda que el tratamiento con lamivudina o IFN en monoterapia. Se detectaron mutaciones YMDD asociadas con resistencia a lamivudina en el 27% de los pacientes tratados con este fármaco en monoterapia y en el 4% de los que recibieron lamivudina en combinación con IFN. Sin embargo, estos efectos teóricamente favorables del tratamiento combinado no determinaron un incremento de la eficacia terapéutica en comparación con la obtenida con PEG-IFN alfa-2a en monoterapia.
La eficacia del PEG-IFN alfa-2b en los pacientes con hepatitis B crónica y HBeAg positivo se ha explorado en 2 estudios realizados por Janssen et al33 y Chan et al34 en Europa y en China, respectivamente. En el estudio europeo se observó que la tasa de seroconversión HBe obtenida con la monoterapia con PEG-IFN alfa-2b fue similar a la descrita en el estudio referido con anterioridad, en el que se utilizó PEG-IFN alfa-2a, si bien la comparación es difícil debido a las profundas diferencias del diseño entre ambos estudios. La tasa de seroconversión HBe obtenida con la combinación de PEG-IFN alfa-2b y lamivudina observada en los pacientes europeos tampoco fue superior a la obtenida con el PEG-IFN alfa-2b en monoterapia33.
En el estudio de Chan et al34 se comprobó que tras 52 semanas de tratamiento, la combinación de PEG-IFN alfa- 2b y lamivudina fue más eficaz que la monoterapia con lamivudina, y se situó en valores del 36%, similares a los observados en los estudios comentados previamente. El análisis de los datos de los estudios precedentes mostró que algunos factores influyen en la respuesta al tratamiento con PEG-IFN, ya que su presencia se asocia con una mayor tasa de seroconversión HBe. Entre ellos se incluye la infección por genotipo A o B y la existencia, al inicio del tratamiento, de unos valores elevados de transaminasas (> 5 × N) y de una concentración baja de ADNVHB en el suero (> 9 log10 copias/ml).
La utilidad del PEG-IFN en el tratamiento de la hepatitis B crónica con HBeAg negativo sólo se ha explorado en un estudio en el que se administró PEG-IFN alfa-2a26. El estudio incluyó a más de 500 pacientes, un 60% de los cuales era de origen asiático, a los que se aleatorizó en 3 grupos para recibir tratamiento durante 48 semanas con PEG-IFN alfa-2a, en monoterapia o en combinación con lamivudina, o sólo con lamivudina. La respuesta virológica observada al finalizar el tratamiento en los 3 grupos del estudio fue excelente. Tras 24 semanas sin tratamiento, las transaminasas eran normales en aproximadamente el 60% de los pacientes que recibieron PEG-IFN y en el 44% de los que recibieron monoterapia con lamivudina, mientras que el ADN-VHB era inferior a 20.000 copias/ml en el 40 y el 30% de los pacientes, respectivamente. La respuesta valorada por la presencia simultánea de transaminasas normales y ADN-VHB inferior a 400 copias/ml fue del 15% en los pacientes tratados con IFN, con o sin lamivudina, y del 6% en los pacientes tratados sólo con lamivudina. La supresión de la replicación viral fue más profunda en los pacientes que recibieron tratamiento combinado, y la tasa de mutaciones que comportan resistencia a lamivudina fue menor en éstos que en los que recibieron monoterapia con lamivudina. Sin embargo, al igual que en los pacientes con HBeAg positivo, la efectividad terapéutica del tratamiento combinado no fue superior a la obtenida con monoterapia con PEG-IFN. Un análisis reciente de los datos de este estudio ha mostrado que la infección con los genotipos B o C, el sexo femenino, la edad joven, las transaminasas elevadas y la viremia baja se asociaban a una respuesta sostenida (evaluada por la presencia simultánea de transaminasas normales y valores de ADN-VHB < 20.000 copias/ml) tras 24 semanas sin tratamiento35.
Los resultados de estos estudios indican que la administración de PEG-IFN durante 48 semanas puede ser una buena opción terapéutica en la hepatitis B crónica, particularmente en los pacientes con HBeAg positivo. Los resultados que avalan la eficacia del PEG-IFN en los pacientes con HBeAg negativo parecen menos convincentes. Esta forma de la enfermedad se caracteriza por la tendencia a recidivar, de forma más o menos tardía, una vez se ha interrumpido el tratamiento, tanto con IFN estándar como con análogos de los nucleósidos. Por ello, el seguimiento postratamiento durante 6 meses no está del todo claro que pueda ser un período suficiente para estimar la eficacia de este tratamiento en términos de respuesta mantenida26,36.
LamivudinaLa lamivudina fue el primer análogo de los nucleósidos del que se dispuso en la práctica clínica habitual. Durante años ha sido el patrón de referencia del tratamiento con análogos de la hepatitis B crónica gracias a su elevada potencia para suprimir la replicación viral y excelente tolerancia.
En los pacientes con HBeAg positivo, los estudios de fase III mostraron que el tratamiento con lamivudina durante un año logró la seroconversión de HBe en el 16-17% de los casos y la negativización del ADN viral (determinada mediante una técnica de hibridación con límite de detección de 1,6 pg/ml) en el 44%27,37,38. En los estudios de registro de PEG-IFN25, entecavir27,28 y telbivudina29, en los que la lamivudina fue el fármaco comparador, se observaron resultados similares.
En los pacientes que no habían seroconvertido tras un año de tratamiento, la administración del fármaco a más largo plazo incrementó la tasa de respuesta, de modo que tras 2 y 3 años de tratamiento el 27 y el 40% de los pacientes, respectivamente, alcanzaron la seronconversión39. En relación con la durabilidad de la respuesta tras la interrupción del tratamiento, los datos son dispares, ya que la sitúan en un intervalo del 40-80%, aproximadamente40–42. No obstante, se sabe que un tratamiento prolongado de consolidación tras la seroconversión aumenta las probabilidades de mantenerla. En este sentido, se ha sugerido que mantener la lamivudina durante al menos 8 meses después de la seroconversión puede ser adecuado43,44.
En los pacientes con HBeAg negativo, la respuesta inicial a lamivudina es buena, con unas tasas de negativización del ADN del VHB al primer año de alrededor del 70%26,28,45,46. Sin embargo, la suspensión del tratamiento comporta la pérdida de la respuesta en el 90% de los casos46. En general, las evidencias presentadas sugieren que el mayor beneficio con lamivudina se obtiene con el tratamiento prolongado, especialmente en pacientes con HBeAg negativo. La excelente tolerabilidad apoya esta opción, pero la elevada tasa de aparición de cepas resistentes a lamivudina es un condicionante importante, ya que una elevada proporción de los pacientes presentan resistencia a los pocos años de tratamiento. En efecto, a partir de las observaciones de diferentes estudios, se cree que aproximadamente el 15% de los pacientes HbeAg positivos y el 10% de los HBeAg negativos en tratamiento con lamivudina presenta al año variantes resistentes del VHB47–51. De forma global, se estima que las tasas de resistencia a los 2, 3, 4 y 5 años de tratamiento son del 38, 49, 66 y 69%, respectivamente. La presencia de cepas resistentes suele asociarse a una pérdida más o menos completa de la repuesta terapéutica que puede favorecer el empeoramiento de la enfermedad47,50. De hecho, tras la introducción de fármacos más potentes y con mejor perfil de resistencia, la lamivudina ha perdido parte del muy relevante papel que ha tenido en el tratamiento de la hepatitis B crónica.
Adefovir dipivoxilEl adefovir fue el primer análogo nucleótido y el segundo fármaco de administración oral para el tratamiento de la hepatitis B crónica comercializado. La aportación más relevante del adefovir ha sido probablemente su capacidad de rescatar a los pacientes con resistencia a la lamivudina, ya que en varios estudios se estableció que tras 12 meses de introducir el fármaco, más de la mitad de estos pacientes presentaba una mejoría bioquímica, virológica e histológica52,53. Si bien no se han comparado directamente, el adefovir y la lamivudina parecen presentar unas tasas similares de respuesta bioquímica e histológica, a pesar de que el adefovir tiene menor potencia antiviral y actúa más lentamente.
El estudio de registro del adefovir en pacientes con HBeAg positivo, realizado frente a placebo, estableció que al año de tratamiento las tasas de negativización del ADN del VHB (< 400 copias/ml por PCR) y de seroconversión son del 21 y el 12%, respectivamente30. La prolongación del tratamiento ha mostrado que dichas tasas aumentan hasta el 45 y el 29% y hasta el 56 y el 43%, respectivamente, tras 2 y 3 años de tratamiento54. En relación con la persistencia de la respuesta, en una serie de 45 pacientes a los que se interrumpió el tratamiento con adefovir tras alcanzar la seroconversión, se observó que ésta se mantenía en el 91% de los casos con un tratamiento de consolidación medio de 37 semanas, con una mayor probabilidad de reaparición del HBeAg en los pacientes que recibieron un tratamiento de consolidación más corto55.
En los pacientes con HBeAg negativo, el ADN viral es indetectable en el 51% de los casos tratados durante 48 semanas con adefovir31. Al igual que en los tratados con lamivudina, menos del 10% de estos pacientes muestran una respuesta persistente tras la interrupción del fármaco, lo que indica que en ellos es necesario mantener el tratamiento durante largo tiempo. La extensión a 5 años de este estudio mostró que la respuesta virológica se mantenía en el 67% de los casos56.
Hasta el momento, no se ha descrito la aparición de resistencia al adefovir durante el primer año de tratamiento, pero la probabilidad acumulada de desarrollar mutaciones resistentes aumenta con el tiempo y dificulta la prolongación del tratamiento. Si bien no se dispone de datos en pacientes con HBeAg positivo, se ha establecido que al segundo año el 3% de los pacientes con HBeAg negativo presenta resistencia al adefovir, el 11% a los 3 años y el 18 y 29% a los 4 y 5 años, respectivamente57. La aparición de resistencia es más frecuente en los pacientes con resistencia previa a la lamivudina58,59, aunque hay importantes diferencias en función de si el adefovir se introduce en estos pacientes como sustituto de la lamivudina o si se añade al tratamiento. En efecto, algunos estudios muy recientes han mostrado que la monoterapia con adefovir de pacientes resistentes a lamivudina comporta un alto riesgo de aparición de resistencia a adefovir, con pérdida del beneficio terapéutico, mientras que la adición de adefovir es útil tanto en términos de mantener la eficacia, como la de prevenir la aparición de resistencia60,61.
La tolerancia al adefovir es comparable a la del placebo con la dosis recomendada de 10 mg/día, aunque se han descrito aumentos leves y reversibles de la creatinina plasmática en el 8% de los pacientes tratados con 30 mg de adefovir62.
EntecavirIntroducido en el año 2006, el entecavir es un fármaco con elevada potencia antiviral. En los estudios de registro se comparó con lamivudina y mostró una respuesta virológica, bioquímica e histológica significativamente superior27,28. En dichos estudios se detectaron casos aislados de reactivación viral, pero no se observó la aparición de mutantes resistentes en el primer año de tratamiento.
En los pacientes con HBeAg positivo tratados con entecavir durante 48 semanas27, se observó la negativización del ADN del VHB (< 300 copias/ml por PCR) en el 67% de los casos, frente a sólo el 36% de los tratados con lamivudina. No obstante, la tasa de seroconversión fue similar con ambos fármacos (el 21 y el 18%, respectivamente). La persistencia de la respuesta en pacientes que han respondido al entecavir es elevada. Los pacientes que al final de las 48 semanas de tratamiento habían perdido el HBeAg y presentaban valores de ADN < 0,7 mEq/ml (respuesta combinada definida por el protocolo) interrumpieron el tratamiento, y se observó una respuesta virológica sostenida en el 82%, frente al 73% con lamivudina. La negativización del HBsAg fue baja con ambos tratamiento (el 2 frente al 1%).
En los pacientes con HBeAg negativo, la reducción del ADN viral hasta valores indetectables a las 48 semanas de tratamiento fue significativamente superior en los pacientes tratados con entecavir que en los tratados con lamivudina (el 90 frente al 72%), pero el mantenimiento de la respuesta al interrumpir el tratamiento fue mucho menor que en los pacientes con HBeAg positivo28. En este estudio se interrumpió el tratamiento en los pacientes con respuesta combinada definida por el protocolo (ADN < 0,7 mEq/ml y ALT < 1,25 × ULN), y se observó una respuesta sostenida con entecavir en un 48%, frente a un 35% con lamivudina. En cualquier caso, el hecho de que en ambos grupos del estudio menos de la mitad de los pacientes presentara una respuesta viral sostenida pone de manifiesto, una vez más, que la tasa de recaída en los pacientes con HBeAg negativo es alta, y de ahí la necesidad de administrar tratamientos a largo plazo.
En el grupo tratado con entecavir durante 2 años, se obtuvo un porcentaje de negativización del ADN del VHB del 91% en pacientes tanto HBeAg positivos como negativos63, pero la interpretación de este dato no es fácil, ya que el diseño de los estudios de extensión del tratamiento es compleja. De entre un total de 354 y 325 pacientes HBeAg positivo y negativo, respectivamente, incluidos el primer año en el estudio de registro, 217 (61%) y sólo 27 (8%) mantuvieron el tratamiento con entecavir; a este subgrupo de pacientes hacen referencia los resultados reportados de eficacia y resistencias durante el segundo año64,65. Del mismo modo, la respuesta del 91% durante el segundo año se refiere a la respuesta acumulada de los pacientes que respondieron en el primer y segundo años, sin tener en cuenta las posibles recidivas entre los que suspendieron el tratamiento en la semana 48.
La tasa de reactivación viral durante el primer año de tratamiento con entecavir fue del 2% en ambas poblaciones y en ningún caso se detectaron mutaciones en el genoma del virus65. A los 2 años, un 3% adicional de pacientes mostró reactivación viral, y al menos en 2 pacientes se aislaron mutantes resistentes. Por otro lado, recientemente se ha descrito que el fármaco puede inducir mutaciones en la posición M184V de la transcriptasa inversa del virus de la inmunodeficiencia humana (VIH) tipo 1 en pacientes coinfectados que no siguen tratamiento antirretroviral concomitante. Esta mutación puede crear dificultades posteriormente si fuera necesario administrar un tratamiento antirretroviral debido a la aparición de resistencias a lamivudina y emtricitabina66. Por este motivo, se ha recomendado evitar la monoterapia con entecavir en los pacientes coinfectados por el VIH que no estén siguiendo tratamiento antirretroviral concomitante67.
Finalmente, cabe destacar que la tolerabilidad del entecavir es buena, similar a la de lamivudina, aunque el uso de dosis elevadas se ha asociado a la aparición de neoplasias en modelos experimentales68.
TelbivudinaLa telbivudina, enantiómero de la D-timidina, es un potente inhibidor de la polimerasa del VHB69. Su uso fue autorizado por la EMEA en abril de 2007, también se ha aprobado en España (Sebivo) y se espera su comercialización próximamente. Es un fármaco que está generando gran interés debido a los buenos resultados documentados en su sólido estudio de registro29.
Este estudio, denominado GLOBE por el gran número de países que participaron, constituye probablemente el más consistente de los efectuados sobre tratamientos orales en la hepatitis B. Incluyó a 1.367 pacientes (921 con HBeAg positivo y 446 con HBeAg negativo), que fueron aleatorizados para recibir telbivudina o lamivudina durante 2 años, de modo que los datos obtenidos en tratamientos de más de un año no hacen referencia a subpoblaciones de pacientes seleccionados, sino a la totalidad de los incluidos. Los resultados se analizaron según la intención de tratar. Al final del primer año, la telbivudina se mostró significativamente superior a la lamivudina en la negativización del ADN del VHB (< 300 copias/ml por PCR) en pacientes con HBeAg positivo (el 60 frente al 40%), aunque la tasa de seroconversión fue similar para ambos fármacos (el 23% con telbivudina y el 22% con lamivudina). A los 2 años, el 56% de los pacientes tratados con telbivudina mantenía el ADN viral en valores indetectables, frente a sólo el 39% de los tratados con lamivudina, mientras que el 30 y el 25%, respectivamente, habían seroconvertido. El mantenimiento de la respuesta se observó en el 83% de los pacientes, después de un tiempo medio de haber interrumpido el tratamiento de 35 semanas en los que habían mantenido la medicación al menos un año, y tras confirmar la pérdida del antígeno HBe durante más de 6 meses.
En la población con HBeAg negativo, los resultados después de las primeras 52 semanas mostraron también que el ADN viral se negativizó con una frecuencia significativamente mayor en los pacientes tratados con telbivudina que en los tratados con lamivudina (el 88 frente al 71%). A los 2 años, el 82% de los pacientes del grupo de telbivudina seguían presentando ADN indetectable, frente al 57% del grupo de lamivudina.
El perfil de resistencia a la telbivudina es claramente mejor que el de la lamivudina. Al finalizar el primer año de tratamiento, el 3 y el 2% de los pacientes con HBeAg positivo o negativo, respectivamente, desarrollaron resistencias a la telbivudina, frente al 8 y el 9% en el grupo tratado con lamivudina. A los 2 años de tratamiento, teniendo en cuenta el total de pacientes incluidos en el estudio analizados por intención de tratar, las resistencias fueron del 21 y el 8%, frente al 35 y el 22%, respectivamente. Los pacientes que desarrollan resistencia tenían cargas virales basales muy elevadas. Las características basales (concentración de ADN viral y cifras de transaminasas) y la evaluación de la respuesta tras 24 semanas de tratamiento son útiles para predecir la eficacia del tratamiento a largo plazo e identificar en qué pacientes puede ser conveniente modificar el tratamiento o continuarlo70,71.
El perfil de tolerabilidad observado para la telbivudina ha sido bueno y comparable a lamivudina.
RESUMEN, PERSPECTIVAS Y CONCLUSIONESEl tratamiento de la hepatitis B crónica ha progresado sustancialmente desde los días en que el único fármaco disponible era el IFN alfa convencional. La introducción de nuevos fármacos, además de mejorar los resultados, ha ampliado las opciones terapéuticas y permite al médico ser más ambicioso en la consecución de los principales objetivos del tratamiento. Sin embargo, ninguna de los tratamientos disponibles es plenamente satisfactorio y la elección del tratamiento es una cuestión difícil y llena de matices.
El tratamiento con PEG-IFN tiene varias ventajas y algunos inconvenientes. Entre las primeras, destacan la duración limitada del tratamiento, la duración mantenida de la respuesta en caso de que ésta hubiera sido favorable en pacientes con HBeAg positivo, así como la posibilidad de alcanzar la seroconversión para HBsAg. Entre los segundos, figura su elevado coste, la aparición de efectos adversos y la relativamente baja tasa de eficacia en términos de respuesta sostenida, particularmente en pacientes con HBeAg negativo. No obstante, se dispone de datos que permiten predecir una buena respuesta a este tratamiento, particularmente en pacientes con HBeAg positivo, lo que puede facilitar la elección de este tratamiento en algunos casos.
La introducción de la lamivudina constituyó un hito fundamental en el tratamiento de la hepatitis B crónica, pero su potencia antiviral ha sido superada por otros fármacos, como entecavir o telbivudina. Lamivudina tiene el inconveniente adicional de que frecuentemente el VHB desarrolla cepas resistentes que disminuyen o anulan los efectos favorables del tratamiento. La posible aparición de resistencia obliga a mantener un control atento durante el tratamiento. A pesar de estos inconvenientes, muchos pacientes responden bien al tratamiento con lamivudina y, con tratamiento continuado, mantienen la respuesta durante largo tiempo. La buena tolerancia y el bajo coste del tratamiento con lamivudina, en comparación con otros fármacos, son datos que hay que tener presente a la hora de decidir el tratamiento.
El adefovir es menos potente que otros análogos, por lo que posiblemente no es una buena elección como tratamiento inicial en pacientes en los que, por su situación clínica delicada, se estime que la supresión rápida de la replicación del virus sea un objetivo muy importante. Sin embargo, su perfil de resistencia es favorable en comparación con lamivudina y ha mostrado buenos resultados en tratamientos a largo plazo, si bien su elevado coste e, incluso, la posible aparición de resistencia, son inconvenientes que hay que tener en cuenta. La gran ventaja de adefovir es su actividad frente a cepas resistentes a lamivudina, situación en la que el tratamiento combinado se ha mostrado claramente satisfactorio. Es probable que tenofovir pueda en el futuro reemplazar con ventaja a adefovir.
Entecavir es uno de los análogos con más potencia antiviral de los disponibles actualmente, si bien su capacidad para inducir seroconversión a anti-HBe en pacientes con HBeAg positivo no es superior a la de lamivudina tras un año de tratamiento. Se dispone de datos muy indicativos de que la barrera genética de entecavir para la aparición de resistencias es elevada, pero no se dispone de información bien contrastada acerca de su utilidad a largo plazo, especialmente en pacientes con HBeAg negativo. Posiblemente, el entecavir sea el fármaco de elección en pacientes con HBeAg positivo y viremia muy elevada, especialmente si se requiere una acción enérgica y rápida. Una desventaja del entecavir frente a lamivudina es su coste más elevado, factor no despreciable cuando se plantean tratamientos de muy larga duración. Recientemente, se ha alertado en contra de su empleo en pacientes coinfectados por el VIH que no reciben tratamiento antirretroviral.
La telbivudina es un fármaco más potente que adefovir y lamivudina, su perfil de resistencia es mejor que el de lamivudina y los datos acerca de su eficacia a 2 años son más consistentes y mejor contrastados que los de otros análogos, por lo que debe considerarse como un fármaco de primera línea que puede ocupar un lugar relevante en el tratamiento de la hepatitis B crónica. Recientemente, del estudio GLOBE han surgido datos muy interesantes acerca del valor pronóstico de la caída de la viremia tras 6 meses de tratamiento con respecto a la eficacia a más largo plazo del tratamiento con telbivudina o lamivudina, lo que facilita el uso de estos fármacos. Se está a la espera de su próxima comercialización en España.
Finalmente, se debe señalar que nuestros conocimientos acerca del tratamiento de la hepatitis B crónica, sin ser rudimentarios, están lejos de ser satisfactorios. Aparte de la incorporación de nuevos fármacos que pudieran erradicar la infección, se deberían investigar opciones terapéuticas que exploraran el potencial de combinaciones imaginativas, como podría ser el empleo combinado o secuencial de distintos fármacos. Obtener mejores resultados en términos de eficacia y tolerancia, reducir los costes y adecuar el tratamiento a las necesidades de cada paciente, son objetivos para cumplir en el curso de los próximos años.