La introducción de los tratamientos con antivirales de acción directa (AAD) ha revolucionado el tratamiento de la infección por el virus de la hepatitis C (VHC). Se han conseguido tasas de curación de la infección superiores al 95%, con tratamientos de corta duración, excelente tolerancia y aplicables a la práctica totalidad de los pacientes infectados.
La curación de la infección o respuesta viral sostenida (RVS) es definida como la negativización de la viremia en la semana 12 después del tratamiento. Esta RVS se asocia a una normalización de las pruebas de función hepática y a una mejoría o desaparición de la necroinflamación y la fibrosis hepática en los pacientes sin cirrosis. En los pacientes con cirrosis, la curación se asocia a una disminución, pero no eliminación, del riesgo de eventos clínicos relacionados con la hepatopatía crónica.
La evaluación pretratamiento debe incluir la valoración de la fibrosis hepática por métodos no invasivos. Esta valoración puede ser necesaria para decidir la duración al usar algunas combinaciones de antivirales y es esencial identificar a los pacientes con fibrosis avanzada, quienes requerirán seguimiento a largo plazo una vez curados. En la mayoría de los casos, si se utilizan combinaciones pangenotípicas, no es necesaria la determinación del genotipo para decidir el tratamiento, sin embargo, puede ayudar a diferenciar reinfecciones de recidivas y a conocer la epidemiología de la infección en escenarios concretos, por ejemplo, en brotes de hepatitis aguda.
Durante el tratamiento no es necesario realizar visitas médicas de seguimiento, excepto en los pacientes con riesgo de complicaciones por su enfermedad hepática avanzada o en los que pueda existir duda del cumplimiento terapéutico. Los pacientes curados sin fibrosis o con fibrosis leve (F0-F2) pueden ser dados de alta una vez que se confirme la RVS. Aunque es probable que en muchos casos no sea necesario, hasta que no dispongamos de más datos sobre factores predictivos de evolución, los enfermos con fibrosis avanzada deben ser seguidos de manera indefinida.
Desde el 2014 se han tratado más de 100.000 pacientes en España con estas nuevas combinaciones, consiguiéndose la curación en la mayor parte de ellos. Ahora es necesario dar un paso más al diagnosticar y dar acceso a tratamiento a aquellos pacientes que se encuentran fuera del sistema. Para ello es necesaria una estrategia nacional de eliminación de la infección por el VHC, que debe incluir un cribado de la población y facilitar el acceso a la evaluación de la necesidad de tratamiento antiviral. Las pautas de tratamiento deben ser lo más sencillas posible.
El objetivo de este documento es asistir al médico que va a tratar a los pacientes infectados para la elección del tratamiento más eficaz, seguro y simple. En el 2018, el tratamiento para cualquier paciente con infección por VHC debe basarse en la utilización de AAD sin interferón (IFN) ni ribavirina (RBV).
MetodologíaLa elaboración de esta guía terapéutica se fundamenta en la definición de objetivos previamente establecidos y la revisión sistemática de la literatura dirigida a responder dichos planteamientos. Para su elaboración se ha seguido la metodología AGREE, que se describe en detalle en la página web: www.agreecollaboration.org
Se definieron como objetivos principales los siguientes puntos:
- •
Establecer las recomendaciones de manejo para pacientes naive o pretratados con IFN, de acuerdo con los distintos genotipos virales.
- •
Establecer las recomendaciones ante el fracaso del tratamiento con AAD.
- •
Fundamentar las decisiones de tratamiento en la presencia de situaciones clínicas especiales: infección aguda, cirrosis hepática y descompensación clínica, pacientes trasplantados con recurrencia de la infección por VHC, coinfección por virus de la inmunodeficiencia humana (VIH) e insuficiencia renal.
Las recomendaciones emitidas se califican con una letra, que indica su fuerza (A: debe ofrecerse siempre; B: en general debe ofrecerse; C: debe ofrecerse opcionalmente), y un número, que expresa las pruebas que sustentan dicha recomendación (i: resultados obtenidos a partir de uno o más ensayos clínicos, un metaanálisis o un análisis integrado de ensayos clínicos; ii: datos observacionales de cohortes; iii: opinión de expertos).
Los regímenes están descritos por orden alfabético y no por preferencia o recomendación. Las recomendaciones de tratamiento se encuentran resumidas en las tablas 1 y 2.
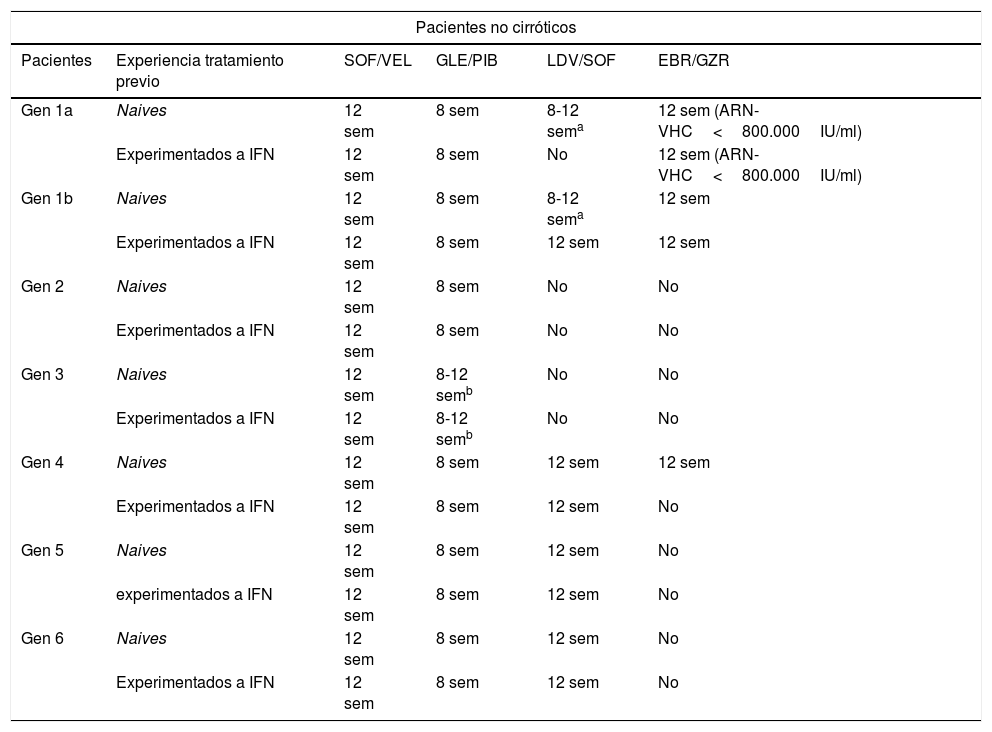
Recomendaciones de tratamiento para la infección crónica por virus de la hepatitis C en pacientes no cirróticos, naive y experimentados a interferón
| Pacientes no cirróticos | |||||
|---|---|---|---|---|---|
| Pacientes | Experiencia tratamiento previo | SOF/VEL | GLE/PIB | LDV/SOF | EBR/GZR |
| Gen 1a | Naives | 12 sem | 8 sem | 8-12 sema | 12 sem (ARN-VHC<800.000IU/ml) |
| Experimentados a IFN | 12 sem | 8 sem | No | 12 sem (ARN-VHC<800.000IU/ml) | |
| Gen 1b | Naives | 12 sem | 8 sem | 8-12 sema | 12 sem |
| Experimentados a IFN | 12 sem | 8 sem | 12 sem | 12 sem | |
| Gen 2 | Naives | 12 sem | 8 sem | No | No |
| Experimentados a IFN | 12 sem | 8 sem | No | No | |
| Gen 3 | Naives | 12 sem | 8-12 semb | No | No |
| Experimentados a IFN | 12 sem | 8-12 semb | No | No | |
| Gen 4 | Naives | 12 sem | 8 sem | 12 sem | 12 sem |
| Experimentados a IFN | 12 sem | 8 sem | 12 sem | No | |
| Gen 5 | Naives | 12 sem | 8 sem | 12 sem | No |
| experimentados a IFN | 12 sem | 8 sem | 12 sem | No | |
| Gen 6 | Naives | 12 sem | 8 sem | 12 sem | No |
| Experimentados a IFN | 12 sem | 8 sem | 12 sem | No | |
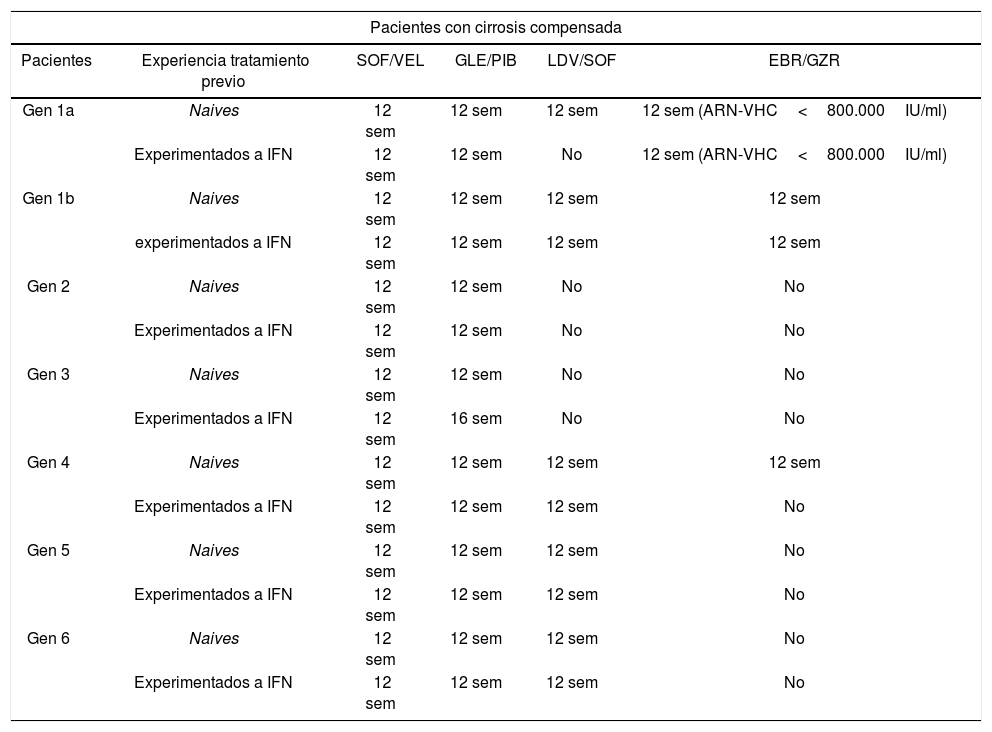
Recomendaciones de tratamiento para la infección crónica por virus de la hepatitis C en pacientes cirróticos, naive y experimentados a interferón
| Pacientes con cirrosis compensada | |||||
|---|---|---|---|---|---|
| Pacientes | Experiencia tratamiento previo | SOF/VEL | GLE/PIB | LDV/SOF | EBR/GZR |
| Gen 1a | Naives | 12 sem | 12 sem | 12 sem | 12 sem (ARN-VHC<800.000IU/ml) |
| Experimentados a IFN | 12 sem | 12 sem | No | 12 sem (ARN-VHC<800.000IU/ml) | |
| Gen 1b | Naives | 12 sem | 12 sem | 12 sem | 12 sem |
| experimentados a IFN | 12 sem | 12 sem | 12 sem | 12 sem | |
| Gen 2 | Naives | 12 sem | 12 sem | No | No |
| Experimentados a IFN | 12 sem | 12 sem | No | No | |
| Gen 3 | Naives | 12 sem | 12 sem | No | No |
| Experimentados a IFN | 12 sem | 16 sem | No | No | |
| Gen 4 | Naives | 12 sem | 12 sem | 12 sem | 12 sem |
| Experimentados a IFN | 12 sem | 12 sem | 12 sem | No | |
| Gen 5 | Naives | 12 sem | 12 sem | 12 sem | No |
| Experimentados a IFN | 12 sem | 12 sem | 12 sem | No | |
| Gen 6 | Naives | 12 sem | 12 sem | 12 sem | No |
| Experimentados a IFN | 12 sem | 12 sem | 12 sem | No | |
Para el tratamiento de la infección por VHC genotipo 1a se recomiendan las siguientes combinaciones: elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir y sofosbuvir/velpatasvir.
Elbasvir/grazoprevirLa combinación elbasvir/grazoprevir se recomienda en pacientes naive y pretratados con IFN, sin cirrosis o con cirrosis compensada (Child A), con una viremia basal inferior a 800.000UI/ml, con una duración de 12 semanas. Esta recomendación se basa en los estudios C-EDGE TN o TE1,2, en los que se observó una tasa de RVS del 92% para pacientes naive (144/157) y pretratados con IFN (55/60). En un análisis integrado de todos los pacientes con genotipo 1a (incluidos aquellos en estudios fase ii y fase iii con esta combinación) se observó una tasa de RVS del 99% (121/122) en los pacientes con una carga viral inferior a 800.000UI/ml3. Por el contrario, la tasa de RVS se vio disminuida en el grupo de pacientes con una carga viral mayor de 800.000UI/ml que tenían resistencias basales a inhibidores de NS5a. Dado que nuestra guía no propone la realización de resistencias basales antes de iniciar tratamiento y que existen otras opciones terapéuticas, no se recomienda su uso en este grupo de pacientes con genotipo 1a y carga viral basal mayor de 800.000 copias3.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Glecaprevir/pibrentasvirLa combinación glecaprevir/pibrentasvir se recomienda en pacientes naive y pretratados con IFN, con una duración de 8 semanas en los pacientes no cirróticos y de 12 semanas en los pacientes con cirrosis. Esta recomendación está basada en los estudios ENDURANCE-1, donde la tasa de RVS fue del 98% (150/152) en pacientes sin cirrosis con 8 semanas de tratamiento4, y EXPEDITION-15, con una tasa de RVS del 98% (47/48) en pacientes con cirrosis, con una duración de 12 semanas.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Ledipasvir/sofosbuvirLa combinación ledipasvir/sofosbuvir se recomienda en pacientes naive sin cirrosis o con cirrosis compensada, con una duración de 12 semanas. Los pacientes naive, no cirróticos y con una carga viral menor de 6.000.000UI/ml pueden ser tratados durante 8 semanas. Esta recomendación se basa en los resultados de los estudios ION-1, ION-3 y ION-46–8, así como en numerosos estudios de práctica real publicados. La tasa de RVS en pacientes naive con y sin cirrosis en el estudio ION 1 fue del 98% (141/144)6. La tasa de RVS en el estudio de vida real en España fue del 95,8%9.
No se recomienda la administración de esta pauta en pacientes pretratados con IFN debido a que precisa de la adición de RBV3. Esta combinación puede administrarse en pacientes con cirrosis descompensada (ver la sección dedicada a pacientes descompensados).
Sofosbuvir/velpatasvirLa combinación sofosbuvir/velpatasvir se recomienda en pacientes naive o pretratados, con o sin cirrosis compensada, con una duración de 12 semanas. Esta recomendación se basa en el estudio ASTRAL-110, en el que se obtuvo una tasa de RVS del 98% (206/210), incluyendo pacientes cirróticos y no cirróticos con todos los genotipos. En el estudio POLARIS-2 se obtuvo una tasa de RVS del 98% en los pacientes naive11. Estos resultados han sido confirmados en estudios de vida real12,13.
Esta combinación puede administrarse en pacientes con cirrosis descompensada (ver la sección dedicada a pacientes descompensados).
Recomendaciones genotipo 1aSe puede utilizar cualquiera de estas combinaciones:
- -
Elbasvir/grazoprevir 12 semanas en pacientes con carga viral basal menor de 800.000UI/ml (BI).
- -
Glecaprevir/pibrentasvir 8 semanas en pacientes sin cirrosis y 12 semanas en pacientes con cirrosis (AI).
- -
Ledipasvir/sofosbuvir 12 semanas en pacientes naive (AI). En pacientes naive, sin cirrosis y con carga viral menor de 6.000.000UI/ml puede acortarse a 8 semanas (BII).
- -
Sofosbuvir/velpatasvir 12 semanas en todos los pacientes (AI).
Para el tratamiento de la infección por VHC genotipo 1b se recomiendan las siguientes combinaciones: elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir, sofosbuvir/velpatasvir.
Elbasvir/grazoprevirLa combinación elbasvir/grazoprevir se recomienda en pacientes naive y pretratados con IFN, sin cirrosis o con cirrosis compensada (Child A), con una duración de 12 semanas. Esta recomendación se basa en los resultados del estudio C-EDGE-TN1(naive) y C-EDGE-TE2 (experimentados), en el que se obtuvieron tasas de RVS del 99% (129/131) y del 100% (34/34), respectivamente. Un análisis integrado de todos los estudios fase ii y iii demostró una tasa de RVS del 97% (1.040/1.070)14.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Glecaprevir/pibrentasvirLa combinación glecaprevir/pibrentasvir se recomienda en pacientes naive y pretratados con IFN, con una duración de 8 semanas en los pacientes no cirróticos y de 12 semanas en aquellos con cirrosis. Esta recomendación está basada en los estudios ENDURANCE-14, donde la tasa de RVS fue del 100% (198/198) en pacientes sin cirrosis con 8 semanas de tratamiento, y EXPEDITION-15, con una tasa de RVS del 100% (39/39) en pacientes con cirrosis, con una duración de 12 semanas.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Ledipasvir/sofosbuvirLa combinación ledipasvir/sofosbuvir se recomienda en pacientes naive o pretratados con IFN, sin cirrosis o con cirrosis compensada, con una duración de 12 semanas. Los pacientes naive con una carga viral menor de 6.000.000UI/ml pueden ser tratados durante 8 semanas. Esta recomendación se basa en los resultados de los estudios ION-1, ION-3 y ION-46–8, así como en numerosos estudios de práctica real publicados12,13. En el estudio ION-1, la tasa de RVS en pacientes naive con y sin cirrosis fue del 100% (66/66)6. En un análisis integrado de los estudios en fase ii y iii en pacientes cirróticos se evidenció una tasa de RVS del 96%6 en pacientes naive y del 96% (124/129) en los pacientes experimentados a IFN. La tasa de RVS en el estudio de vida real en España fue del 97%9.
Esta combinación puede administrarse en pacientes con cirrosis descompensada (ver la sección dedicada a pacientes descompensados).
Sofosbuvir/velpatasvirLa combinación sofosbuvir/velpatasvir se recomienda en pacientes naive o pretratados con IFN, con o sin cirrosis compensada, con una duración de 12 semanas. Esta recomendación se basa en el estudio ASTRAL-110, en el que se obtuvo una tasa de RVS del 99% (117/118), incluyendo todo tipo de pacientes. Estos resultados han sido confirmados en estudios de vida real12,13.
Esta combinación puede administrarse en pacientes con cirrosis descompensada (ver la sección dedicada a pacientes descompensados).
Recomendaciones genotipo 1bSe puede utilizar cualquiera de estas combinaciones:
- –
Elbasvir/grazoprevir 12 semanas (AI).
- –
Glecaprevir/pibrentasvir 8 semanas en pacientes sin cirrosis y 12 semanas en pacientes con cirrosis (AI).
- –
Ledipasvir/sofosbuvir 12 semanas (AI). En pacientes naive sin cirrosis y con carga viral menor de 6.000.000UI/ml puede acortarse a 8 semanas (BII).
- –
Sofosbuvir/velpatasvir 12 semanas en todos los pacientes (AI).
Para el tratamiento de la infección por VHC genotipo 2 se recomiendan las siguientes combinaciones: glecaprevir/pibrentasvir y sofosbuvir/velpatasvir.
Glecaprevir/pibrentasvirLa combinación glecaprevir/pibrentasvir se recomienda en pacientes naive y pretratados con IFN o sofosbuvir más RBV, con una duración de 8 semanas en los pacientes no cirróticos y 12 semanas en aquellos con cirrosis. Esta recomendación está basada en los resultados del estudio fase ii SURVEYOR-215, en el que se consiguió una tasa de RVS del 98% (53/54) en pacientes sin cirrosis tratados durante 8 semanas. Estos resultados fueron confirmados en el estudio CERTAIN-216 (127/129) en pacientes japoneses. En pacientes con cirrosis tratados durante 12 semanas se obtuvo una tasa RVS del 100% (31/31) en el estudio EXPEDITION-15 y en el CERTAIN-216 en pacientes japoneses.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Sofosbuvir/velpatasvirLa combinación sofosbuvir/velpatasvir se recomienda en pacientes naive o pretratados con o sin cirrosis compensada, con una duración de 12 semanas. Esta recomendación se basa en el estudio ASTRAL-217, en el que se obtuvo una tasa de RVS del 99% (133/134), incluyendo todo tipo de pacientes con genotipo 2. Estos resultados han sido confirmados en estudios de vida real13.
Esta combinación puede administrarse en pacientes con cirrosis descompensada (ver la sección dedicada a pacientes descompensados).
Recomendaciones genotipo 2Se puede utilizar cualquiera de estas combinaciones:
- –
Glecaprevir/pibrentasvir 8 semanas en pacientes sin cirrosis y 12 semanas en pacientes con cirrosis (AI).
- –
Sofosbuvir/velpatasvir 12 semanas en todos los pacientes (AI).
Las combinaciones disponibles para el tratamiento de la infección por VHC genotipo 3 son: sofosbuvir/velpatasvir y glecaprevir/pibrentasvir.
Sofosbuvir/velpatasvirEn pacientes no cirróticos se recomiendan 12 semanas. Esta recomendación está basada en el estudio ASTRAL-317, en el que se obtuvo una tasa RVS del 98% (160/163). En pacientes cirróticos se recomienda también la utilización de 12 semanas sin RBV. Esta recomendación está basada en el estudio ASTRAL-317, en el que se obtuvo una tasa de respuesta sin RBV del 91% (73/80), y en el estudio POLARIS-311, en el que la tasa fue del 96% (105/109), también sin RBV. Un estudio reciente obtuvo una tasa de RVS en pacientes cirróticos tratados con RBV del 96% (99/103), y del 91% (92/101) sin RBV18. El beneficio de la RBV se observó fundamentalmente en los pacientes con resistencias basales en el gen NS5a. Por ello, la recomendación de usar RBV en pacientes en los que exista evidencia de resistencias en NS5a fue debatida dentro del panel, siendo votada a favor por un 42% de los miembros, frente a la opción de usar sofosbuvir/velpatasvir sin RBV en todos los pacientes, que fue soportada por un 58%.
Glecaprevir/pibrentasvirEn pacientes no cirróticos se recomienda el tratamiento con glecaprevir/pibrentasvir durante 8 semanas. Esta recomendación está basada en el estudio ENDURANCE-319, en el cual la tasa de RVS global fue del 95% (149/157) para el tratamiento de 8 semanas y del 96% (223/233) para el de 12 semanas. En pacientes con resistencias basales en NS3, la tasa de RVS con 8 semanas fue del 86% (19/22) y con resistencias en NS5a (A30K) del 76% (12/16). Igualmente, en pacientes con F3 la tasa de RVS fue del 89% (24/27). Por ello, cuando exista evidencia de la presencia de estos factores de mal pronóstico (fibrosis F3 o alguna de las resistencias citadas), se recomienda alargar el tratamiento a 12 semanas.
En pacientes cirróticos naive se recomienda la duración de 12 semanas con base en el estudio SURVEYOR-215, en donde la tasa de RVS fue del 100% (48/48). En pacientes cirróticos sin respuesta previa a IFN se recomienda una duración de 16 semanas. Esta recomendación se basa en el mismo estudio.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Recomendaciones genotipo 3Se puede utilizar cualquiera de estas combinaciones:
- –
Glecaprevir/pibrentasvir 8 semanas para pacientes no cirróticos. En caso de que haya factores de mal pronóstico o cirrosis compensada en pacientes naive extender el tratamiento a 12 semanas, y en pacientes con fallo a IFN y cirrosis compensada, a 16 semanas (AI).
- –
Sofosbuvir/velpatasvir 12 semanas en pacientes tanto cirróticos como no cirróticos (AI).
Se consideran recomendadas las combinaciones de elbasvir/grazoprevir, glecaprevir/pibrentasvir, ledipasvir/sofosbuvir y sofosbuvir/velpatasvir.
Elbasvir/grazoprevirSe recomienda elbasvir/grazoprevir durante 12 semanas en pacientes naive. En un análisis conjunto de ensayos clínicos con elbasvir/grazoprevir, 97 de 101 (96%) enfermos con genotipo 4, naive, tratados durante 12 semanas, sin RBV, lograron RVS12. Por el contrario, solo 39 de 44 (89%) de los pretratados respondieron20, por lo que esta pauta no es aconsejable en este escenario.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Glecaprevir/pibrentasvirSe recomienda la utilización de glecaprevir/pibrentasvir durante 8 semanas en pacientes sin cirrosis y 12 semanas en aquellos con cirrosis. En el ensayo de fase iii ENDURANCE-4 se incluyeron 76 pacientes naive o pretratados con Peg-IFN y/o RBV y/o sofosbuvir, sin cirrosis hepática, que recibieron glecaprevir/pibrentasvir durante 12 semanas21. De ellos, 76 (99%) lograron RVS12. En un análisis integrado de ensayos clínicos con glecaprevir/pibrentasvir en el que se incluyeron 62 enfermos con genotipo 4 no cirróticos tratados durante 8 semanas, 59 (95%) lograron RVS12 en el análisis por intención de tratar, pero ninguno de los 3 que no la alcanzaron tuvo un fallo virológico, por lo que la tasa de RVS por intención de tratar modificada fue del 100%22.
En el ensayo en fase 3 EXPEDITION-1 se seleccionaron 16 pacientes con genotipo 4 y cirrosis compensada y fueron tratados durante 12 semanas con glecaprevir/pibrentasvir; todos lograron RVS125. Los datos de vida real comunicados hasta la fecha (registro alemán y estudio NAVIGATOR-II23), aunque aún escasos, son coherentes con los del EXPEDITION-1.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Ledipasvir/sofosbuvirSe recomienda la utilización de ledipasvir/sofosbuvir durante 12 semanas. En el estudio SYNERGY24, de 21 pacientes (33% cirróticos), 20 (95%) lograron RVS12. En un estudio multicéntrico francés25, 31 de 34 (91%) pacientes no cirróticos y los 10 (100%) cirróticos incluidos lograron RVS12. Los datos comunicados de práctica clínica, con un mayor número de pacientes que en ensayos clínicos, han mostrado también tasas de RVS superiores al 95%.
Sofosbuvir/velpatasvirSe recomienda la utilización de sofosbuvir/velpatasvir durante 12 semanas. En el ensayo ASTRAL-1, que globalmente incluyó un 19% de cirróticos, se trataron 116 pacientes con genotipo 4 con sofosbuvir/velpatasvir 12 semanas, de los que todos lograron RVS1210. En el ensayo POLARIS-211 se incluyeron 57 pacientes con genotipo 4 tratados con sofosbuvir/velpatasvir y el 98% alcanzó RVS12. Igualmente, los 60 pacientes con genotipo 4 incluidos en un análisis integrado de pacientes con fibrosis avanzada o cirrosis y participantes en ensayos de desarrollo clínico de sofosbuvir/velpatasvir consiguieron RVS1226.
Recomendaciones genotipo 4Se puede utilizar cualquiera de estas combinaciones:
- –
Elbasvir/grazoprevir durante 12 semanas (BI) en pacientes naive.
- –
Glecaprevir/pibrentasvir durante 8 semanas en pacientes sin cirrosis y 12 semanas en pacientes con cirrosis (AI).
- –
Ledipasvir/sofosbuvir durante 12 semanas (BI).
- –
Sofosbuvir/velpatasvir durante 12 semanas (AI).
En estos pacientes se pueden utilizar las pautas glecaprevir/pibrentasvir, ledipasvir/sofosbuvir y sofosbuvir/velpatasvir.
Glecaprevir/pibrentasvirSe recomienda glecaprevir/pibrentasvir durante 8 semanas en pacientes sin cirrosis y durante 12 semanas en pacientes cirróticos. En el estudio ENDURANCE-5,627, cuyos datos han sido presentados solo de manera preliminar, 22 de 23 (96%) pacientes con genotipo 5 y 46 de 47 (98%) con genotipo 6 lograron RVS12, sin diferencias entre cirróticos y no cirróticos. En un análisis integrado de ensayos clínicos con glecaprevir/pibrentasvir que incluyó 30 pacientes con genotipo 5 (2 tratados durante 8 semanas) y 43 con genotipo 6 (12 tratados 8 semanas), el 100% logró RVS1221.
Esta combinación está contraindicada en pacientes cirróticos descompensados o con historia previa de descompensación (ver la sección dedicada a pacientes descompensados).
Ledipasvir/sofosbuvirSe recomienda ledipasvir/sofosbuvir durante 12 semanas. En un estudio multicéntrico francés, 39 de 41 (95%) pacientes con genotipo 5 (9 de ellos cirróticos) consiguieron RVS12 con ledipasvir/sofosbuvir durante 12 semanas28. Este mismo régimen consiguió RVS12 en 24 de 25 (96%) pacientes naive y pretratados con genotipo 6 en un estudio neozelandés29.
Sofosbuvir/velpatasvirSe recomienda sofosbuvir/velpatasvir durante 12 semanas. Veintitrés de 24 (96%) pacientes con genotipo 5 y los 38 (100%) con genotipo 6 tratados durante 12 semanas con sofosbuvir/velpatasvir en el ensayo ASTRAL-1 consiguieron RVS1210. Los 9 pacientes con genotipo 6 en la rama de sofosbuvir/velpatasvir del POLARIS-2 también consiguieron RVS11. En un análisis integrado de pacientes con fibrosis avanzada o cirrosis seleccionados en ensayos clínicos con sofosbuvir/velpatasvir, los 13 (100%) y 20 (100%) con genotipo 5 y 6, respectivamente, consiguieron RVS1226.
Recomendaciones genotipos 5 y 6Se puede utilizar cualquiera de estas pautas:
- –
Glecaprevir/pibrentasvir durante 8 semanas en pacientes sin cirrosis y 12 semanas en pacientes con cirrosis (BI).
- –
Ledipasvir/sofosbuvir durante 12 semanas (BI).
- –
Sofosbuvir/velpatasvir durante 12 semanas (BI).
Aunque la tasa de RVS es cada vez más alta, existe un número limitado de pacientes en los que el tratamiento antiviral previo fracasa. En estos casos es esencial hacer un análisis del cumplimiento terapéutico, así como revisar si recibió el régimen óptimo con la duración adecuada.
El retratamiento debe ser guiado por la probabilidad de respuesta según el perfil individual de resistencias, o bien de acuerdo con el tratamiento previo recibido, de no disponer de la determinación de resistencias.
La combinación sofosbuvir/velpatasvir/voxilaprevir durante 12 semanas se recomienda en pacientes sin cirrosis o con cirrosis compensada y con fracaso a cualquier régimen de AAD. Esta recomendación se basa en los estudios POLARIS-1 y POLARIS-430. En el estudio POLARIS-1, que incluyó pacientes con fallos a regímenes con inhibidores de NS5a y hasta un 46% de pacientes cirróticos, se obtuvo una tasa de RVS del 96% (253/263). En el estudio POLARIS-4, que incluyó pacientes con fallos a regímenes sin inhibidores de NS5a y hasta un 46% de pacientes cirróticos, se obtuvo una tasa de RVS del 98% (178/182), con 12 semanas de tratamiento. No se observó en estos estudios ningún impacto del genotipo ni de las resistencias basales en la tasa de RVS. No existe ningún dato que permita recomendar el uso de RBV.
En pacientes cirróticos descompensados, que no pueden recibir un régimen que contenga un inhibidor de la proteasa, se recomienda sofosbuvir/velpatasvir con RBV durante 24 semanas.
No se recomienda el uso de glecaprevir/pibrentasvir como rescate. Esta recomendación se basa en el estudio MAGELLAN-131. La combinación de sofosbuvir/glecaprevir/pibrentasvir puede ser utilizada como último rescate en pacientes con criterios de mala respuesta. Esta recomendación está basada en la inhibición más potente in vitro conseguida por pibrentasvir en comparación con el resto de los inhibidores de NS5a y en los datos preliminares de un estudio en el que consiguió un 100% de RVS. En el estudio MAGELLAN-332, esta combinación consiguió rescatar 22/23 pacientes con fracaso previo a glecaprevir/pibrentasvir. Aunque no existe ninguna evidencia publicada, esta combinación podría considerarse en el rescate de la combinación sofosbuvir/velpatasvir/voxilaprevir, que en muchos escenarios no alcanza el 100% de respuesta.
Recomendaciones en pacientes con fracaso a tratamiento con antivirales de acción directa- -
Conocer el perfil de resistencias del paciente individual antes del retratamiento es útil, pero no imprescindible para realizarlo (BI).
- -
La combinación sofosbuvir/velpatasvir/voxilaprevir durante 12 semanas está recomendada como terapia de rescate en todos los pacientes sin cirrosis o con cirrosis compensada que han fracasado a un tratamiento previo, con independencia del tipo de tratamiento o del genotipo (AI).
- -
En pacientes con cirrosis descompensada se puede utilizar la combinación sofosbuvir/velpatasvir con RBV durante 24 semanas (BII).
- -
La combinación sofosbuvir/glecaprevir/pibrentasvir debe ser reservada para casos excepcionales, como podría ser el rescate de pacientes en que falla la combinación sofosbuvir/velpatasvir/voxilaprevir (CIII) o glecaprevir/pibrentasvir (BII).
En pacientes con hepatitis aguda por VHC, en términos generales, debe iniciarse tratamiento con AAD. Las pautas recomendadas son ledipasvir/sofosbuvir y elbasvir/grazoprevir.
Las tasas de RVS que se alcanzan en el genotipo 1 con ledipasvir/sofosbuvir, durante 6 semanas, son del 100%33. La RVS a este mismo tratamiento en pacientes infectados por VIH es del 77%. Tanto ledipasvir/sofosbuvir durante 8 semanas34 como elbasvir/grazoprevir durante el mismo período35 dan lugar a tasas de RVS altas, en los genotipos 1 o 4 en la infección por VIH (100 y 98%, respectivamente).
En sujetos con alta probabilidad de aclaramiento espontáneo (edad≤35 años, pico de bilirrubina≥6mg/dL, IL28B CC y caída de ARN-VHC≥1log10 tras 4 semanas de infección o≥2log10 en los pacientes coinfectados por VIH) puede plantearse observación y diferir la decisión de tratar la infección aguda. No hay datos suficientes para sustentar recomendaciones específicas en pacientes con genotipos distintos del 1 y el 4, por lo que el tratamiento será el mismo que el de la infección crónica.
Recomendaciones en la infección aguda por VHC- –
Debe tratarse la infección aguda por genotipo 1 o 4 en todos los pacientes con pocas posibilidades de curación espontánea (AII).
- –
Los pacientes no infectados por VIH y con hepatitis aguda por genotipo 1 o 4 pueden tratarse con ledipasvir/sofosbuvir durante 6 semanas (AI).
- –
Los pacientes infectados por VIH con hepatitis aguda por genotipo 1 o 4 pueden tratarse con elbasvir/grazoprevir durante 8 semanas (AI) o con ledipasvir/sofosbuvir durante 8 semanas (AI).
- –
Las hepatitis agudas por genotipos distintos del 1 y el 4 deben tratarse como las correspondientes infecciones crónicas (AIII).
El tratamiento antiviral está indicado en todos los pacientes con cirrosis descompensada, independientemente de la indicación de trasplante hepático. Lógicamente en aquellos pacientes sin indicación de trasplante, el tratamiento no está indicado en presencia de comorbilidades graves, que condicionen la sobrevida de paciente a corto plazo.
En pacientes con indicación de trasplante es importante recordar que la eliminación del virus se asocia a una mejoría de la función hepática en una proporción significativa de casos; de hecho, se produce la salida de la lista en aproximadamente un 15-20% de los pacientes que obtienen RVS36,37. Con los datos disponibles, parece que el mayor beneficio se obtiene en aquellos individuos con un MELD inferior a 18-20. En pacientes con MELD muy altos no parece que el tratamiento antiviral suponga un beneficio claro y, por lo tanto, este puede demorarse hasta una vez el paciente haya sido trasplantado3.
Es importante recordar que en este grupo de pacientes está contraindicada la utilización de inhibidores de proteasa y que, por lo tanto, el tratamiento se basará en la combinación de sofosbuvir y un inhibidor de la proteína NS5a (sofosbuvir/ledipasvir, sofosbuvir/velpatasvir).
En pacientes con indicación de trasplante hepático por carcinoma hepatocelular, el tratamiento antiviral debe individualizarse. Existen estudios que evidencian una asociación temporal entre la administración de AAD y la recurrencia del carcinoma hepatocelular38,39. No obstante, estos hallazgos son controvertidos y otros estudios retrospectivos, de cohortes y metaanálisis no han confirmado dicha asociación.
Los regímenes terapéuticos recomendables en pacientes con cirrosis descompensada son ledipasvir/sofosbuvir y sofosbuvir/velpatasvir.
Ledipasvir/sofosbuvirLos estudios SOLAR-1 y SOLAR-2 evaluaron la eficacia de ledipasvir/sofosbuvir con RBV, durante 12 o 24 semanas, en pacientes Child B7 a C12, mayoritariamente genotipo 139,40. Incluyeron más de 300 pacientes, el 70% pretratados y el 58% genotipo 1a. Las tasas de RVS a las 12 semanas oscilaron entre el 83-94%, sin diferencias con las tasas obtenidas en aquellos tratados durante 24 semanas. La eficacia en el genotipo 4 fue del 57% (SOLAR-1) y el 86% tras 12 o 24 semanas de tratamiento (SOLAR-2).
En la cohorte británica de vida real, en la que se incluyeron 280 pacientes, mayoritariamente Child B y C, la combinación ledipasvir/sofosbuvir con o sin RBV, durante 12 semanas, obtuvo una eficacia en genotipo 1 del 86 y el 81%, respectivamente. Esta combinación (con y sin RBV) se evaluó igualmente en pacientes infectados por genotipo 3, siendo la cifra de RVS del 59 y 43%, respectivamente, por lo que se considera subóptima41.
Sofosbuvir/velpatasvirEn el estudio ASTRAL-4 se evaluó la eficacia de sofosbuvir/velpatasvir, con o sin RBV, 12 o 24 semanas en pacientes con cirrosis descompensada (solo Child B)42. Se incluyeron 267 pacientes y la tasa global de RVS en pacientes tratados durante 12 semanas, sin RBV, fue del 83%, siendo por subgrupos, en genotipo 1a: 88%; 1b: 89%; 2: 100%; 3: 50%, y 4: 100%. Con RBV, la RVS global fue del 94%; en genotipo 1a: 94%; 1b: 100%; 2: 100%; 3: 85%, y 4: 100%.
Recomendaciones en la cirrosis hepática por VHC y descompensación clínica- –
En general, el tratamiento antiviral está indicado en todos los pacientes con cirrosis descompensada que no presenten comorbilidades graves que condicionen la sobrevida del paciente (AI).
- –
En pacientes en lista de espera de trasplante, el tratamiento antiviral prevendría la infección del injerto y, en una proporción considerable de casos (15-20%), puede evitar el trasplante hepático al mejorar la función hepática (AII).
- –
La mejoría en la función hepática se ha observado particularmente en pacientes con MELD<20. Por dicho motivo, en los pacientes con cirrosis descompensada grave (MELD≥20) se recomienda posponer el tratamiento a después del trasplante hepático (BII).
- –
La pauta terapéutica recomendada en estos pacientes es la combinación de velpatasvir y sofosbuvir durante 12 semanas. Siempre que sea posible se recomienda la utilización de RBV; en caso de que no sea posible, se alargará el tratamiento a 24 semanas (AI).
- –
En el paciente en lista de espera de trasplante por carcinoma hepatocelular la prioridad debe ser el tratamiento del cáncer. La indicación de tratamiento antiviral debe individualizarse, ya que no puede descartarse la posible influencia de la utilización de AAD en la progresión tumoral (BII).
En nuestro medio, la cirrosis por el VHC era la principal indicación de trasplante hepático hasta hace poco. El tratamiento de pacientes cirróticos infectados por el VHC ha hecho que la indicación de trasplante por descompensación en este grupo de pacientes se haya reducido de forma significativa43. Además, gran parte de los pacientes con carcinoma hepatocelular en el contexto de una cirrosis por el VHC e indicación de trasplante ya han recibido tratamiento con AAD y no presentan una infección activa por el VHC. Si a ello se suma el hecho de que la mayoría de los pacientes trasplantados de hígado con infección por VHC ya han recibido tratamiento durante los últimos años, son pocos los pacientes que actualmente requieren tratamiento en el postrasplante.
A pesar de las consideraciones previas, disponemos de regímenes terapéuticos eficaces y seguros para erradicar la infección en este colectivo.
Los tratamientos que se recomiendan en pacientes receptores de trasplante hepático son: ledipasvir/sofosbuvir, glecaprevir/pibrentasvir y sofosbuvir/velpatasvir.
Ledipasvir/sofosbuvirLa combinación de ledipasvir/sofosbuvir+RBV durante 12 (vs. 24) semanas es una opción que ha sido estudiada en 2 ensayos clínicos44,45, obteniéndose unas tasas de curación cercanas al 100% en pacientes F0-F4 y superiores al 80% en pacientes con cirrosis descompensada (CPT B y C), independientemente de la duración del tratamiento. En estos estudios, donde se incluyeron fundamentalmente pacientes infectados por el genotipo 1, la frecuencia de RVS fue del 96-98% en pacientes sin cirrosis (108/111) o con cirrosis compensada (49/51), del 85-88% (45/52) en aquellos con disfunción moderada y del 60-75% (6/9) en los pacientes con insuficiencia hepática grave. El perfil de seguridad fue muy bueno.
Glecaprevir/pibrentasvirEl ensayo MAGELLAN-2 evaluó la seguridad y la eficacia del tratamiento con glecaprevir/pibrentasvir en 100 pacientes trasplantados hepáticos (80) y renales (20)46. Se incluyeron pacientes a partir de los 3 meses del trasplante, infectados con cualquier genotipo (1, 2, 4-6) y naive o previamente tratados con IFN y RBV (con o sin sofosbuvir). La mayoría de los pacientes tenían fibrosis leve (no se incluyeron individuos con cirrosis). La duración del tratamiento fue de 12 semanas. La tasa de RVS fue del 98% y solo se constató un fallo virológico en un paciente trasplantado hepático infectado por el G3 y con fibrosis leve. No se observaron efectos adversos graves relacionados con la medicación. Cabe destacar que glecaprevir puede interaccionar de forma leve con inmunosupresores de uso frecuente, como la ciclosporina A y el tacrolimus, por lo que se recomienda monitorización de sus niveles durante el tratamiento.
Sofosbuvir/velpatasvirEsta pauta terapéutica se ensayó en 79 pacientes trasplantados hepáticos infectados por diversos genotipos (47% genotipo 1, 4% genotipo 2, 44% genotipo 3 y 5% genotipo 4)47. Los pacientes recibieron tratamiento con sofosbuvir/velpatasvir, sin RBV, por espacio de 12 semanas. Un 18% tenía cirrosis compensada y el 60% habían recibido tratamiento previo. La mediana del tiempo de trasplante al inicio del tratamiento fue de 7 años. La tasa de RVS fue del 96%. Solo se registraron 2 fallos virológicos: un paciente con genotipo 1, naive y no cirrótico, y un paciente con genotipo 3, no cirrótico y con tratamiento previo. No se reportaron efectos adversos atribuibles al tratamiento.
Recomendaciones en pacientes trasplantados con recurrencia de la infección por VHC- –
El tratamiento de la hepatitis C postrasplante está indicado en todos los pacientes (AI).
- –
La utilización de regímenes terapéuticos pangenotípicos es la opción más recomendable en estos momentos. Tanto la combinación de glecaprevir/pibrentasvir como sofosbuvir/velpatasvir, sin RBV, y durante un período de 12 semanas, serían las pautas terapéuticas a utilizar para el tratamiento de la hepatitis C en pacientes trasplantados (AI).
- –
En el caso de la utilización de glecaprevir/pibrentasvir es aconsejable la monitorización de los niveles de inmunosupresores, especialmente en el caso de ciclosporina (BII).
- –
En pacientes con cirrosis hepática compensada del injerto, infectados por el genotipo 3, las recomendaciones para la utilización de estas 2 pautas terapéuticas son las mismas que para pacientes inmunocompetentes (BII).
- –
En pacientes con cirrosis hepática descompensada las pautas serán las mismas que las utilizadas en pacientes no trasplantados (BII).
Algunos datos indican que las tasas de RVS podrían ser ligeramente inferiores en la coinfección por VIH/VHC. En la hepatitis aguda, las pautas de 6 semanas que son muy eficaces en individuos sin infección por VIH dan lugar a unas peores tasas de RVS en los infectados por VIH. En la hepatitis crónica, en la mayor parte de los estudios existe una pequeña diferencia en la frecuencia de RVS en contra de los coinfectados por VIH/VHC48–50, consecuencia de una mayor tasa de recidivas. Antes de plantear un tratamiento con AAD en la coinfección por VIH/VHC, deben revisarse las interacciones potenciales entre el tratamiento antirretroviral y los AAD. Para ello resulta muy útil consultar la web de interacciones en hepatitis vírica de la Universidad de Liverpool (https://www.hep-druginteractions.org).
Recomendaciones en la coinfección por VIH- –
Los pacientes con hepatitis crónica por VHC e infección por VIH deben tratarse con la misma pauta que aquellos sin infección por VIH (AI).
- –
No deben emplearse pautas de corta duración no probadas en ensayos clínicos en la coinfección por VIH/VHC. Pueden plantearse de forma individualizada en pacientes con altas probabilidades de respuesta (BII).
- –
Deben revisarse las interacciones potenciales entre la terapia antirretroviral y los AAD actuales antes de iniciar un tratamiento con estos fármacos (AI).
Las opciones de tratamiento para los individuos con aclaramiento de creatinina<30ml/min/1,73m2 se restringen a elbasvir/grazoprevir y glecaprevir/pibrentasvir.
Si el uso de RBV es necesario, debe iniciarse con dosis bajas (200-400mg cada 24-48h) y ajustar según los niveles de hemoglobina. Los pacientes en estadio CKD 4, es decir, con filtrado de 15-29ml/min/1,73m2, si es posible no deben recibir sofosbuvir dado que el sofosbuvir y su principal metabolito se eliminan por vía renal51. En la cohorte TARGET, los tratamientos basados en sofosbuvir en pacientes en estadio CKD 4 o 5 dieron lugar a tasas de RVS y tolerabilidad similares a las del resto de los pacientes, aunque con un mayor riesgo de deterioro de la función renal52. En los pacientes con insuficiencia renal crónica en estadio CKD 3 (filtrado de 30-59ml/min/1,73m2) se deben seguir las recomendaciones generales de tratamiento sin ajuste de dosis.
Elbasvir/grazoprevirElbasvir/grazoprevir es un régimen seguro y eficaz en pacientes infectados por genotipo 1 con aclaramiento de creatinina<30ml/min/1,73m2. En el estudio C-SURFER53,54, 212 de 221 (96%) pacientes (6% cirróticos) tratados con elbasvir/grazoprevir 50/100mg/24h consiguieron RVS, con una frecuencia similar de efectos adversos en los grupos placebo y tratado. En un estudio observacional se han confirmado estos resultados, con tasas de RVS del 96% en 747 pacientes en estadio CKD 4 o 555.
Glecaprevir/pibrentasvirGlecaprevir/pibrentasvir se ha ensayado en 104 pacientes en estadio CKD 4 o 5 con distintos genotipos, incluyendo 54 infectados por genotipo 1, en el estudio abierto de un solo brazo EXPEDITION-456. Las tasas de RVS globales fueron del 98%. Los efectos adversos graves observados no fueron atribuibles al tratamiento.
Si se plantea el trasplante renal en sujetos infectados por VHC, debe discutirse el mejor momento para tratar la infección. Los AAD hoy disponibles no interaccionan significativamente con los inmunosupresores empleados para evitar el rechazo (https://www.hep-druginteractions.org), por lo que las opciones se abren a tratar la infección por VHC tanto antes como después del trasplante.
Recomendaciones en la insuficiencia renalEn los pacientes con insuficiencia renal crónica en estadio CKD 4 o 5, es decir, con aclaramiento de creatinina<30ml/min/1,73m2, se deben seguir las siguientes recomendaciones:
- –
Genotipo 1 o 4:
- ∘
Elbasvir/grazoprevir siguiendo las recomendaciones generales (AI para genotipo 1, AIII para genotipo 4).
- ∘
Glecaprevir/pibrentasvir siguiendo las recomendaciones generales (AI)
- ∘
- –
Genotipo 2 o 3:
- ∘
Glecaprevir/pibrentasvir siguiendo las recomendaciones generales (AI).
- ∘
Situaciones en las que no pueda usarse una pauta basada en un inhibidor de la proteasa del VHC (elbasvir/grazoprevir o glecaprevir/pibrentasvir): sofosbuvir/velpatasvir, vigilando la función renal estrechamente (CIII).
- ∘
- –
En los pacientes con insuficiencia renal crónica en estadio CKD 3, es decir, con aclaramiento de creatinina de 30-59ml/min/1,73m2, se deben seguir las recomendaciones generales de tratamiento (AI).
- –
Los pacientes que hayan recibido un trasplante renal pueden recibir tratamiento con AAD siguiendo las recomendaciones generales (AII). La decisión de tratar la infección por VHC antes o después del trasplante renal debe individualizarse (AII).
Los autores declaran los siguientes conflictos de intereses:
JLC: consultor para Abbvie, Gilead y MSD.
XF: consultor para Abbvie y Gilead.
JM: asesor para Abbvie, Gilead y MSD. Ha recibido honorarios por ponencias de Janssen, Gilead y MSD y ha percibido ayudas para asistencia a actividades formativas de Janssen y Gilead.
JAP: asesor para Abbvie, Janssen, Gilead y MSD. Ha recibido soporte para investigación de Abbvie, Janssen, Gilead y MSD. También ha recibido honorarios por ponencias de Abbvie, Janssen, Gilead y MSD y ha percibido ayudas para asistencia a actividades formativas de Janssen y Gilead.
M. Berenguer: ponente para Abbvie, Gilead, MSD, Astellas y Novartis.
M. Buti: consultor para Abbvie, Gilead y MSD.
JAC: ha recibido honorarios por ponencias de Bristol-Myers Squibb, Abbvie, Merck Sharp & Dohme, Roche/Genentech, Intercept y Gilead.
IF: consultor para Abbvie, Janssen, MSD y Gilead.
FG: asesor para ViiV, Gilead, Abbvie, Roche y Hologic. Ha recibido soporte para investigación de Gilead y Roche. También ha recibido honorarios por ponencias de ViiV, Gilead, Abbvie, MSD, Janssen, Roche, BioMérieux, Hologic y Qiagen y ha percibido ayudas para asistencia a actividades formativas de ViiV, Gilead, Abbvie, MSD, Janssen, Roche, BioMérieux, Hologic y Qiagen.
MG: asesor para Abbvie, Janssen, Gilead y MSD. Ha recibido soporte para investigación de Abbvie, Janssen, Gilead y MSD. También ha recibido honorarios por ponencias de Abbvie, Janssen, Gilead y MSD y ha percibido ayudas para asistencia a actividades formativas de Janssen y Gilead.
RG: asesor para Janssen y Abbvie. Ha recibido honorarios por ponencias de Janssen, Gilead, MSD, Abbvie y Bristol-Myers Squibb y ha percibido ayudas para asistencia a actividades formativas de Abbvie, Gilead, MSD y Janssen.
LM: asesor para Abbvie, Janssen y Gilead. Ha recibido honorarios por ponencias de Abbvie, Janssen, Gilead, ViiV y MSD y ha percibido ayudas para asistencia a actividades formativas de Janssen, ViiV, MSD y Gilead.
PC: declara no tener ningún conflicto de intereses.
Coordinadores:
José Luis Calleja
Xavier Forns
Juan Macías
Juan Antonio Pineda
Panel de expertos:
Marina Berenguer
María Buti
Jose Antonio Carrión
Inmaculada Fernández
Federico García
Miguel García Deltoro
Rafael Granados
Luis Morano