Las quinolonas son un grupo de antibióticos que pueden causar elevaciones transitorias de las enzimas hepáticas, pero parecen tener un menor potencial hepatotóxico que otros antibióticos, como beta-lactámicos o sulfamidas1,2.
El levofloxacino es una fluoroquinolona de amplio espectro usada para el tratamiento de infecciones del aparato respiratorio, urinario, piel y tejidos blandos3. Su eliminación, concretamente un 87%, es mediante excreción renal sin formación de metabolitos activos de interés4. Presenta un buen perfil de seguridad y es generalmente bien tolerada3. Presentamos un caso de hepatitis colestásica aguda asociada a levofloxacino.
Mujer de 51 años que consulta en nuestro hospital por fiebre, disnea y dolor pleurítico derecho intenso. Tras la realización de toracocentesis diagnóstica se procedió a colocación de tubo de drenaje pleural, con salida accidental de éste y aparición de hidroneumotórax que provoca su recolocación. Fue diagnosticada de derrame pleural derecho paraneumónico, iniciando tratamiento con levofloxacino (500mg cada 12h, por vía oral) y ceftriaxona (2g cada 24h, por vía intravenosa).
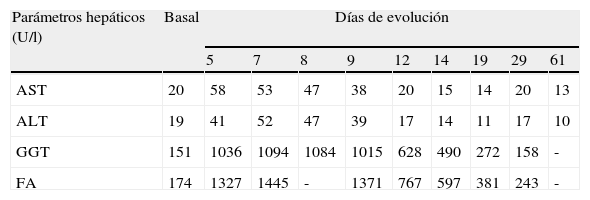
Transcurridos 5 días de tratamiento con levofloxacino, se observaron los siguientes hallazgos analíticos que motivaron su suspensión: ALT 41 (VN 10-40 U/l), AST 58 (8-30 U/l), GGT 1.036 (10-30 U/l), fosfatasa alcalina 1.327 (90-360 U/l) y actividad de protrombina 86%. Otros parámetros analíticos destacables fueron: hemoglobina 10,6 (12-15,6mg/dl), leucocitos 15,1 × 109/l (4,2-10,6 × 109/l) y albúmina 29 (34-48g/l). El resto de los parámetros se mostraban normales (bilirrubina, glucemia y función renal). La serología para el virus de la hepatitis A, B y C fue negativa. La ecografía abdominal mostraba un hígado de morfología normal con un hemangioma en el segmento VII del lóbulo hepático derecho de 5mm, vía biliar y vesícula normales, y una lesión nodular renal izquierda sólida de 2cm. Se suspendió el tratamiento con levofloxacino, siguiendo con ceftriaxona y posteriormente con amoxicilina/ácido clavulánico (1g cada 8h, por vía intravenosa). Los parámetros hepáticos mejoraron al suspender levofloxacino, normalizándose a los 24 días excepto el valor de GGT que estaba elevado basalmente (tabla 1).
Evolución de los parámetros hepáticos
| Parámetros hepáticos (U/l) | Basal | Días de evolución | ||||||||
| 5 | 7 | 8 | 9 | 12 | 14 | 19 | 29 | 61 | ||
| AST | 20 | 58 | 53 | 47 | 38 | 20 | 15 | 14 | 20 | 13 |
| ALT | 19 | 41 | 52 | 47 | 39 | 17 | 14 | 11 | 17 | 10 |
| GGT | 151 | 1036 | 1094 | 1084 | 1015 | 628 | 490 | 272 | 158 | - |
| FA | 174 | 1327 | 1445 | - | 1371 | 767 | 597 | 381 | 243 | - |
AST: aspartato aminotransferasa (VN 8-30 U/l); ALT: alanino aminotransferasa (VN 10-40 U/l); GGT: gamma glutamiltransferasa (VN 10-30 U/l); FA: fosfatasa alcalina (VN 90-360 U/l).
La lesión hepática clasificada por los criterios de la Conferencia Internacional de Consenso5 arrojaba una R=0,37 que correspondía a un patrón colestásico. La escala CIOMS6, que evalúa la probabilidad de que un fármaco produzca daño hepático, clasificó como probable (puntuación total de 8) que levofloxacino en nuestro caso fuese responsable del daño.
Levofloxacino puede producir diferentes efectos adversos entre los que destacan náuseas (1-3%) y diarrea (1-2%), con un promedio reportado de efectos adversos del 6,2%7. En un estudio clínico (314 pacientes) en el que se comparaba levofloxacino 500mg, 2 veces al día, y ceftriaxona para el tratamiento de la neumonía se observó un aumento de los niveles de AST y ALT en un 3,5 y un 4,8% de los pacientes tratados con levofloxacino, respectivamente8. Asimismo, un análisis conjunto de los registros español, sueco y americano de hepatotoxicidad recientemente publicado identificó el levofloxacino como una de las quinolonas con más de 5 casos adjudicados9.
En la literatura se han descrito casos de lesiones hepáticas con el uso de diferentes quinolonas: daño hepatocelular por trovaflocaxino, lesión hepatocelular ictérica y anictérica con ofloxacino y norfloxacino, respectivamente, lesión colestásica por ciprofloxacino y ofloxacino, hepatitis granulomatosa por flumequina y hepatitis fulminante por ciprofloxacino7,10. Respecto a levofloxacino, tras hacer una revisión en Medline entre 1998 y 2010, se han encontrado 7 casos de hepatotoxicidad: cuatro casos atribuibles a levofloxacino7,10–12, y tres tras tratamiento secuencial asociado con diferentes antibióticos13–15. El tipo de daño hepático en casi todos los casos fue de tipo hepatocelular7,10–12,14,15, excepto en uno que fue mixto13, a diferencia de nuestro caso, que es el primero de tipo colestásico. El periodo de latencia fue variable, desde 2 días10 hasta 30 días15, desarrollándose en un caso al quinto día13 como en nuestro caso. En 4 casos el desenlace fue fatal: dos de ellos12,14 por fallo fulminante a los 14 y 27 días, respectivamente, en otro por coma hepático a los 6 días de la suspensión de levofloxacino11 y el último por complicación de la neumonía y fallo multiorgánico10. Los otros 3 casos7,13,15 tuvieron una resolución favorable, con normalización variable de las pruebas hepáticas según el caso (7, 70 y 103 días, respectivamente). En nuestro caso, se normalizaron a los 24 días.
En resumen, levofloxacino ocasionalmente puede producir un amplio espectro de lesiones hepáticas, incluida la colestasis aguda.