INTRODUCCIÓN
La atorvastatina es un potente inhibidor de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, enzima que suprime la síntesis hepática de colesterol produciendo un descenso en los valores séricos de colesterol unido a lipoproteínas de alta densidad (cLDL) y triglicéridos. Desde su comercialización, en 1996, este compuesto ha demostrado poseer una muy buena valoración riesgo-beneficio. En comparación con otros medicamentos de su clase, la atorvastatina presenta una eficacia superior y un grado de seguridad equivalente, debido probablemente a la inhibición prolongada de la HMG-CoA reductasa y a su alto efecto de primer paso en el hígado1.
El consumo de atorvastatina ocasiona una elevación de las transaminasas, con valores que superan más de 3 veces el límite alto de la normalidad, en un 1-3% de pacientes. Este efecto es dependiente de la dosis y generalmente reversible tras la suspensión del fármaco1. Recientemente la atorvastatina se ha asociado al desarrollo de cuadros de hepatitis aguda2-5.
OBSERVACIÓN CLÍNICA
Varón de 72 años de edad que en octubre de 2003 acude al hospital por presentar ictericia y coluria de 3 días de evolución. El paciente no refería fiebre, dolor abdominal o síndrome constitucional acompañante. En su anamnesis constaba en el año 2000 un episodio de trombosis venosa profunda en el miembro inferior derecho, siguiendo desde entonces tratamiento con 100 mg/día de ácido acetilsalicílico. En diciembre de 2002 presentó una anemia normocítica normocrómica (hemoglobina, 7,7 g/dl; hematocrito, 22,6%), asociada a velocidad de sedimentación globular elevada y autoanticuerpos positivos: ANA 1/320 con patrón centrómero. La biopsia de la arteria temporal fue normal, y en la biopsia de médula ósea se encontró mielofibrosis e hipoplasia de la serie roja. El paciente siguió tratamiento con 10 mg de prednisona, 5 mg de ácido fólico y 20 mg de omeprazol al día, y se constató la completa recuperación de la anemia. En febrero de 2003 se le detectó hipercolesterolemia (tabla I), por lo que se añadió a su tratamiento diario 20 mg de atorvastatina.
El paciente no refería la ingesta reciente de ningún fármaco nuevo o sustancia potencialmente hepatotóxica, aunque admitió haber suspendido la atorvastatina 3 meses antes, y reanudó su toma a dosis de 40 mg/día una semana antes de su hospitalización.
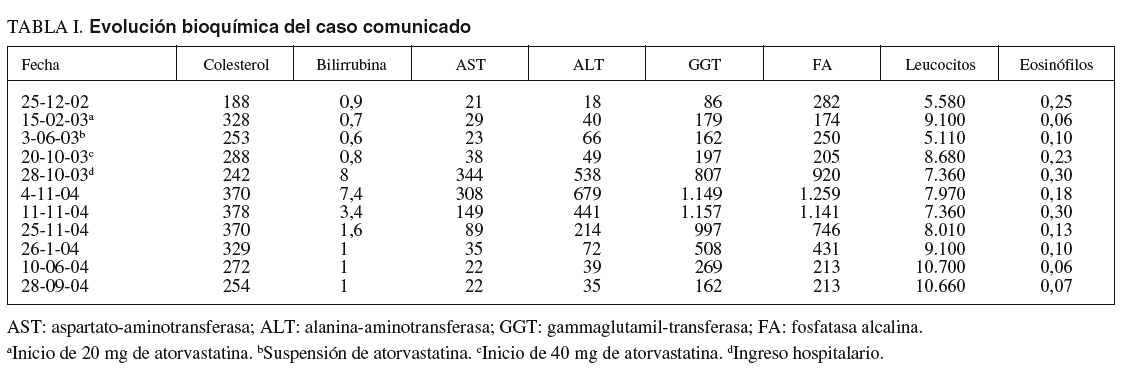
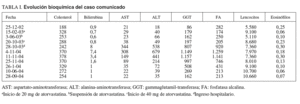
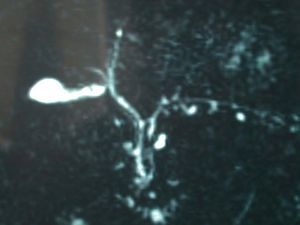
A su ingreso las constantes vitales eran normales (presión arterial, 160/80; temperatura, 36 oC; frecuencia cardíaca, 114), y la exploración física sólo revelaba ictericia de piel y mucosas. La analítica mostraba normalidad en el hemograma y en el estudio de coagulación, y existía una franca elevación de las pruebas de función hepática (tabla I). El estudio inmunológico encontró ANA positivos a 1/80 con patrón centrómero; el resto de los autoanticuerpos fueron negativos. La serología para virus de la hepatitis A, B y C fue también negativa. La ecografía abdominal mostró un hígado homogéneo y la ausencia de dilatación de la vía biliar. Una colangiopancreatografía por resonancia magnética halló microlitiasis biliar, leves cambios ductales sugestivos de pancreatitis crónica y un quiste de 5 mm en la cabeza pancreática que no afectaba a la vía biliar (fig. 1).
Fig. 1. La colangiopancreatografía por resonancia magnética mostró una vesícula con microlitiasis y la completa normalidad de la vía biliar.
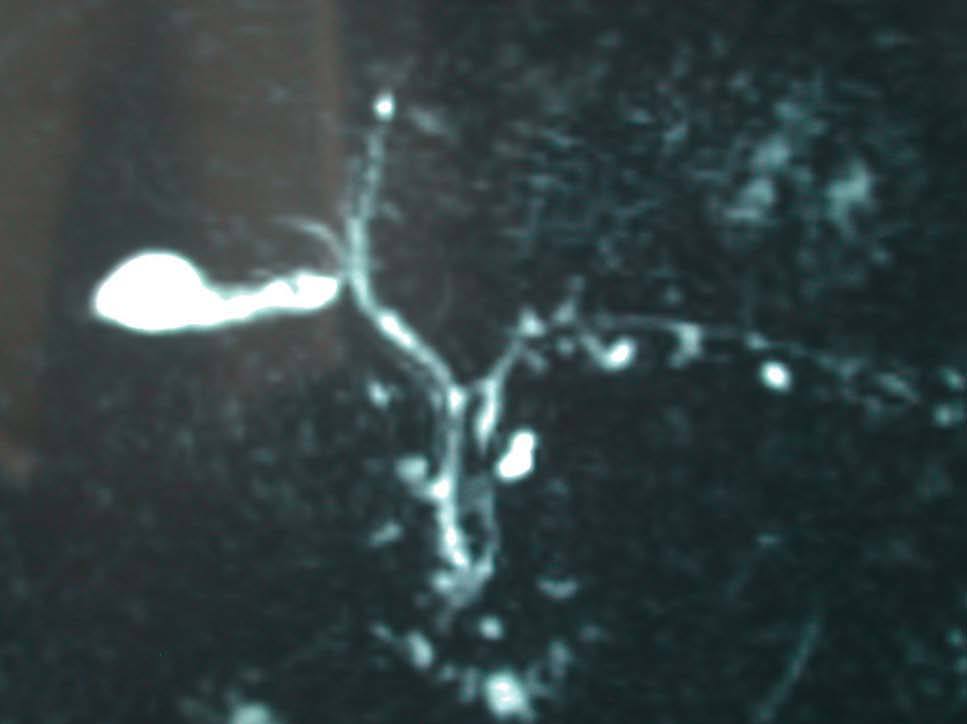
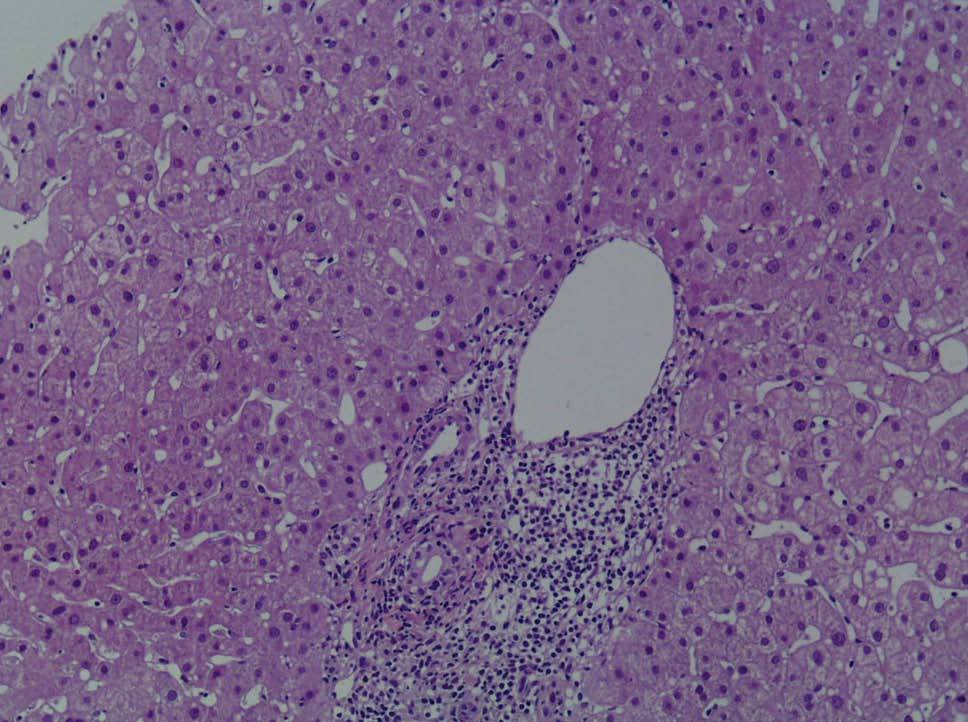
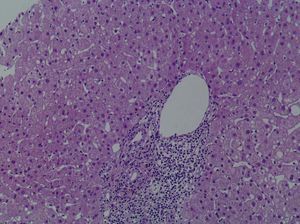
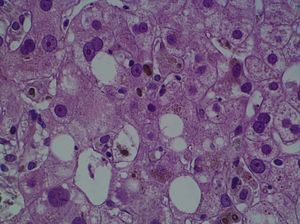
Se practicó una biopsia hepática percutánea que mostró la infiltración de los espacios porta por linfocitos y neutrófilos, que afectaba al epitelio de los conductos biliares. En el lobulillo hepático existía colestasis centrolobulillar, infiltrado inflamatorio mixto y leve hepatocitólisis (figs. 2 y 3).
Fig. 2. La biopsia hepática mostraba aislada hepatocitólisis y colestasis centrolobulillar.
Fig. 3. Ensanchamiento de los espacios porta por un intenso infiltrado inflamatorio compuesto por linfocitos y aislados neutrófilos sin la presencia de eosinófilos.
La discontinuación de la atorvastatina desde su ingreso se siguió de un progresivo descenso de las alteraciones analíticas. En su seguimiento se constata hipercolesterolemia y la normalización de su analítica hepatobiliar, a excepción de una leve elevación de gammaglutamil transpeptidasa. En la actualidad se le ha prescrito 10 mg de ezetimiba como tratamiento hipolipemiante.
DISCUSIÓN
Las estatinas son actualmente los fármacos hipolipemiantes más prescritos. Se estima que en el año 2000 el 2,47% de la población española las consumía6. Estas sustancias se consideran medicamentos seguros y eficaces para reducir los valores de colesterol, no obstante un pequeño porcentaje de los pacientes tratados puede presentar reacciones adversas de miotoxicidad o hepatotoxicidad.
El consumo de estatinas puede producir una elevación moderada de las transaminasas, que es generalmente autolimitada y reversible, aun manteniendo la toma del fármaco7. Su origen puede estar en relación con el descenso sérico de los valores de colesterol, o bien deberse a otras causas primariamente hepáticas como infecciones, hígado graso o alcoholismo8. Sin embargo, la presentación de cuadros agudos de toxicidad hepática tras la ingesta de diversas estatinas también se ha comunicado9,10.
Algunos autores han observado diferencias respecto de los efectos adversos y el consumo de diferentes estatinas, atribuyéndole a la atorvastatina una mayor hepatotoxicidad11. Sin embargo, estos datos se contradicen con la amplia utilización clínica de esta sustancia y el escaso número de efectos adversos hepáticos comunicados hasta el momento. Entre más de 4.000 pacientes que recibieron atorvastatina, Black et al1 encontraron un 1% de efectos adversos que obligaron a la retirada del fármaco y tan sólo un paciente desarrolló una ictericia colestásica. Creemos que la respuesta a esta contradicción reside en la amplia definición que la toxicidad hepática por medicamentos tiene en la literatura médica12,13. Así, el consumo de atorvastatina se ha asociado a la elevación asintomática de las transaminasas1, cuadros de colestasis14, hepatitis aguda2, fallo hepático fulminante15 e incluso se ha considerado el agente desencadenante de un daño hepático inmunológico16.
En 1999 Nakad et al2 describen el primer caso de hepatitis colestásica aguda asociada a atorvastatina, destacando la ausencia concomitante de toxicidad hepática de otras estatinas, y negando así que ésta se deba a un efecto de clase medicamentosa. Posteriormente, se han comunicado otros casos en los que existe una hepatotoxicidad clínica (ictericia) y analítica (elevación de enzimas hepáticas), aunque no existe confirmación del daño histológico3-5. Por otra parte, el consumo de atorvastatina también se ha asociado a una disfunción colestásica hepática, caracterizada por producir importantes elevaciones analíticas hepatobiliares con una biopsia hepática normal. Esta última observación sugiere que la elevación de las pruebas bioquímicas sería un mal indicador de la existencia real de lesión hepática por estatinas14.
Se ha comunicado que hasta un 30% de los pacientes que consumen estatinas reciben simultáneamente otros fármacos con los que éstas pueden interactuar17. La mayoría de estas sustancias comparte su vía de metabolización a través del citocromo P450, que puede originar una inhibición enzimática y, secundariamente, daño hepático mediante un mecanismo de toxicidad directa. Sin embargo, la sustitución de atorvastatina por otras estatinas que utilizan su misma ruta metabólica no ha reducido la hepatotoxicidad en estos pacientes2,4,5.
La hipótesis de un mecanismo hepatotóxico inmunoalérgico asociado a la atorvastatina es concordante con la presencia de eosinófilos en la biopsia hepática2, y con la aparición de toxicidad hepática aguda ante la reexposición al fármaco, asociada a eosinofilia en sangre periférica4. No obstante, ninguno de estos hechos es constante en los casos hasta ahora comunicados. En nuestro caso, el paciente toleró una dosis de 20 mg de atorvastatina sin presentar síntomas clínicos ni analíticos de toxicidad hepática, mientras que una dosis superior ocasionó un cuadro agudo hepatotóxico en ausencia de datos clínicos, analíticos o histológicos claramente compatibles con un mecanismo patogénico inmunoalérgico.
Así las cosas, la hipótesis más plausible de la hepatotoxicidad asociada al consumo de estatinas parece residir en un mecanismo idiosincrásico de base genética. El polimorfismo genético de un individuo determinaría las diferencias de absorción, biodisponibilidad, metabolización y excreción de los fármacos causando gran parte de las reacciones adversas y los fracasos terapéuticos18. El conocimiento de estas bases genéticas puede permitir en un futuro seleccionar óptimamente los fármacos y su dosis para un determinado individuo. Sin embargo, hoy día la incógnita está en la seguridad real de las estatinas y la necesidad de mantener una monitorización analítica durante su consumo.
Estudios recientes parecen confirmar tanto la seguridad como la eficacia de estos fármacos en el tratamiento de pacientes con una elevación basal de las enzimas hepáticas19. Respecto a los controles analíticos periódicos ante su posible toxicidad hepática y muscular, actualmente muchos autores abogan por la suspensión de éstos basándose en la baja frecuencia de estos efectos adversos, la alta tasa de falsos positivos asociada a la elevación de transaminasas durante el tratamiento y, sobre todo, a la falta de asociación demostrable entre estas elevaciones y el desarrollo de cuadros graves de toxicidad hepática20.
En resumen, la toxicidad hepática por atorvastatina es muy infrecuente; la mayoría de los casos descritos se trata de cuadros de hepatitis colestásica aguda, reversibles tras su supresión. El mecanismo subyacente sería idiosincrásico y relacionado con el polimorfismo genético. El beneficio ampliamente probado de las estatinas en la prevención de la enfermedad cardiovascular no debe ser antagonizado por su infrecuente toxicidad hepática, más aún al no existir un efecto de clase medicamentosa.