La constante actualización en el campo del trasplante hepático llevó a la celebración de la III Reunión de consenso de la Sociedad Española de Trasplante Hepático. En ella se debatió acerca de 3 temas actuales y de gran interés clínico: el trasplante en pacientes con cirrosis hepática por virus C, trasplante hepático de donante vivo y la evaluación de la calidad de los injertos hepáticos. También se abordó un tema de gran interés para las unidades de trasplante hepático: la evaluación de su calidad.
The constant updating in the field of liver transplant led to the holding of the III Consensus Meeting of the Spanish Liver Transplant Association. Three current topics of great clinical interest were debated during this meeting; transplant in patients with liver cirrhosis due to hepatitis C, live donor liver transplant and the evaluation of the quality of liver grafts. A subject of great interest to Liver Transplant Units was also discussed: the assessment of their quality.
El presente documento resume la III Reunión de consenso de la Sociedad Española de Trasplante Hepático (SETH), celebrada en noviembre de 2010. En las reuniones previas se abordaron los temas de indicaciones y acceso a la lista de espera, priorización, trasplante pediátrico e indicadores de calidad1–4. En esta ocasión, la jornada se estructuró en 4 grupos de trabajo, que abordaron los siguientes temas: a) trasplante en la cirrosis hepática por virus C; b) trasplante hepático de donante vivo; c) calidad de los donantes hepáticos, y d) calidad de los programas de trasplante hepático.
Trasplante hepático y cirrosis por virus de la hepatitis C5–40Este grupo de trabajo dio sus recomendaciones de acuerdo con los niveles de evidencia expresados en la tabla 1.
Sistema de graduación utilizado para la asignación de la clase y nivel de evidencia
| Clase | Descripción |
| I | Condiciones por las cuales hay evidencia y/o acuerdo general de que una evaluación diagnóstica, procedimiento o tratamiento es beneficioso, útil y efectivo |
| II | Condiciones por las cuales hay evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia de una evaluación diagnóstica, procedimiento o tratamiento |
| IIa | Peso de evidencia/opinión a favor de utilidad/eficacia |
| IIb | Utilidad/eficacia no bien establecida por la evidencia/opinión |
| III | Condiciones por las cuales hay evidencia y/o acuerdo general de que una evaluación diagnóstica/procedimiento/tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial |
| Nivel de evidencia | Descripción |
| A | Datos derivados de mútiples estudios clínicos aleatorizados o metaanálisis |
| B | Datos derivados de un simple estudio aleatorizado o de estudios no aleatorizados |
| C | Solo opiniones de consenso de expertos, estudio de casos o estándar de tratamiento |
- 1.
Indicaciones del trasplante hepático en la infección por virus de la hepatitis C (VHC) y factores pretrasplante del potencial receptor
- •
Dado su peor pronóstico, se recomienda seguir criterios estrictos de selección para el trasplante hepático en los pacientes con hepatocarcinoma asociado al VHC (Clase I-Nivel B) (tabla 1).
- •
También parece recomendable considerar la edad, la presencia de diabetes o de síndrome metabólico, así como la ausencia de respuesta al tratamiento antiviral combinado previo a la hora de limitar la indicación del trasplante hepático en los pacientes infectados por VHC (Clase I-Nivel B).
- •
- 2.
Factores del donante/factores quirúrgicos y del trasplante
- 2.1
Edad del donante (tablas 2 y 3)
- •
Aunque existe suficiente evidencia científica de que la edad del donante es el factor independiente que más impacta de manera negativa sobre la gravedad de la recidiva del VHC, así como en la supervivencia del injerto y del paciente, no podemos identificar un punto claro de corte en la edad del donante a partir del cual no sería recomendable su utilización en pacientes cirróticos VHC.
- •
La asignación preferente de donantes jóvenes a receptores infectados por el VHC puede ir en detrimento de otros pacientes sin infección por VHC y teniendo en cuenta la elevada edad de una gran proporción de la población donante, podría suponer un aumento de la mortalidad en lista de espera de los pacientes con VHC.
- •
Se recomienda a cada grupo de trasplante abordar el estudio del impacto de la edad del donante en la supervivencia de los receptores con o sin infección por VHC.
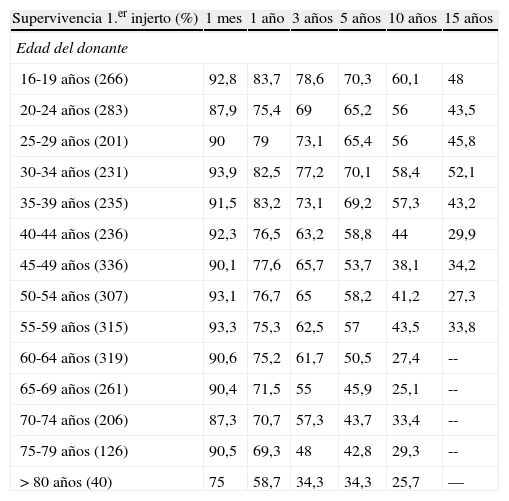
Tabla 2.Supervivencia del primer injerto según la edad del donante en pacientes con cirrosis por VHC (excluidos hepatocarcinomas) adultos. Trasplantes electivos (1984-2009)
Supervivencia 1.er injerto (%) 1 mes 1 año 3 años 5 años 10 años 15 años Edad del donante 16-19 años (266) 92,8 83,7 78,6 70,3 60,1 48 20-24 años (283) 87,9 75,4 69 65,2 56 43,5 25-29 años (201) 90 79 73,1 65,4 56 45,8 30-34 años (231) 93,9 82,5 77,2 70,1 58,4 52,1 35-39 años (235) 91,5 83,2 73,1 69,2 57,3 43,2 40-44 años (236) 92,3 76,5 63,2 58,8 44 29,9 45-49 años (336) 90,1 77,6 65,7 53,7 38,1 34,2 50-54 años (307) 93,1 76,7 65 58,2 41,2 27,3 55-59 años (315) 93,3 75,3 62,5 57 43,5 33,8 60-64 años (319) 90,6 75,2 61,7 50,5 27,4 -- 65-69 años (261) 90,4 71,5 55 45,9 25,1 -- 70-74 años (206) 87,3 70,7 57,3 43,7 33,4 -- 75-79 años (126) 90,5 69,3 48 42,8 29,3 -- > 80 años (40) 75 58,7 34,3 34,3 25,7 — Informe elaborado por Gloria de la Rosa. Fecha de elaboración: enero 2011. Fuente: datos RETH.
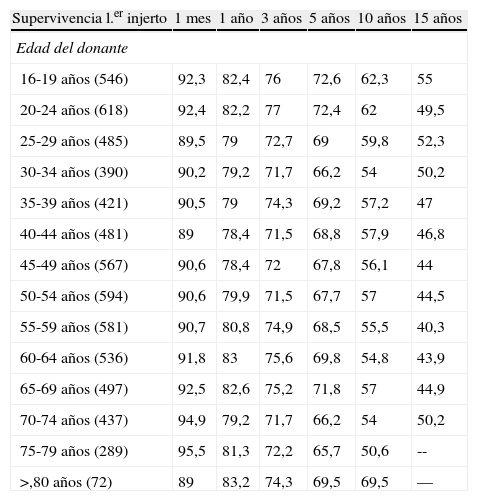
Tabla 3.Supervivencia del primer injerto según la edad del donante en pacientes VHC (−) (excluidos hepatocarcinomas) adultos. Trasplantes electivos (1984-2009)
Supervivencia l.er injerto 1 mes 1 año 3 años 5 años 10 años 15 años Edad del donante 16-19 años (546) 92,3 82,4 76 72,6 62,3 55 20-24 años (618) 92,4 82,2 77 72,4 62 49,5 25-29 años (485) 89,5 79 72,7 69 59,8 52,3 30-34 años (390) 90,2 79,2 71,7 66,2 54 50,2 35-39 años (421) 90,5 79 74,3 69,2 57,2 47 40-44 años (481) 89 78,4 71,5 68,8 57,9 46,8 45-49 años (567) 90,6 78,4 72 67,8 56,1 44 50-54 años (594) 90,6 79,9 71,5 67,7 57 44,5 55-59 años (581) 90,7 80,8 74,9 68,5 55,5 40,3 60-64 años (536) 91,8 83 75,6 69,8 54,8 43,9 65-69 años (497) 92,5 82,6 75,2 71,8 57 44,9 70-74 años (437) 94,9 79,2 71,7 66,2 54 50,2 75-79 años (289) 95,5 81,3 72,2 65,7 50,6 -- >,80 años (72) 89 83,2 74,3 69,5 69,5 — Informe elaborado por Gloria de la Rosa. Fecha de elaboración: enero 2011. Fuente: datos RETH.
- •
- 2.2
Tiempo de isquemia
- •
La prolongación en el tiempo de isquemia impacta de manera negativa sobre la gravedad de la recidiva del VHC así como en la supervivencia del injerto y del paciente.
- •
Sería recomendable evitar un tiempo de isquemia fría superior a 8 h y/o un tiempo de isquemia caliente superior a los 90 min.
- •
- 2.3
Donantes anti-VHC (+)
- •
Se pueden utilizar donantes con infección por VHC para receptores cirróticos con infección por VHC con las siguientes condiciones: edad del donante no superior a 55 años, con bioquímica hepática normal, ecografía e inspección visual del hígado normales y receptor con infección por VHC genotipo 1b.
- •
Deberán minimizarse los tiempos de isquemia.
- •
Aunque es recomendable la práctica de la biopsia hepática, disponer de su resultado no deberá incrementar el tiempo de isquemia por encima de las 8 h.
- •
- 2.4
Otros factores
- •
En referencia a otras variables como la esteatosis, compatibilidad HLA-DR (donante-receptor), utilización de donantes a corazón parado, injertos parciales procedentes de la donación de vivo o tipo split, no se puede hacer ningún tipo de recomendación.
- •
- 2.1
- 3.
Factores virales
La infección por citomegalovirus debe monitorizarse estrechamente con el fin de detectarla y tratarla precozmente (Clase IIa-Nivel B).
- 4.
Factores del receptor: síndrome metabólico/diabetes/resistencia a la insulina (postrasplante)
Debe intentarse el tratamiento efectivo de la diabetes y otros componentes del síndrome metabólico, en un intento de mejorar la evolución de la hepatitis C recurrente postrasplante (Clase I-Nivel B).
- 5.
Patrón de recurrencia bioquímica e histológica y hallazgos histológicos tempranos (primeros 12 meses postrasplante)
- •
El mayor riesgo de evolución a cirrosis puede ser previsto por el patrón de recurrencia bioquímica e histológica (Clase I-Nivel B).
- •
La ictericia y/o la colestasis bioquímica en el momento de la recurrencia se asocian a un riesgo elevado de desarrollo de cirrosis (Clase I-Nivel B).
- •
Los hallazgos histológicos en la biopsia realizada en los primeros 12 meses postrasplante son muy útiles para predecir el riesgo de desarrollo de cirrosis (Clase I-Nivel B).
- •
La presencia de inflamación moderada/grave y/o de fibrosis implica un riesgo elevado de evolución a cirrosis y la necesidad de instaurar tratamiento antiviral (Clase I-Nivel B).
- •
- 6.
Complicaciones biliares
Aunque existe controversia acerca de la posible influencia de las complicaciones biliares en la mayor progresión de la lesión histológica por el VHC, se recomienda una actitud activa de detección y tratamiento precoz de las estenosis biliares para minimizar el posible efecto perjudicial de estas sobre la evolución de la hepatitis recurrente por VHC (Clase IIb-Nivel B).
- 1.
Papel de la inmunosupresión en la historia natural de la hepatitis C recurrente
- 1.1
Inhibidores de calcineurina (ICN)
Hasta la fecha y con los datos existentes no se puede recomendar la utilización un ICN específico, al no haberse hallado diferencias en la supervivencia del injerto ni del paciente ni en la evolución de la hepatitis C recurrente (Clase I-Nivel A).
- 1.2
Corticoides
- •
Se recomienda evitar la utilización de bolos de esteroides en los rechazos leves-moderados (Clase IIa-Nivel B).
- •
Las pautas sin esteroides son seguras en pacientes infectados por el VHC (Clase IIa-Nivel B).
- •
Si se utilizan corticoides, se recomienda la retirada de los mismos de forma progresiva y no antes del sexto mes (Clase IIa-Nivel B).
- •
- 1.3
Papel de otros inmunosupresores (IS): micofenolato, azatioprina, inhibidores mammalian Target of Rapamycin, anticuerpos antirreceptor de interleucina-2
- •
La utilización de protocolos que incluyan micofenolato mofetil, pautas sin esteroides, o anticuerpos frente al receptor de la interleucina 2, no influyen en la gravedad de la recidiva a medio plazo (Clase IIa-Nivel B).
- •
No existe un protocolo idóneo de inmunosupresión para pacientes con infección por VHC. La única recomendación firme es la de evitar un estado de sobreinmunosupresión. Para ello, se recomienda evitar los bolos de corticoides y las pautas triples o cuádruples en dosis plenas (Clase I-Nivel B).
- •
- 1.1
- 2.
Papel de la inmunosupresión en la respuesta al tratamiento antiviral
La modificación del tratamiento IS no ha demostrado tener impacto en la respuesta viral sostenida (RVS), y se deberá modificar según el perfil tóxico de cada IS (Clase IIa-Nivel B).
- •
Se recomienda el tratamiento antiviral en todos los pacientes en lista de trasplante en situación compensada y clase A de Child-Pugh, independientemente del genotipo y de la carga viral, siempre que no presenten contraindicaciones y no hayan sido no respondedores al tratamiento antiviral combinado previo (Clase I-Nivel B).
- •
También se recomienda el tratamiento en los pacientes en situación funcional clase A-B de Child-Pugh y Model for end-stage liver disease (MELD) < 18 que tengan un buen perfil virológico de respuesta (naïve, genotipos 2-3 o genotipos 1-4 y baja carga viral) (Clase I-Nivel B).
- •
Debe contraindicarse el tratamiento en todos los pacientes en situación funcional de clase C de Child-Pugh o MELD ≥ 18 (Clase I-Nivel B).
- •
El tratamiento de elección es la combinación de interferón alfa pegilado y ribavirina en las dosis estándar (Clase I-Nivel C).
- •
Se recomienda la utilización de factores de crecimiento (eritropoyetina y factor estimulante de colonias de granulocitos) si son necesarios (Clase IIa-Nivel C).
- •
El tratamiento antiviral en el trasplante hepático debe llevarse a cabo por médicos dedicados al trasplante, o por médicos en contacto estrecho con el centro de trasplante (Clase I-Nivel C).
- •
El tratamiento antiviral postrasplante hepático se realiza con los mismos fármacos que los utilizados en los individuos inmunocompetentes. Sin embargo, para optimizar los resultados, el tratamiento puede no ser el mismo en duración, dosis, reglas de interrupción precoz y/o utilización de factores de crecimiento (Clase I-Nivel A).
- •
En los genotipos 2-3 no hay datos que indiquen que la duración del tratamiento deba reducirse (Clase I-Nivel C).
- •
La ausencia de respuesta virológica precoz (RVP) predice la ausencia de respuesta con terapias de 12 meses (Clase I-Nivel B).
- •
La prolongación del tratamiento puede ser beneficiosa en algunas situaciones. Por ello:
- ∘
En pacientes con escasa lesión histológica y ausencia de RVP, se recomienda suspender el tratamiento antiviral (Clase I-Nivel C).
- ∘
En pacientes con lesión histológica avanzada y/o factores de predicción de mal pronóstico, con mejoría clínica y/o respuesta bioquímica, y que toleren el tratamiento, puede estar justificada la prolongación/mantenimiento del tratamiento (Clase II-Nivel C).
- ∘
- •
La modificación del tratamiento IS no ha demostrado tener impacto en la RVS, y se deberá modificar según el perfil tóxico de cada IS (Clase II-Nivel A).
- •
Se recomienda una monitorización estrecha de los niveles de inmunosupresión (Clase I-Nivel C).
- •
El tratamiento antiviral no implica una modificación del rango terapéutico de los IS (Clase I-Nivel C).
- •
Es necesario realizar una biopsia hepática antes de iniciar un tratamiento antiviral (Clase I-Nivel B).
- •
Se recomienda el tratamiento en las hepatitis agudas graves y en las formas colestásicas (Clase I-Nivel B).
- •
Es imprescindible la valoración de la gravedad de la hepatitis C de forma seriada (Clase I-Nivel B).
- •
La biopsia hepática es la técnica gold standard para valorar la gravedad de la hepatitis C recurrente postrasplante (Clase I-Nivel B).
- •
Se aconseja realizar una biopsia hepática a los 12 meses del trasplante (Clase I-Nivel B).
- •
La elastografía ha demostrado ser el método no invasivo con mayor capacidad para identificar fibrosis significativa e hipertensión portal en este contexto y puede ser un método adecuado alternativo a la biopsia para el seguimiento evolutivo de la hepatitis C postrasplante (Clase I-Nivel A).
- •
El retrasplante hepático no está contraindicado en pacientes infectados por el VHC.
- •
Se recomienda utilizar el «Rosen score» para determinar la indicación del retrasplante en estos pacientes.
- •
En pacientes con un valor de Rosen ≥ 20,5 el retrasplante debe contraindicarse ya que la supervivencia esperada al año es inferior al 50%.
El trasplante hepático se ha consolidado en los últimos 25 años en todo el mundo, con supervivencias actualmente cercanas al 95% al año y por encima del 80% a los 5 años. En España, a pesar de la elevada tasa de donación de cadáver, los donantes son insuficientes para el número de receptores. El trasplante hepático de donante vivo (THDV), que se desarrolló especialmente en los países orientales, por la falta de donación cadavérica, se extendió a los países occidentales con rapidez. En España se han realizado cerca de 300 trasplantes de donante vivo, la mitad de ellos pediátricos, sin cambios en los últimos años, representando apenas poco más del 2% de la actividad de trasplante. La tendencia, no solo en España, es descendente, al contrario de lo que ocurre con los donantes vivos de riñón.
Los resultados del THDV son mejores que los obtenidos con donantes cadavéricos, la mortalidad real en lista de espera permanece estable y en 2010 la posibilidad de ser trasplantado antes del año ya está por debajo del 50% en España. Por otra parte, las encuestas de satisfacción realizadas a los donantes revelan que menos del 4% se siente presionado para donar y que la inmensa mayoría está satisfecha de la donación41. ¿Por qué disminuye entonces el THDV? Por un lado, la implantación casi universal de la priorización por gravedad (MELD) hizo disminuir de manera considerable la urgencia de la donación, al identificar a los pacientes con más riesgo de fallecer en lista42. Si bien es cierto que con la selección de donantes vivos todavía disminuye mucho más la mortalidad en lista43. Por otro lado, la morbimortalidad del donante juega en contra del THDV, y cada vez que se produce una muerte de un donante (aunque no llegue al 0,3%), la donación de vivo baja e incluso algunos programas abandonan su práctica44–48, en el proceso de evaluación se descarta un importante número de donantes, la mayoría por volumen residual insuficiente o por incompatibilidad de grupo, lo que hace que la aplicabilidad sea baja, inferior al 20%49–51.
El THDV es una buena opción para los pacientes con hepatocarcinoma (HCC) y función hepática conservada, que no siempre son bien priorizados, pese a otorgarles puntos adicionales en el MELD. Además, hay una tendencia a ampliar los criterios de Milán, y el THDV podría evitar la disminución de órganos de cadáver para el resto de indicaciones si se amplían estos criterios. En contra de esta ventaja, estaría que, al no permanecer tiempo en lista, no se produciría la caída por progresión en casos de tumores agresivos biológicamente y los resultados serían peores. Pero esto mismo ocurre si se prioriza a los pacientes con HCC otorgándole puntos adicionales. La opción de THDV debe ser tenida en cuenta en los pacientes con HCC52–56.
Trasplante hepático de donante vivo en población pediátricaEL THDV en los niños está consolidado como una buena opción, con menor morbimortalidad para los donantes (habitualmente los padres), como consecuencia de implantarse los segmentos laterales izquierdos. Es una opción, además, demandada por los padres.
El THDV en niños ha demostrado igual o mejor supervivencia que el trasplante de cadáver, especialmente en niños menores de 2 años, y no presenta mayor riesgo de pérdida del injerto, lo que sí ocurre con el split o el hígado reducido57,58.
Uno de los dilemas éticos es la posibilidad de ofrecer el THDV en situaciones de urgencia, con la toma de decisiones por parte de los padres en un contexto dramático.
Estímulos para la donación de vivoPara incentivar la donación de vivo es necesario minimizar las consecuencias, físicas, psíquicas e incluso económicas, en los donantes.
El proceso de evaluación del donante debe ser exhaustivo para tratar de conocer cualquier problema que afecte a la morbimortalidad del procedimiento. El impacto de la cicatriz, valorado a menudo por los donantes como un importante inconveniente, podría disminuirse efectuando gran parte de la intervención por vía laparoscópica o incluso toda en el caso de la donación de segmentos laterales izquierdos59–61.
En el aspecto económico, gran parte de los donantes refiere pérdidas económicas, la mayoría por salarios no percibidos. También refieren dificultades para hacerse un seguro de vida o aumento de las primas62,63. Los donantes vivos de hígado deberían tener un sistema de protección similar al que tienen las mujeres después del parto (baja maternal y conservación de puesto de trabajo). Podría crearse para ellos la figura de «benefactor social», que incluya esta protección y posiblemente incentivos fiscales, ya que los donantes vivos benefician a la sociedad en su conjunto, permitiendo el acceso al trasplante a otros pacientes que no disponen de un donante vivo.
La posibilidad de establecer una incentivación económica directa es todavía un tema controvertido, pero podría ser el estado el que asumiese este papel, como se ha hecho en algún país para potenciar el trasplante renal de vivo64,65.
Por otra parte, es necesario, y debería ser obligado, informar a todos los receptores en lista de espera de todas las unidades de trasplante de la posibilidad de ser trasplantados de donante vivo, con sus ventajas e inconvenientes, aunque el THDV no se realice en el hospital en el que se encuentran en lista de espera. Las administraciones públicas deberían asumir los gastos derivados del traslado de estos pacientes y sus posibles donantes a los hospitales en que se puede realizar.
Evaluación del riesgo del donanteLa evaluación de los donantes debe ser exhaustiva, para minimizar los riesgos inherentes a la donación. En todo caso, la morbilidad está en torno a un 25% y la mortalidad en torno al 0,3%66,67. Estas cifras deberían ser todavía más bajas, puesto que de ello depende en gran medida la potenciación de la donación.
En la evaluación deben estimarse los riesgos generales de la hepatectomía y llevar a cabo un análisis pormenorizado de la anatomía, lo que permitirá no arriesgar el post-operatorio del donante y disminuir también los riesgos para el receptor.
En una primera fase del estudio, y tras el consentimiento informado, se realizan la historia, la exploración física y la analítica elemental (con serologías) y ecografía Doppler, junto con la primera evaluación psicológica, que asegure la estabilidad mental del donante, su información y determinación adecuadas y la voluntariedad altruista de la donación.
En la segunda fase del estudio se completan los estudios analíticos de laboratorio (con bioquímica completa, inmunoglobulinas, marcadores tumorales, perfil lipídico, hierro, ferritina, transferrina, alfa-1-antitripsina, función tiroidea, factores de coagulación, etc.). Se realiza la evaluación cardiopulmonar (con radiografía de tórax, electrocardiograma, ecocardiograma y en su caso espirometría) y la evaluación radiológica del hígado (colangio-RM, angio-TC y otras opcionales como el MEVIS), con el fin de conocer con la mayor exactitud posible la anatomía hepática y prever las dificultades técnicas que se pueden derivar de variantes anatómicas.
En la tercera fase del estudio se realiza biopsia hepática, para valorar no solo el grado de esteatosis sino también la presencia de fibrosis portal, esteatohepatitis no alcohólica o cambios inflamatorios. La necesidad de esta biopsia es controvertida, y en el Foro de Vancouver se acordó realizarla solo cuando hay alteraciones de pruebas hepáticas o radiológicas o si el índice de masa corporal (IMC) es mayor de 30, y cuando el donante es familiar de un receptor con cirrosis biliar primaria o hepatitis autoinmune68. Algunos grupos la realizan sistemáticamente.
Durante todo el proceso se realizan también las extracciones sanguíneas para autotransfusión.
Antes de pasar al comité de ética, es necesario un segundo consentimiento informado. Y, tras obtener el visto bueno del comité se solicita la autorización judicial en el Registro Civil, como establece la ley69.
El donante ideal debe ser mayor de edad y menor de 55 años, con un IMC < 30, sin enfermedad cardiopulmonar, renal o metabólica, con un remanente hepático superior al 30% y un peso estimado del injerto > 0,8% del peso del receptor, con esteatosis inferior al 20% y con una anatomía vascular y biliar favorable.
El donante debe ser adecuadamente informado de las consecuencias físicas, psíquicas y laborales del procedimiento (cicatriz, hospitalización, complicaciones posibles, tiempo de baja estimado, riesgo de muerte del receptor, posibilidad de complicaciones tardías, etc.)
Selección de candidatos a trasplanteLas indicaciones de THDV son las mismas que para el trasplante de cadáver. Con el actual sistema de priorización por gravedad, basado fundamentalmente en el MELD, los pacientes con mayor riesgo de muerte en lista de espera son identificados de mejor forma y, por lo tanto, no es necesario valorar en ellos la opción de THDV, puesto que recibirán un órgano de cadáver con cierta rapidez. Sin embargo, hay otros pacientes no bien identificados por el MELD, como los cirróticos con encefalopatía, ascitis, peritonitis bacteriana, etc., que no son bien priorizados y tienen riesgo de fallecer en lista, que se beneficiarían del THDV. Los pacientes con HCC son excelentes candidatos para el THDV, puesto que pese a la adjudicación de puntos MELD adicionales siempre están en riesgo de progresión en lista. El THDV es bueno para los pacientes que cumplen los criterios de Milán y para los que los sobrepasan y que entrarían dentro de lo que se conocen como criterios expandidos. Estos pacientes, en los que se han demostrado supervivencias buenas con trasplante de donante cadáver, son excluidos del trasplante por muchos grupos, para evitar el crecimiento de las listas de espera. No obstante, la indicación de THDV en pacientes con criterios «expandidos» debe realizarse en un contexto de estudios controlados.
Procedimiento en el donante adultoLa incisión para la extracción del hígado derecho puede ser subcostal bilateral o, más frecuentemente, vertical supraumbilical con prolongación transversa derecha. Se deben evitar otro tipo de incisiones más eventrógenas.
La colangiografía es un paso obligado para identificar correctamente la anatomía biliar y sus variantes, a veces no del todo definidas por las pruebas de imagen, y para estimar el punto en que se seccionará más adelante el conducto o los conductos hepáticos derechos.
La disección del pedículo se debe realizar a la derecha de la vía biliar, para no afectar a la vascularización de esta y evitar daños al pedículo izquierdo.
La liberación del hígado derecho se completa mediante la maniobra de «piggy-back» respetando las venas retrohepáticas mayores de 5mm, que supongan un importante drenaje del futuro injerto y que deberán, por tanto, ser anastomosadas en el receptor.
Mediante ecografía se identifica el plano de corte y el punto de sección de las posibles venas de drenaje de los segmentos V y VIII hacia la vena media. Esta vena se queda en el donante, aunque algunos grupos defienden su inclusión en el injerto, lo que nos parece un riesgo inaceptable para el donante. La sección del parénquima se realiza habitualmente mediante disector ultrasónico o similar. En el último tercio de la sección se secciona la vía biliar, con especial cuidado de no dañar ningún radical biliar del remanente.
Al final de la transección, algunos grupos esperan 30-45min con la intención de que se abran colaterales venosas hacia la vena derecha y esto facilite el futuro drenaje de los segmentos mediales del injerto.
Cirugía de bancoEl injerto se perfunde en banco por vía portal. Habitualmente, las venas de drenaje de los segmentos mediales deben ser reconstruidas y unidas a la suprahepática derecha, mediante plastias o injertos criopreservados, con el fin de garantizar el drenaje venoso. En caso de doble arteria también es mejor hacer una reconstrucción en banco para tener luego una única anastomosis. Y en caso de doble conducto biliar se puede hacer una plastia cuando la distancia entre ambos no es mayor de 3mm.
Procedimiento en el donante para receptor pediátricoEl injerto hepático para niños comprende los segmentos laterales izquierdos, y tiene mucha menor variabilidad anatómica. De hecho, la gran mayoría tienen una sola vía biliar. Algunos grupos con experiencia llevan a cabo esta intervención con éxito mediante abordaje laparoscópico.
Procedimiento en el receptor adultoEl drenaje venoso adecuado del injerto es vital para su inmediata función, por lo que se deben anastomosar las venas retrohepáticas de más de 5mm de diámetro o que supongan el drenaje de más de un 5% del injerto en los estudios de volumetría (MEVIS).
La anastomosis portal es similar a la del donante cadáver. La mayoría de grupos efectúan anastomosis portocava temporal en el receptor. Es importante conocer el flujo portal previo y medirlo al revascularizar el injerto, puesto que un flujo mayor de 2.000ml/min puede ser nocivo para el injerto y puede requerir otras medidas para disminuirlo (ligadura de arteria esplénica, shunts, etc.).
La anastomosis biliar es el mayor problema en el receptor de donante vivo. La vascularización de la vía puede ser precaria y dar lugar a fugas o estenosis. En general, la mejor anastomosis es conducto a conducto, con o sin Kehr, pero en ocasiones es necesaria la hepaticoyeyunostomía. No es infrecuente la necesidad de doble anastomosis, que puede ser con los conductos hepáticos izquierdo y derecho del receptor o bien empleando el conducto cístico. La tasa de complicaciones biliares es superior al 30% en la mayoría de grupos y requiere un importante apoyo de radiología intervencionista y endoscopia.
Procedimiento en el receptor infantilLos receptores infantiles con frecuencia han sido operados previamente (la mayoría por atresia de vía biliar) y tienen hipertensión portal grave y porta hipoplásica. Esto condiciona la intervención, puesto que a veces es difícil conseguir un buen flujo portal, absolutamente necesario para la supervivencia del injerto. La anastomosis arterial, realizada con técnica meticulosa, rara vez da problemas, y el índice de trombosis es muy bajo. La reconstrucción biliar es siempre con hepaticoyeyunostomía y no es infrecuente la aparición de estenosis que necesita tratamiento mediante radiología intervencionista.
ResultadosEn la Conferencia de consenso de Bethesda en el año 2000, de los National Institutes of Health (NIH), se estableció que el objetivo del THDV era aumentar el número de donantes, disminuyendo la morbimortalidad de los receptores y aumentando su supervivencia a largo plazo70. Los datos de los registros americano, europeo y español permiten analizar la consecución de estos objetivos. En EE.UU. el número de THDV se ha ido reduciendo desde el año 2001 en que se alcanzó un pico de 524 hasta 2009, en que se hicieron 219. En 2010 ha vuelto a aumentar, hasta 282, y previsiblemente seguirá de nuevo una curva ascendente. La supervivencia al año es del 90,1% frente a una supervivencia del 86,3% con injerto cadavérico, y a 5 años es del 77,7% con donante vivo y del 71% con donante cadáver. La supervivencia del injerto a 1 y 5 años es idéntica para donante vivo y para donante cadáver71.
En el Registro Europeo (ELTR), el THDV ha aumentado en los últimos años, aunque las cifras globales están por debajo de las americanas. La supervivencia a 1 y 5 años es también mejor para el THDV que para el trasplante de donante cadáver, tanto para paciente como para injerto72. Y según los datos del Registro Español de Trasplante Hepático, en nuestro país se han realizado más de 250 THDV con supervivencia de injerto y paciente similares a las obtenidas con injerto cadavérico73. En España no ha habido ningún fallecimiento de donante, pero sí un 20% de complicaciones.
En el THDV infantil, los datos tanto mundiales como españoles son mejores que en el caso de adultos, con supervivencias en torno al 90% a 1 y 5 años71–73.
Consideraciones finalesEl THDV es hoy una opción válida de trasplante, permitiendo el acceso rápido al trasplante de muchos receptores, con supervivencias de injerto y paciente por encima de las obtenidas con donante cadavérico, una vez superada la curva de aprendizaje de los equipos.
La disminución de la morbimortalidad de los donantes es crucial para el desarrollo amplio de este procedimiento.
Esta modalidad de trasplante debe ser ofrecida a todos los receptores cuando entran en lista de espera, independientemente del centro en que se pueda realizar.
Los donantes vivos deberían ser considerados «benefactores sociales» y ser protegidos por las administraciones públicas, en todos los aspectos, médicos, laborales y económicos, de forma que no se vean perjudicados en ningún momento.
Es necesario abrir un debate para valorar la posibilidad de aumentar las indicaciones en el THDV, admitiendo que la supervivencia esperada del receptor será algo inferior a la de las indicaciones habituales con donante cadáver.
Calidad de los donantes hepáticosLa calidad del donante hepático condiciona el resultado del trasplante en términos de supervivencia del receptor, supervivencia del injerto, disfunción temprana del injerto y/o disfunción tardía del injerto. Dentro de ellos, se engloban diversos conceptos: disfunción primaria del injerto, función retardada del injerto y pobre función inicial del injerto74. El trabajo de este grupo se ha centrado en 3 apartados: analizar la existencia de límites biológicos para la donación y sistemas de puntuación empleados y su aplicabilidad en España; estrategias para el empleo de donantes con criterios extendidos, y magnitud actual del problema y análisis de su evolución en los últimos años.
Análisis de la existencia de límites biológicos para la donación y sistemas de score empleados y su aplicabilidad en EspañaEl empleo de donantes con criterios extendidos (DCE) condiciona un incremento de riesgo mediado por una mayor lesión de isquemia/reperfusión75. Dicho riesgo ha de entenderse como un continuum de riesgo que puede medirse76. El análisis de los trabajos más recientes apunta a que no existen variables en el donante que, de forma aislada, contraindiquen la donación. Esto es especialmente cierto en el caso de la edad del donante77. En el caso de la esteatosis macrovesicular, que es la causa principal del rechazo de injertos hepáticos en España, debe valorarse la influencia de otras variables, como el tiempo de isquemia fría, de forma que el límite de macroesteatosis del 30% puede ser expandido78.
La escasez de donantes para satisfacer la demanda existente condiciona la necesidad de aceptar donantes hepáticos de mayor riesgo y supone el empleo de donantes en los que coexiste más de una variable de riesgo. Esto determina una mayor puntuación en las escalas de valoración del riesgo y una mayor probabilidad de desarrollo de lesión de isquemia/reperfusión, y por ende, de disfunción del injerto. De especial interés es la combinación de un tiempo de isquemia prolongado con el resto de variables del donante, por lo que es preciso intensificar esfuerzos para que se minimice en la medida de lo posible cuando coexiste algún otro factor de riesgo79,80.
Los cambios en el perfil epidemiológico de los donantes registrados en nuestro país han dado lugar a un escenario cada vez más frecuente de donante añoso con muerte cerebral por accidente cerebrovascular, con trastornos metabólicos añadidos, fármacos inotrópicos de soporte en dosis elevadas y hospitalización prolongada en la unidad de cuidados intensivos (UCI). El grupo de trabajo, aun siendo consciente del sobreesfuerzo que se está realizando en este sentido, considera necesario insistir en que tanto los profesionales de las coordinaciones de trasplante de cada hospital como aquellos encargados del mantenimiento de los donantes han de extremar el cuidado y optimizar el manejo de los mismos. Debido al estado proinflamatorio que conlleva la muerte encefálica y su daño sobre el injerto hepático previo a la extracción, es fácil entender que dicha repercusión puede verse agravada aún más en el caso de donantes con criterios expandidos81.
La necesidad de precisar el riesgo del donante ha conllevado la elaboración de sistemas de puntuación multifactoriales a partir de variables del donante solas o combinadas con variables del receptor. En este sentido, caben destacar el Donor Risk Index (DRI)82, la escala SOFT (Survival Outcomes Following liver Transplantation)83 y el D-MELD (Donor-MELD)84. Aunque la reciente modificación de la información recogida en el Registro Español de Trasplante Hepático (RETH) va a posibilitar el cálculo del D-MELD es preciso señalar que el resto de los sistemas de puntuación no son apropiadamente aplicables a los donantes en nuestro país, dado que algunas de las variables que conforman estas puntuaciones de riesgo no se ajustan a las características de nuestros donantes (por ejemplo, raza afroamericana o trasplante tipo split), por lo que el grupo de trabajo recomienda intensificar la colaboración entre la Organización Nacional de Trasplante (ONT) y el RETH para la elaboración por expertos de un «índice de riesgo del donante hepático en España», más ajustado a la naturaleza y características de nuestros donantes.
Respecto al papel de la biopsia hepática en el donante, el grupo de trabajo no recomienda el uso sistemático de la misma, sin alcanzarse consenso en su empleo en donantes con criterios expandidos. Ahora bien, se debe garantizar la posibilidad de obtener biopsia con parámetros adecuados en los centros autorizados para donación o, en su defecto, en los hospitales donde se llevará a cabo el trasplante en aquellos casos en los que el equipo responsable lo precise para tomar una decisión. Los parámetros susceptibles de recogerse en una biopsia del injerto no deben limitarse a la cuantificación de la esteatosis del injerto, recomendando al patólogo responsable de su interpretación que incluya los siguientes85: tamaño de la biopsia y número de espacios porta incluidos; estimación semicuantitativa de esteatosis micro y macrovesicular; grado de inflamación portal y necrosis periportal; presencia de necrosis lobulillar parcheada; presencia de infiltrado polimorfonuclear; presencia de necrosis lobulillar en puentes; extensión de fibrosis expresada en número de tractos fibrosos, expansión fibrosa portal y porto-portal; grado de colestasis; presencia de pigmentos, balonización y cuerpos de Mallory en los hepatocitos; y evaluación del estrechamiento de la íntima de las arteriolas en los espacios porta en función del diámetro original de la arteriola.
El empleo sistemático en donantes con criterios expandidos de sistemas para evaluación de la función hepática (colorantes como el verde de indocianina, bioimpedanciometría eléctrica) han de incluirse aún en la categoría de modelos experimentales, dado que no han demostrado evidencia científica suficiente86.
Estrategias para el empleo de donantes con criterios extendidosLa asignación de un determinado donante a un receptor (matching) es objeto de gran controversia. Para la misma, pueden seguirse 3 criterios: el principio de eficacia, el principio de justicia y el beneficio de supervivencia. Según el principio de eficacia, el donante, en función de su calidad, debe asignarse al candidato que pueda ofrecer mejores resultados post-operatorios. En este sentido hay trabajos recientes que demuestran que la combinación de un donante con criterios expandidos con un receptor con un MELD alto es la que ofrece peores resultados. Sin embargo, este mismo tipo de donantes en receptores con un menor MELD ofrecen una mayor supervivencia al año del trasplante. El principio de justicia considera que el donante debe adjudicarse a aquel candidato que más lo necesita, esto es, aquel cuya situación clínica es más grave y con mayor riesgo de muerte en lista de espera. Según este principio, no habría que hacer ningún tipo de selección o matching, sino seguir un estricto orden según la gravedad del enfermo. En este segundo principio se basa la priorización en lista de espera según la puntuación MELD, de forma que los enfermos con puntuaciones más altas deben ser los primeros en ser trasplantados87. El tercero de los principios, el beneficio de supervivencia, se basa en una función que relaciona la gravedad del receptor y, por tanto, su supervivencia en lista de espera, y la supervivencia tras el trasplante hepático, teóricamente, determinada por la calidad del donante. Su principal mérito es definir aquellos candidatos en los que el trasplante resulta fútil, es decir, la supervivencia tras el trasplante hepático no supera a la esperada si se mantiene en la lista de espera. Aplicando este razonamiento, los receptores más graves presentarían un mayor beneficio de supervivencia, aun cuando se les asignasen donantes con criterios expandidos (combinación de riesgos), mientras que la adjudicación de un donante de este tipo a pacientes con menor gravedad disminuiría notablemente su beneficio de supervivencia88,89.
El grupo de trabajo no encuentra consenso sobre si deben prevalecer los resultados globales de las series sobre el beneficio de supervivencia de los receptores, y encuentran ventajas e inconvenientes en ambas posturas, a la espera de mayor información acerca del desarrollo práctico del principio de beneficio de supervivencia. No obstante, en aquellos equipos que actualmente aplican el sistema MELD en España, y, por tanto, sin posibilidad de realizar un matching donante-receptor, el criterio del beneficio de supervivencia respalda que la combinación de riesgos donante-receptor queda éticamente justificada.
Ante la evidencia reciente de que la combinación de determinadas características de los donantes con ciertas enfermedades del receptor conlleva peores resultados, se recomienda no destinar dichos donantes a otros receptores. Esto es especialmente relevante en los receptores con VHC, en los que los trasplantes con donantes añosos6 (y en algunas series, los injertos con esteatosis moderada y grave)90 conllevan resultados inferiores en comparación con el resto de etiologías. En este sentido, hay suficiente evidencia científica para recomendar no adjudicar donantes de edad avanzada a receptores con cirrosis por VHC.
Dada la evolución de las tasas de donación de cadáver y de la listas de espera para trasplante hepático, el grupo de trabajo recomienda: estimular el desarrollo de programas de donante vivo y potenciar aquellos ya consolidados; promocionar la donación en asistolia e implantar el empleo de máquinas de perfusión normotérmica91,92 en donantes de alto riesgo, en los que la lesión de isquemia-reperfusión se prevé más grave (sobre la práctica del precondicionamiento isquémico).
Sin embargo, no se alcanza consenso sobre la implantación de un check-list telefónico que determine criterios del donante (o su combinación) que aconsejen la desestimación (telefónica) del mismo, evitando así desplazamientos potencialmente inútiles.
Magnitud actual del problema y análisis de su evolución en los últimos añosDel análisis de los datos proporcionados por la Organización Nacional de Trasplantes (ONT) destaca que, aunque los equipos españoles de trasplante hepático han sabido adaptarse en los últimos años a los cambios producidos en las características epidemiológicas de los donantes, la magnitud del tiempo y la mortalidad en lista de espera, unido a la estabilización y posible reducción de las tasas de donación en España, hace imprescindible impulsar las alternativas al trasplante hepático convencional: trasplante hepático de donante vivo, trasplante procedente de donantes en asistolia, trasplante tipo split, ya que en 2010 apenas supusieron el 6% del total de trasplantes hepáticos realizados en nuestro país.
En este sentido, son destacables las iniciativas, conclusiones y recomendaciones de otros grupos de trabajo así como la creación por parte de la ONT del Programa Nacional para el fomento de la donación en asistolia.
Calidad de los programas de trasplante hepático93,94IntroducciónTras las reuniones de consenso de la SETH de 2005 y 2008, se elaboraron una serie de indicadores de calidad en trasplante hepático, que formaron parte de los documentos de consenso publicados previamente1–4. En la jornada de consenso celebrada en Madrid el 18 de noviembre de 2010 se incluyó un grupo de trabajo sobre Calidad y Acreditación de los Programas de Trasplante Hepático. En esta ocasión, se han revisado y actualizado los indicadores de calidad anteriormente propuestos y se han definido los criterios de calidad específicos exigibles o de referencia para un servicio clínico o profesional que participe o colabore en el proceso de trasplante hepático.
Indicadores de calidad en trasplante hepático| 1. Mortalidad post-operatoria en el trasplante hepático |
| Definición |
| Porcentaje de pacientes trasplantados que fallecen en el primer mes o primer ingreso postrasplante. |
| Justificación |
| Indicador de resultados que determina la mortalidad precoz postrasplante y permite enfocar el análisis de las causas con relación al proceso de evaluación del candidato, las características del donante, el procedimiento y la atención post-operatoria reciente. |
| Fórmula/formato |
| Número de pacientes trasplantados fallecidos en el primer mes postrasplante / número de pacientes trasplantados x 100 del mismo periodo. |
| Explicación de términos |
| Se incluyen los pacientes que fallecen desde el inicio del trasplante hepático (quirófano, UCI y planta de hospital) |
| Población |
| Todos los pacientes sometidos a trasplante hepático. |
| Tipo |
| Resultado basado en porcentajes. |
| Fuente de datos |
| Documentación clínica CMBD (Conjunto Mínimo Básico de Datos). |
| Aplicación informática del Servicio de Admisión del centro. |
| Comisión de mortalidad e historia clínica para el análisis cualitativo. |
| Estándar |
| Inferior al 10%. |
| Comentarios |
| La periodicidad de la medida debería ser semestral. |
| 2. Mortalidad perioperatoria |
| Definición |
| Porcentaje de pacientes trasplantados que fallecen desde el inicio de la cirugía hasta las primeras 24h posteriores a la intervención. |
| Justificación |
| Conocer la tasa de mortalidad de trasplante en las primeras 24 h. Estudio de las causas. Relación con las complicaciones de los receptores (trombosis portal, complicaciones cardiovasculares graves no conocidas antes del trasplante) con relación al total de trasplantados. |
| Fórmula/formato |
| Número de fallecidos durante las primeras 24h del trasplante / número total de trasplantados × 100 del mismo período. |
| Explicación de términos |
| Se incluyen los pacientes trasplantados que fallecen en el quirófano, reanimación y/o UCI. |
| Población |
| Todos los pacientes sometidos a trasplante hepático. |
| Tipo |
| Indicador de resultados basado en porcentajes. |
| Fuente de datos |
| Registros de la unidad de trasplante de cada centro. |
| Estándar |
| Inferior al 1%. |
| Comentarios |
| El objetivo es analizar si las muertes se producen con relación a la situación clínica del receptor, como consecuencia de hallazgos imprevistos no detectados en la evaluación pretrasplante o debido a complicaciones intraoperatorias. |
| La periodicidad será semestral. |
| 3. Tasa de retrasplante hepático precoz |
| Definición |
| Porcentaje de retrasplantes hepáticos que se indican en los primeros 7 días, en el global de cada serie de trasplante, realizado con donante cadáver. |
| Justificación |
| Evaluar la frecuencia y causas del retrasplante precoz. |
| Detectar la selección inadecuada de receptores y donantes (cadáver) y de los problemas técnicos que supongan una grave disfunción del injerto. |
| Fórmula/formato |
| Número de retrasplantes hepáticos indicados en la primera semana postrasplante / número total de trasplantes de la serie × 100 de un determinado periodo. |
| Explicación de términos |
| Pacientes que han recibido un segundo trasplante hepático en la primera semana postrasplante. |
| Población |
| Toda la serie de pacientes trasplantados. Se excluyen los trasplantes no realizados con donación de cadáver. |
| Tipo |
| Resultados basado en porcentajes. |
| Fuente de datos |
| Los de cada serie de trasplante. Historias clínicas. |
| Estándar |
| Inferior al 5%. |
| Comentarios |
| Podría ser un indicador de calidad en el postrasplante inmediato. |
| La periodicidad debería ser semestral. |
| 4. Tasa de retrasplante hepático tardío |
| Definición |
| Porcentaje de retrasplantes hepáticos, excluidos los indicados en la primera semana, en el global de cada serie de trasplante. |
| Justificación |
| Evaluar la frecuencia y causas del retrasplante tardío. Detectar las consecuencias a largo plazo de los problemas técnicos y las de los problemas médicos (protocolos inadecuados de inmunosupresión o de profilaxis de recidiva viral). |
| Fórmula / formato |
| Número de retrasplantes hepáticos indicados después de la primera semana del trasplante / número total de trasplantes de la serie × 100 de un determinado periodo. |
| Explicación de términos |
| Pacientes que han recibido un segundo trasplante hepático. |
| Población |
| Toda la serie de pacientes trasplantados. |
| Tipo |
| Resultados basados en porcentajes. |
| Fuente de datos |
| Los de cada serie de trasplante. Historias clínicas. |
| Estándar |
| Inferior al 8%. |
| Comentarios |
| Es un indicador de calidad en el postrasplante y uno de actividad a largo plazo. |
| La periodicidad debería ser semestral. |
| 5. Tasa de reintervención precoz |
| Definición |
| Porcentaje de pacientes trasplantados que requieren una segunda intervención en el primer ingreso, debido a una complicación de la primera intervención. |
| Justificación |
| Evaluación de la frecuencia de problemas técnicos del trasplante y complicaciones quirúrgicas derivadas del mismo. Las complicaciones y reintervenciones se pueden producir a pesar de una técnica quirúrgica correcta. |
| Fórmula/formato |
| Número de pacientes trasplantados sometidos a reintervención en el primer ingreso / número de pacientes trasplantados × 100 de un determinado periodo. |
| Explicación de términos |
| Todo procedimiento quirúrgico (se excluyen las técnicas percutáneas o endoscópicas y los fallecidos que no llegan al periodo evaluado) realizado bajo anestesia general, realizado por una complicación derivada del trasplante hepático, aparecida en el primer ingreso. |
| Población |
| Todos los pacientes sometidos a trasplante hepático. |
| Tipo |
| De resultados basado en porcentajes. |
| Fuente de datos |
| CMBD. |
| Estándar |
| Inferior al 10%. |
| Comentarios |
| Periodicidad semestral. |
| 6. Supervivencia del paciente trasplantado |
| Definición |
| Tasa de supervivencia de los pacientes trasplantados de la serie al cabo de 1, 3, 5 y 10 años postrasplante. |
| Justificación |
| Conocer si los resultados de supervivencia al cabo de 1, 3, 5 y 10 años postrasplante se ajustan a los estándares publicados para identificar problemas y poner en marcha soluciones en caso de que fuesen deficientes. |
| Fórmula/formato |
| Curvas de supervivencia actuarial a 1, 3, 5 y 10 años. |
| Explicación de términos |
| Pacientes trasplantados que siguen vivos al cabo de 1, 3, 5 y 10 años de su intervención. Incluir todos los fallecimientos no relacionados con el proceso. |
| Población |
| Todos los pacientes sometidos a trasplante hepático. |
| Tipo |
| Indicador de resultados basado en índices. |
| Fuente de datos |
| Historias clínicas de los pacientes trasplantados. Memorias anuales de los centros de trasplantes. Registro Nacional de Trasplante. |
| Estándar |
| Supervivencia global del 80% al año, del 75% a los 3, del 70% a los 5 años y del 60% a los 102. |
| 7. Pacientes estudiados en menos de 30 días tras su envío a la Unidad Funcional de Trasplante Hepático (UFTH) |
| Definición |
| Porcentaje de pacientes que han sido evaluados (se decida su inclusión o no en LA, tras realizar una evaluación) por la unidad de trasplante hepático en menos de 30 días desde la fecha de la primera visita. |
| Justificación |
| Evaluar la eficiencia del proceso de estudio de inclusión en la lista de espera. Las demoras en un proceso de evaluación de un paciente son con frecuencia por causas organizativas del servicio o centro sanitario. La disminución de las demoras disminuye la ansiedad de los pacientes y permite mejorar la toma de decisiones. |
| Fórmula/formato |
| Número de pacientes con estudio completado en menos de 30 días desde la solicitud de la cita para evaluación de trasplante / número de pacientes enviado para evaluación de trasplante × 100 de un determinado período. |
| Explicación de términos |
| Pacientes citados en la unidad de trasplante como primera visita para ser evaluados como posibles candidatos de trasplante hepático. |
| Tiempo transcurrido desde la petición de estudio y la toma de decisión por el comité del trasplante. |
| Número de pacientes que han completado el estudio en los que se toma una decisión en un plazo inferior a 30 días, con relación al total de pacientes derivados para su evaluación. |
| Población |
| Todos los pacientes enviados a la unidad de trasplantes para su evaluación e inclusión en lista de espera. |
| Tipo |
| Indicador de proceso. |
| Fuente de datos |
| Estudio de los historiales de todos los pacientes en estudio por la UFTH y la revisión de los tiempos desde la primera consulta hasta su inclusión o no en la lista de espera de trasplante hepático. |
| Estándar |
| Proporción de pacientes estudiados en un tiempo menor o igual a 30 días: 75% al menos. |
| 8. Porcentaje fallo primario de función |
| Definición |
| Porcentaje de pacientes trasplantados que desarrollan una no función primaria del injerto. |
| Justificación |
| Conocer la tasa de no función primaria del injerto como indicador de la comunicación, coordinación, destreza y experiencia de los equipos, en relación con los tiempos de isquemia fría y caliente, calidad del hígado implantado, factores técnicos, logística, coordinación de los equipos, etc. |
| Fórmula/formato |
| Pacientes trasplantados que desarrollan una no función primaria del injerto causante de retrasplante o muerte / total de pacientes trasplantados × 100 en un determinado periodo. |
| Población |
| Pacientes trasplantados. |
| Tipo |
| Indicador de resultados. |
| Fuente de datos |
| Registros de la unidad de trasplante, historia clínica. |
| Estándar |
| Inferior al 2%. |
| Comentarios |
| La frecuencia de monitorización debería ser trimestral. |
| 9. Tasa de hígados no implantados sin causa objetiva justificable |
| Definición |
| Porcentaje de hígados no implantados, tras su aceptación, sin causa objetiva justificable (lo ideal sería la existencia de histología que demuestre la no posibilidad de utilización -causa objetiva-. Podemos poner como causa justificable la presencia de una alteración, en el injerto, encontrada bien histológicamente o por el cirujano que realiza la extracción) por el equipo de trasplante. Es recomendable que siempre exista histología del injerto. |
| Justificación |
| Evaluar la adecuación de la tasa de rechazos de hígados ofertados con arreglo a los criterios de aceptación de donantes en vigor. El objetivo es detectar los rechazos injustificados y aumentar las opciones de trasplante para los pacientes en lista de espera. |
| Fórmula/formato |
| Número de hígados no implantados / número de hígados implantables × 100 en un determinado periodo. |
| Población |
| Todos los hígados totales o parciales con criterios de inclusión para ser implantados. |
| Tipo |
| Indicador de proceso. |
| Fuente de datos |
| Registros de la unidad de trasplante y de la ONT. |
| Protocolo de donante. Anatomía patológica en el momento del implante. Análisis de causas de rechazo. Evolución de hígados rechazados que han sido implantados por otro grupo. |
| Estándar |
| 0-1%. |
| 10. Satisfacción del paciente trasplantado |
| Definición |
| Realización de encuesta de satisfacción del grupo de pacientes trasplantados. |
| Grado de satisfacción global de los pacientes trasplantados de hígado. |
| Justificación |
| Evaluar la calidad percibida por el paciente trasplantado sobre la asistencia integral recibida durante el proceso de trasplante hepático. |
| Fórmula/formato |
| Medición global de la satisfacción del usuario después de puntuar cada ítem de la encuesta. |
| Población |
| Pacientes trasplantados totales. |
| Tipo |
| Indicador de resultados. |
| Fuente de datos |
| Análisis de encuestas realizadas a pacientes y familiares. |
| Estándar |
| Realización de la encuesta. |
| Porcentaje de satisfecho o muy satisfecho superior al 80%. |
| Comentarios |
| Debe ser anual. Validar un cuestionario común y elaborar ficha técnica. |
| 11. Mortalidad en lista de espera |
| Definición |
| Porcentaje de pacientes excluidos de la lista de espera de trasplante hepático por fallecimiento o progresión de la enfermedad. |
| Justificación |
| Evaluar la calidad de la gestión de la lista de espera de los pacientes candidatos a trasplante hepático. |
| Fórmula/formato |
| Número de pacientes excluidos de la lista de espera de trasplante hepático de la ONT (por fallecimiento o por progresión de la enfermedad) / número total de pacientes incluidos en lista de espera para trasplante. |
| Población |
| Todos los pacientes incluidos en la lista de espera. |
| Tipo |
| Indicador de resultados. |
| Fuente de datos |
| Lista de espera de trasplante hepático de la ONT. |
| Estándar |
| < 15%. |
| Comentarios |
| La frecuencia de monitorización debería ser anual. |
| 12. Mortalidad precoz postrasplante con hígado funcionante |
| Definición |
| Porcentaje de pacientes trasplantados que fallecen durante el ingreso postrasplante, con adecuada función hepática. |
| Justificación |
| Indicador de resultados que monitoriza la selección de pacientes y permite enfocar el análisis de las causas con relación al proceso de evaluación del candidato. |
| Fórmula/formato |
| Número de pacientes trasplantados fallecidos durante el ingreso postrasplante con función hepática normal / número de pacientes trasplantados × 100 del mismo periodo. |
| Explicación de términos |
| Se incluyen los pacientes que fallecen desde el inicio del trasplante hepático (quirófano, UCI y planta de hospital). |
| Población |
| Todos los pacientes sometidos a trasplante hepático. |
| Tipo |
| Indicador de resultados. Resultado basado en porcentajes. |
| Fuente de datos |
| Documentación clínica del conjunto mínimo básico de datos (CMBD). |
| Aplicación informática del servicio de admisión. |
| Comisión de mortalidad e historia clínica para el análisis cualitativo. |
| Estándar |
| < 1%. |
| Comentarios |
| La periodicidad de la medida debería ser anual. |
| 13. Mortalidad postrasplante con hígado funcionante |
| Definición |
| Porcentaje de pacientes trasplantados que fallecen con adecuada función hepática. |
| Justificación |
| Indicador de resultados que monitoriza la actividad y condiciones de vida de los pacientes y permite enfocar el análisis de la mortalidad con ese sesgo. |
| Fórmula/formato |
| Número de pacientes trasplantados fallecidos con función hepática normal / número de pacientes trasplantados × 100 del mismo periodo. |
| Explicación de términos |
| Se incluyen los pacientes que fallecen desde el inicio del trasplante hepático (quirófano, UCI y planta de hospital). |
| Población |
| Todos los pacientes que han recibido trasplante hepático. |
| Tipo |
| Indicador de resultados. Resultado basado en porcentajes. |
| Fuente de datos |
| Documentación clínica CMBD. |
| Aplicación informática del servicio de admisión. |
| Comisión de mortalidad e historia clínica para el análisis cualitativo. |
| Estándar |
| Desconocido. |
| Comentarios |
| La periodicidad de la medida debería ser anual. |
| Criterios de calidad en el trasplante hepático |
| El grupo de trabajo sobre Calidad y Acreditación de los Programas de Trasplante Hepático definió una primera versión de los Criterios de Calidad del Trasplante Hepático. Cada criterio tiene, además de la descripción que se menciona a continuación, una guía explicativa del mismo y un listado de comprobación. En el presente documento únicamente se expone la descripción de cada criterio. |
| 1. Criterios relacionados con la definición documental del proceso |
| El proceso asistencial debe estar descrito y documentado. El documento, accesible y fácilmente localizable, recogerá los principales elementos del mismo, incluyendo la distribución de las responsabilidades. |
| 1.1. Definición |
| La documentación del proceso debe especificar su definición funcional y los límites de entrada y salida. Asimismo, deben definirse destinatarios, objetivos e indicadores de evaluación. Todo proceso debería tener una representación gráfica. |
| 2. Criterios relacionados con la responsabilidad |
| El trasplante hepático debe contar con una persona que se responsabilice de la gestión sistemática y de la mejora continua del mismo con las capacidades y competencias profesionales adecuadas para el cumplimiento de su misión. |
| 3. Criterios relacionados con los recursos del trasplante |
| 3.1. Profesionales |
| 3.1.1. El trasplante hepático debe disponer de los recursos humanos necesarios para garantizar de manera adecuada cada una de las fases del mismo. Debe disponer del personal médico (clínico, quirúrgico, radiológico y anestésico, etc.) y de enfermería adecuados en número y en competencia profesional. |
| 3.1.2. Los profesionales que participan en los diferentes procesos deben tener reconocidas sus competencias. |
| 3.2. Servicios |
| El centro debe garantizar la realización de los procedimientos que sean necesarios en el estudio y seguimiento de los pacientes. El centro debe asegurar la realización de las exploraciones que se consideren necesarias bien en el propio centro o a través de centros concertados. |
| 3.3. Recursos de espacio físico |
| El centro debe disponer del espacio físico para el trasplante hepático, que se considere conveniente, en las distintas áreas de hospitalización y de seguimiento ambulatorio en consultas. |
| 3.4. Materiales diagnósticos y terapéuticos |
| El centro debe garantizar la realización de los procedimientos diagnósticos y terapéuticos que sean necesarios en el estudio y seguimiento de los pacientes. El centro debe asegurar la realización de las exploraciones que se consideren necesarias, bien en el propio centro o a través de centros concertados. |
| 4. Criterios relacionados con las actividades del proceso |
| Las actividades asistenciales necesarias para llevar a cabo el trasplante hepático deben estar descritas, así como sus características de calidad. |
| 4.1. Evaluación pretrasplante |
| La evaluación del paciente candidato a trasplante hepático debe estar descrita en el proceso de trasplante hepático y debe realizarse de tal forma que los pacientes sean evaluados, en su mayoría, en menos de 30 días. |
| 4.2. Gestión de la lista de espera |
| Debe existir un modelo de gestión de lista de espera con unos criterios bien definidos para la inclusión de pacientes, el orden de trasplante de los mismos y los motivos de exclusión de ésta. El objetivo de cualquier modelo de gestión es disminuir la mortalidad en la lista de espera. |
| 4.3. Procedimiento quirúrgico |
| Debe existir un proceso de trasplante que recoja las actuaciones pertinentes que deben realizarse cuando aparece un donante compatible con un receptor de la lista de espera. Es fundamental que la coordinación entre la cirugía en el donante y del receptor sea la adecuada para disminuir el tiempo de isquemia del injerto. |
| 4.4. Post-operatorio de trasplante hepático |
| El manejo del paciente en el post-operatorio de trasplante hepático es fundamental para conseguir una buena supervivencia a corto plazo, evitando y en su caso tratando complicaciones graves que pueden aparecer en este periodo tan crítico. |
| 4.5. Seguimiento del paciente trasplantado |
| Un buen seguimiento del paciente tras el alta hospitalaria se relaciona con la supervivencia a largo plazo y hará que ésta se sitúe dentro de los estándares admitidos. |
| 5. Criterios relacionados con los protocolos |
| Deben existir, ser conocidos y revisados periódicamente, protocolos de actuación tanto diagnósticos como terapéuticos que puedan ser utilizados por los diferentes profesionales. |
| 5.1. Protocolo de detección y tratamiento de factores de riesgo cardiovascular |
| Debe existir en cada centro de trasplante un protocolo establecido para la detección, tratamiento y seguimiento de los factores de riesgo cardiovascular que pueden aparecer en el postrasplante (obesidad/diabetes/hipercolesterolemia e hipertrigliceridemia/HTA). A partir del sexto mes postrasplante. |
| 6. Criterios relacionados con la evaluación |
| El proceso del trasplante hepático debe tener definido un sistema de evaluación de la calidad del mismo. El sistema deberá incluir la identificación y selección de indicadores y la definición de un plan de monitorización. Dicho plan recogerá, como mínimo, la periodicidad de las mediciones, el sistema de recogida de información y la responsabilidad de la monitorización. |
| 7. Criterios relacionados con el sistema de registro de la información |
| Debe medirse y registrarse la información que permita hacer una evaluación objetiva del proceso. |
| 8. Criterios relacionados con la documentación |
| El trasplante hepático debe disponer de un catálogo ordenado que contemple la documentación específica del mismo. Este catálogo debe estar permanentemente actualizado. |
Los autores declaran no tener ningún conflicto de intereses.
| Grupo 01 | |
| Trasplante en cirrosis hepática por virus C | |
| Coordinadores | |
| Marina Berenguer Haym | En representación de AEEH |
| Ramón Charco Torra | Hospital Universitario Vall d’Hebron |
| Juan Manuel Pascasio Acevedo | Hospital Universitario Virgen del Rocío |
| Participantes | |
| Rafael Bañares Cañizares | Hospital General Universitario Gregorio Marañón |
| Fernando Casafont Morencos | Hospital Universitario Marqués de Valdecilla |
| Lluís Castells Fuste | Hospital Universitario Vall d’Hebron-Barcelona |
| Valentín Cuervas-Mons Martínez | Clínica Universitario Puerta de Hierro-Majadahonda |
| Manuel Delgado Blanco | Hospital Universitario Juan Canalejo |
| Inmaculadada Fernández Vázquez | Hospital Universitario 12 de Octubre |
| Félix García Pajares | Hospital Universitario Río Hortega |
| Antonio González Rodríguez | Hospital Universitario Nuestra Señora de la Candelaria |
| Sara Lorente Pérez | Hospital Clínico Universitario Lozano Blesa |
| Esther Molina Pérez | Hospital Clínico Universitario de Santiago |
| Miquel Navasa Anadon | Hospital Universitario Clínic |
| María Flor Nogueras López | Hospital Universitario Virgen de las Nieves |
| José Antonio Pons Miñano | Hospital Universitario Virgen de la Arrixaca |
| Juan Miguel Rodrigo López | Hospital Regional Universitario Carlos Haya |
| Manuel Rodríguez García | Hospital Universitario Central de Asturias |
| Milagros Testillano Tarrero | Hospital de Cruces |
| Xavier Xiol Quingles | Hospital Universitario de Bellvitge |
| Grupo 02 | |
| Trasplante hepático de donante vivo | |
| Coordinadores | |
| Juan Carlos García-Valdecasas Salgado | En representación de AEC |
| Paloma Jara Vega | Hospital Universitario La Paz |
| Fernando Pardo Sánchez | Clínica Universitaria de Navarra |
| Participantes | |
| Itxarone Bilbao Aguirre | Hospital Universitario Vall d’Hebron-Barcelona |
| Loreto Hierro Llanillo | Hospital Universitario La Paz |
| Rafael López Andújar | Hospital Universitario La Fe |
| Manuel López Santamaría | Hospital Universitario La Paz |
| Alejandro Manrique Municio | Hospital Universitario 12 de Octubre |
| Javier Nuño Vázquez-Garza | Hospital Universitario Ramón y Cajal |
| Grupo 03 | |
| Evaluación de la calidad de los donantes hepáticos | |
| Coordinadores | |
| Gloria De la Rosa | En representación de ONT |
| Javier Briceño Delgado | Hospital Universitario Reina Sofía |
| Trinidad Serrano Aullo | Hospital Clínico Universitario Lozano Blesa |
| Participantes | |
| José María Álamo Martínez | Hospital Universitario Virgen del Rocío |
| Manuel de la Mata García | Hospital Universitario Reina Sofía |
| José Fuster Obregón | Hospital Universitario Clínic |
| Manuel Gómez Gutiérrez | Hospital Universitario Juan Canalejo |
| Jorge Ortiz de Urbina López | Hospital de Cruces |
| Fernando Rotellar Sastre | Clínica Universitaria de Navarra |
| Belinda Sánchez Pérez | Hospital Regional Universitario Carlos Haya |
| Grupo 04 | |
| Calidad y acreditación de los programas de trasplante hepático | |
| Coordinadores | |
| Juan José Pérez Lázaro | En representación de EASP |
| Gerardo Clemente Ricote | Hospital General Universitario Gregorio Marañón |
| Evaristo Varo Pérez | Hospital Clínico Universitario de Santiago |
| Participantes | |
| Juan Fabregat Prous | Hospital Universitario de Bellvitge |
| Agustín García Gil | Hospital Clínico Universitario Lozano Blesa |
| Daniel Garrote Lara | Hospital Universitario Virgen de las Nieves |
| Ignacio González-Pinto Arrillaga | Hospital Universitario Central de Asturias |
| Luis Antonio Herrera Morena | Hospital Universitario Marqués de Valdecilla |
| José Ignacio Herrero Santos | Clínica Universitaria de Navarra |
| Jorge Martínez Castro | Hospital Clínico Universitario de Santiago |
| David Pacheco Sánchez | Hospital Universitario Río Hortega |
| Martín Prieto Castillo | Hospital Universitario La Fe |
| Pablo Ramírez Romero | Hospital Universitario Virgen de la Arrixaca |
| Guillermo Solórzano Peck | Hospital Universitario Infanta Cristina |
| Arturo Soriano Benítez de Lugo | Hospital Universitario Nuestra Señora de la Candelaria |
| José Manuel Sousa Martín | Hospital Universitario Virgen del Rocío |
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en Cir Esp. 2011. doi:10.1016/j.ciresp.2011.06.005.