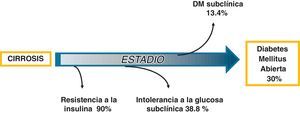
La prevalencia de la diabetes mellitus (DM) clínica en la cirrosis hepática es del 30%, sin embargo en pacientes con glucemia en ayuno normal puede haber intolerancia a la glucosa y DM en el 90% de los casos después de una carga oral de glucosa. La DM tipo 2 puede producir una cirrosis, sin embargo, la cirrosis puede complicarse con una DM. A esta última forma de diabetes se la conoce como diabetes hepatógena. Se ha demostrado que la DM clínica o subclínica se asocia a un incremento de las complicaciones hepáticas y de la mortalidad. El tratamiento de la diabetes del cirrótico tiene muchas dificultades propias de la enfermedad hepática. Se desconoce cuál es el tratamiento más adecuado, ya que no existen guías de tratamiento. Además, no se sabe cómo impacta el manejo adecuado de este trastorno en la historia natural de la cirrosis hepática.
The prevalence of overt diabetes mellitus (DM) in liver cirrhosis is about 30%. However, DM or impaired glucose tolerance can be observed in 90% after an oral glucose tolerance test in patients with normal fasting plasma glucose. Type 2 DM may produce cirrhosis, whereas DM may be a complication of cirrhosis. The latter is known as «hepatogenous diabetes». Overt and subclinical DM is associated with liver complications and death in cirrhotic patients. Treating diabetes is difficult in cirrhotic patients because of the metabolic impairments due to liver disease and because the most appropriate pharmacologic treatment has not been defined. It is also unknown if glycemic control with hypoglycemic agents has any impact on the course of the liver disease.
La prevalencia de diabetes mellitus (DM) abierta en pacientes con cirrosis hepática de cualquier etiología es de alrededor del 30%1. Sin embargo, por curva de tolerancia oral a la glucosa (CTOG) en pacientes con glucemia en ayunas normal existe intolerancia a la glucosa (IG) y DM hasta en el 96%2.
Existen 2 vertientes en la relación de la DM y la cirrosis hepática: a) la DM tipo 2 hereditaria, (que forma parte del síndrome metabólico con la obesidad, la hipertrigliceridemia y la hipertensión portal), puede ser un factor de riesgo para el desarrollo de enfermedad hepática3–5. En una época en que la obesidad y la DM se han incrementado al grado de ser problemas de salud pública, las enfermedades hepáticas que resultan de estas alteraciones metabólicas adquieren mayor relevancia6, y b) por otro lado, la DM puede ser una complicación de la cirrosis. Esta diabetes se conoce con el nombre de «diabetes hepatógena» (DH). Ambos tipos de DM se asocian a un aumento de las complicaciones y de muerte7.
El tratamiento de la diabetes del cirrótico es complejo debido al daño hepático y a la hepatotoxicidad de algunos hipoglucemiantes orales. Actualmente no existen estudios que evalúen cuáles son los mejores esquemas terapéuticos de la diabetes en los cirróticos y se desconoce además si el control de la DM modifica la historia natural de la enfermedad hepática. En la presente revisión señalaremos también de forma breve el papel de la DM como factor de riesgo para el desarrollo y agravamiento del cáncer hepatocelular (CHC).
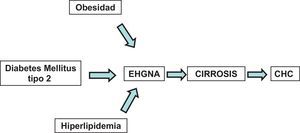
La diabetes mellitus tipo 2 es causa de enfermedad hepática crónica y de cáncer hepatocelular (CHC)EpidemiologíaEn la actualidad no existen dudas de que el síndrome metabólico causa enfermedad hepática crónica y CHC independientemente del alcohol y de los virus8 (fig. 1).
En un estudio de cohortes con 173.643 pacientes, se estudiaron durante 10 años a 650.620 que no tenían DM tipo 2 en el momento de su inclusión. La incidencia de enfermedad hepática crónica no alcohólica y de CHC fue significativamente más alta en los pacientes diabéticos. Este riesgo fue independiente de enfermedad hepática alcohólica, hepatitis viral y factores demográficos3. Sin embargo, no fueron tomados en cuenta otros factores del síndrome metabólico como la obesidad y la dislipidemia. No obstante, en otro estudio realizado en Canadá, recientemente publicado y conducido en población abierta, se observó que después de ajustar obesidad, dislipidemia e hipertensión arterial los sujetos diabéticos tuvieron 2 veces mayor riesgo de desarrollar enfermedad hepática severa que los no diabéticos9.
Por otra parte, en otro estudio realizado en Dinamarca la tasa de incidencia estandarizada de CHC fue de 4,0 (IC 95%: 3,5-4,6) en hombres y de 2,1 (IC 95%: 1,6-2,7) en mujeres con DM tipo 2 comparados con la población general10, mientras que en otro estudio italiano reciente de casos y controles con 465 pacientes la prevalencia de DM fue más frecuente en los pacientes con CHC que en los controles (31,2 vs 12,7%; OR 3,12; IC 95%: 2,22-4,43). La DM había sido diagnosticada antes de la aparición del CHC en el 84% de los casos con un periodo promedio de 181,4 meses11.
Recientemente se observó que los pacientes con hepatitis crónica por virus C, DM y fibrosis avanzada tenían un riesgo 3 veces mayor que los no diabéticos con fibrosis leve a moderada de desarrollar CHC a 5 años de seguimiento (13 vs 5%)12.
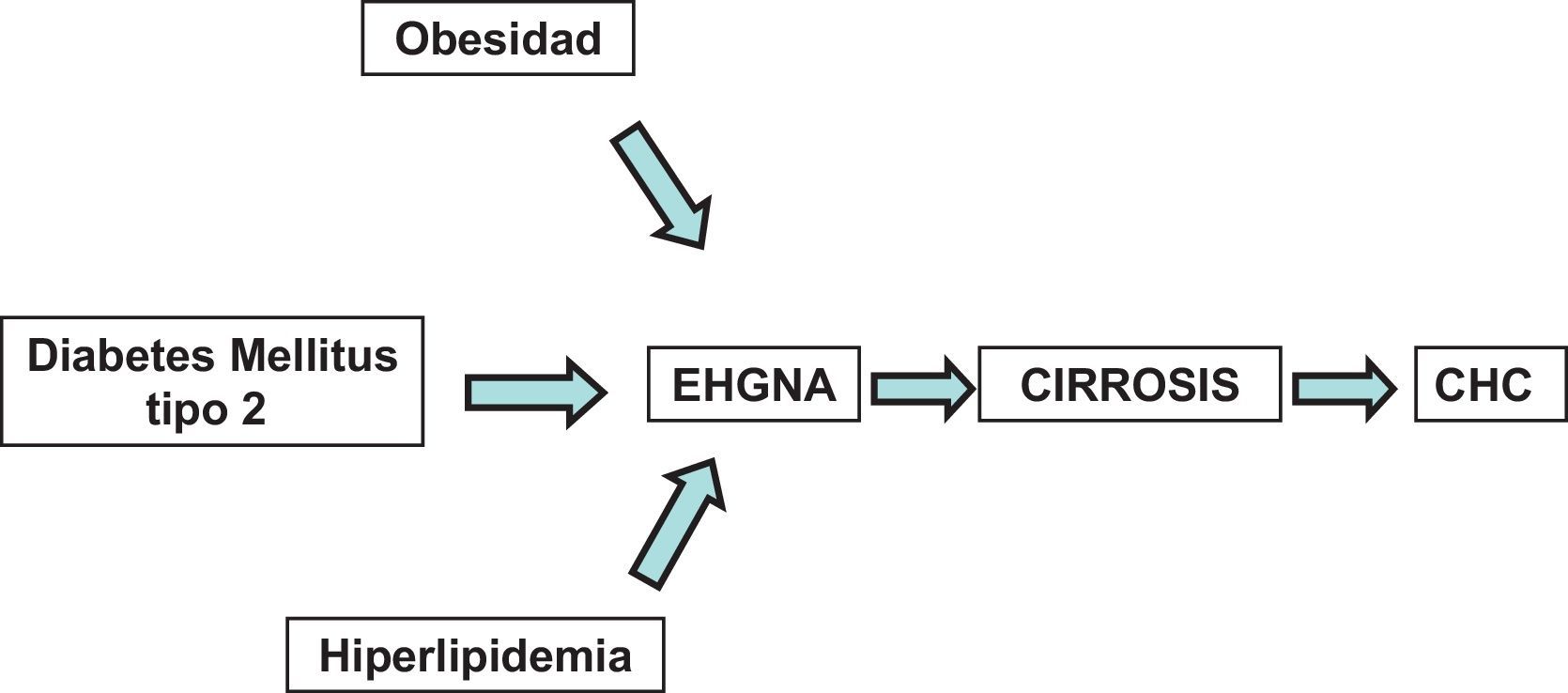
Enfermedad hepática grasa no alcohólicaLa enfermedad hepática grasa no alcohólica (EHGNA) comprende un conjunto de afecciones que van desde la esteatosis simple hasta la cirrosis pasando por la esteatohepatitis y la fibrosis. Se estima que una tercera parte de los individuos adultos americanos pueden tener esteatosis hepática13,14, la cual se considera como la manifestación más benigna de la EHGNA. La esteatohepatitis no alcohólica (EHNA) es una manifestación severa de la EHGNA pues da lugar a inflamación tisular, daño celular y fibrosis. No obstante, la prevalencia de EHNA es baja (2-3%). La EHNA puede progresar a cirrosis y fallo hepático y existen evidencias de que es la causa más común de la cirrosis criptogénica6,15.
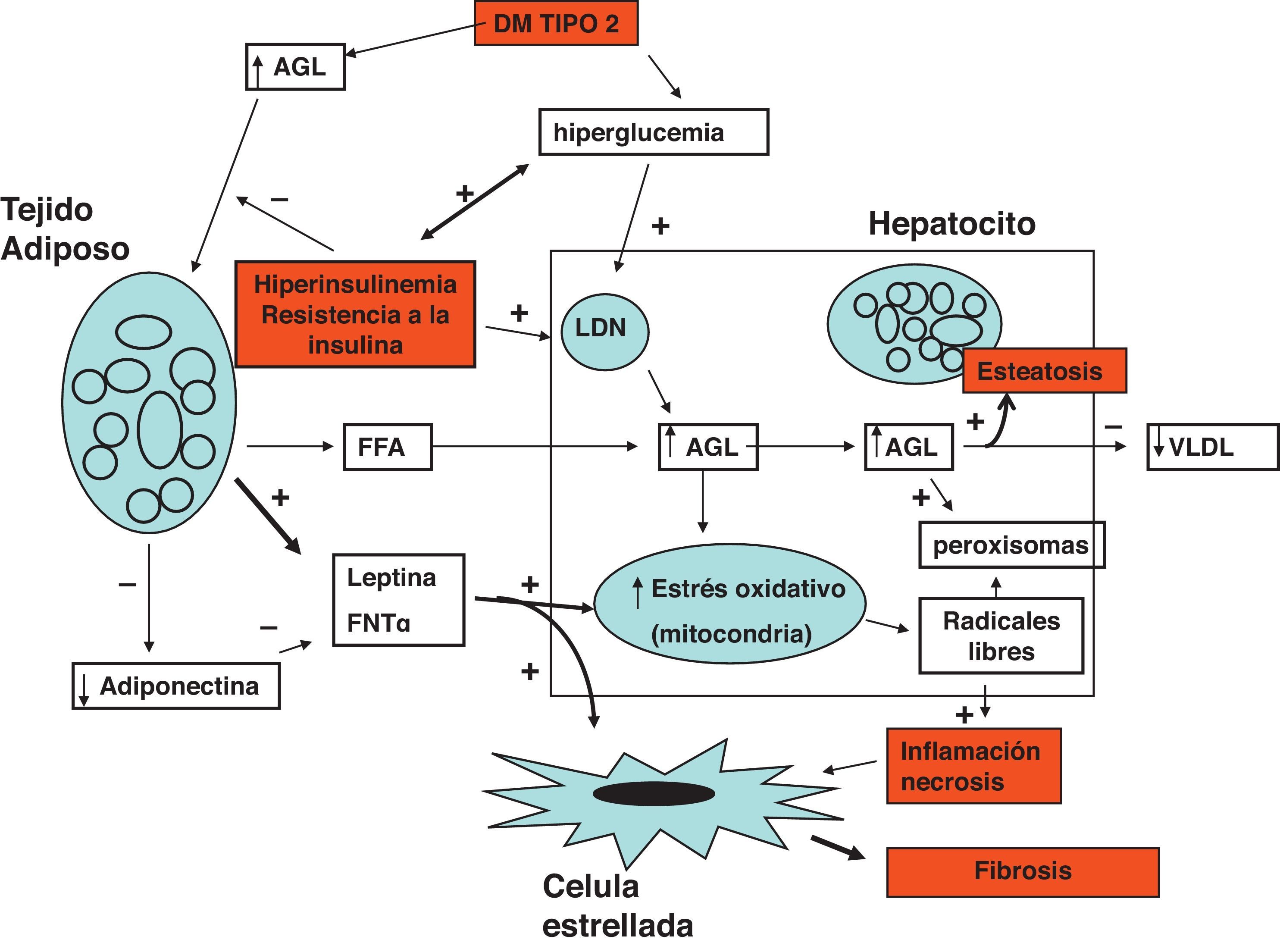
Fisiopatogenia de la enfermedad hepática causada por diabetes mellitus tipo 2Los mecanismos mediante los cuales la DM tipo 2 pudiera causar enfermedad hepática no alcohólica son complejos. La esteatosis hepática, la obesidad y la resistencia a la insulina actúan como cofactores para provocar daño hepático1,4,5. La esteatosis es el resultado de una acumulación intracelular de triglicéridos debido a la captación aumentada de ácidos grasos libres y a la síntesis de novo en los hepatocitos14. El daño hepático consiste en necrosis celular e inflamación producidos por un incremento del estrés oxidativo mitocondrial de triglicéridos con la consecuente generación de peroxisomas y radicales libres16,17. El estrés oxidativo mitocondrial se incrementa también por acción de las adipocinas como la leptina, adiponectina, interleucina 6 y el factor de necrosis tumoral alfa (TNFα), los cuales se producen en exceso debido a un estado de inflamación del tejido adiposo visceral y subcutáneo18. La reducción de adiponectina favorece la acción de las adipocinas inflamatorias19. Los mediadores químicos derivados de la inflamación y la necrosis celular, así como las adipocinas, activan las células estelares induciéndolas a producir colágeno aumentando la producción del factor de crecimiento de tejido conjuntivo y acumulación de matriz extracelular favoreciendo la fibrosis20. La transcripción nuclear de factor peroxisome proliferator-activated receptor gamma (PPARγ) y el sistema endocanabinoide podrían tener un papel importante en la fibrogénesis y pudieran ser potenciales blancos terapéuticos21 (fig. 2).
Daño hepático producido por la DM tipo 2. La resistencia a la insulina promueve liberación de ácidos grasos libres (AGL) del tejido adiposo. Los AGL se acumulan en el hepatocito a lo cual contribuye la lipogénesis de novo (LDN). La reducción de la secreción de lipoproteínas de muy baja densidad (VLDL) satura la célula de grasa produciendo esteatosis. El estrés oxidativo mitocondrial se encuentra incrementado debido al exceso de AGL intracelulares y la acción de las adipocinas (leptina y factor de necrosis tumoral alfa [TNFα]). El exceso de estrés oxidativo produce radicales libres lo cual a su vez induce la inflamación y necrosis celular. La inflamación estimula las células estelares para que produzcan colágeno.
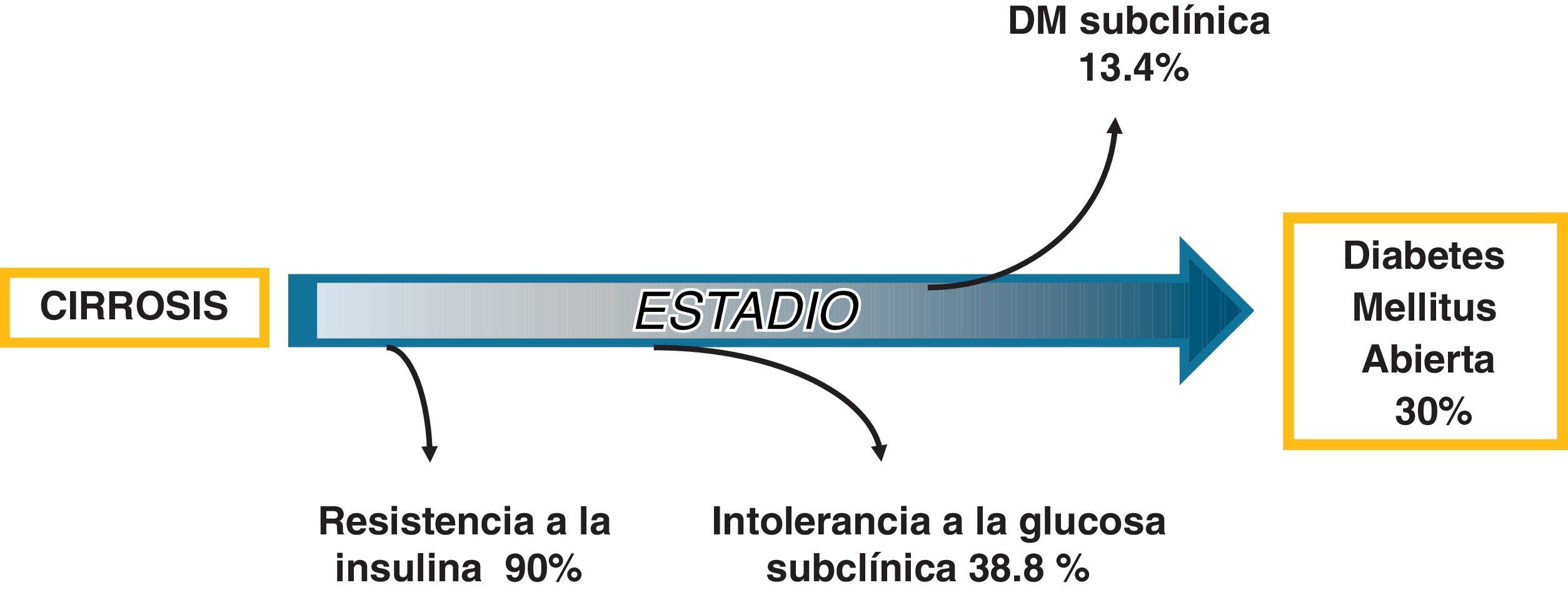
A pesar que existen evidencias sólidas de que la diabetes es una complicación de la cirrosis hepática, este tipo de diabetes no es reconocida por la Asociación Americana de Diabetes en su nueva clasificación22. Además, es frecuentemente subestimada por los médicos gastroenterólogos a pesar de que se asocia a un aumento de las complicaciones hepáticas, resistencia a los antivirales y muerte en los pacientes cirróticos7. Si bien es cierto que no existen pruebas de laboratorio que permitan distinguir entre una DH y una DM tipo 2 cuando ya está establecida la cirrosis, existen algunas diferencias clínicas entre ellas. La DH se asocia con menor frecuencia a antecedentes familiares de DM tipo 2, hipertrigliceridemia, hipertensión arterial y microangiopatía2. Por estudios recientes se sabe que desde las etapas tempranas de la enfermedad hepática existe resistencia a la insulina e IG en la mayoría de los pacientes2,23,24. A medida que se deteriora más la función hepática la DM se manifiesta clínicamente por lo que la DH puede considerarse como un indicador de enfermedad hepática avanzada2,25 (fig. 3). La etiología de la enfermedad hepática crónica es crucial ya que alcohol, el virus de la hepatitis C y la hemocromatosis son agentes que con más frecuencia producen DH.
En un estudio realizado por el National Health and Nutrition Examination Survey en Estados Unidos se identificó un riesgo 3 veces mayor de DM en sujetos mayores de 40 años y hepatitis crónica C, en comparación con aquellos pacientes sin hepatitis26. Knobler et al. observaron prevalencia de DM en el 33% de los pacientes no cirróticos con virus de la hepatitis C, comparado con 5,6% en un grupo control27. En pacientes infectados crónicamente se observa esteatosis hepática en un 30-70%28.
En la infección por virus de la hepatitis C existe intolerancia a la glucosa en más del 40% y DM en más del 17%. La resistencia a la insulina observada en estos pacientes es un factor de riesgo independiente de esteatosis en relación con la severidad de la fibrosis29–32.
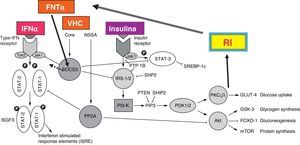
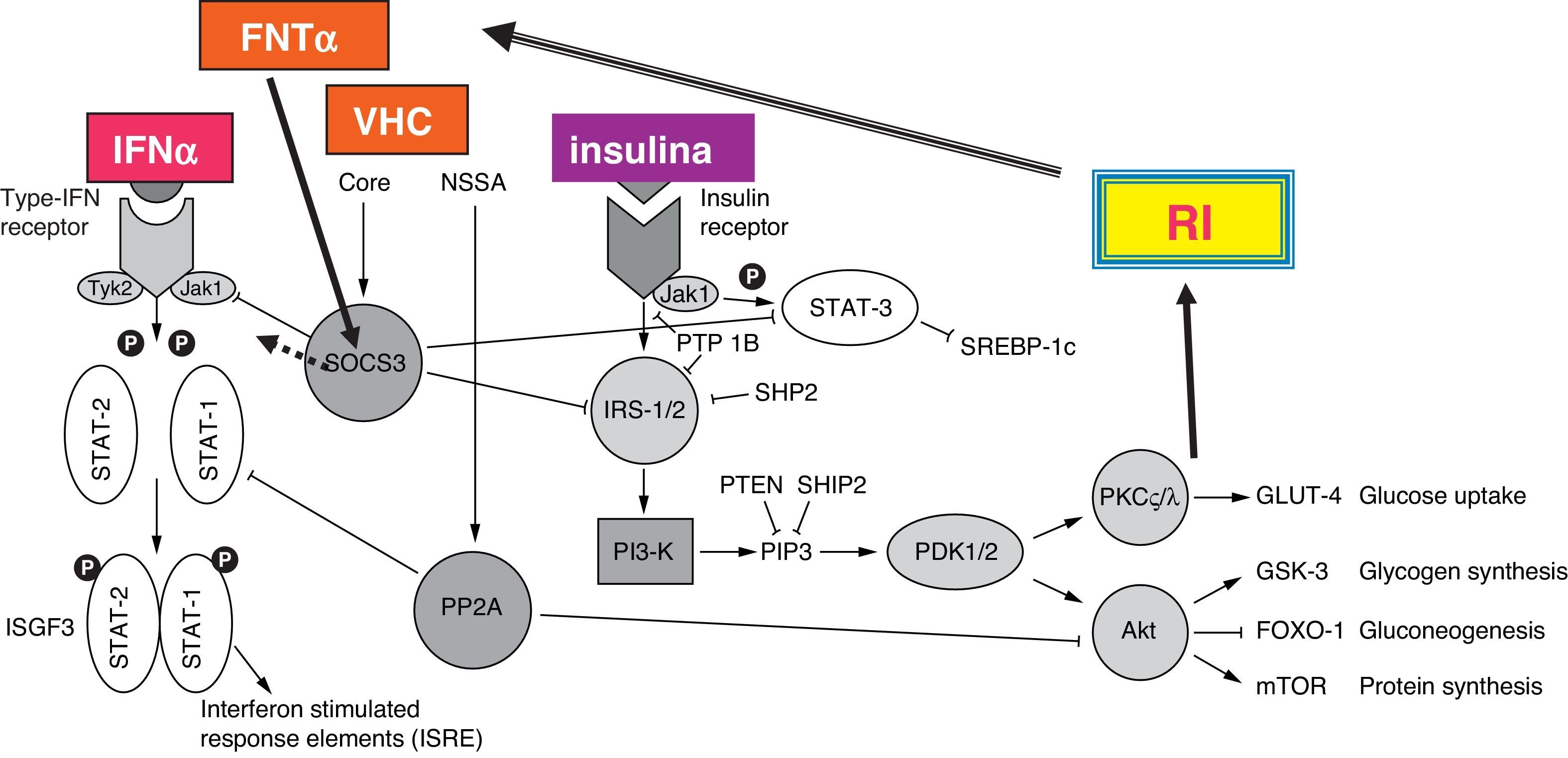
El virus C induce resistencia a la insulina independientemente del índice de masa corporal y del estadio de la fibrosis. En el modelo animal transgénico, la proteína core del VHC fue capaz de inducir resistencia a la insulina, esteatosis y DM. El mecanismo principal parece relacionarse con la sobreproducción de FNTα, la cual fosforila los residuos de serina de los sustratos 1 y 2 del receptor de la insulina (IRS) y estimula la producción del supresor de citocinas (SOC3). La SOC-3 inhibe la fosforilación de AKT y de la fosfatidilinositol 3 cinasa (PI3K). Todos estos trastornos podrían bloquear la transactivación de GLUT-4, que tendría como resultado un bloqueo en la captación de glucosa celular (fig. 4). En el ratón transgénico el FNTα se correlaciona con hiperinsulinismo y el bloqueo de TNFα con fármacos anti-FNTα como el infliximab evita la aparición de resistencia a la insulina. Además, la sobreproducción de FNTα en pacientes con hepatitis crónica C se correlaciona con una progresión más rápida de la fibrosis y una menor respuesta al interferón33.
Las proteínas NSSA y core del virus de la hepatitis C pueden inhibir el efecto de la insulina y el interferón alfa (véasetexto). Sustratos de receptor de insulina: P13 K: fosfatidil inositol 3 cinasa; PDK: cinasa dependiente de fosfoinositido; PKC: isoformaC de proteinacinasa; PP2A: fosfatasa de proteína 2 A; SOCS3: supresor de se¿nalización de citocinas 3; SREBP: proteína reguladorade síntesis de esteroides.
Por otra parte, los genotipos 1 y 4 del virus C se asocian con resistencia a la insulina en una proporción mayor que los genotipos 2 y 3 (37 vs 17%), con mayor carga viral (60 vs 45%) con esteatosis severa (44 vs 16%) y con fibrosis significativa (68 vs 44%)31. Sin embargo, la resistencia a la insulina es un factor de mayor peso que el genotipo en relación con la respuesta al tratamiento antiviral. En un estudio reciente se observó que en pacientes con genotipo 1 la respuesta viral sostenida a los antivirales fue 2 veces mayor en pacientes con HOMA<2 (60,5%) que en pacientes con HOMA>2 (32,8%)34. En apoyo a este concepto en los experimentos llevados a cabo en células Huh-7 infectadas con ARN-VHC, la replicación viral se bloqueó al agregar interferón al sistema. Sin embargo, cuando se agregó insulina al interferón a la dosis de 128 μU/ml (similar a la que se observa en los estados hiperinsulinémicos) la habilidad del interferón para bloquear la replicación viral se abolió35. En términos generales se ha reportado que los pacientes con hepatitis crónica por virus C y resistencia a la insulina, independientemente del genotipo, tienen menor respuesta sostenida al tratamiento con peginterferón mas ribavirina que los pacientes sin resistencia insulínica33,34.
La erradicación del VHC se asocia con una reducción de la incidencia de diabetes. En un estudio reciente 234 pacientes con hepatitis crónica C y glucemia en ayuno normal fueron monitorizados durante 3 años después de terminar el tratamiento antiviral. A los 14 meses de seguimiento solo el 14,6% de los pacientes con respuesta viral sostenida y el 34,1% de los no respondedores desarrollaron intolerancia a la glucosa o DM (p=0,04)36. Sin embargo, en otro estudio reciente se observó que la depuración del virus C mediante tratamiento con antivirales no redujo el riesgo de la incidencia de DM en pacientes con hepatitis crónica y glucosa sérica en ayunas normal durante un periodo de 8 años de seguimiento posterior al tratamiento. Los pacientes con respuesta viral sostenida tuvieron una incidencia semejante a los no respondedores37.
AlcoholLos pacientes con enfermedad hepática alcohólica tienen un riesgo relativo elevado de tener DM38, el cual está en relación directa con la cantidad de alcohol ingerido ya que se aumenta al doble en los que ingieren más de 270g de alcohol por semana en comparación con los que ingieren de 60 a 120 g39. La intoxicación aguda provoca una disminución en la captación de glucosa mediada por insulina. Por otra parte, los pacientes con alcoholismo crónico con frecuencia presentan daño pancreático crónico y lesión de las células beta de los islotes pancreáticos dando como consecuencia DM1.
HemocromatosisLa hemocromatosis hereditaria es una enfermedad caracterizada por la acumulación de hierro en diversos tejidos, particularmente en el hígado, causada por una mutación del gen HFE. Además el hierro puede acumularse en el páncreas y el miocardio. En el páncreas la concentración de hierro es predominantemente en los acinos de secreción exocrina. Sin embargo, también se puede observar infiltración en los islotes de Langerhans con daño de las células β productoras de insulina. Es por esto que en pacientes con hemocromatosis hereditaria entre el 50 y el 85% presentan DM, particularmente en etapas avanzadas40. A esta frecuencia elevada de DM contribuye también probablemente la serie de trastornos del metabolismo glúcido secundarios al daño hepático1,7.
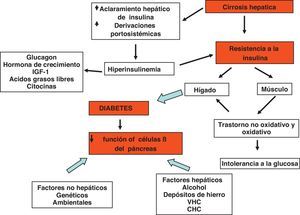
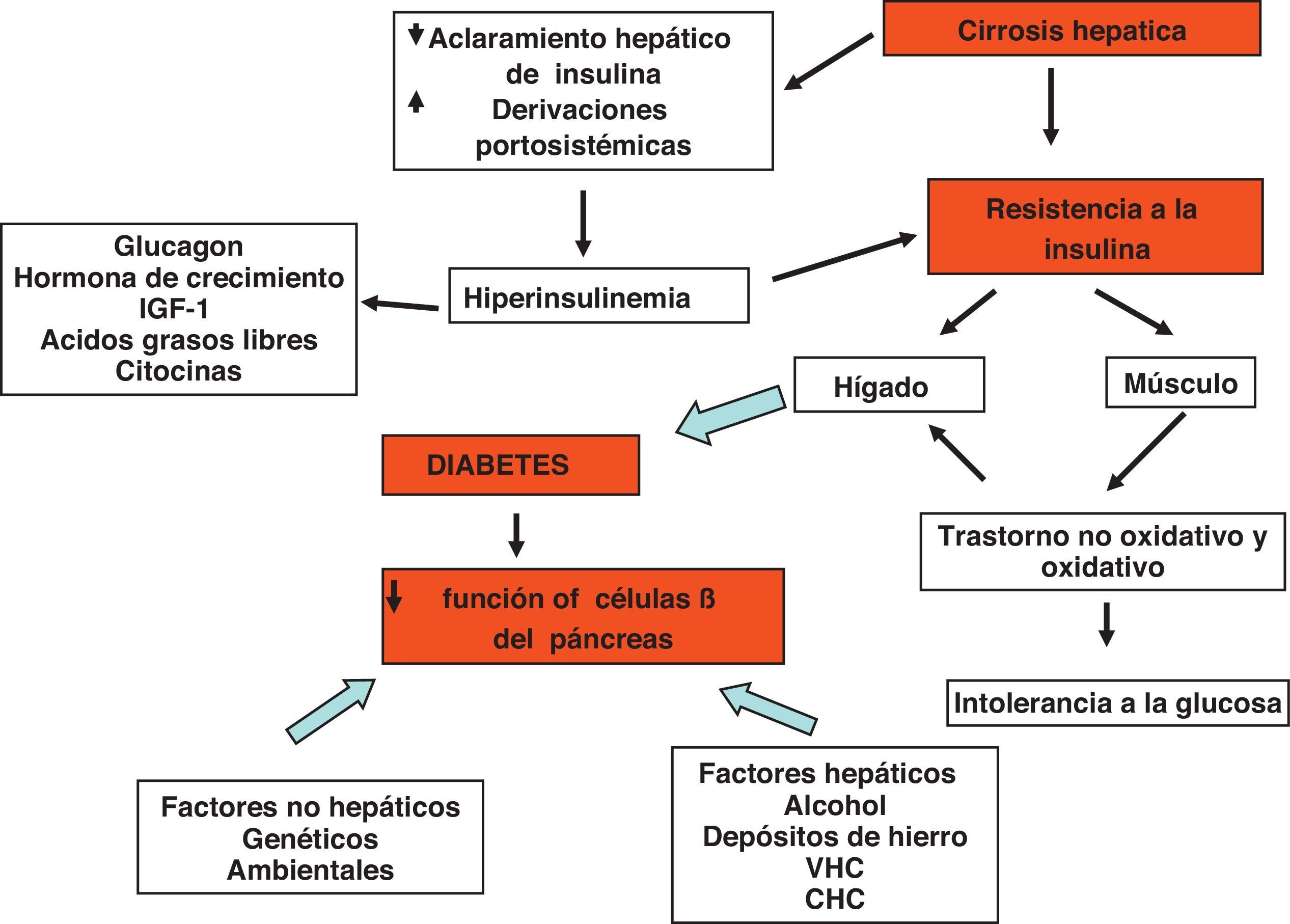
Fisiopatogenia de la diabetes hepatógenaLa fisiopatogenia de la DH es compleja y no se conoce con precisión. La resistencia a la insulina de los tejidos periféricos tiene un papel central1,3,41–46. Se ha propuesto que la reducida extracción hepática de insulina y los cortocircuitos portosistémicos da como resultado una hiperinsulinemia, la cual es potenciada por la elevación de los niveles de hormonas contrainsulínicas (glucagón, hormona de crecimiento, factor de crecimiento similar a la insulina, ácidos grasos libres y citocinas)3,42,44,46. En un estudio reciente con pacientes cirróticos en estadio B de Child-Pugh se observó que el hiperinsulinismo podría deberse a un incremento de la sensibilidad de las células beta del páncreas a la glucosa mientras que la extracción hepática de insulina no fue significativa47. Se ha especulado también que podrían existir factores genéticos y ambientales por una parte y algunos agentes etiológicos de la cirrosis por otra, como el virus C, el alcohol, depósitos de hierro los cuales actuarían de manera sinérgica41. En conclusión, la DM podría resultar de 2 alteraciones que ocurren simultáneamente: resistencia a la insulina del tejido muscular y una respuesta inadecuada de las células β para secretar insulina43,44 (fig. 5).
Fisiopatogenia de la cirrosis hepatógena. El fenómeno clave es la resistencia a la insulina. La disminución en la depuraciónde la insulina y los cortocircuitos portosistémicos causados por la cirrosis por una parte y la desensibilización de las células betadel páncreas por diversos agentes por otra parte produce hiperinsulinemia. La resistencia a la insulina es a nivel del músculoinicialmente y del hígado en etapas posteriores. La resistencia a la insulina en el músculo es a nivel del metabolismo oxidativo y nooxidativo.
En estudios retrospectivos transversales se ha observado que la DM se asocia a un incremento del riesgo de complicaciones de la cirrosis de cualquier etiología48–50. De acuerdo con el estudio de Verona, el cual se basa en una población de más de 7.000 sujetos con DM tipo 2, se observó un riesgo de muerte a los 5 años de 2,52 veces mayor (IC 1,96-3,2) que en la población general51. Otros estudios reportan que la DM, la obesidad y la esteatosis se asocian a enfermedad hepática y fibrosis más severa en hepatitis crónica C52,53.
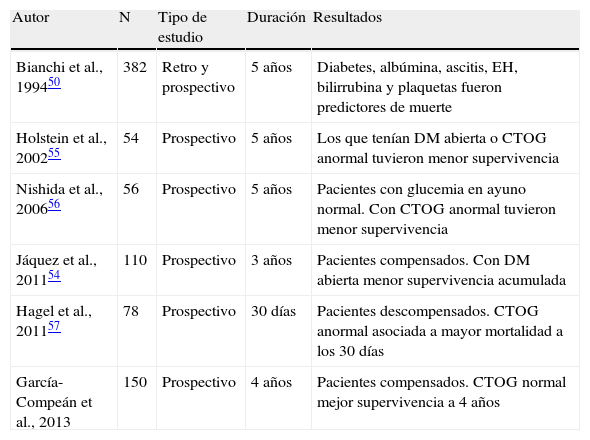
Solo se han publicado muy pocos estudios prospectivos en los cuales se ha evaluado la influencia de la diabetes en la morbimortalidad de los pacientes cirróticos con o sin descompensación hepática (tabla 1). En un estudio con 110 pacientes cirróticos, 50 de ellos con DM, la supervivencia acumulada a 3 años fue significativamente menor en los diabéticos. En el análisis de regresión la DM fue predictiva de mortalidad. La creatinina sérica y la clasificación de Child-Pugh fueron también predictores independientes de muerte54. Se ha demostrado también que los trastornos subclínicos del metabolismo de la glucosa (IG y DM) tienen efecto negativo en la supervivencia a largo plazo de los pacientes cirróticos55,56. En un estudio con 56 pacientes con glucemia en ayuno normal en quienes se realizó CTOG con una carga de 75 g de glucosa se observó que la supervivencia a 5 años en los pacientes con la prueba normal fue más alta (94,7%) que en aquellos con IG o DM (68,8 y 56,6% respectivamente). Las diferencias entre los pacientes con CTOG normal vs pacientes con IG y DM fueron estadísticamente significativas. El análisis de regresión múltiple mostró que la albúmina y la CTOG fueron predictores independientes de supervivencia55. En otro estudio con 54 pacientes cirróticos, 35 (64%) sin DM, se observó que aquellos con IG y DM detectados por CTOG y con DM abierta tuvieron una reducción significativa de la supervivencia acumulada a 5 años56.
Estudios prospectivos con pacientes cirróticos en los cuales se evalúa la influencia de la diabetes mellitus en la supervivencia
| Autor | N | Tipo de estudio | Duración | Resultados |
| Bianchi et al., 199450 | 382 | Retro y prospectivo | 5 años | Diabetes, albúmina, ascitis, EH, bilirrubina y plaquetas fueron predictores de muerte |
| Holstein et al., 200255 | 54 | Prospectivo | 5 años | Los que tenían DM abierta o CTOG anormal tuvieron menor supervivencia |
| Nishida et al., 200656 | 56 | Prospectivo | 5 años | Pacientes con glucemia en ayuno normal. Con CTOG anormal tuvieron menor supervivencia |
| Jáquez et al., 201154 | 110 | Prospectivo | 3 años | Pacientes compensados. Con DM abierta menor supervivencia acumulada |
| Hagel et al., 201157 | 78 | Prospectivo | 30 días | Pacientes descompensados. CTOG anormal asociada a mayor mortalidad a los 30 días |
| García-Compeán et al., 2013 | 150 | Prospectivo | 4 años | Pacientes compensados. CTOG normal mejor supervivencia a 4 años |
Recientemente, en 78 pacientes cirróticos descompensados a quienes se realizó CTOG se observó que aquellos cuya prueba fue anormal tuvieron significativamente una menor supervivencia a corto plazo (30 días)57. De forma similar, nosotros hemos observado en 150 pacientes cirróticos compensados que la CTOG normal permite identificar pacientes con una supervivencia acumulada a 4 años significativamente más alta (resultados no publicados).
La DM en conjunto con la infección por virus de la hepatitis B y C y cirrosis hepática por alcohol incrementan hasta 10 veces el riesgo de CHC1,3.
Por otra parte, los pacientes con DM y CHC tienen un riesgo de mortalidad mayor que los pacientes sin diabetes. En otro estudio con 160 pacientes con CHC aquellos que tenían DM tuvieron mayor mortalidad a un año que los pacientes sin diabetes. Además, tuvieron enfermedad más extensa58.
Probables mecanismos mediante los cuales la diabetes mellitus se asocia a un aumento de la morbimortalidadSe ha especulado que la DM y la IG mediante los mecanismos previamente señalados podrían agravar la enfermedad hepática promoviendo la inflamación y la fibrosis con la consecuente insuficiencia hepática. La DM podría reducir la supervivencia al incrementar las complicaciones. Se ha demostrado que los pacientes cirróticos con DM fallecen por causas principalmente relacionadas con la enfermedad del hígado50,54–56. No obstante, este hecho podría deberse a la corta duración de la diabetes y la reducción de la esperanza de vida del paciente cirrótico o bien al efecto protector del sistema cardiovascular y la aterosclerosis producido por la enfermedad hepática59. Por otra parte, la DM reduce la inmunocompetencia de los pacientes aumentando la incidencia de infecciones severas. En un estudio reciente la peritonitis bacteriana espontánea fue significativamente más frecuente en pacientes con cirrosis criptogénica60. Los pacientes con peritonitis bacteriana espontánea tuvieron una elevada mortalidad intrahospitalaria, fallo hepático y síndrome hepatorrenal61.
Tratamiento de la diabetes del paciente cirróticoA pesar del cúmulo de información reciente en relación con el impacto negativo de la DM en la supervivencia de los pacientes cirróticos, hasta el momento actual se han publicado muy escasos estudios terapéuticos con el objetivo de conocer cuáles son los regímenes de tratamiento más adecuados de la diabetes y, sobre todo, para saber cuál es el impacto del tratamiento en la supervivencia de los pacientes. Además, la DM del paciente cirrótico puede ser con frecuencia subestimada por los médicos como lo ilustra un estudio realizado en Alemania en donde se envió una encuesta a 576 gastroenterólogos con preguntas específicas basándose en publicaciones recientes. De 253 cuestionarios contestados, el 90 y 40% de los médicos subestimaron la prevalencia de IG y DM en los pacientes cirróticos, respectivamente62. Este estudio podría reflejar que una proporción sustancial de la comunidad médica, incluyendo la altamente especializada, podría no tener suficiente información acerca de las implicaciones de la DM en la cirrosis. Quizá todo lo anteriormente señalado explique por qué no existen guías de tratamiento orientadas a los médicos generales y especializados.
Como si lo anterior fuera poco, el tratamiento de la DM del paciente cirrótico es difícil por lo siguiente: a) alrededor de la mitad de los pacientes tiene malnutrición; b) cuando se diagnostica la DM el paciente tiene insuficiencia hepática avanzada; c) la mayor parte de los hipoglucemiantes orales y la insulina se metabolizan en el hígado; d) estos pacientes tienen con frecuencia episodios de hipoglucemia; e) la adherencia al tratamiento posiblemente es baja, particularmente en los alcohólicos, y f) la persistencia de la ingestión de alcohol4.
En un estudio retrospectivo de reciente publicación con 87 pacientes cirróticos con DM, el 39,1% de los pacientes con estadios avanzados de la enfermedad hepática recibieron tratamiento potencialmente nocivo por parte del médico. Un tercio de los pacientes continuó la intoxicación alcohólica en forma importante durante el tratamiento y en 41,4% no hubo adherencia a la medicación. Solo el 28,7% de los pacientes tuvieron control satisfactorio de la glucemia (definido por HbA1c < 6,5%)63.
El tratamiento inicial de los pacientes con hiperglucemia leve a moderada y enfermedad hepática compensada podría ser el cambio del estilo de vida, ya que en esta etapa la resistencia a la insulina es un factor predominante. Sin embargo, estas medidas terapéuticas pueden verse comprometidas por dietas muy restrictivas que podrían agravar el estado de malnutrición. El ejercicio, el cual mejora la resistencia a la insulina, no es adecuado en pacientes con enfermedad hepática activa44.
En estadios avanzados de la enfermedad hepática, cuando la DM se manifiesta clínicamente, puede ser necesario el uso de hipoglucemiantes orales. Sin embargo, la mayor parte de estos fármacos se metaboliza en el hígado, por lo que la monitorización de las cifras de glucosa en sangre durante el tratamiento debe ser estrecha para evitar la hipoglucemia64. La metformina, que disminuye la resistencia a la insulina, podría ser de utilidad. Sin embargo, este medicamento está relativamente contraindicado en pacientes con insuficiencia hepática avanzada y en los que continúan la ingesta de alcohol por el riesgo de acidosis láctica65.
Los secretagogos de la insulina, a pesar de que son medicamentos seguros, probablemente no son útiles ya que no modifican la resistencia a la insulina y los pacientes con cirrosis alcohólica con frecuencia tienen daño en las células beta de los islotes pancreáticos66.
Los inhibidores de la alfaglucosidasa reducen la absorción intestinal de hidratos de carbono por lo que disminuyen los riesgos de la hiperglucemia posprandial la cual es común en estos pacientes. En un estudio doble ciego con 100 pacientes con cirrosis hepática compensada y DM tratada con insulina el control de la glucemia en ayunas y posprandial mejoró de forma significativa con el uso de acarbosa67. En otro estudio controlado cruzado con placebo en pacientes con encefalopatía hepática la acarbosa produjo una mejoría significativa de la glucemia posprandial, una reducción de los niveles plasmáticos de amonio y un incremento de la frecuencia de las evacuaciones68.
Las tiazolidinas pueden ser especialmente útiles, ya que incrementan la sensibilidad a la insulina. Sin embargo, la troglitazona ha sido retirada del mercado debido a su potencial efecto hepatotóxico. No obstante, la rosiglitazona y la pioglitazona, al parecer más seguros69, no se recomiendan si hay evidencia de enfermedad hepática activa o si los niveles de ALT están por encima de 2,5 ULN.
Los requerimientos de insulina pueden variar. En pacientes con cirrosis compensada los requerimientos pueden ser mayores, ya que en estos predomina la resistencia a la insulina mientras que en los pacientes con cirrosis descompensada el metabolismo hepático de la insulina está muy deteriorado. La insulina debe de utilizarse de preferencia con el paciente internado con monitorización estrecha de las glucemias por el riesgo de hipoglucemia70.
Finalmente, el trasplante hepático normaliza la tolerancia a la glucosa y la sensibilidad a la insulina de forma rápida. Se piensa que este efecto se debe a una mejora de la depuración hepática y de la disposición periférica de la glucosa. Este último efecto podría ser secundario a una corrección de la hiperinsulinemia crónica45,71. No obstante, el trasplante hepático cura la DH solo en el 67% de los casos. En el 33% la diabetes no fue corregida debido a la persistencia de una reducción del funcionamiento de las células beta del páncreas72.
Perspectivas de la investigación de la diabetes mellitus en la cirrosis hepáticaEn el futuro deberán aclararse los siguientes puntos: a) la importancia del diagnóstico temprano de la diabetes (mediante CTOG) en la reducción de la mortalidad de los pacientes con cirrosis; b) los beneficios que aporta el control de la DM en el manejo de las complicaciones de la cirrosis hepática y la supervivencia, y f) el establecimiento de guías de tratamiento en el manejo de la diabetes del paciente cirrótico.
Quizá la combinación de la diabetes o de intolerancia a la glucosa con los instrumentos predictivos de morbimortalidad actualmente utilizados en los pacientes cirróticos (Child-Pugh y MELD) tenga mejor sensibilidad y especificidad en cierto tipo de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Daño hepático producido por la DM tipo 2. La resistencia a la insulina promueve liberación de ácidos grasos libres (AGL) del tejido adiposo. Los AGL se acumulan en el hepatocito a lo cual contribuye la lipogénesis de novo (LDN). La reducción de la secreción de lipoproteínas de muy baja densidad (VLDL) satura la célula de grasa produciendo esteatosis. El estrés oxidativo mitocondrial se encuentra incrementado debido al exceso de AGL intracelulares y la acción de las adipocinas (leptina y factor de necrosis tumoral alfa [TNFα]). El exceso de estrés oxidativo produce radicales libres lo cual a su vez induce la inflamación y necrosis celular. La inflamación estimula las células estelares para que produzcan colágeno. Daño hepático producido por la DM tipo 2. La resistencia a la insulina promueve liberación de ácidos grasos libres (AGL) del tejido adiposo. Los AGL se acumulan en el hepatocito a lo cual contribuye la lipogénesis de novo (LDN). La reducción de la secreción de lipoproteínas de muy baja densidad (VLDL) satura la célula de grasa produciendo esteatosis. El estrés oxidativo mitocondrial se encuentra incrementado debido al exceso de AGL intracelulares y la acción de las adipocinas (leptina y factor de necrosis tumoral alfa [TNFα]). El exceso de estrés oxidativo produce radicales libres lo cual a su vez induce la inflamación y necrosis celular. La inflamación estimula las células estelares para que produzcan colágeno.](https://static.elsevier.es/multimedia/02105705/0000003600000007/v1_201308090026/S0210570513000770/v1_201308090026/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)