La recidiva de la enfermedad hepática de base, la aparición de enfermedades de novo o la aparición de otras lesiones heterogéneas de etiología desconocida son las principales lesiones se encuentran en injertos hepáticos a largo plazo. En un porcentaje no despreciable de casos la analítica es normal y estas lesiones solo se detectan mediante biopsia hepática. Diagnosticarlas es fundamental ya que pueden afectar al pronóstico del paciente y del injerto, condicionar la necesidad de realizar cambios en el tratamiento inmunosupresor o introducir nuevos medicamentos para tratar enfermedades específicas. Además, algunos pacientes seleccionados con injertos hepáticos normo-funcionantes podrían beneficiarse de minimizar la inmunosupresión. Actualmente no se puede recomendar la realización de biopsias de protocolo, pero dada la elevada prevalencia de estas lesiones se debe realizar un seguimiento estrecho del injerto. La elastografía de transición podría tener un papel en la selección de pacientes que se beneficien de la realización de una biopsia hepática.
The main lesions found in long-term liver grafts are recurrence of underlying liver disease and the development of de novo diseases or heterogeneous lesions of unknown etiology. In a not insignificant percentage of patients, the results of laboratory tests are normal and these lesions are only detected by liver biopsy. Diagnosis of these lesions is essential since they can affect patient and graft prognosis and may require changes in immunosuppressive therapy or the introduction of new drugs to treat specific diseases. Moreover, some patients with normally functioning liver grafts could benefit from minimization of immunosuppressive therapy. Currently, the performance of protocol biopsies cannot be recommended. However, given the high prevalence of these lesions, grafts should be closely monitored. Transient elastrography could play a role in the selection of patients who might benefit from a liver biopsy.
La supervivencia de los pacientes con trasplante hepático ha mejorado significativamente en las últimas décadas1. Esta mejoría en la supervivencia ha aumentado la relevancia de las complicaciones del injerto y de las complicaciones extrahepáticas en periodos tardíos del trasplante hepático. Los factores que ejercen una mayor influencia sobre la supervivencia a largo plazo son: a) las complicaciones debidas al uso crónico de fármacos inmunosupresores (neoplasias, enfermedades cardiovasculares, insuficiencia renal); b) el daño hepático causado por la recidiva de la enfermedad de base (fundamentalmente la reinfección del injerto por el virus de la hepatitis C [VHC]), y c) la aparición de lesiones inflamatorias crónicas del injerto, entre las que se encuentran un conjunto de lesiones heterogéneas cuya etiología se desconoce.
La prevalencia de las lesiones histológicas que aparecen en periodos tardíos del trasplante hepático es variable según el centro y en adultos puede oscilar entre un 5 y un 90%2–6. La razón de esta variabilidad es desconocida pero podría estar relacionada con varios factores como son la etiología de la enfermedad de base, el motivo de realización de la biopsia (protocolo o por indicación clínica), la duración del seguimiento, el tipo y la cantidad de inmunosupresión y, finalmente, la diferencia en la terminología utilizada. En niños, sin embargo, la prevalencia de estas lesiones es más elevada y oscila entre un 67 y 97% de los casos7–11.
Por otra parte, debido a gran número de efectos secundarios del tratamiento inmunosupresor, la mayoría de los programas de trasplante tienen como práctica clínica habitual minimizar el tratamiento inmunosupresor una vez el paciente se ha estabilizado. Habitualmente en muchas unidades estas estrategias se realizan utilizando como guía los parámetros analíticos de la función hepática. Esto es muy poco preciso, ya que la analítica hepática a menudo no refleja el grado de lesión hepática en el injerto. Diversos estudios han demostrado que hasta un 25% de los pacientes con analítica hepática normal presentan alteraciones histológicas significativas en las biopsias de seguimiento, y otro 60% de los pacientes presentan cambios histológicos menores3,4,6. Por este motivo diversos investigadores defienden la realización de biopsias hepáticas de protocolo para individualizar el grado de inmunosupresión necesario para cada paciente. El principal problema de esta estrategia radica en que las biopsias hepáticas de protocolo a menudo revelan la presencia de lesiones inflamatorias crónicas de etiología desconocida en relación con las cuales no existe un consenso sobre el tratamiento a seguir.
En esta revisión se comentarán los hallazgos histológicos más frecuentemente encontrados en las biopsias hepáticas realizadas en períodos tardíos del trasplante hepático, y su importancia en el pronóstico y tratamiento de los pacientes.
Recidiva de la enfermedad de baseLa recidiva de la enfermedad de base es la principal causa de disfunción del injerto después de los primeros 12 meses del trasplante. La prevalencia y el significado de la recurrencia varían de forma significativa. En algunas enfermedades como la hepatitis C la recidiva es prácticamente universal y tiene un impacto sobre la supervivencia del injerto y del paciente12, mientras que en otras, la recidiva es subclínica o responde fácilmente al tratamiento instaurado y tiene poco impacto en la supervivencia del paciente o del injerto. Las enfermedades que recidivan después del trasplante hepático se resumen en la tabla 1 y a continuación se comentarán en profundidad las más frecuentes.
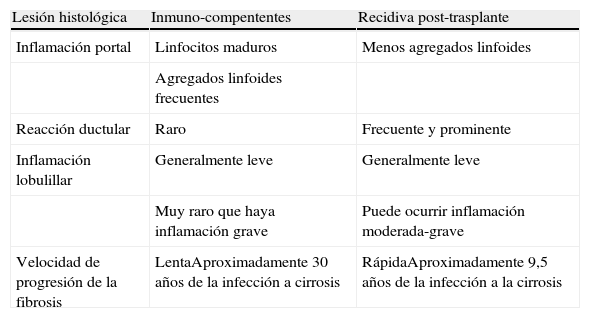
La enfermedad hepática relacionada con el VHC es la principal indicación de trasplante hepático en muchos centros en el mundo. La reinfección por el virus es universal y se produce unas pocas horas después del trasplante13,14. En más del 80% de los casos se desarrolla inflamación del injerto pero la severidad de la inflamación y las consecuencias clínicas de la reinfección son muy variables. Cuando la recidiva de la hepatitis C está establecida (generalmente 3-6 meses postrasplante) se desarrolla inflamación portal crónica y hepatitis de interfase. Estas lesiones están presentes en el 70-90% de los pacientes al año del trasplante y en el 90-95% a los 5 años15. El infiltrado inflamatorio portal está formado por linfocitos maduros y algunas células plasmáticas. En general estas lesiones son similares a las de los pacientes inmunocompetentes, aunque existen algunas características especiales en la evaluación histológica del VHC en el injerto hepático como son: una menor presencia de agregados linfoides, la presencia de reacción ductular y rápida progresión de la fibrosis12,16 (tabla 2). Además de estas diferencias, existen variantes histológicas de la recidiva del VHC en el postrasplante. Estas variantes son la hepatitis con rasgos de rechazo, la hepatitis colestásica fibrosante y la variante con rasgos de hepatitis autoinmune rica en células plasmáticas12,16. La primera se caracteriza por presentar las alteraciones histológicas propias del rechazo (lesión de los conductos biliares, endotelitis portal y presencia de eosinófilos), aunque generalmente son más leves que en el rechazo agudo típico16,17. La otra forma de presentación es la hepatitis colestásica fibrosante que se caracteriza por necrosis hepatocitaria, colestasis y fibrosis de la interfase, aparece durante el primer año del trasplante hepático y probablemente es debida a un daño citopático del virus por una replicación masiva18. Finalmente, la variante rica en células plasmáticas o «autoinmune» se caracteriza por perivenulitis y hepatitis de interfase con abundantes células plasmáticas que recuerdan una hepatitis autoinmune (HAI). Esta variante se ha considerado por algunos autores como una forma de rechazo ya que muchos pacientes mejoran cuando se aumenta la inmunosupresión basal19,20.
Diferencias histológicas entre la hepatitis crónica por virus de la hepatitis C en pacientes inmunocompetentes y la recidiva del virus postrasplante hepático
| Lesión histológica | Inmuno-compententes | Recidiva post-trasplante |
| Inflamación portal | Linfocitos maduros | Menos agregados linfoides |
| Agregados linfoides frecuentes | ||
| Reacción ductular | Raro | Frecuente y prominente |
| Inflamación lobulillar | Generalmente leve | Generalmente leve |
| Muy raro que haya inflamación grave | Puede ocurrir inflamación moderada-grave | |
| Velocidad de progresión de la fibrosis | LentaAproximadamente 30 años de la infección a cirrosis | RápidaAproximadamente 9,5 años de la infección a la cirrosis |
- 1.
Cirrosis biliar primaria (CBP). La recidiva de la CBP ocurre en un 9-35% de los pacientes entre 3 y 5,5 años después del trasplante hepático pero puede llegar hasta el 43% a los 15 años del trasplante21. Generalmente cursa de forma asintomática y se diagnostica mayoritariamente tras la realización de biopsias de protocolo. En menos del 1% de los casos puede progresar a cirrosis y fallo del injerto4,22,23. La presentación histológica es similar a la CBP en el hígado nativo, y se caracteriza por una colangitis linfocítica con inflamación portal mononuclear focal y posteriormente ductopenia. Por el contrario, la presencia de anticuerpos antimitocondriales no es un buen marcador serológico para el diagnóstico de la recidiva de la enfermedad, cuyos valores pueden estar presentes tras el trasplante aun en ausencia de recidiva24. Los factores de riesgo para la recidiva de la CBP varían según los estudios pero al parecer podría estar relacionada con un número reducido de disparidad HLA entre donante y receptor25, y el uso de tacrolimus y no ciclosporina como tratamiento inmunosupresor26.
- 2.
Colangitis esclerosante primaria (CEP). La colangitis esclerosante primaria recidiva en un 10-27% de los casos entre 6 meses y 5 años tras el trasplante hepático27–31. A diferencia de la CBP, la CEP es por lo general sintomática y hasta un 10% de los casos pueden progresar a fallo del injerto. Los criterios diagnósticos de recidiva de la CEP son: 1) diagnóstico confirmado de CEP previo al trasplante; 2) colangiograma con estenosis no anastomóticas en la vía biliar intra y/o extrahepática que aparecen después de los 3 primeros meses postrasplante sin otra causa que justifique estas alteraciones (por ejemplo, colangiopatía isquémica secundaria a trombosis arterial); 3) cambios histológicos compatibles con colangitis fibrosante o lesión obliterativa de la de conductos biliares de gran tamaño con y sin ductopenia, o cirrosis biliar secundaria (tras excluir otras causas de cirrosis biliar secundaria). Los factores predictivos de recurrencia son múltiples e incluyen la edad del receptor, el sexo masculino, el grado de disparidad entre el HLA del donante y el receptor, la coexistencia de enfermedad inflamatoria intestinal, la infección por citomegalovirus, el rechazo agudo y el tratamiento con dosis elevadas de corticoides u OKT332.
- 3.
Hepatitis autoinmune (HAI). La recidiva de la hepatitis autoinmune aparece en un 16-41% de los pacientes33,34. El diagnóstico se basa en la combinación de criterios bioquímicos, histológicos (infiltrado inflamatorio portal acompañado de hepatitis de interfase y en algunas ocasiones inflamación lobulillar con perivenulitis central) y serológicos. Si no se detecta y se trata adecuadamente, con frecuencia sigue un curso progresivo con fallo del injerto.
- 4.
Esteatohepatitis no alcohólica (EHNA). Es debido a que la mayoría de los factores de riesgo para esta enfermedad persisten después del trasplante hepático y, de hecho, pueden verse exacerbados por los efectos secundarios del tratamiento inmunosupresor. La mayoría de los pacientes con recidiva de la EHNA tienen un perfil hepático normal. En cambio, desde el punto de vista histológico, hasta un 70% presentan esteatosis en el injerto, un 10-40% de los pacientes progresan a esteatohepatitis y hasta un 12% desarrollan cirrosis hepática12,34–36.
Las enfermedades que aparecen tras el trasplante hepático se resumen en la tabla 3.
Se trata de una enfermedad que comparte las características bioquímicas, inmunológicas e histológicas de la HAI del hígado nativo que se presenta en receptores de trasplante hepático por trastornos no autoinmunes37,38. Es más frecuente en niños (5-10 vs 1-2% de los adultos) posiblemente porque el tratamiento inmunosupresor afecta a la maduración normal de los linfocitos T en un sistema inmune inmaduro12. Histológicamente se caracteriza por la presencia de un infiltrado inflamatorio mononuclear y hepatitis de interfase. A diferencia de la HAI sobre hígado nativo, la HAI de novo se manifiesta con mayor inflamación lobulillar y necrosis y, en algunas ocasiones, perivenulitis central. Algunos autores han identificado áreas de sobreposición entre HAI de novo y rechazo. La evidencia más convincente de respuesta aloinmune viene de 2 grupos españoles que han encontrado HAI de novo exclusivamente en receptores de trasplante hepático glutatión S-transferasa T1 (GSTT1) negativos con donantes GSTT1 positivos39,40. El desarrollo de HAI en esta situación de disparidad entre donante y receptor puede representar una forma de rechazo tardío en la cual el daño mediado por el sistema inmunitario es dirigido contra los hepatocitos.
Esteatosis y esteatohepatitis no alcohólicaLa esteatosis está presente en hasta un 40% de las biopsias postrasplante incluyendo biopsias de protocolo y entre el 1 y el 13% presentan esteatohepatitis12. Es difícil distinguir entre EHNA de novo y recurrente. Los receptores de trasplante hepático tienen un riesgo aumentado de desarrollar hipertensión arterial, diabetes mellitus y dislipidemia que los predispone a desarrollar síndrome metabólico y EHNA. La esteatosis en el donante es un factor de riesgo, aunque el mecanismo es incierto.
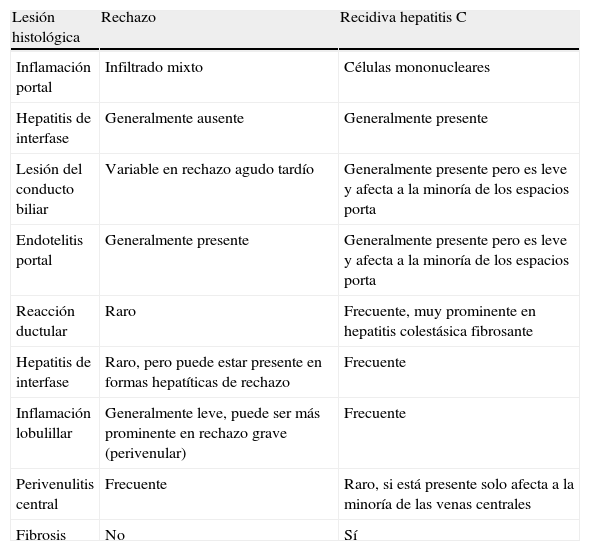
Rechazo agudo tardíoLa mayoría de los episodios de rechazo agudo aparecen en las primeras semanas tras el trasplante hepático y se caracterizan por inflamación portal y lesión inflamatoria de los conductos biliares y el endotelio de las ramas venosas portales. Algunos pacientes, sin embargo, desarrollan episodios de rechazo después de los 3-6 primeros meses del trasplante hepático. El rechazo agudo tardío se comporta de forma diferente al rechazo agudo temprano desde el punto de vista histológico2,41, y se caracteriza por un infiltrado inflamatorio portal con predominio de células mononucleares, menor inflamación de los conductos biliares y las ramas venosas portales, mayor hepatitis de interfase y presencia de una hepatitis lobulillar que puede ocurrir incluso en ausencia de inflamación significativa de los espacios porta42. En el rechazo agudo tardío el componente de inflamación centrolobulillar puede ser incluso más importante que la inflamación portal la cual, en ocasiones, puede estar ausente (perivenulitis central aislada). La apariencia histológica del rechazo agudo tardío recuerda a la hepatitis viral crónica, la hepatitis autoinmune (recurrente o de novo) o la hepatitis idiopática postrasplante (que se comentará más adelante). Desde el punto de vista clínico es importante distinguir entre rechazo y hepatitis viral (especialmente secundaria a recidiva del VHC en el injerto), ya que puede condicionar cambios en el tratamiento del paciente12 (tabla 4). Es fundamental realizar un diagnóstico precoz ya que en un 46% de los pacientes esta enfermedad se debe a niveles subóptimos de inmunosupresión y hasta en un 27% de los casos puede progresar a rechazo crónico y pérdida del injerto, especialmente en aquellos pacientes con necrosis centrolobulillar o pérdida de conductos biliares en el momento del diagnóstico43. Asimismo, se ha puesto de manifiesto que los pacientes que desarrollan un rechazo agudo tardío presentan disminución estadísticamente significativa en la supervivencia44.
Diferencias histológicas entre recidiva de la hepatitis C y rechazo agudo
| Lesión histológica | Rechazo | Recidiva hepatitis C |
| Inflamación portal | Infiltrado mixto | Células mononucleares |
| Hepatitis de interfase | Generalmente ausente | Generalmente presente |
| Lesión del conducto biliar | Variable en rechazo agudo tardío | Generalmente presente pero es leve y afecta a la minoría de los espacios porta |
| Endotelitis portal | Generalmente presente | Generalmente presente pero es leve y afecta a la minoría de los espacios porta |
| Reacción ductular | Raro | Frecuente, muy prominente en hepatitis colestásica fibrosante |
| Hepatitis de interfase | Raro, pero puede estar presente en formas hepatíticas de rechazo | Frecuente |
| Inflamación lobulillar | Generalmente leve, puede ser más prominente en rechazo grave (perivenular) | Frecuente |
| Perivenulitis central | Frecuente | Raro, si está presente solo afecta a la minoría de las venas centrales |
| Fibrosis | No | Sí |
Los avances en el tratamiento inmunosupresor no solo han disminuido de forma importante la prevalencia de pérdida del injerto asociada a rechazo crónico (siendo menor del 1-2%), sino que también han cambiado su forma de presentación. Actualmente, la mayoría de los casos de rechazo crónico se presentan después de los primeros 12 meses del trasplante hepático, tiene una presentación más insidiosa y un curso indolente, ya que muchos pacientes pueden estar años sin presentar fallo del injerto. La mayoría de los casos de rechazo crónico están precedidos de uno o más episodios de rechazo agudo generalmente resistentes al tratamiento con corticoides45–47. Las principales características histológicas del rechazo crónico clásico son la degeneración de los conductos biliares con pérdida de más del 50% de los mismos y la presencia de arteriopatía obliterativa que afecta a las arterias de mediano y gran tamaño41,45,46. En estadios tempranos de la enfermedad puede existir afectación centrolobulillar con bilirrubinostasis y pérdida de hepatocitos (perivenulitis central). Estas lesiones generalmente desaparecen a medida que la enfermedad progresa desarrollando fibrosis centrolobulillar y eventualmente cirrosis (relacionada con la obliteración de las venas hepáticas y las venas portales)41,48. Sin embargo, estas lesiones clásicas también han cambiado y en algunas ocasiones esta enfermedad se manifiesta con características de colestasis crónica consistentes en reacción ductular y fibrosis periportal que recuerda una obstrucción biliar o enfermedad biliar crónica como cirrosis biliar primaria, colangitis esclerosante primaria o colangiopatía isquémica. En estos casos es fundamental evaluar el árbol biliar antes de atribuir las lesiones a rechazo crónico12,46.
Otras alteracionesHepatitis idiopáticaEs una entidad que describe aquellos pacientes que presentan características histológicas compatibles con hepatitis crónica no relacionada con recidiva de la enfermedad de base o enfermedad de novo. Su prevalencia varía según los estudios, pero oscila entre el 10 y el 50% de las biopsias de protocolo realizadas después del primer año postrasplante, y puede alcanzar el 60% en niños a los 10 años del trasplante5,10,49,50. La mayoría de los pacientes están asintomáticos y tienen una función del injerto normal, y algunos pacientes pueden tener mínimas elevaciones de las transaminasas. En un estudio realizado en nuestro centro se encontró que el 34% de 53 pacientes con más de 10 años tras el trasplante hepático presentaban lesiones compatibles con hepatitis crónica idiopática51. En pacientes con pruebas hepáticas normales, la severidad de la lesión histológica parece estar correlacionada con los niveles de ALT. Desde el punto de vista histológico, esta entidad se caracteriza por la presencia de un infiltrado inflamatorio portal mononuclear asociado a hepatitis de interfase de grado variable. Es frecuente encontrar cambios inflamatorios lobulillares, más marcados en la región perivenular y asociado con necrosis confluente o en puentes.
Estudios realizados en niños han encontrado una asociación entre estas lesiones y la presencia de anticuerpos o ciertas características de rechazo, sugiriendo la hepatitis crónica idiopática podría representar una forma de daño del injerto inmunomediado8,52. Esta hipótesis está apoyada por el hecho de que el aumentar la inmunosupresión puede prevenir la progresión de la fibrosis y por que el rechazo tardío puede presentar características de hepatitis que recuerdan una hepatitis viral o autoinmune8,53. Por otra parte, se ha puesto de manifiesto que la presencia de hepatitis crónica en las biopsias de protocolo puede ocasionar fibrosis y cirrosis a los 10 años del trasplante en el 50-70% de los niños8 y el 27% de los adultos53.
Anomalías estructuralesEstas alteraciones están presentes en 20-30% de las biopsias más de 5 años postrasplante. La lesión más común es hiperplasia nodular regenerativa, pero también puede observarse desorganización de las trabéculas hepatocitarias, fibrosis perisinusoidal, atrofia, dilatación sinusoidal y lesiones oclusivas venosas. Las posibles causas son problemas vasculares, toxicidad a drogas (AZA) o daño inmunológico contra las células sinusoidales o las células del endotelio vascular. En la mayoría de los casos estas lesiones se diagnostican en biopsias de protocolo y no presentan manifestaciones clínicas, pero algunos pacientes desarrollan signos de hipertensión portal y unos pocos progresan a insuficiencia hepática que requiere retrasplante.
¿Es necesario realizar biopsias de protocolo?La prevalencia de lesiones histológicas en biopsias de protocolo realizadas a largo plazo tras el trasplante hepático es elevada (puede alcanzar un 90%) y en al menos la mitad de los pacientes la presencia de estas lesiones se acompaña de análisis hepáticos normales. En algunas ocasiones se detectan lesiones potencialmente significativas que podrían traducir la necesidad de realizar cambios en el tratamiento inmunosupresor8 o añadir nuevos medicamentos para el tratamiento de enfermedades específicas. Por el contrario, el hallazgo de biopsias normales o casi normales podría justificar la decisión de disminuir el tratamiento inmunosupresor si está clínicamente indicado (por presencia de efectos secundarios) o en protocolos de retirada vigilada de la inmunosupresión5,9,54.
Por otra parte, existe evidencia de que estas lesiones podrían tener un impacto en el pronóstico del paciente y del injerto ya que pueden progresar a fibrosis significativa, cirrosis y finalmente fallo del injerto.
A pesar de la importancia de estas lesiones, la cantidad de biopsias de protocolo ha disminuido de manera considerable en las últimas décadas y actualmente la mayoría de los centros solo realizan biopsias de protocolo en receptores de trasplante hepático por el VHC para evaluar la progresión de la enfermedad. Ello se debe, probablemente, al hecho de que la biopsia hepática no deja de ser un procedimiento invasivo, costoso, no exento de complicaciones (aunque muy poco frecuentes)55 y que está sujeto a un error de muestra importante que puede falsear los resultados. Para evitar estos problemas de la biopsia hepática, desde hace unos años, se han introducido las técnicas no invasivas para evaluar la fibrosis hepática. La más popular es la elastografía de transición (Fibroscan®) que evalúa de una forma sencilla y rápida la rigidez del hígado y ha demostrado predecir correctamente la fibrosis en diferentes situaciones clínicas (especialmente en la hepatitis C)56–60. Un estudio reciente evaluó el papel de la elastografía de transición en la detección de lesiones histológicas no relacionadas con enfermedades virales a largo plazo tras el trasplante hepático. Los autores encontraron que valores superiores a 7,4kPa se asocian con una probabilidad post-test de detección de lesiones histológicas del 100%61. Esta técnica podría ser utilizada para decidir qué pacientes pueden beneficiarse de la realización de una biopsia hepática en periodos tardíos del trasplante hepático auque los datos requieren ser validados con mayor número de pacientes.
ConclusionesParece claro de los datos mencionados previamente que un porcentaje no despreciable de pacientes presentan lesiones histológicas en el injerto (por recidiva de la enfermedad de base, aparición de enfermedad de novo o aparición de lesiones compatibles con hepatitis crónica idiopática) que en la mayoría de los casos no se detectan en los análisis sanguíneos habituales. Además, estas lesiones pueden condicionar el pronóstico del paciente y del injerto, o cambios en el tratamiento inmunosupresor. Por lo tanto, es importante evaluar el injerto en periodos tardíos del trasplante hepático. Pero, ¿cuál es el mejor método para evaluar el injerto? ¿Es necesario realizar biopsias de protocolo a todos los pacientes? Actualmente no tenemos la respuesta a esta pregunta. Con los resultados de los estudios en este campo es probable que la respuesta sea sí. Sin embargo, la elastografía de transición hepática podría tener un papel en la selección de los pacientes que pueden beneficiarse de la realización de una biopsia hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradezco al Dr. Antonio Rimola por su revisión crítica de este manuscrito.