INTRODUCCION
La endoscopia gastrointestinal, efectuada tanto con fines diagnósticos como terapéuticos, puede ser un factor de riesgo para la transmisión de enfermedades bacterianas y virales1,2. Por este motivo, la desinfección de los endoscopios y el material accesorio ha adquirido una gran importancia y se ha convertido en una necesidad ineludible que debe ser asumida por el personal médico y de enfermería que trabaja en las unidades de endoscopia digestiva3. Así, un gran número de sociedades científicas, relacionadas tanto con la endoscopia digestiva como con las enfermedades infecciosas, han publicado guías de práctica clínica, con normas y recomendaciones cuya implementación ha contribuido a disminuir la transmisión de infecciones tras la endoscopia digestiva4-17. Una encuesta realizada en nuestro país sobre los métodos empleados para la limpieza y la desinfección de los endoscopios muestra cómo en los últimos años ha aumentado el porcentaje de las unidades de endoscopia que cumplen las normas mínimas de desinfección, pasando del 41% en el año 1993 al 79% en 199818,19. Sin embargo, a pesar de esta mejoría observada en el cumplimiento de las normas mínimas de desinfección y la disminución en el número de infecciones declaradas, todavía hay aspectos relacionados con la desinfección claramente susceptibles de mejoría.
TRANSMISION DE MICROORGANISMOS
Hay un riesgo potencial, aunque reducido, para la transmisión de infecciones a través de la endoscopia digestiva. Una revisión de todos los trabajos relacionados con la transmisión de infecciones tras la endoscopia digestiva o la broncoscopia, efectuados entre los años 1966 y 1992, identificó únicamente 281 casos1. Sin embargo, este riesgo podría estar infraestimado debido a que, en ocasiones, no se realiza un seguimiento completo de los pacientes y, muchas veces, las infecciones no se declaran, cursan de forma asintomática o tienen un período de incubación largo. El incumplimiento de las normas y las recomendaciones de desinfección es quizás el factor más importante asociado con la transmisión de infecciones tras la endoscopia digestiva2.
Transmisión de bacterias
La transmisión de infecciones bacterianas a los pacientes es rara; se han comunicado casos de infección por Salmonella, Pseudomonas, Escherichia coli, Klebsiella, Enterobacter, Serratia y Helicobacter pylori14. En la mayoría de estos casos, la infección guarda relación con una desinfección inadecuada del endoscopio y del material accesorio. Se ha descrito que la no realización de una correcta limpieza mecánica del endoscopio favorece la formación de biocapas bacterianas que dificultan la posterior acción del desinfectante, con el consiguiente riesgo para la transmisión de infecciones a los pacientes11. En ocasiones, la existencia de disrupciones en la superficie interna del endoscopio dificulta la acción del desinfectante y favorece su contaminación. En los casos de transmisión de Pseudomonas se ha implicado la contaminación de las fuentes y los recipientes de agua20.
La desinfección de los endoscopios, siguiendo las recomendaciones y normativas actuales, es eficaz para la eliminación de las bacterias de los endoscopios21. Únicamente, las micobacterias y las formas bacterianas esporuladas ofrecen cierta resistencia a la desinfección. Sin embargo, no se han documentado casos de transmisión de Clostridium difficile, Criptosporidium o micobacterias tras la realización de endoscopia digestiva, y varios estudios experimentales han demostrado que las medidas habituales de desinfección son eficaces para su eliminación22,23.
Transmisión de virus
Se han documentado casos de transmisión de infección por los virus de las hepatitis B y C, todos ellos relacionados con fallos en la limpieza y la desinfección de los canales de trabajo del endoscopio o el material accesorio24,25. Varios estudios epidemiológicos han encontrado una asociación entre el antecedente de la toma de biopsias durante una endoscopia digestiva y la infección por el virus de la hepatitis C (VHC), si bien otros estudios no han confirmado esta asociación2,26,27. No hay casos documentados de transmisión del virus de la inmunodeficiencia humana (VIH)2.
En general, los virus son más sensibles que las bacterias a la desinfección. Se considera que el VIH, el virus de la hepatitis B (VHB) y el VHC son poco resistentes a las soluciones desinfectantes28-30. Se ha demostrado que después del lavado y la desinfección durante 5 min en solución alcalina de glutaraldehído al 2% no se detectan partículas de los VHB o VHC ni en el exterior ni en los canales operativos del endoscopio28. El empleo de glutaraldehído al 3% podría ser más eficaz que el glutaraldehído al 2% para la desinfección de los endoscopios utilizados para la ligadura de varices con bandas en pacientes con infección por el VHC31. Otros virus más resistentes, como los poliovirus y el virus de la hepatitis A, también se eliminan eficazmente tras la inmersión en glutaraldehído32.
Transmisión de hongos y priones
Los priones son unas partículas proteicas responsables de un grupo de enfermedades neurodegenerativas agrupadas bajo el nombre de encefalopatías espongiformes (enfermedad Creutzfeldt-Jakob [EC]), kuru, enfermedad del insomnio familiar fatal). La encefalopatía espongiforme bovina o variante de la enfermedad de Creutzfeldt-Jakob (vECJ) es otra forma de encefalopatía espongiforme que parece adquirirse por el consumo de carne de ganado vacuno afectado con la enfermedad. En los últimos años, se han detectado numerosos casos de esta enfermedad, especialmente en el Reino Unido que han generado una importante alarma social33,34.
Hasta la fecha, no hay casos documentados de transmisión de hongos y enfermedades relacionadas con priones tras la realización de la endoscopia digestiva2,11,14,33. Sin embargo, el hecho de que los priones sean resistentes a las medidas habituales de desinfección y esterilización ha creado una importante inquietud en la comunidad médica, y varias sociedades científicas han redactado recomendaciones para minimizar el riesgo de transmisión a través de la endoscopia digestiva. En el caso de la ECJ los priones se localizan únicamente en el tejido nervioso, por lo que aparentemente no hay riesgo de transmisión de la enfermedad a través de la endoscopia. La Asociación para la Prevención y Control de Enfermedades Infecciosas (APIC)11 y algunos autores33 consideran que las actuales recomendaciones para la limpieza y la desinfección de los endoscopios son suficientes para evitar la transmisión de la ECJ. Con respecto al material endoscópico accesorio, recomiendan su esterilización y, si ésta no es posible, el empleo de material desechable. En la vECJ la endoscopia podría ser un factor de riesgo para la transmisión de la enfermedad, dado que se ha detectado por técnicas moleculares la presencia de priones en las placas de Peyer intestinales, el apéndice y las amígdalas, si bien en una concentración mucho menor a la observada en el cerebro35. Aunque la posibilidad de transmisión de la vECJ es remota, la Sociedad Europea de Endoscopia Digestiva ha recomendado que se eviten los procedimientos endoscópicos en los pacientes con una vECJ conocida34. En el caso de que éstos fueran absolutamente necesarios, se debería utilizar sólo equipos destinados a pacientes con vECJ. Sin embargo, la vECJ es una enfermedad con un período de incubación largo, por lo que puede haber pacientes asintomáticos que en el momento de realizar la exploración estén en una fase de incubación de la encefalopatía. Por este motivo, se recomienda de una forma general el empleo de pinzas desechables siempre que se tomen biopsias en el íleon terminal, así como realizar una rigurosa limpieza manual del endoscopio para eliminar todos los restos de material orgánico34.
DESINFECCION EN ENDOSCOPIA FLEXIBLE
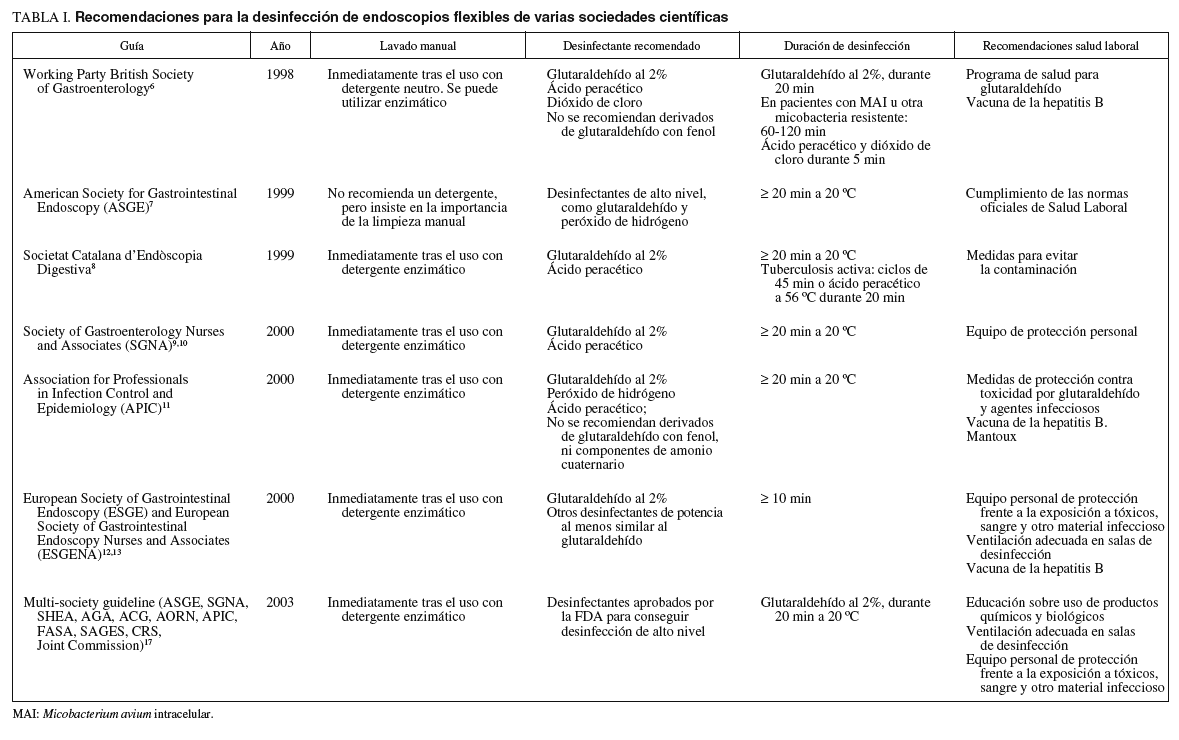
Hay numerosas guías de práctica clínica publicadas por diferentes sociedades científicas, en las cuales están perfectamente estructuradas las diferentes fases de la desinfección, así como las recomendaciones para el personal sanitario con el fin de disminuir los riesgos relacionados con la toxicidad de los desinfectantes y el contagio de enfermedades infecciosas (tabla I)4-17. Entre estas guías, quizá se podría destacar la realizada por la American Society for Gastrointestinal Endoscopy (ASGE) y la Society for Healthcare Epidemiology of America (SHEA), en colaboración con diferentes sociedades médicas, quirúrgicas y de enfermería, así como agencias federales y estatales17. En ésta se establecen una serie de recomendaciones para la desinfección y la prevención de riesgos en el personal sanitario (hasta un total de 34), categorizadas según el nivel de evidencia científica.
Es importante subrayar que la limpieza y la desinfección de los endoscopios es un procedimiento especializado y debería llevarse a cabo únicamente por personal auxiliar entrenado y concienciado sobre la importancia de su labor. Todo el personal que participa en la desinfección debería conocer los principios básicos necesarios para el manejo y la exposición a los productos químicos empleados, los riesgos de transmisión de infecciones (especialmente tuberculosis, hepatitis virales, VIH y enterobacterias) entre los pacientes, así como las medidas de protección frente a la exposición a la sangre y otros fluidos corporales6,11,17.
Niveles de desinfección y dificultades en la desinfección en endoscopia flexible
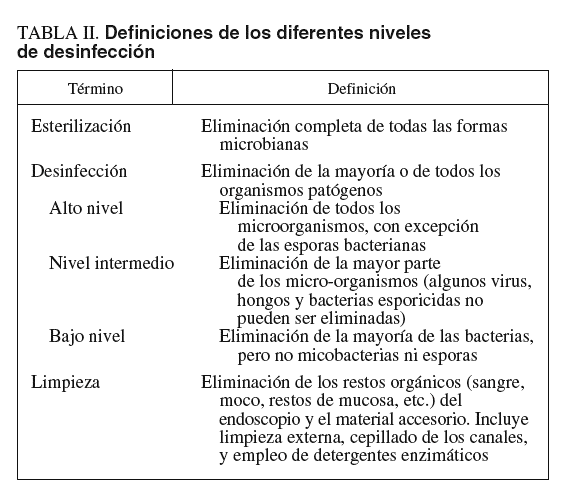
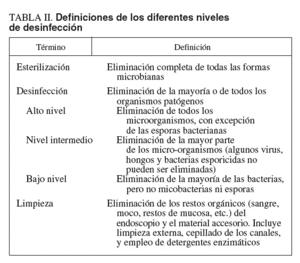
Todo el material de uso hospitalario que entra en contacto con el enfermo es un vehículo potencial para la transmisión de infecciones. El nivel de desinfección recomendado para el instrumental medicoquirúrgico está en relación con el riesgo de infección asociado a su uso: esterilización, desinfección (alto, medio o bajo nivel) y limpieza (tabla II). En relación con el riesgo de infección, Spaulding36 clasificó el material de uso hospitalario en 3 categorías: crítico, semicrítico y no crítico. El material crítico es el que está en contacto con tejidos estériles o con el sistema vascular. En caso de reutilización, debe ser sometido a un proceso de esterilización. Algunos ejemplos de material crítico en endoscopia digestiva son las pinzas de biopsia, las agujas de esclerosis o los esfinterótomos. El material semicrítico es el que entra en contacto con las membranas mucosas o la piel no intacta, pero que no contacta con áreas estériles del cuerpo (p. ej., endoscopios flexibles). Requiere desinfección de alto nivel. Finalmente, el material no crítico está formado por los objetos que contactan con la piel intacta, pero no con las membranas mucosas (p. ej., estetoscopios). Es suficiente la desinfección de medio o de bajo nivel. En la tabla II se muestran las definiciones de los diferentes niveles de desinfección.
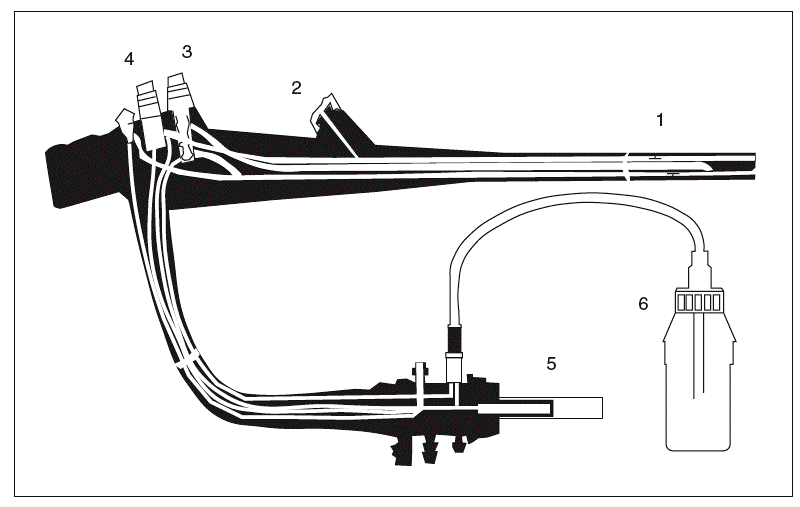
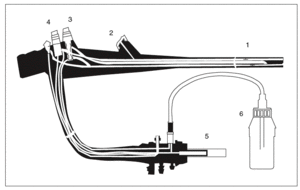
Los endoscopios flexibles tienen una estructura compleja y están dotados de canales y superficies internas que dificultan el acceso a la limpieza y la desinfección (fig. 1). Además, en su composición hay materiales que se alteran cuando se les somete a temperaturas superiores a 60 ºC y, por tanto, no pueden someterse a un proceso de esterilización en autoclave. Por este motivo, y porque es un material semicrítico, actualmente se recomienda la realización de una desinfección de «alto nivel» (capaz de eliminar todos los microorganismos con excepción de las esporas bacterianas). Sin embargo, el material accesorio contacta habitualmente con los tejidos estériles y la sangre (por tanto, es un material crítico). Por ello, se recomienda que sea sometido a un proceso de esterilización o bien utilizar material de un solo uso6-13,17.
Fig. 1. Estructura de un endoscopio flexible: 1) caña del endoscopio con los canales de instrumentación/aspiración e insuflación/lavado en su interior; 2) entrada al canal de instrumentación; 3) botón de insuflación/lavado; 4) botón de aspiración; 5) conexión a la fuente de iluminación/videoprocesador; 6) bote de agua para el lavado.
Fases de la desinfección
La desinfección comprende 3 fases: limpieza mecánica, desinfección propiamente dicha y, por último, aclarado externo, secado y almacenamiento adecuado.
Limpieza mecánica
Consiste en la limpieza de la superficie del aparato, así como el cepillado con agua y detergente enzimático de los canales del endoscopio y el material accesorio, para eliminar los restos de material orgánico, como sangre, moco y saliva, que pueden ser ricos en microorganismos. Esta fase se podría estructurar en los siguientes pasos:
1. Inmediatamente después de completada la exploración se succiona durante unos 10-15 s, a través del canal de aspiración, una solución con un detergente enzimático con la finalidad de eliminar los restos de sangre o moco que hayan podido quedar dentro de dicho canal.
2. Posteriormente, tras retirar las válvulas de los canales de aspiración e insuflación/lavado, así como el tapón del canal de instrumentación, el endoscopio se sumerge en una solución con detergente enzimático. La superficie externa del endoscopio se limpia con esponjas y/o gasas, y el extremo distal se cepilla con un cepillo suave, prestando especial atención al orificio de insuflación/lavado, y en el caso de duodenoscopios a la uña elevadora.
3. El canal de aspiración/instrumentación y todos los canales accesibles deben limpiarse con ayuda de un catéter cepillo especialmente diseñado para cada endoscopio. Este cepillo debe introducirse al menos 3 veces a través del canal de instrumentación y, posteriormente, a través del orificio de succión, dirigiéndolo primero hacia el extremo distal del endoscopio, y finalmente hacia la conexión del endoscopio con la fuente de vacío. Cada vez que se introduce el cepillo por alguno de los canales, éste debe limpiarse en la solución con el detergente enzimático.
4. Aclarar los canales mediante la irrigación de agua, y posteriormente secar con aire.
En esta fase de la desinfección, no se deben utilizar detergentes con aldehídos, porque pueden causar desnaturación y coagulación de las proteínas, fijándolas a la superficie del endoscopio. Tampoco se deben utilizar detergentes espumosos porque dificultan la visualización de la superficie del endoscopio durante la limpieza. También es importante desechar el detergente enzimático después de cada uso porque estos productos no tienen acción microbicida y, por tanto, no retrasan el crecimiento bacteriano. Al finalizar esta fase, es recomendable realizar una inspección del endoscopio y un test de «estanqueidad» que permite detectar la presencia de disrupciones de la superficie interna o externa. Éstas pueden ser un foco de colonización de microorganismos de difícil eliminación, así como generar averías importantes por entrada de líquido en el endoscopio. En el caso de que el test de «estanqueidad» detecte un daño en la superficie del endoscopio, éste se debe enviar para su reparación, y no continuar con su desinfección.
La limpieza mecánica es quizás la fase más importante de la desinfección por varios motivos: a) la presencia de restos de materia orgánica puede hacer ineficaz la desinfección propiamente dicha o la esterilización, ya que favorece la formación de biocapas bacterianas en la superficie interna del endoscopio que dificultan la acción de la mayoría de desinfectantes, y b) es una fase que se realiza de forma manual, por lo que su eficacia depende del personal. Por tanto, es fundamental la educación del personal auxiliar, recalcando la trascendencia de su misión en materia de prevención de enfermedades. Se ha demostrado que la realización de una limpieza manual de una forma metódica puede eliminar hasta el 99% de los microorganismos21, y se acepta que corresponde a una disminución de la carga bacteriana de 4Log10. En un trabajo realizado en nuestro país por De la Peña et al37, en el que se evaluó mediante la realización de cultivos las diferentes fases de la desinfección, se demostró que una limpieza mecánica metódica se seguía de una disminución en el porcentaje de cultivos positivos del 53 al 17%.
Desinfección propiamente dicha
Los endoscopios son instrumentos sensibles al calor y no pueden someterse a esterilización por autoclave, por lo que se recomienda, como ya se ha mencionado, la desinfección de «alto nivel». Esta desinfección se obtiene por inmersión del endoscopio en soluciones desinfectantes, que tienen que estar en contacto con toda su superficie. Además, para que el desinfectante pueda actuar sobre las superficies internas del endoscopio, todos sus canales accesibles se deben llenar con la misma solución. El tiempo de inmersión varía según el desinfectante utilizado; se recomienda un mínimo de 20 min en el caso del glutaraldehído al 2%6-10,17.
Actualmente hay numerosos productos comerciales que han demostrado conseguir una desinfección de «alto nivel»15,38-41. Sin embargo, el desinfectante ideal eficaz ante todos los microorganismos en un tiempo corto, que además no dañe el utillaje y que no afecte a las personas ni al medio ambiente, no existe. Quizás el producto del que se tiene más experiencia es el glutaraldehído al 2%, considerado además como el desinfectante de referencia con el que se compara la eficacia del resto de productos41. Diversos estudios han demostrado que su aplicación durante 20 min, a una temperatura de 20 ºC, es eficaz para la eliminación de micobacterias, virus y bacterias del endoscopio38-41. La fijación del material orgánico y las proteínas exige que antes de su utilización deba realizarse una metódica limpieza manual del endoscopio con detergentes enzimáticos. Su principal inconveniente son los efectos secundarios en el personal y los pacientes, ya que se ha asociado a cefalea, conjuntivitis, asma, irritación nasal, sinusitis, dermatitis alérgica (por irritación e hipersensibilidad), y el desarrollo de colitis en los pacientes42. El ácido peracético es un desinfectante más potente que el glutaraldehído, que tiene como principales ventajas un menor tiempo de aplicación, una acción esporicida y una menor toxicidad sobre el personal. Además, a diferencia del glutaraldehído, no fija las proteínas por lo que su acción no se ve modificada por la persistencia de restos orgánicos. Sin embargo, y a pesar de que no afecta al medio ambiente, en función de la concentración puede interactuar con los metales y algunos pegamentos, lo que puede incidir en la duración del material endoscópico, tiene un olor desagradable, resulta más caro y es más inestable, lo cual requiere su sustitución a las 24 h de su preparación14,38,39. El agua ácida electrolizada es un método de desinfección/esterilización con acción esporicida, poca toxicidad, bajo precio y acción rápida, por lo que en un futuro, si se confirma su eficacia en estudios clínicos, podría extenderse su uso en las unidades de endoscopia digestiva. Sin embargo, al igual que ocurre con el glutaraldehído, su eficacia se ve afectada por la persistencia de restos orgánicos43,44. En la tabla III se muestran los desinfectantes actualmente disponibles en el mercado, con sus principales ventajas e inconvenientes, así como los tiempos necesarios para conseguir la desinfección de alto nivel. Dado que cada desinfectante ejerce su acción a una concentración y temperatura determinada, es recomendable comprobar al menos una vez al día mediante un indicador químico que el desinfectante se encuentra en su concentración efectiva mínima. Cada desinfectante tiene una vida media diferente y deberá ser sustituido cuando finalice ésta, independientemente de su concentración efectiva mínima17.
En los últimos años, se está extendiendo el uso de las máquinas de lavado automáticas para la desinfección de los endoscopios6,15. Aunque hay diferentes diseños y fabricantes, y algunas características pueden variar de un modelo a otro, todas estas «lavadoras» son capaces de realizar las fases de limpieza, desinfección y aclarado. Su eficacia es similar a la desinfección manual45-47, aportando como principales ventajas las siguientes: a) aseguran la completa irrigación de todos los canales del endoscopio (instrumentación, aspiración, insuflación, agua) y algunos modelos también el del elevador de la uña de los duodenoscopios; b) ofrecen unos ciclos de perfusión del desinfectante con los tiempos y la temperatura adecuada, evitando la variabilidad inherente a la desinfección manual; c) al estar todos los procesos automatizados, la desinfección es menos vulnerable a los posibles fallos relacionados con el personal; d) permiten al personal auxiliar llevar a cabo otras tareas, y reducen su exposición a los efectos tóxicos del desinfectante. Sin embargo, estas máquinas de desinfección también tienen desventajas: a) su utilización no exime de realizar una limpieza mecánica previa a la desinfección; b) requieren un desembolso económico inicial mayor; c) es necesario realizar un mantenimiento regular y desinfectar periódicamente la máquina de lavado, en especial sus reservorios, y en algunas de ellas, prestar atención a la dilución gradual del desinfectante que se utiliza de nuevo en ella.
Aclarado, secado y almacenamiento adecuado
Después de la desinfección de «alto nivel», el endoscopio debe aclararse con agua destilada estéril, para eliminar todos los restos del desinfectante y evitar los posibles efectos tóxicos de éste sobre los pacientes. Se han descrito casos de colitis química, similar a una colitis seudomembranosa, en relación con el empleo de glutaraldehído y peroxido de hidrógeno al 3%48. En el aclarado se debe utilizar agua destilada estéril para evitar una posible contaminación del endoscopio con bacterias como Pseudomonas, cuya presencia se ha demostrado en los tapones de los recipientes de agua49-51. Finalmente, tanto la superficie externa como los canales del endoscopio deben secarse cuidadosamente para evitar el crecimiento bacteriano que puede verse favorecido por un ambiente húmedo. Se ha descrito que la realización de un segundo aclarado con alcohol al 70%, seguida de un nuevo secado con aire, mejora la eficacia de la desinfección37,46 y disminuye el riesgo de contaminación por Pseudomonas52. La APIC11 recomienda realizar este aclarado con alcohol entre cada exploración en los centros en que no se utilice agua destilada estéril para el aclarado del endoscopio, y al finalizar la jornada de trabajo en todas las unidades. El almacenamiento de los endoscopios se debe realizar en armarios con buena ventilación. Los aparatos se colgarán verticalmente para facilitar su secado, y previamente se deben retirar las válvulas de insuflación y aspiración/lavado, el tapón del canal de instrumentación y el capuchón distal en el caso de los duodenoscopios.
Material endoscópico accesorio
En general, todo el material accesorio que puede contactar con la sangre del paciente debe someterse a un proceso de esterilización tras la limpieza mecánica. La limpieza de este material, antes de la esterilización debe ser extremadamente cuidadosa, y debe incluir una limpieza ultrasónica para facilitar la eliminación de todos los restos de materia orgánica13,53. Sin embargo, debido a la estructura de estos dispositivos puede resultar extremadamente difícil la eliminación completa de todos los restos orgánicos y, por tanto, su esterilización eficaz54. Además, se han descrito casos de infección por Salmonella, VHB y VHC tras la realización de endoscopia digestiva que se relacionaron con una desinfección inadecuada de las pinzas de biopsia24,25,55.
Por estos motivos, la tendencia actual es emplear cada vez con mayor frecuencia material accesorio desechable con el fin de evitar la inseguridad en los resultados de la esterilización, pérdidas de tiempo y riesgos para el personal auxiliar (fundamentalmente inoculación accidental con las agujas de esclerosis). En diversos estudios prospectivos de coste-efectividad, que comparan el empleo de pinzas de biopsia reutilizables y desechables, se concluye que las pinzas reutilizables tienen un coste económico menor si éstas se usan frecuentemente (más de 20 veces)54,56-60. Sin embargo, en los costes de las pinzas reutilizables hay que añadir los derivados de la esterilización, y los precios de las pinzas desechables tienden a ser cada vez menores. Actualmente, las boquillas, el material accesorio para la colangiopancreatografía retrógrada endoscópica (esfinterotomos, balones de Fogarty, guías, etc.), las pinzas de biopsia, las asas de polipectomía, los cepillos para citología y las agujas de esclerosis se pueden adquirir para un solo uso, a unos precios aceptables. Una revisión reciente de la ASGE sobre el material accesorio desechable concluye que la selección de una u otra clase de material (desechable o reutilizable) debería basarse en el precio que se pueda conseguir para el material accesorio, los costes de desinfección y esterilización de cada hospital, en la capacidad de almacenamiento y, finalmente, en las preferencias personales61.
El bote de agua para la irrigación e insuflación se contamina frecuentemente por bacterias, especialmente Pseudomonas, por lo que se recomienda realizar su limpieza y desinfección de «alto nivel» después de cada jornada de trabajo9.
CONTROL DE CALIDAD DE LA DESINFECCION
Tan importante como realizar la desinfección siguiendo las recomendaciones establecidas, es realizar un control periódico para controlar la efectividad de las medidas de desinfección en la práctica clínica habitual, es decir, en nuestro medio62. Se ha demostrado que la realización de cultivos microbiológicos del endoscopio de forma periódica puede facilitar la detección de fallos en la desinfección o la presencia de disrupciones de la superficie del endoscopio que favorezcan la persistencia de infección63,64. Sin embargo, actualmente ni tampoco a la periodicidad con la que se debe realizar.
La «desinfección de alto nivel» es un concepto que no se sustenta sobre datos objetivos, lo que da lugar a dudas, cuando con un método microbiológico sensible se detectan algunos microorganismos en el material sometido a desinfección. Es necesario considerar que, en función del tamaño de la inócula y del método microbiológico utilizado, la sensibilidad del estudio varía. Los métodos de valoración de la desinfección pueden ser cuantitativos relativos (disminución de la carga bacteriana, para lo que se suele utilizar la reducción logarítmica en función de la carga bacteriana inicial conocida) o cuantitativos absolutos contando el número de unidades formadoras de colonias (UFC) por ml, generalmente en cultivos efectuados en placa. Otro método de valoración es el cualitativo, en el cual únicamente se valora el hecho de que en un medio de cultivo se aprecie la presencia de crecimiento bacteriano. De esta forma, si después de la incubación de una inócula introducida en un medio líquido, como el tioglicolato, se aprecia turbidez, ello indica un crecimiento bacteriano. El hecho de que aumentando el volumen de la inócula por 10, 100... se incremente proporcionalmente la sensibilidad del método microbiológico, permite comprender que la detección de algún microorganismo, si se utilizan métodos sensibles, únicamente es útil en la realización de estudios41. En general, se considera que la negatividad de las siembras en placa es suficiente, si no se obtiene crecimiento bacteriano, para demostrar que se ha obtenido una «desinfección de alto nivel».
La recogida de muestras de los endoscopios para valorar la desinfección puede realizarse de la siguiente manera. Una vez finalizada la desinfección y el secado de los endoscopios, cada uno de los canales se irriga con 10 ml de suero salino. El efluente se recoge en condiciones estériles y se remite al laboratorio de microbiología, para realizar siembra en placas agar (método cuantitativo) o inoculación en líquido tioglicolato (método cualitativo)41. Se ha comunicado que la introducción de un cepillo estéril a través de los canales puede aumentar la rentabilidad de los cultivos11. Por último, es recomendable realizar un diario para establecer el seguimiento de la transmisión de las infecciones o los posibles efectos secundarios relacionados con la endoscopia y la desinfección, en el que se recojan los datos del paciente, el endoscopio utilizado, el tipo de desinfección y el personal que participa en ella17.
MEDIDAS DE PREVENCION DE RIESGOS PARA EL PERSONAL
El personal sanitario que trabaja en una unidad de endoscopias se expone diariamente a productos químicos con conocidos efectos secundarios, así como a material biológico procedente del paciente (moco, sangre, etc.), con un riesgo potencial de transmisión de infecciones. Por este motivo, es importante adoptar una serie de medidas de protección, tanto general como individual6,9-13,17:
1. Educación del personal auxiliar sobre la manipulación y los riesgos de toxicidad de los productos de desinfección (desinfectantes y máquinas de lavado automáticas). Igualmente, se debe instruir sobre los riesgos de transmisión de infecciones durante la endoscopia y la manipulación de los endoscopios y el material accesorio. El personal temporal que participa en la desinfección debería estar supervisado hasta que demuestre su capacitación.
2. Utilización de medidas de protección personal, como guantes y batas impermeables desechables, gafas y máscaras respiratorias, para minimizar los riesgos de exposición tanto a los desinfectantes, como al material biológico potencialmente infeccioso (moco, sangre, etc.).
3. Es conveniente que la sala de desinfección esté situada en un lugar diferente a las salas de exploración, y su diseño debería asegurar un ambiente seguro, tanto para el personal sanitario como para los pacientes. Es recomendable disponer de ventilación adecuada y un sistema de extracción de aire para minimizar los riesgos de exposición a los vapores potencialmente tóxicos de los desinfectantes. La concentración de vapor del desinfectante no debería exceder los límites establecidos por los organismos de prevención de riesgos laborales y los servicios de medicina preventiva.
4. Vacunación frente al VHB.
RECOMENDACIONES PARA LA DESINFECCION DE ENDOSCOPIOS
Las siguientes recomendaciones están basadas en los resultados de los estudios comparativos realizados entre diferentes desinfectantes, así como las revisiones técnicas y guías de práctica clínica realizadas por las sociedades y organismos relacionados con la endoscopia y la prevención de enfermedades infecciosas. En la tabla IV se muestran el grado de recomendación y el nivel de evidencia empleados6-17,21,37,40,41,61:
1. Inmediatamente después de completada la exploración, se debe succionar una solución de detergente enzimático a través del canal de aspiración del endoscopio. Posteriormente, tras desconectar el endoscopio y retirar las válvulas de los canales de aspiración e insuflación/lavado, así como el tapón del canal de instrumentación, se debe sumergir el endoscopio en un recipiente con detergente enzimático. Grado de recomendación A. Nivel de evidencia 1c.
2. La limpieza mecánica es la fase fundamental de la desinfección, por lo que debe realizarse una limpieza meticulosa de todo el endoscopio, incluidas las válvulas y los canales, con un detergente enzimático. Esta limpieza debe completarse con el paso de cepillos a través de todos los canales accesibles del endoscopio para eliminar todos los restos de materia orgánica y otros residuos. Grado de recomendación A. Nivel de evidencia 1a.
3. Antes de sumergir el endoscopio en la solución desinfectante, es recomendable realizar un test para detectar la pérdida de estanqueidad en los canales del endoscopio y la presencia de disrupciones internas que pueden dificultar la desinfección. Grado de recomendación A. Nivel de evidencia 1b.
4. Para la desinfección propiamente dicha, se debe utilizar un desinfectante con eficacia demostrada para conseguir la desinfección de «alto nivel», que además sea compatible con el endoscopio. Actualmente, el glutaraldehído al 2%, el glutaraldehído fenato al 0,4-1% y el ácido peracético al 0,2% son los desinfectantes más empleados. Grado de recomendación A. Nivel de evidencia 1a.
5. La desinfección con agua electrolizada, gracias a su eficacia, bajo coste y poca toxicidad para el personal, puede constituir una alternativa en el futuro. Grado de recomendación B. Nivel de evidencia 2b.
6. El endoscopio se debe sumergir en la solución con el desinfectante, que incluya el llenado de los diferentes canales. El tiempo de exposición y la temperatura para realizar la desinfección de «alto nivel» varía según el producto empleado. Así, el glutaraldehído al 2% requiere al menos 20 min a una temperatura de 20 ºC, mientras que el ácido peracético al 0,35% precisa únicamente 10 min. Grado de recomendación A. Nivel de evidencia 1a.
7. En el caso de utilizar una máquina de lavado automática, se debe comprobar la correcta conexión de todos los conectores a los canales del endoscopio y seguir las recomendaciones del fabricante para conseguir la desinfección de alto nivel. El empleo de estas máquinas no exime de la necesidad de realizar una limpieza mecánica cuidadosa del endoscopio. Es necesario, además, realizar controles periódicos de la dilución del desinfectante, en caso de que la máquina lo reutilice, y desinfección de los diferentes recipientes. Grado de recomendación A. Nivel de evidencia 1b.
8. Cada desinfectante, especialmente si precisa activación, mantiene la actividad durante un tiempo preestablecido. Se recomienda sustituir el desinfectante después de este período, independientemente de su concentración efectiva mínima. Grado de recomendación A. Nivel de evidencia 1b.
9. Después de la desinfección de «alto nivel», se debe aclarar el endoscopio con agua preferentemente estéril, lo que se puede conseguir con filtros específicos, y posteriormente secar los canales con aire. Grado de recomendación A. Nivel de evidencia 1b.
10. La utilización de alcohol al 70%, seguida de un nuevo secado con aire, puede mejorar la eficacia de la desinfección. Grado de recomendación B. Nivel de evidencia 2b.
11. Se debe almacenar el endoscopio colgado verticalmente (para mejorar el escurrido del agua residual) en un armario con buena ventilación. Las válvulas y el tapón del canal de instrumentación se deben almacenar por separado. Grado de recomendación B. Nivel de evidencia 2b.
12. La botella de agua para la irrigación del endoscopio, así como su conexión, se deben someter a desinfección de «alto nivel» después de cada jornada. Es conveniente usar agua destilada estéril para su relleno. Grado de recomendación A. Nivel de evidencia 1b.
13. El material accesorio que ha podido contactar con sangre (agujas de esclerosis, pinzas de biopsia, asas de polipectomía, etc.) debe someterse a esterilización tras una rigurosa limpieza mecánica. Idealmente, el material accesorio debería ser desechable. Grado de recomendación A. Nivel de evidencia 1a.
14. Es fundamental la educación del personal auxiliar encargado de la desinfección, y subrayar la trascendencia de su misión en materia de prevención de infecciones cruzadas. El personal temporal que participa en la desinfección debería trabajar bajo supervisión hasta que demuestre su capacitación. Grado de recomendación A. Nivel de evidencia 1a.
15. Es recomendable la utilización por parte del personal de endoscopia de protección frente a la exposición de los productos de desinfección, sangre u otro material potencialmente infeccioso (p. ej., guantes, protección ocular, máscaras de protección respiratoria, etc.). Grado de recomendación A. Nivel de evidencia 1c.
16. Debe procurarse que la sala de desinfección de los endoscopios cumpla una serie de medidas para proporcionar un ambiente seguro al personal y a los pacientes. Es recomendable que la desinfección se realice en una sala independiente del lugar donde se realicen la exploración, y disponer de un sistema de ventilación para minimizar la exposición a los vapores potencialmente tóxicos de los desinfectantes. Grado de recomendación A. Nivel de evidencia 1c.
17. La realización de controles de calidad periódicos, mediante cultivos microbiológicos de los canales de los endoscopios, puede servir de ayuda para detectar fallos en la desinfección y disrupciones en los endoscopios que la dificulten. Grado de recomendación B. Nivel de evidencia 2b.
El manuscrito ha sido revisado antes de su publicación por un grupo de gastroenterólogos que han emitido sugerencias sobre el texto original, algunas de las cuales han sido incorporadas por los autores. El grupo de revisores ha estado constituido por Montse Andreu, José Ramón Aparicio, José Luis Cabriada, Xavier Calvet, Rafael Campo, Fernando Carballo, Antoni Castells, Enrique Domínguez, Vicente Garrigues, Fernando Gomollón, Ferran González-Huix, Ángel Lanas, Fermín Mearín, Adolfo Parra, Virginia Pretejo y Angels Vilella.