INTRODUCCION
Hace 20 años se dieron los primeros pasos para disponer de un tratamiento de efectividad probada (interferón [IFN]) para la hepatitis por virus C con la primera publicación de Hoofnagle et al1. La mejoría ha sido clara desde entonces, con las sucesivas incorporaciones del tratamiento combinado con ribavirina en 1998 y más recientemente del IFN pegilado2-4.
El objetivo del tratamiento antiviral es la erradicación del virus para evitar la progresión de la fibrosis y, en definitiva, de la enfermedad hepática, pero se plantean múltiples interrogantes acerca de lo que sucede en los pacientes que no responden al tratamiento; algunos datos apuntan que en ellos puede también remitir la fibrosis. Asimismo, está por aclarar si el tratamiento antiviral puede modificar el curso clínico de la cirrosis evitando las descompensaciones, y si ello sucede sólo en los pacientes con respuesta virológica o también en los no respondedores. También está por demostrar si el tratamiento antiviral de mantenimiento varía la historia natural de la cirrosis y evita las descompensaciones, aspecto que está siendo estudiado en 3 amplios ensayos multicéntricos actualmente en marcha y de los que tendremos respuesta en unos años. Analizaremos los datos actuales disponibles de este problema.
HISTORIA NATURAL DE LA INFECCION POR VIRUS DE LA HEPATITIS C
La infección crónica por virus de la hepatitis C (VHC) es la principal causa de cirrosis en el mundo occidental y la cirrosis por VHC es la principal indicación de trasplante hepático, lo que indica la importancia de la enfermedad hepática avanzada por este virus. La historia natural de los pacientes con VHC se caracteriza por una progresión lenta de la fibrosis hasta el desarrollo de cirrosis. La tasa de progresión a cirrosis es variable, pero se estima que el 30% de los pacientes progresa a cirrosis tras 20 años de infección5.
Las citocinas inflamatorias del hígado promueven la activación de células estrelladas, proceso en el que también podrían influir polimorfismos genéticos del huésped o determinadas proteínas virales y, en definitiva, determinarán la aparición y progresión de la fibrosis6.
Algún estudio ha señalado que los valores séricos de alanina-aminotransferasa (ALT) y la necroinflamación en la biopsia eran factores predictivos de progresión, en tanto otros, como el de Ryeder7, realizado en 214 pacientes con biopsias pareadas, encuentran que la edad en el momento de la biopsia y la existencia de fibrosis en la biopsia inicial eran factores de progresión, en tanto que los valores de ALT y la inflamación no predecían progresión7.
Una de las dificultades con que se encuentran los estudios sobre la progresión de la enfermedad es la evaluación de esta fibrosis y si la biopsia hepática, nuestro patrón de referencia para su valoración, es realmente fiable y representativa de lo que está sucediendo en todo el hígado. Asimismo, las variaciones en la valoración por el mismo observador e interobservadores y el tamaño de la biopsia hacen que se cuestione el valor de ésta en muchos estudios realizados, pero de momento es la forma que tenemos para evaluar la progresión de la fibrosis.
Los factores que influyen en la progresión de la fibrosis fueron estudiados por Poynard et al8 en 2.313 pacientes con hepatitis C, estimando el momento de la infección, su duración, la fibrosis presente, la edad en el momento de la biopsia, el sexo, el consumo de alcohol, el modo de infección, la actividad del genotipo y la carga viral. El porcentaje de pacientes sin cirrosis 20 años después de la infección era del 91%, y tras 40 años, del 56%. Los factores asociados a una progresión más rápida fueron la edad en el momento de la infección, el consumo de alcohol superior a 50 g/día y ser varón. Estos autores establecieron también 4 patrones sucesivos de progresión de la fibrosis (muy lento, lento, intermedio y rápido), remarcando que la mayor progresión de la fibrosis se produce en las personas mayores de 50 años8.
La progresión de la fibrosis y su máximo grado de cirrosis implican la distorsión de la arquitectura hepática y la presencia de anomalías vasculares, lo que provoca un aumento de la resistencia vascular intrahepática, seguido de alteraciones funcionales de los lechos vasculares esplácnico e intrahepático que lleva a la hipertensión portal. Tras el desarrollo de hipertensión portal, el riesgo de ciertas complicaciones, como hemorragia por varices esofágicas, ascitis, translocación bacteriana, hiponatremia e insuficiencia renal, empeora de forma ostensible el pronóstico de la cirrosis.
El conocimiento de la historia natural cuando la cirrosis ya está establecida es importante en el análisis de riesgos y beneficios del tratamiento. En un estudio multicéntrico europeo, 384 pacientes con cirrosis compensada fueron observados durante un promedio de 5 años9. Durante dicho período, el 8% de los pacientes desarrolló un hepatocarcinoma, y el 18% algún episodio de descompensación; la probabilidad de supervivencia después de la primera descompensación fue del 50% a los 5 años, mientras que en los pacientes que no sufrieron ninguna descompensación fue del 91%. Dado que la supervivencia de los pacientes con cirrosis compensada es satisfactoria, este grupo, al igual que los pacientes con hepatitis crónica, constituye un objetivo prioritario para el tratamiento antiviral, ya que puede prevenir el desarrollo de descompensaciones.
TRATAMIENTO ANTIVIRAL EN PACIENTES CON CIRROSIS COMPENSADA
La cirrosis compensada se define por la ausencia de complicaciones de la hipertensión portal (ascitis, hemorragia por varices esofagogástricas y encefalopatía hepática) y una función hepática conservada (albúmina, >= 3,5 g/dl; bilirrubina total, ¾ 1,5 mg/dl). El objetivo del tratamiento puede ser distinto en pacientes con cirrosis en comparación con los pacientes con enfermedad menos avanzada. En pacientes con cirrosis, la erradicación sostenida del virus puede ser difícil de alcanzar y otros objetivos alternativos han de ser aplicados como sustitutos del aclaramiento viral, como la mejoría de la histología, la prevención del hepatocarcinoma y el retraso en la aparición de las complicaciones de la hipertensión portal.
No se han realizado ensayos de tratamiento con IFN pegilado y ribavirina dirigidos específicamente a estos pacientes, pero disponemos de los datos de los subgrupos de pacientes con cirrosis incluidos en los estudios de registro2-4. Los criterios de inclusión de dichos estudios fueron estrictos y no incluyeron a pacientes con leucopenia, plaquetopenia o hemoglobina disminuida (hemoglobina > 12 g/l, recuento de neutrófilos > 1.500/µl y de plaquetas > 75.000-100.000/µl como requisitos iniciales), que eran realmente pacientes con hepatitis crónica F3-F4 (Metavir); por tanto, los buenos resultados obtenidos deben ser interpretados teniendo en cuenta estos hechos, que hacen que estos pacientes con cirrosis difieran sensiblemente de los que observamos en la práctica habitual. También hay que señalar que el objetivo primario en los ensayos de registro era la erradicación del virus y no se valoraron otros parámetros, como la prolongación de la supervivencia, la progresión de la cirrosis y la posible prevención del hepatocarcinoma, aspectos que nos preocupan en la práctica habitual.
En el estudio de Fried et al3 se trató a 56 pacientes F3-F4 con la combinación de IFN pegilado 2a y ribavirina, con una respuesta virológica sostenida de 43%. El estudio de Hadziyannis et al4 incluía a 115 pacientes F3-F4, y se obtuvo una respuesta sostenida del 50% (el 73% en los pacientes con genotipo 2/3 y el 41% en los pacientes con genotipo 1). Estos resultados son sólo ligeramente inferiores a los que se obtienen en pacientes con menos fibrosis y suponen que los pacientes con cirrosis hepática compensada pueden ser tratados con éxito. Con la combinación de IFN pegilado 2b (12 kD) y ribavirina se trataron 136 pacientes F3-F4 en el estudio de Manns et al2, con una respuesta sostenida del 44% (tabla I).
DIFICULTADES PARA EL TRATAMIENTO ANTIVIRAL EN LA CIRROSIS
Las alteraciones hematológicas constituyen los efectos adversos más comunes durante el tratamiento con IFN, sobre todo el PEG IFN, asociado a ribavirina que conducen a modificaciones y/o interrupción del tratamiento. Esto es particularmente problemático en pacientes con cirrosis que tengan hiperesplenismo. La anemia hemolítica inducida por la ribavirina y el efecto supresor del IFN sobre la médula ósea, que también contribuye a la anemia, son los mecanismos predominantes para la leucopenia y trombocitopenia.
Todos los análisis de factores predictivos de respuesta al IFN estándar, solo o combinado con ribavirina, han mostrado que la presencia de fibrosis avanzada es un factor predictivo de peor respuesta al tratamiento. De esta forma, los pacientes con cirrosis hepática son «difíciles de tratar» por las citopenias y otros efectos adversos que pueden presentarse con el tratamiento combinado, y también «difíciles de curar» en razón de que con IFN estándar las tasas de respuesta virológica eran muy bajas, resultado que llevó a que muchos médicos desaconsejaran el tratamiento de estos pacientes, si bien la situación ha cambiado con la combinación de IFN pegilado y ribavirina. Una situación diferente son los pacientes con cirrosis descompensada en los que el objetivo fundamental sería en muchos casos conseguir la erradicación viral para evitar la necesidad del trasplante o evitar la recurrencia de la infección postrasplante. En la cirrosis descompensada se han llevado a cabo estudios de series pequeñas y con resultados decepcionantes y muchas suspensiones de tratamiento, por la especial dificultad de manejo de las citopenias unido al riesgo de desarrollar una insuficiencia hepática grave, lo que ha llevado a que estos pacientes sólo deban tratarse actualmente en el entorno de los grupos que realizan trasplante hepático y en el marco de ensayos clínicos.
FIBROSIS HEPATICA EN EL TRATAMIENTO ANTIVIRAL
Una cuestión importante que hay que dilucidar es si la fibrosis puede remitir con el tratamiento antiviral tanto en los pacientes respondedores como en los no respondedores, así como si puede mantenerse sin progresar con las denominadas terapias de mantenimiento.
El objetivo principal del tratamiento actual, basado en la combinación de IFN pegilado y ribavirina, es obtener una respuesta virológica sostenida (RVS), definida por la ausencia de replicación viral 6 meses después de interrumpir el tratamiento. Pero varios estudios han sugerido el beneficio de la terapia combinada sobre la histología hepática con una reducción significativa de la fibrosis. En un estudio realizado por Poynard et al10 en 1.509 pacientes, tratados con IFN solo o asociado a ribavirina. y de los que se disponía biopsias pareadas antes y después del tratamiento, se analizó la progresión y la remisión de la fibrosis, así como los posibles factores asociados, y se halló que la combinación de IFN y ribavirina reduce significativamente la tasa de progresión de la fibrosis en pacientes con hepatitis crónica C; este efecto fue más intenso en los pacientes que consiguen una respuesta sostenida, en los que han recibido 48 semanas de tratamiento y en los que tenían inicialmente una fibrosis más grave. Varios situaciones son llamativas en este estudio: la notable regresión de la fibrosis desde F4 en algunos pacientes y la progresión hacia cirrosis en un 10% de los pacientes respondedores frente a un 52% de los no respondedores, conceptos que sin duda requieren un estudio más amplio. Se cuestiona si se puede considerar curado un paciente con F3-F4 que ha presentado una respuesta sostenida y también si se debe interrumpir el tratamiento precozmente en los pacientes no respondedores, ya que se podría variar la historia de progresión de la fibrosis.
Otro estudio de Shiratori et al11 compara la progresión de fibrosis en 487 pacientes tratados con IFN con 106 pacientes no tratados, y encuentra una reducción de la progresión de la fibrosis e incluso una regresión de ésta asociada a la respuesta sostenida, y una menor progresión de fibrosis en pacientes no respondedores que en pacientes no tratados.
Parece claro que el tratamiento con IFN produce una mejoría histológica en los pacientes con hepatitis C, tanto en la fibrosis como en la inflamación12. La respuesta histológica a los distintos tratamientos con IFN, solo o asociado, se correlaciona con la respuesta virológica2,13. La proporción de pacientes que alcanzan una respuesta histológica está relacionada con la eficacia antiviral del tratamiento, y los pacientes que alcanzan una RVS tienen mayor probabilidad de presentar una mejoría histológica, independientemente del tipo de tratamiento. La adición de ribavirina al IFN incrementó de forma notable la RVS, respecto a la monoterapia con IFN, e incrementó la proporción de pacientes con mejoría del índice de actividad inflamatoria14.
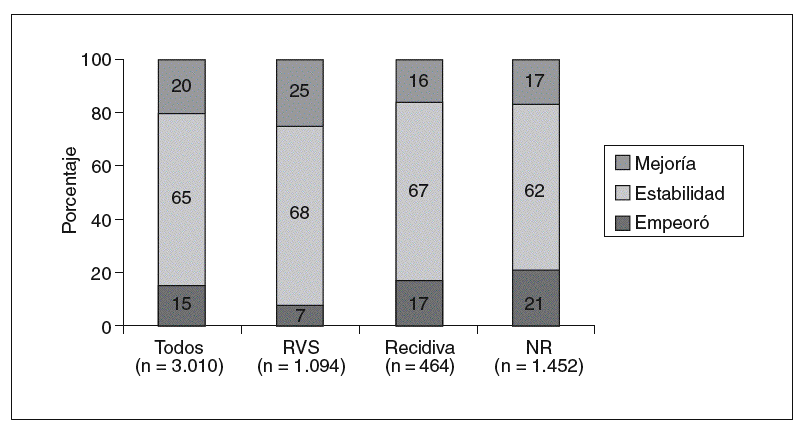
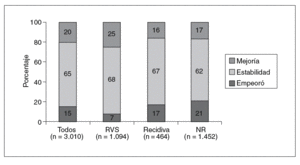
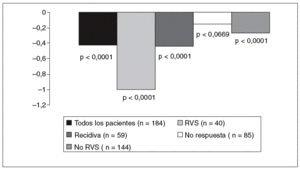
La evaluación más amplia del efecto del tratamiento antiviral en la inflamación y la fibrosis ha sido realizada por Poynard et al15, en un análisis de los datos de 3.010 pacientes incluidos en 4 ensayos aleatorizados que, en conjunto, comparan 10 tipos de tratamiento desde IFN estándar a pegilado 2b con ribavirina. El objetivo era evaluar el impacto de los distintos regímenes terapéuticos en la inflamación y la progresión de la fibrosis entre la biopsia hepática basal y la del postratamiento, según la escala METAVIR. En lo referente a la mejoría histológica (fig. 1), se observó una disminución de la fibrosis en el 20% de los pacientes, se mantuvo estable en el 65% y empeoró en el 15%. Se observó una menor progresión de la fibrosis en el grupo de pacientes con RVS (7%) en comparación con los recidivantes (17%) o los no respondedores (21%) (p < 0,001). La mejoría de la actividad varió desde el 39% en pacientes tratados con IFN estándar durante 24 semanas hasta 73% en los tratados con pegilado 1,5 µg con dosis altas de ribavirina durante 48 semanas (p < 0,001). La progresión de la fibrosis fue desde un 23% con IFN estándar hasta un 8% con la combinación de IFN pegilado (p < 0,001). De los 153 pacientes con cirrosis en la biopsia pretratamiento, se observó una regresión de ésta en 75 pacientes (49%) tratados con monoterapia con IFN, o terapia combinada con IFN y ribavirina durante 48 semanas, y en ninguno (0%) del grupo tratado con IFN durante 24 semanas. Estos datos indican que la combinación de IFN pegilado y ribavirina durante 48 semanas reduce significativamente la tasa de progresión de la fibrosis, sobre todo en los pacientes que presentan una RVS.
Fig. 1. Impacto del tratamiento con interferón/interferón pegilado alfa-2b y ribavirina en la progresión de la fibrosis hepática. NR: no respondedores; RVS: respuesta virológica sostenida. Tomado de Poynard et al15.
Las biopsias hepáticas pareadas pre/postratamiento de 184 pacientes cirróticos incluidos en el estudio de Everson et al16, sobre el tratamiento con IFN pegilado 2a de pacientes con cirrosis, se analizaron según la escala METAVIR. El grado de inflamación mejoró en el 24% de los casos y el estadio de fibrosis en el 29% de todos los pacientes. El estadio de fibrosis mejoró en el 35% de los pacientes tratados con IFN pegilado 180 µg/semana, frente al 27% de los pacientes tratados con IFN estándar. Por otro lado, los pacientes tratados con 180 y 90 µg tuvieron una significativa mejoría en el grado de actividad inflamatoria del 28% (p = 0,0201) y el 31% (p = 0,0084), respectivamente, frente al 11% en el grupo tratado con IFN. El análisis de la mejoría histológica según la respuesta virológica puso de manifiesto que, aunque los pacientes con RVS son los que obtienen los mayores beneficios, los pacientes recidivantes virológicos y los no respondedores obtuvieron un moderado beneficio histológico y el índice medio de fibrosis mejoró en la población global, en pacientes con una RVS y en recidivantes virológicos (p < 0,0001) y tiende a mejorar en los no respondedores virológicos (p = 0,067) (fig. 2). Estos resultados avalan el uso una terapia antiviral de mantenimiento.
Fig. 2. Monoterapia con interferón pegilado 2a en pacientes con cirrosis compensada. Cambio en el estadio de fibrosis respecto a la biopsia basal. RVS: respuesta virológica sostenida. Tomada de Everson et al16.
EFECTO EN LA HIPERTENSION PORTAL
Ha quedado claro el efecto del tratamiento antiviral en la fibrosis, pero no sabemos si esto se plasma en algún efecto en la presión portal, que es un factor importante en la progresión hacia la cirrosis hepática y sus descompensaciones. Es posible que la terapia basada en el IFN pueda tener algún papel en la fisiopatología de la hipertensión portal. Analizaremos los datos disponibles acerca del papel del IFN en la hipertensión portal y, en concreto, si la terapia antiviral disminuye esta afección.
Varios estudios han mostrado que el grado de aumento en la presión portal medido por el gradiente de presión venosa hepática (HVPG) tiene un papel central en el desarrollo de complicaciones de la cirrosis. La importancia de la presión portal se demuestra claramente por la existencia de varios valores clave de HVPG en el desarrollo de diferentes manifestaciones del este síndrome. La disminución del HVPG es un objetivo importante del tratamiento de la hipertensión portal y éste se considera el método más adecuado de evaluación de los efectos de la terapia.
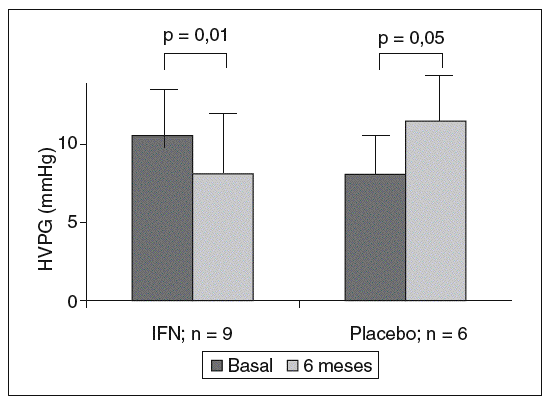
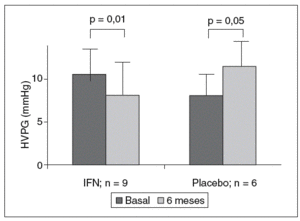
Tres estudios han evaluado el efecto de la terapia antiviral en la presión portal. El primero de estos estudios de García Tsao et al17 evalúa el efecto de la administración de IFN estándar sobre la presión portal en pacientes con cirrosis hepática por VHC. En este pequeño estudio controlado con placebo el HVPG al final de tratamiento era más bajo que el basal en los pacientes tratados con IFN, mientras que aumentaba en los pacientes tratados con placebo (fig. 3). Este estudio debió interrumpirse por la imposibilidad de asignar pacientes al grupo placebo.
Fig. 3. Efecto de interferón (IFN) estándar y placebo en la presión portal (gradiente de presión venosa hepática [HVPG].
La segunda evidencia acerca de la disminución de presión portal por efecto del tratamiento antiviral parte del subanálisis de un amplio estudio controlado y dirigido a evaluar la evolución de pacientes cirróticos tras tratamiento de 6 meses con IFN18. Las medidas repetidas del gradiente de presión portal se disponían sólo en 10 de los 19 pacientes, 5 en el grupo activo y 5 en el grupo placebo. En este estudio no se detectaron efectos de la terapia viral, debido posiblemente al pequeño tamaño de la muestra.
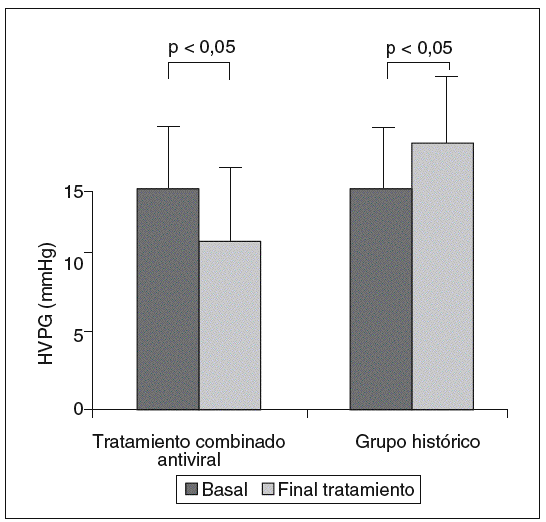
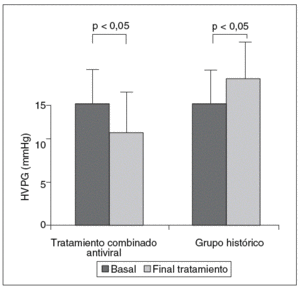
El tercer estudio se presentó en AASLD 2004, en Boston19. Éste es un estudio abierto con evaluación de HVPG antes y a las 24 y 48 semanas de tratamiento combinado en pacientes con fibrosis de tipos 3 y 4 e hipertensión portal. La presencia de hipertensión portal era evaluada por un HVPG superior a 5 mmHg. Se realizaron biopsias basales y a final de tratamiento. Se detectó una disminución de HVPG tras la terapia antiviral (fig. 4). El descenso de HVPG se produjo en todos los pacientes excepto en uno, que experimentó un aumento de ALT durante el tratamiento. El descenso de HVPG parecía relacionado con la disminución de la actividad inflamatoria. De hecho, la reducción del HVPG era mayor en los pacientes con ALT normal al final del tratamiento. Estos hallazgos eran muy diferentes de los observados en un grupo histórico de pacientes cirróticos en los que 2 estudios hemodinámicos se realizaban tras una media de tiempo de 12 meses. En este caso las medidas pareadas de HVPG mostraron un significativo incremento de la presión portal. Sólo en el 10% de los casos la presión portal disminuyó espontáneamente.
Fig. 4. Efecto del tratamiento combinado (interferón pegilado más ribavirina) en la presión portal. HVPG: gradiente de presión venosa hepática.
En resumen, hay evidencia de que la terapia antiviral puede disminuir la presión portal de forma inmediata tras la terapia con IFN. No hay datos acerca del efecto a largo plazo, pero parece que éste no se mantiene en el tiempo. Así, un tercio de las medidas realizadas en 6 pacientes sin respuesta sostenida un año después de interrumpir el tratamiento mostraron un significativo aumento del HVPG. Serían necesarios más estudios para determinar si la reducción de la presión portal se mantiene especialmente en los pacientes que presentan una respuesta sostenida.
TRATAMIENTO ANTIVIRAL Y HEPATOCARCINOMA
Otra complicación importante de la cirrosis hepática es el desarrollo de hepatocarcinoma. Diversos estudios han analizado el impacto del tratamiento antiviral en esta progresión. Los estudios iniciales sugirieron que el tratamiento con IFN podía reducir la probabilidad de desarrollar un hepatocarcinoma, sobre todo en pacientes que hubieran obtenido una RVS20, lo que no fue confirmado por otros18. Papatheodoridis et al21 realizaron un metaanálisis de los estudios publicados para evaluar si el tratamiento con IFN reduce la incidencia de hepatocarcinoma. El análisis incluyó a 2.178 pacientes con cirrosis, de los que 1.223 fueron tratados y 955 no. El hepatocarcinoma se desarrolló con más frecuencia en el grupo no tratado (21,5%) que en el grupo tratado (8,2%) (p < 0,001). Dentro del grupo tratado, el hepatocarcinoma fue detectado con mayor frecuencia entre los pacientes que no tuvieron una RVS (9%) que en los que desarrollaron una RVS (0,9%) (p = 0,001). Esto demuestra una frecuencia muy baja en los pacientes con RVS, y una reducción importante en los que no alcanzaron una respuesta sostenida.
EVOLUCION CLINICA TRAS EL TRATAMIENTO ANTIVIRAL
No sabemos con certeza si la disminución de la presión portal es clínicamente relevante. Varios estudios han sugerido que consiguiendo una adecuada reducción de la presión portal tras tratamiento farmacológico de la presión portal disminuye la probabilidad de presentar manifestaciones graves de enfermedad hepática terminal, como hemorragia por varices esofágicas, peritonitis bacteriana espontánea, síndrome hepatorrenal o muerte22. Una reducción de HVPG por debajo de 12 mmHg o una disminución de más del 20% tras el tratamiento se considera la finalidad del tratamiento de la hipertensión portal. La magnitud de la disminución del HVPG tras la terapia antiviral se ha evaluado en un estudio, en el cual el 80% de los pacientes con hipertensión portal grave (definida por un HVPG mayor de 12 mmHg) tienen un descenso clínicamente significativo de presión portal al final de tratamiento.
No sabemos si el efecto de la terapia antiviral en la presión portal se mantiene en el tiempo y así proporciona una prevención efectiva de las complicaciones de la hipertensión portal.
Los efectos de la terapia antiviral en la presión portal se han evaluado solamente en un pequeño número de cirrosis compensadas, sin haber examinado los objetivos clínicos.
No hay suficiente evidencia para recomendar el uso del tratamiento antiviral en el manejo de los eventos clínicos relacionados con la hipertensión portal, como la prevención de la hemorragia por varices. El efecto de la terapia antiviral en cirrosis descompensada no ha sido evaluada.
En el estudio de Rincón et al19, el tratamiento antiviral con IFN pegilado 2b y ribavirina durante 24/48 semanas en pacientes no tratados previamente o no respondedores virológicos al IFN estándar, con fibrosis de tipos 3 o 4 según la escala METAVIR, produjo una notable y significativa reducción en el gradiente de presión portal, tal vez relacionada con la mejoría de la histología hepática, independientemente de la respuesta virológica, aunque no hay evidencia de la duración de esta respuesta a largo plazo.
Son necesarios más estudios para evaluar si el uso de la terapia antiviral durante largo tiempo puede retrasar la aparición y disminuir la gravedad de las manifestaciones de la hipertensión portal. La descripción del probable efecto de la terapia antiviral en la presión portal es un importante hallazgo fisiopatológico, pero hay pocos datos acerca de los efectos de la terapia antiviral sobre las manifestaciones clínicas de la hipertensión portal. Un estudio aleatorizado (COPILOT) realizado en un gran número de pacientes ha comparado la evolución de los no respondedores a la terapia combinada tras tratamiento continuo con IFN pegilado alfa 2b (1,5 µg/kg/semana) o colchicina (0,6 mg bid) como fármaco potencialmente antifibrogénico23. Este estudio incluye pacientes con un seguimiento clínico, que comprende biopsias repetidas y exámenes ecográficos y endoscópicos. El número de pacientes con hemorragia por varices durante el seguimiento era más bajo en el grupo de IFN que en el grupo de colquicina (11 de 42 en el grupo de colquicina frente a 1 de 26 en el de IFN). La probabilidad acumulativa de estar libre de manifestaciones de hipertensión portal era mayor en los pacientes tratados con IFN. Este estudio sugiere que la terapia antiviral puede tener un papel potencial en la prevención de complicaciones de hipertensión portal, pero no incluye medidas hemodinámicas que puedan proporcionar datos relevantes de aspectos fisiopatológicos. Estos resultados preliminares deben ser confirmados por éste y otros estudios en marcha.
UTILIDAD DEL TRATAMIENTO DE MANTENIMIENTO
Como la erradicación viral puede ser difícil de alcanzar en algunos pacientes, se han señalado unos objetivos clínicos alternativos, como la mejoría de la histología y la prevención o el retraso en el desarrollo del hepatocarcinoma o la descompensación de la enfermedad hepática, para evaluar la respuesta al tratamiento antiviral actual y también a otros fármacos.
El efecto de la administración de IFN a largo plazo en pacientes no respondedores ha sido estudiado en pequeños estudios piloto, como el de Guerret et al24, que encontró una regresión de la fibrosis, sobre todo en pacientes con cirrosis tras un tratamiento durante 5 años con monoterapia con IFN. Algunos estudios histológicos previamente reseñados resaltan la utilidad de la histología hepática como un objetivo del tratamiento y un papel potencial para el mantenimiento del tratamiento antiviral con el fin de prevenir o retrasar la actividad inflamatoria y la progresión de la fibrosis15,16.
Shiffman et al25 examinaron los efectos de la terapia de mantenimiento con IFN estándar 2b en el retraso de la progresión histológi cirrosis) no respondedores virológicos, que habían alcanzado una respuesta histológica después de un curso inicial con 5 MU de IFN 3 veces/semana durante 6 meses, fueron aleatorizados a interrumpir el tratamiento (27 pacientes) o continuar durante 24 meses con 3 MU 3 veces/semana (26 pacientes). Después de 30 meses de tratamiento, el índice de fibrosis disminuyó desde 2,5 ± 0,3 hasta 1,7 ± 0,4, y el 80% de los pacientes tuvo una mejoría histológica (p < 0,03), mientras que la interrupción del tratamiento se asoció a un incremento del índice de fibrosis desde 2,2 ± 0,3 hasta 2,4 ± 0,4 y un empeoramiento de la histología hepática en el 30% de los pacientes (p < 0,01). Estos estudios sugieren que la terapia de mantenimiento puede ser una opción importante para los pacientes no respondedores virológicos, con el fin de prevenir o retrasar la progresión de la fibrosis y evitar las complicaciones de la enfermedad hepática.
Con el fin de evaluar los beneficios clínicos e histológicos de la terapia de mantenimiento, se ha diseñado un estudio a largo plazo con IFN pegilado 2a en pacientes con cirrosis/puentes de fibrosis, no respondedores virológicos a un tratamiento previo con IFN estándar con o sin ribavirina (denominado HALT-C [Hepatitis C long term treatment against cirrhosis]). Después de una fase inicial de 20 semanas de tratamiento con IFN pegilado de 180 µg/semana y 1.000/1.200 mg/día de ribavirina según el peso, los pacientes con negatividad en suero del ARN del VHC continúan con la misma pauta terapéutica, hasta un total de 48 semanas y un posterior seguimiento evolutivo de 24 semanas. Los pacientes sin respuesta virológica se incluyen en la fase de mantenimiento del HALT-C y son aleatorizados a continuar con IFN pegilado en dosis reducidas de 90 µg/semana durante 3,5 años o a interrumpir el tratamiento, con un seguimiento durante el mismo período. Un análisis provisional de los primeros 604 pacientes incluidos (el 39% con cirrosis y el 61% con puentes de fibrosis) ha demostrado que un 35% de los pacientes en la semana 20 obtuvo una respuesta virológica, y un 18% alcanzó una RVS; los factores predictivos de ello fueron la monoterapia previa con IFN, el genotipo 2/3, el valor basal de ARN del VHC < 1,5 millones de U/ml y la ausencia de cirrosis26. El estudio está en marcha con una duración de 3,5 años y no se tienen datos todavía del objetivo fundamental, que es el efecto del tratamiento de mantenimiento.
Otro ensayo controlado y prospectivo muy similar al anterior, denominado EPIC27, se diseñó para conocer la eficacia del tratamiento con 1,5 µg/kg/semana de IFN pegilado 2b y 800-1.400 mg/día de ribavirina durante 48 semanas en una población no respondedora o recidivante a un tratamiento previo con IFN y ribavirina. Los pacientes sin respuesta virológica se aleatorizaron para recibir dosis más bajas de IFN pegilado 2b (0,5 µg/kg/semana) en monoterapia u observación durante un período de 3,5 años para estudiar si se produce un retraso en la progresión de la cirrosis o si se previenen complicaciones de la enfermedad hepática en pacientes cirróticos. Finalmente, un tercer ensayo realizado a largo plazo, ya mencionado (COPILOT), valoró la seguridad y la eficacia de IFN pegilado 2b en dosis de 0,5 µg/kg/semana como terapia de mantenimiento frente a colquicina en dosis de 1.200 mg/día en pacientes con fibrosis avanzada (> 3 puntos de la escala de Ishak) no respondedores a tratamiento previo con IFN. El análisis provisional a los 2 años ha puesto de manifiesto que unas dosis bajas de IFN pegilado 2b son superiores a la colquicina para prevenir las complicaciones de la cirrosis, particularmente en pacientes con hipertensión portal e hipoalbuminemia23. Aunque los resultados de estos 3 ensayos son esperados con entusiasmo, se recomienda que el tratamiento de mantenimiento con IFN se reserve por el momento para pacientes incluidos en ensayos clínicos, ya que la relación riesgo/beneficio de tal tratamiento todavía es desconocida.
En resumen, los pacientes con cirrosis compensada por VHC pueden ser tratados con éxito, consiguiéndose una mejoría de la fibrosis tanto en respondedores virológicos como en no respondedores. Con el tratamiento antiviral se consigue también una disminución, al menos temporal, de la presión portal. En pacientes que no hayan obtenido una respuesta virológica, es posible que el tratamiento de mantenimiento con dosis bajas de IFN pegilado pueda retrasar o prevenir las complicaciones de la enfermedad hepática avanzada. Pero habrá que esperar a los resultados de los estudios actualmente en marcha.