La introducción del tratamiento con fármacos inhibidores del factor de necrosis tumoral (anti-TNF) ha supuesto un cambio en el manejo de los pacientes con enfermedad inflamatoria intestinal (EII) sin una respuesta adecuada a las terapias convencionales con esteroides e inmunomoduladores. En la actualidad disponemos de varios tratamientos biológicos con este mecanismo de acción que han demostrado su eficacia tanto en la inducción como en el mantenimiento de la remisión clínica1. Para la enfermedad de Crohn (EC) tenemos acceso al empleo de infliximab, adalimumab y certolizumab pegol, este último solo disponible en EE. UU. y Suiza2,3, sin haber demostrado diferencias significativas al compararlos entre ellos en un metaanálisis reciente4. En el caso de pacientes con colitis ulcerosa (CU), están aprobados el uso de infliximab, adalimumab y de forma más reciente el golimumab5–7. Pese a que con ellos se ha ampliado el panorama terapéutico obteniendo unas tasas altas de respuesta y remisión, en torno a un 20-40% de pacientes con EC y un 30-40% con CU no responden al tratamiento (fallo primario)8. Hay otro grupo de pacientes que responde pero posteriormente pierde la respuesta, denominado no respondedor secundario, sin claros criterios para su definición en los diferentes estudios. En la mayor parte de los casos se pierde la respuesta durante el primer año de tratamiento, oscilando entre un 23-46% a los 12 meses en pacientes con EC en tratamiento con infliximab o adalimumab, si se define la no respuesta secundaria como la necesidad de intensificación de la dosis9. Se estima una pérdida anual de respuesta por paciente en torno a un 13% con infliximab10 y a un 20% con adalimumab11 en la EC. En la CU se ha visto en un estudio una no respuesta secundaria de aproximadamente el 59% durante el tratamiento con infliximab y adalimumab, teniendo en cuenta tanto la intensificación del tratamiento como la cirugía o el requerimiento de rescate con esteroides12. Habitualmente cuando se produce una pérdida de respuesta se intensifica la dosis del anti-TNF, se modifica por otro anti-TNF o se cambia por otro fármaco con un mecanismo de acción diferente. En varios estudios se ha propuesto la potencial utilidad de la medición de los anticuerpos anti-TNF así como de los niveles del fármaco para el manejo de los pacientes en estos casos, pudiendo optimizar de esta forma el empleo de los tratamientos. La actual revisión tiene el objetivo de analizar los estudios disponibles hasta el momento evaluando la aplicabilidad de la determinación de los mismos en la práctica clínica.
Farmacocinética de los fármacos inhibidores del factor de necrosis tumoralLa ausencia o pérdida de respuesta puede estar influida por la variabilidad inter- e intraindividual en la biodisponibilidad y farmacocinética de los fármacos, que dependen de la estructura del fármaco, la vía de administración, degradación y eliminación. El infliximab se administra por vía intravenosa, permitiendo administrar grandes volúmenes de fármaco con lo que se alcanza una concentración pico casi inmediata tras la infusión, obteniendo una distribución rápida con baja variabilidad interindividual. El adalimumab, certolizumab y golimumab se administran por vía subcutánea con menor volumen de fármaco y una absorción más lenta a través del drenaje linfático. Estos fármacos alcanzan la concentración pico a los 5-10 días y tienen una biodisponibilidad entre 50-100%, por lo que hay una mayor variabilidad interindividual13,14. El mecanismo de degradación y eliminación de los anti-TNF no se conoce con exactitud, aunque se cree que se realiza principalmente mediante catabolismo proteolítico en el sistema reticuloendotelial tras la endocitosis mediada por receptor del anticuerpo15. Existen mecanismos protectores del catabolismo mediados por el receptor Fc neonatal que reciclan los anticuerpos IgG y los devuelven a la circulación, aumentando su vida media16,17. Dicho receptor tiene una mayor afinidad por las IgG humanas, variando la vida media en función del nivel de humanización del anticuerpo, de tal forma que los anticuerpos murinos tienen una vida media de 1-2 días, los quiméricos de 10-14 días y los humanizados de 10-20 días16,18. No obstante, estos mecanismos son saturables en determinadas situaciones como las enfermedades inflamatorias sistémicas, disminuyendo la vida media del fármaco13,16. Otro mecanismo que se relaciona con el aclaramiento es la modificación de la estructura del fármaco, como en el caso del certolizumab, que tiene reemplazada la porción Fc por polietilenglicol, aumentando su vida media al disminuir su proteolisis y su inmunogenicidad19.
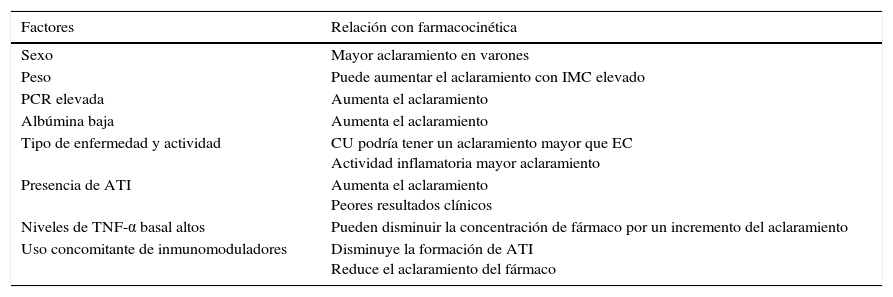
Existen otros factores que influyen en el aclaramiento de los fármacos como los valores de albúmina, proteína C reactiva (PCR), índice de masa corporal, sexo, tipo de enfermedad (EC o CU) y actividad, citocinas inflamatorias, uso concomitante de inmunomoduladores y desarrollo de anticuerpos antifármaco (ADA)17,20. Hay un estudio que evalúa dichos factores en 169 pacientes con EC y CU, observando que los niveles bajos de albúmina, unas cifras elevadas de PCR y la presencia de anticuerpos antiinfliximab (ATI) se asociaban de forma significativa a un aclaramiento elevado de infliximab21. En varios estudios se han asociado estos factores con la farmacocinética de los fármacos biológicos, que se resumen en la tabla 120,22.
Factores relacionados con la farmacocinética de los fármacos anti-TNF
| Factores | Relación con farmacocinética |
|---|---|
| Sexo | Mayor aclaramiento en varones |
| Peso | Puede aumentar el aclaramiento con IMC elevado |
| PCR elevada | Aumenta el aclaramiento |
| Albúmina baja | Aumenta el aclaramiento |
| Tipo de enfermedad y actividad | CU podría tener un aclaramiento mayor que EC Actividad inflamatoria mayor aclaramiento |
| Presencia de ATI | Aumenta el aclaramiento Peores resultados clínicos |
| Niveles de TNF-α basal altos | Pueden disminuir la concentración de fármaco por un incremento del aclaramiento |
| Uso concomitante de inmunomoduladores | Disminuye la formación de ATI Reduce el aclaramiento del fármaco |
Los fármacos anti-TNF son anticuerpos monoclonales del tipo IgG1. El sistema inmune puede no reconocer como propios los tratamientos biológicos generando ADA, que aumentan el aclaramiento del fármaco debido a la formación de inmunocomplejos que se eliminan por el sistema reticuloendotelial.
La formación de los anticuerpos está dirigida contra la región variable F(ab)2, mejor caracterizada en el caso del infliximab23, pero se ha descrito la formación de ADA también en caso de adalimumab y certolizumab.
El desarrollo de ADA está influido por varios factores, incluyendo la estructura biológica, el estado inmunológico del paciente, la vía de administración, el esquema de tratamiento (mantenimiento o episódico) y las medicaciones concomitantes24. Debido a ello y a la presencia de distintas técnicas y momentos de la medición, la incidencia de ADA es muy variable en los distintos estudios. La formación de los ATI varía entre un 6-61%25,26. En el estudio ACCENT I en EC se describe la formación de ATI entre un 6-28%, teniendo en cuenta que en un 46% de los pacientes los resultados no fueron concluyentes por la detección de infliximab sérico que interfería con la determinación de ATI mediante ensayo por inmunoabsorción ligado a enzima (ELISA)25. En el caso de los anticuerpos antiadalimumab (ATA), en el estudio CLASSIC II de mantenimiento en EC se desarrollaron un 2,6% de ATA en la semana 5427. Sin embargo, en los estudios realizados en enfermedades reumatológicas, sobre todo en artritis reumatoide, se describen cifras de ATA entre 12-17%28,29. En cuanto al certolizumab, en los estudios PRECISE los anticuerpos aparecen entre un 8-9% en la semana 2630,31. Por último, en el estudio PURSUIT de mantenimiento con golimumab en CU, se desarrollaron ATA en el 2,9% de los pacientes7.
Como se ha mencionado previamente, la realización de una terapia mantenida en comparación con el tratamiento episódico supone una menor tasa de ADA26,32–34. En un estudio realizado por Hanauer et al. se observó que la formación de anticuerpos era significativamente mayor en aquellos pacientes con tratamiento episódico, siendo de un 30%, con cifras de 7 y 10% en los grupos de mantenimiento. Además las cifras fueron menores en los que tenían terapia inmunosupresora asociada33. En un metaanálisis realizado por Lee et al. con 3.326 pacientes con EC y CU se observó que la prevalencia de ATI total fue del 20,8%, siendo del 45,8% si las infusiones eran episódicas y del 12,4% en el tratamiento de mantenimiento (p<0,00001)34.
Es importante tener en cuenta que la aparición de los ADA puede ser transitoria y que no siempre tiene un impacto clínico. Así se muestra en un estudio de Vande Casteele et al. en el que se analizan 1.232 muestras séricas consecutivas de 90 pacientes con EC y CU tratados con infliximab. De los pacientes que presentaron ATI, un 28% fueron transitorios y un 72% persistentes, observando que en el grupo con ATI persistentes presentaron mayores niveles medios de ATI con respecto al grupo transitorio, requiriendo una mayor necesidad de interrumpir el tratamiento (68 vs. 13%; p=0,0005). No se conoce con exactitud la causa de la desaparición de los anticuerpos, pero en este estudio se hace referencia a que un 20% recibían tratamiento inmunosupresor concomitante, en un 20% se realizó intensificación de dosis y en el 60% restante se desconoce la causa35. En otro estudio de Steenholdt et al. se vio que los anticuerpos desaparecen en 2 tercios de los pacientes que presentan una respuesta clínica, persistiendo en el caso de ausencia de respuesta. Se observó que al suspender el tratamiento con infliximab los niveles de anticuerpo disminuían a lo largo del tiempo, pudiendo persistir durante años36.
La mayoría de los pacientes que desarrollan ATI de forma persistente lo hacen en los primeros 12 meses de tratamiento, mientras que los transitorios se producen en cualquier momento del tratamiento. En algunos el comienzo de la clínica de pérdida de respuesta puede venir precedida por el desarrollo de ATI37.
Otro de los factores implicados en la formación de ADA es la terapia concomitante con inmunomoduladores, que se asocia a una menor formación de anticuerpos26,38–40, con una disminución del riesgo de desarrollar ATI de hasta el 50% en algunos estudios34. Vermeire et al. analizaron una cohorte de 174 pacientes con EC evaluando la aparición de ATI en función de la presencia de terapia inmunosupresora, encontrando que la terapia concomitante (azatioprina o metotrexato) tenía una menor incidencia de ATI comparado con aquellos pacientes sin inmunosupresión, el 46 y 73%, respectivamente (p<0,001), sin observar diferencias entre la azatioprina y el metotrexato38. En el estudio SONIC se asigna a 508 pacientes con EC a recibir azatioprina en monoterapia, infliximab en monoterapia o ambos. En la semana 30 de seguimiento se observaron ATI en un 0,9% de los pacientes con terapia combinada comparado con 14% en el grupo de infliximab en monoterapia, presentando un menor número de reacciones infusionales el grupo con inmunomoduladores comparado con el de infliximab (5 y 16,6%, respectivamente)39. En otro estudio reciente realizado por van Schaik et al. también se vio que la incidencia de ATI fue mayor en el grupo de monoterapia comparado con la combinación con inmunomoduladores (29,8 vs. 5,7%; p=0,001)40. Sin embargo, la administración concomitante de inmunomoduladores se debe individualizar por el riesgo de que una inmunosupresión profunda pueda condicionar un incremento de los efectos secundarios.
Métodos de mediciónLas técnicas para la medición de los niveles de anti-TNF y ADA son muy variadas, entre las que se encuentran el ensayo por inmunoabsorción ligado a enzima (ELISA), el radioinmunoanálisis, el ensayo por movilidad variable, el ensayo mediante gen reportero y el enzimoinmunoanálisis, este último empleado para la detección de ADA. La más utilizada en los estudios por su simplicidad es el ELISA en fase sólida, una técnica que es sensible y barata; sin embargo, existe riesgo de falsos positivos por la interacción con inmunoglobulinas distintas de infliximab (por ejemplo puede reconocer la fracción Fc de la IgG del factor reumatoide) y de falsos negativos al no detectar anticuerpos en presencia de fármaco ni la presencia de IgG418,41. El radioinmunoanálisis se emplea fundamentalmente en fase líquida, siendo más sensible comparado con el ELISA. Además, no interacciona con otras inmunoglobulinas y permite detectar IgG4, con el inconveniente de ser más complejo por la utilización de radioisótopos42.
El ensayo por movilidad variable se ha validado de forma más reciente para la medición tanto de los niveles de fármaco como de los ADA. Tiene una alta sensibilidad y especificidad, es capaz de detectar todos los subtipos de inmunoglobulinas y permite identificar anticuerpos en presencia de fármaco con unos niveles de detección de los mismos más bajos comparados con respecto a las técnicas previas43,44.
Existe una gran variabilidad en cuanto al empleo de las técnicas por los diferentes grupos. En diversos estudios se han comparado las distintas técnicas, con una buena correlación entre ellas en cuanto a la medición de la concentración de infliximab y de los niveles de ATI, con resultados clínicos similares45,46. Sin embargo, se ha observado que las concentraciones de infliximab y niveles de ATI muestran diferencias y que se debería emplear la misma técnica en el mismo paciente47.
Impacto clínico de la concentración de fármaco y los niveles de anticuerpos antifármacoNiveles de anticuerpos antifármacoEn varios estudios se ha observado que la presencia de los ADA se correlaciona con una menor concentración de fármaco y con un aumento de las reacciones infusionales26,34,48–50.
En cuanto a la asociación de la presencia de los anticuerpos con la remisión, no está tan clara, con resultados en los distintos estudios contradictorios. En un estudio con una cohorte prospectiva realizado por Warman et al. y en un metaanálisis de Lee et al. se observó que la presencia de ATI se asociaba a una ausencia de detección de niveles valle de infliximab, sin diferencias en cuanto a la remisión34,48. Sin embargo, en un metaanálisis de Nanda et al. con 1.378 pacientes con EII se encontró una mayor pérdida de respuesta en aquellos pacientes que desarrollaban ATI, con un riesgo relativo de pérdida de respuesta de 3,2 (intervalo de confianza 2-4,9; p<0,0001)49.
Concentración de inhibidores del factor de necrosis tumoralEn varios estudios se han relacionado los niveles de fármaco con la respuesta y remisión clínica, de tal forma que si son adecuados se consigue una mayor tasa de remisión, tanto en EC como en CU y con los distintos fármacos32,51–53. Otros aspectos que se han evaluado son la remisión endoscópica y los marcadores bioquímicos como la PCR, habiendo observado una mejoría en los pacientes con niveles terapéuticos de fármaco52,54–56. Existe una enorme dificultad para establecer los valores de referencia óptimos para conseguir los objetivos clínicos, debido a la heterogeneidad de los estudios y a la variabilidad en cuanto a las técnicas de medición de los mismos. Mencionamos a continuación los más relevantes.
En un estudio post hoc del ACCENT I realizado por Cornillie et al. se evaluó la utilidad de la medición de los niveles valle de infliximab en la semana 14 para predecir la respuesta sostenida en aquellos pacientes en tratamiento de mantenimiento, realizando un seguimiento durante 54 semanas. Se observó que los pacientes con respuesta sostenida con infliximab tenían mayores niveles valle en la fase postinducción con respecto a los que no la tenían. Como predictores de respuesta sostenida se encontraron unos niveles valle≥3,5μg/ml y un descenso≥60% de los valores de PCR en la semana 1455.
Baert et al. analizaron una cohorte consecutiva de 125 pacientes con EC que recibieron tratamiento episódico con infliximab, determinando los niveles de fármaco y ATI previo y a las 4 semanas de la infusión, evaluando la respuesta clínica, efectos secundarios y el uso concomitante de inmunomoduladores. La incidencia de ATI fue del 61%, dividiendo a los pacientes en 2 grupos con un punto de corte en 8μg/ml. Los valores>8μg/ml predijeron una duración de la respuesta más corta y con mayor riesgo de reacciones infusionales. La concentración de infliximab estaba relacionada de forma significativa con los niveles de anticuerpo antes de la infusión, con una respuesta más duradera con unos niveles de fármaco>12μg/ml. Además, los pacientes con terapia inmunosupresora concomitante tuvieron menor incidencia de ATI26.
En un estudio de Vande Casteele et al. se analizaron de forma retrospectiva 1.232 muestras séricas de 90 pacientes con EC y CU tratados con infliximab para valorar la relación de los ATI y niveles de fármaco con los marcadores inflamatorios y la evolución clínica. Se observó mediante análisis ROC que unos niveles valle de infliximab<13μg/ml en la semana 6 tenían una sensibilidad y especificidad altas para la formación de ATI, siendo mayores cuando los niveles eran<2,2μg/ml en la semana 14. La presencia de niveles valle<2,2μg/ml en la semana 14 además predice la suspensión del tratamiento con infliximab de forma significativa debido a una pérdida de respuesta persistente o a reacciones infusionales (sensibilidad del 82%, especificidad del 74%). Los autores proponen por ello medir los niveles valle de infliximab en la semana 14 tras la inducción o en caso de pérdida de respuesta; si son bajos o indetectables, realizar una medición de ATI. Si los ATI son positivos y se mantienen en el tiempo se debería plantear modificar la terapia35.
Maser et al. analizaron a un grupo consecutivo de 105 pacientes con EC que recibieron tratamiento de inducción con infliximab seguido de tratamiento episódico o mantenido, con el objetivo de evaluar la formación de ATI, la concentración de fármaco y el significado clínico. Se observó que aquellos pacientes con unos niveles detectables de fármaco tuvieron una mayor remisión clínica a las 52 semanas comparado con los que tenían niveles indetectables (82 vs. 6%; p<0,001), menores cifras de PCR (2 vs. 11,8μg/L; p<0,001) y una mejor tasa de mejoría endoscópica (88 vs. 33%; p<0,001). Además, la formación de ATI y reacciones infusionales fueron mayores en el grupo de tratamiento episódico32. Hay otro estudio de Imaeda et al. en el que se confirma que la actividad endoscópica se correlaciona negativamente con los niveles de fármaco y positivamente con la PCR y calprotectina fecal57.
En un estudio de 115 pacientes con CU en tratamiento de mantenimiento con infliximab se observó que aquellos con niveles adecuados de fármaco tenían mayores tasas de remisión y mejoría endoscópica, presentando un aumento en el riesgo de colectomía en los pacientes con niveles indetectables58.
En un estudio de pacientes con EC en tratamiento con adalimumab se vio que los niveles de fármaco fueron menores en los pacientes que interrumpieron el tratamiento a los 6 meses por pérdida de respuesta comparado con aquellos que continuaron con el tratamiento, y que la presencia de ATA estaba asociada a menores niveles de fármaco (p<0,0001)59. Hay otro estudio más reciente que analiza los niveles de adalimumab en la población de pacientes con EC de los estudios CLASSIC I y CLASSIC II, confirmando la relación positiva entre los niveles medios de adalimumab y la remisión60.
Como se ha referido previamente, la concentración de fármaco está relacionada con la presencia de tratamiento concomitante con inmunosupresores, aumentando la combinación los niveles de fármaco comparado con aquellos pacientes que no reciben inmunomoduladores asociados38,40. En un estudio retrospectivo de pacientes que reciben tratamiento con infliximab o adalimumab se evalúan los niveles de fármaco y anticuerpos en función del uso previo de inmunomoduladores, observando que los niveles de infliximab fueron mayores en el grupo de combinación comparado con el grupo de monoterapia (4,6 vs. 7,5μg/ml; p=0,04), sin diferencias significativas con el adalimumab40.
Aplicabilidad en la práctica clínica de la monitorización de los niveles de anticuerpos antifármaco y la concentración de inhibidores del factor de necrosis tumoral en enfermedad inflamatoria intestinalLos pacientes pueden presentar pérdida de respuesta para los fármacos anti-TNF en un porcentaje importante. Ante esta situación, en la práctica clínica habitualmente se realiza intensificación mediante el aumento de la dosis o el acortamiento en la frecuencia de administración, cambiando a otro anti-TNF si fracasa o a un fármaco con otra diana terapéutica, todo ello guiado por la clínica y por los parámetros bioquímicos. En muchos pacientes se realiza esta estrategia sin obtener una respuesta, pudiendo incrementar el riesgo de efectos secundarios.
En los casos en los que se desarrollan ADA, se ha visto que tras la intensificación la mayor parte de los pacientes no responden. Esto se ha observado en un estudio de Afif et al. con 155 pacientes en los que se midieron los niveles de ADA y de fármaco, evaluando la estrategia más eficaz con intensificación de dosis o modificación a otro anti-TNF. Esta medición supuso una modificación en la actitud en el 73% de los casos, observando que en presencia de ADA positivo, el cambio a otro anti-TNF tuvo una mejor respuesta comparado con la intensificación de dosis (17 vs. 92%; p<0,004). En los pacientes con niveles infraterapéuticos de fármaco, con la intensificación se obtuvieron mejores respuestas (86 vs. 33%; p<0,016)61. Por ello, se podría evitar en los pacientes con ADA positivos la realización innecesaria de intensificación de dosis, estando asociada además con mayores reacciones infusionales. Sin embargo, en un porcentaje de los pacientes la aparición de los anticuerpos es transitoria.
Otra de las posibles aplicaciones sería realizar una monitorización de los niveles para alcanzar una concentración adecuada de fármaco, sabiendo que se asocia a unas mejores tasas de remisión. El inconveniente es que, debido a la heterogeneidad de los estudios, no están validados los niveles de corte ni el momento más adecuado para realizar la medición. En los últimos años se han realizado varios estudios dirigidos a ello, entre los que se encuentra el TAXIT realizado por Vande Casteele et al. en 275 pacientes con EC y CU en remisión clínica, evaluando la utilidad del tratamiento individualizado con infliximab basado en la monitorización de los niveles, ajustando los mismos entre 3 y 7μg/ml en una fase de optimización, con una fase posterior de mantenimiento. En la fase de optimización se observó que los pacientes con niveles terapéuticos tenían menores cifras de PCR y menores niveles de ATI en comparación con los que tenían niveles infraterapéuticos. Los resultados de la fase de mantenimiento mostraron que los pacientes con terapia guiada por la clínica presentaron menor tasa de niveles terapéuticos de fármaco y mayores niveles de ATI comparados con la monitorización con niveles, sin diferencias en cuanto a la remisión clínica62,63. El mismo grupo ha realizado recientemente un estudio pendiente de publicar similar al TAXIT, valorando los aspectos clínicos de la terapia con infliximab en función de la evolución clínica o basada en los niveles de fármaco64. Se trata de un estudio aleatorizado que incluye 263 pacientes con EC y CU en remisión en tratamiento de mantenimiento con infliximab. En la primera fase (optimización) se alcanzan unos niveles de fármaco óptimos entre 3-7μg/ml (según el esquema TAXIT), aumentando o disminuyendo la dosis. Posteriormente en la fase de mantenimiento se aleatoriza a los pacientes a recibir infliximab según las características clínicas o los niveles de fármaco. Aunque no se observaron diferencias significativas en la remisión clínica al año (66 y 69% respectivamente; p=0,686), sí se encontraron en la tasa de recaída (17 y 7%, respectivamente; p=0,018). Por otro lado, en la fase de optimización se observó que en el grupo de pacientes que tenía niveles altos de fármaco, al reducir la dosis se produjo un ahorro del 28% del fármaco (p=0,001), sin existir diferencias importantes en el total de los costes tras la fase de mantenimiento comparando el grupo guiado por concentración de fármaco con el basado en la clínica (20.723 vs. 21.023€, respectivamente).
En relación con los aspectos económicos, hay 2 estudios de Steenholdt et al. en los que se ha visto que la modificación del tratamiento individualizada en función de los niveles de fármaco y anti-TNF es coste-efectiva65,66. Se evaluó a pacientes con fallo de tratamiento con infliximab que se aleatorizaron a intensificación o modificación en función de los niveles de fármaco y anticuerpos. No se observaron diferencias en cuanto a la respuesta ni remisión, pero los costes fueron significativamente menores en el grupo de actitud guiada por el algoritmo, con una reducción de un 31% en la población por intención de tratar (11.940 vs. 17.236 $; p=0,005). En el estudio de seguimiento la estrategia guiada por el algoritmo continuaba siendo coste-efectiva al año de tratamiento66.
En la mayor parte de los casos, la causa de la pérdida de respuesta suele ser secundaria a la presencia de anticuerpos neutralizantes o por niveles bajos de fármaco, pero también puede ser debida a vías con mecanismos inflamatorios diferentes o a ausencia de actividad relacionada con la EII67. El empleo de la monitorización de fármaco y anticuerpos puede suponer una nueva estrategia para modificar la actitud terapéutica.
Debido a la heterogeneidad en los estudios con utilización de diferentes técnicas y momentos de medición, no disponemos de ningún protocolo validado para la realización de una terapia guiada por la monitorización de los niveles. Actualmente hay varios estudios en proceso en este sentido, entre los que se encuentra el PREDICROHN, para valorar diferentes factores predictores de respuesta a corto y largo plazo en pacientes con EC, entre los que se están evaluando los niveles de anti-TNF y ATI.
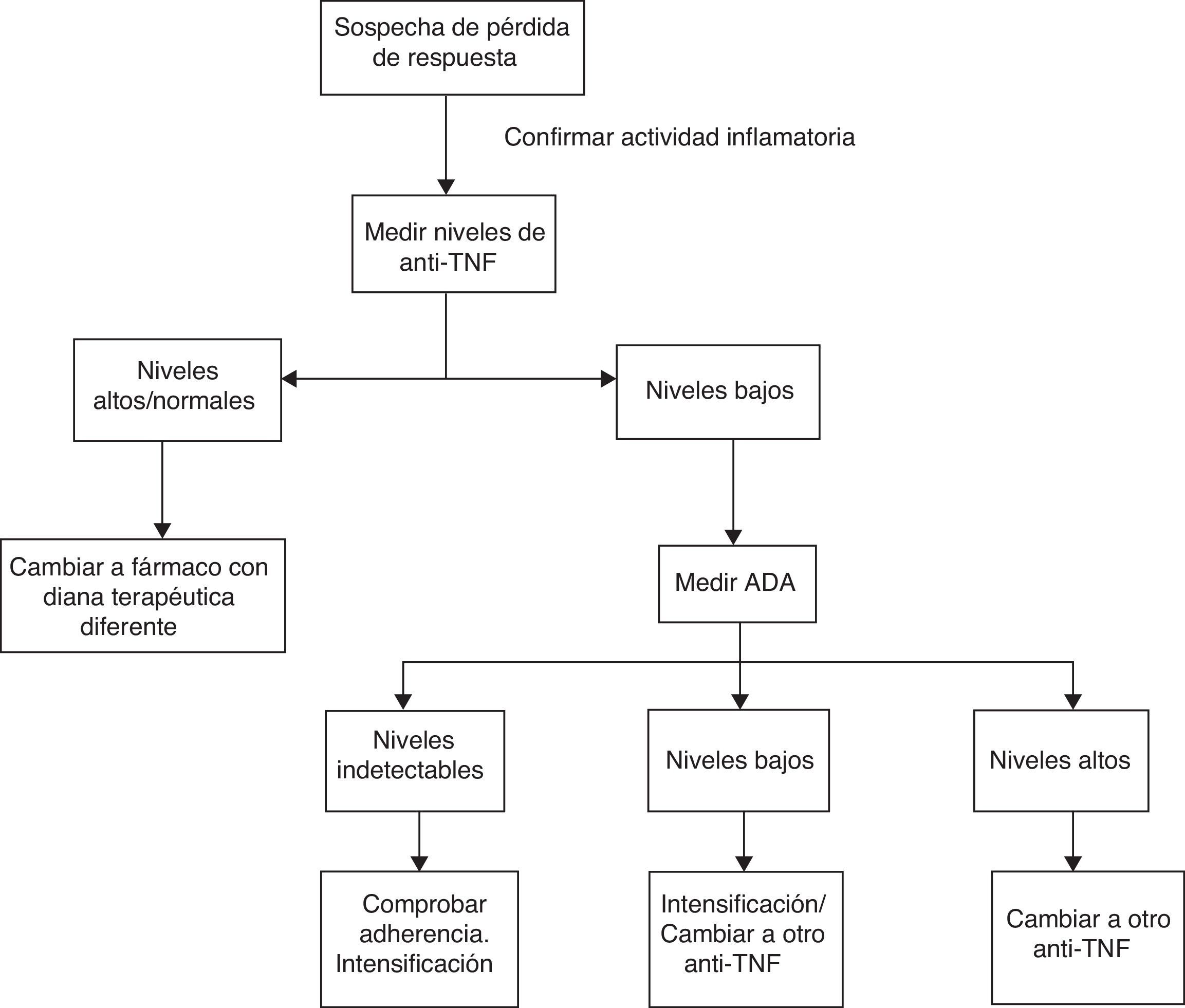
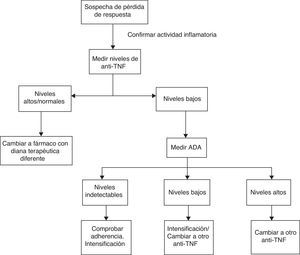
Teniendo en cuenta todos los estudios mencionados previamente, proponemos un algoritmo que se muestra en la figura 1. En primer lugar, ante la sospecha de pérdida de respuesta se debería confirmar que la clínica del paciente está relacionada con actividad de la EII y no con otros procesos intercurrentes (sobreinfección, síndrome de intestino irritable, estenosis, malabsorción de sales biliares, etc.) mediante la realización de estudios analíticos con parámetros bioquímicos y exploraciones endoscópicas. Una vez confirmada la actividad, se deben medir los niveles de fármaco. En función de los mismos podríamos encontrarnos las siguientes situaciones:
- 1.
Niveles supraterapéuticos/normales: es posible que en estos casos el mediador inflamatorio sea diferente al TNF. Deberíamos modificar el tratamiento por otro biológico con una diana terapéutica diferente.
- 2.
Niveles subterapéuticos de anti-TNF con niveles de ADA elevados: la mayoría de los pacientes no responden a la intensificación de tratamiento. Por ello, lo más adecuado sería realizar un cambio por otro anti-TNF.
- 3.
Niveles subterapéuticos de anti-TNF en ausencia de ADA: en primer lugar se debe asegurar una adecuada adherencia al tratamiento. Si es así, intensificar el fármaco.
En el momento actual existen muchas limitaciones para la utilización extendida de estos algoritmos debido a que los estudios realizados son muy heterogéneos, utilizando técnicas diferentes para la medición de los niveles, sin emplear los mismos criterios para definir la pérdida de respuesta. No se ha establecido claramente el momento adecuado para realizar la medición de los niveles, aunque en algunos estudios se propone realizarlo tras la inducción, a las 14 semanas o ante la sospecha de pérdida de respuesta. Además, hay que tener en cuenta que en algunos casos la presencia de ATI es transitoria sin estar relacionada con un deterioro clínico como se ha mencionado previamente, por lo que la presencia de los mismos se debe interpretar con cautela. Sin embargo, los resultados son esperanzadores por la posibilidad de optimizar los recursos, evitando el tratamiento e intensificación de dosis en pacientes con poca probabilidad de respuesta.
ConclusionesLos fármacos anti-TNF tienen un papel importante en el manejo de la EII, habiendo demostrado su eficacia en la inducción y mantenimiento de la remisión. Sin embargo, hay un grupo de pacientes que tienen ausencia o pérdida de respuesta a los mismos. Hasta el momento, habitualmente se realiza intensificación de la dosis de anti-TNF guiado por la clínica y por los parámetros bioquímicos. La utilización de la monitorización de los niveles de fármaco y de los anticuerpos podría emplearse para guiar la actitud terapéutica en esta situación. Esta estrategia podría implicar un uso más eficiente de los fármacos debido a una disminución de los costes, encontrando una mayor rentabilidad en aquellos casos en los que los niveles de fármaco son adecuados, puesto que la mayoría no responden a una intensificación de la dosis, evitando tratamientos innecesarios. No obstante, son necesarios más estudios para validar un algoritmo terapéutico que nos permita optimizar los recursos, ampliando el estudio con todos los fármacos anti-TNF así como en todo tipo de pacientes con EII.