El pioderma gangrenoso (PG) representa la segunda manifestación extraintestinal cutánea más frecuente de la enfermedad inflamatoria intestinal (EII) (1-3% de casos). Más frecuente en colitis ulcerosa (CU) (5-12%), que en enfermedad de Crohn (EC) (1-2%), 2 recientes trabajos multicéntricos retrospectivos italiano y español parecen señalar un cambio de tendencia1,2. La variante periestomal (PGP), es sin duda una de las complicaciones más temidas de cuantas afectan a un estoma quirúrgico. Probablemente infradiagnosticado, supone un 10-15% del total de localizaciones de pioderma. Su rápido reconocimiento es clave para implementar de forma precoz medidas terapéuticas en un contexto multidisciplinar. Notificamos un caso de difícil y peculiar manejo por un doble motivo: su gravedad y refractariedad, y la contextualización en un ámbito de neoplasia reciente que ocasionó un dilema terapéutico.
Mujer de 43 años de edad actual diagnosticada en 1993 de EC de localización colónica (afectación de recto y colon izquierdo) y perianal según criterios estandarizados (A2L2B1p). Desde el año 2000 inicia inmunosupresión con azatioprina por corticodependencia. A partir de 2004 la enfermedad perianal se torna compleja (fistula rectovaginal más varias fístulas transesfinterianas altas), por lo que a inicios de 2005 se asocia infliximab según pauta de inducción y mantenimiento habitual precisando intensificación máxima (acortamiento de intervalo a 4 semanas) a partir del segundo año de tratamiento. El tratamiento médico se combina con múltiples intervenciones quirúrgicas (drenaje de abscesos, sedalización de trayectos fistulosos y colgajos de avance para la fistula rectovaginal). La evolución no es satisfactoria con limitación severa de la calidad de vida, estenosis rectal y abscesos perianales de repetición. Es por ello, que a finales de 2012 se plantea a la paciente colostomía terminal definitiva y hemicolectomía izquierda con proctectomía por refractariedad a tratamiento médico-quirúrgico máximo (la colonoscopia con toma de biopsias de estenosis rectal de inicios de 2012 no demostraba neoplasia). La paciente no contempló en primera instancia dicha opción y prefirió agotar otras opciones solicitando inclusión en ensayo clínico de inyección intralesional de células madre. En la colonoscopia previa del protocolo de inclusión en dicho ensayo (junio 2013) se biopsia recto inferior con resultado histológico de adenocarcinoma.
A finales de julio de 2013 se realiza hemicolectomía izquierda y resección abdominoperineal con confección de colostomía definitiva con colon transverso distal presentando 2 complicaciones postoperatorias inmediatas: infección y dehiscencia parcial de las suturas perineal y de la pared vaginal. La pieza quirúrgica evidenciaba un segmento de intestino grueso con severa afectación por EC con extensa ulceración e inflamación transmural. A nivel rectal, adenocarcinoma moderadamente diferenciado de 2cm con componente mucinoso de más del 50% que infiltraba la capa muscular sin alcanzar grasa perirrectal. Los márgenes quirúrgicos no estaban afectos, así como ningún ganglio (pT2N0MX). La TC abdominopélvica no reveló afectación a distancia.
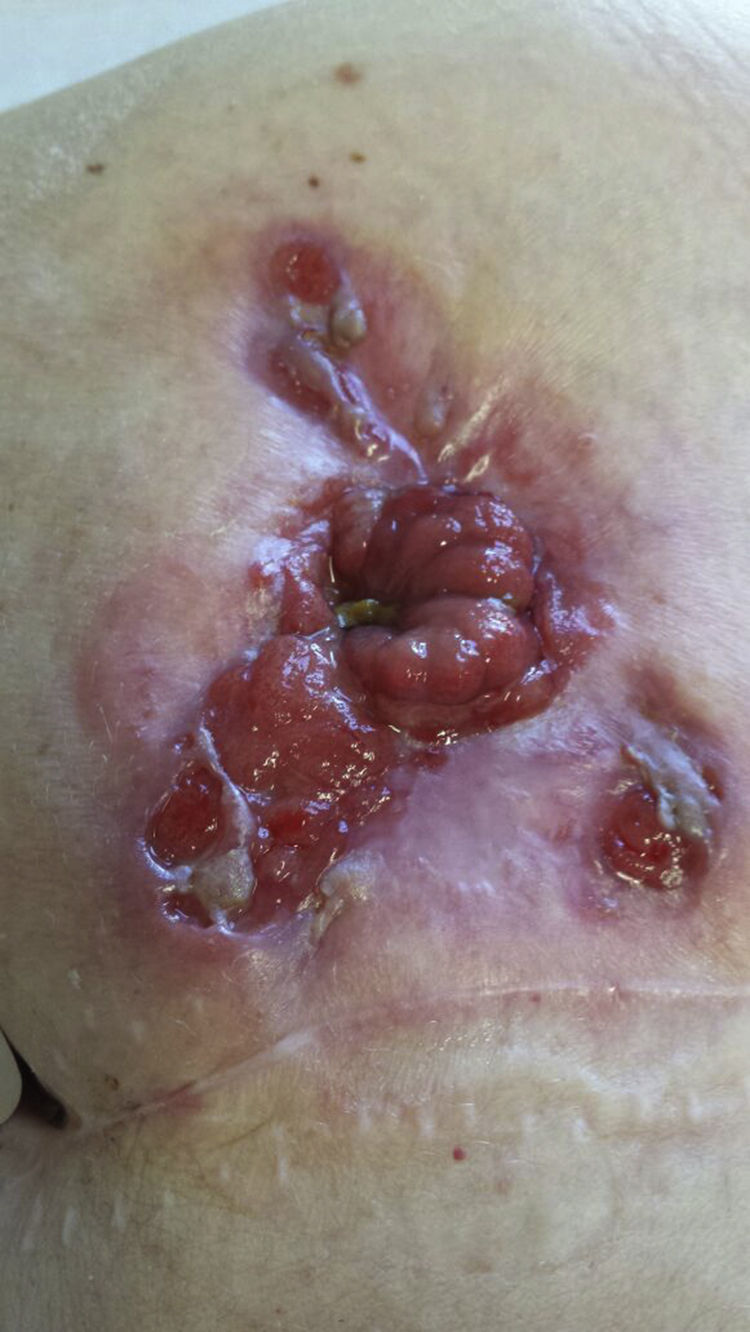
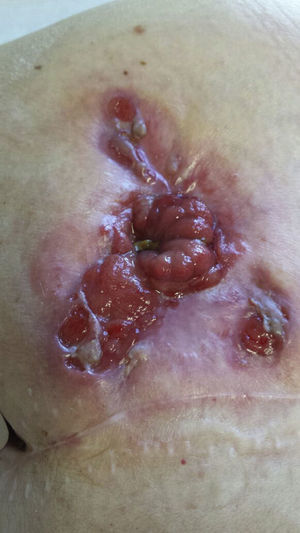
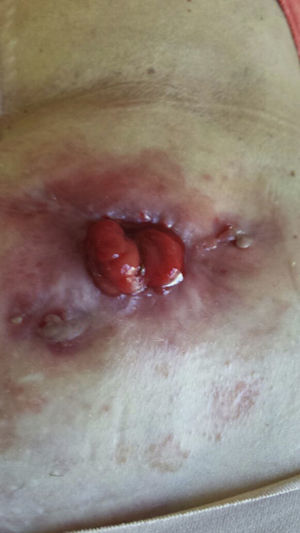
En septiembre de 2013 aparece lesión periestomal ulcerada de grandes dimensiones, de bordes violáceos y anfractuosos, que rodea en su totalidad al estoma provocando dolor local intenso, retracción y compromiso de su funcionalidad, compatible con PGP (fig. 1). Las biopsias de la lesión fueron compatibles con PGP y los cultivos tomados de la lesión negativos.
Tras la evaluación conjunta por dermatólogo, cirujano, estomaterapeuta y gastroenterólogo optamos por un manejo integral y secuencial.
Como parte importante del tratamiento, se atendió a la optimización del estado nutricional y control del dolor producido por el pioderma según escala de la OMS.
El manejo local en la unidad de estomaterapia consistió en la limpieza de ulceraciones con salino estéril bajo anestesia local, aplicación de agentes antibacterianos (peróxido de hidrógeno) y la colocación de apósitos absorbentes hidrocoloides (carboximetilcelulosa y película de poliuretano).
El tratamiento médico local se inició en octubre de 2013 con corticoides tópicos (clobetasol propionato 0,05%, 2 aplicaciones/día) objetivándose a las 2 semanas ausencia de mejoría de las lesiones, por lo que se cambió a tacrolimus tópico (pomada 0,3%, 2 aplicaciones/día). Tras un mes de tratamiento sin respuesta y con escasa tolerabilidad de la paciente se decidió iniciar tratamiento sistémico.
El tratamiento sistémico comenzó en diciembre de 2013 con corticoides orales a dosis de 1mg/kg/día durante un mes. Al no evidenciar mejoría clínica, iniciamos a mediados de enero 2014 ciclosporina oral a dosis de 5mg/kg/día junto con un descenso paulatino en la pauta de corticoides. En febrero de 2014 tras una respuesta muy discreta y transitoria del pioderma al tratamiento con ciclosporina oral se plantea como opción tratamiento biológico con infliximab.
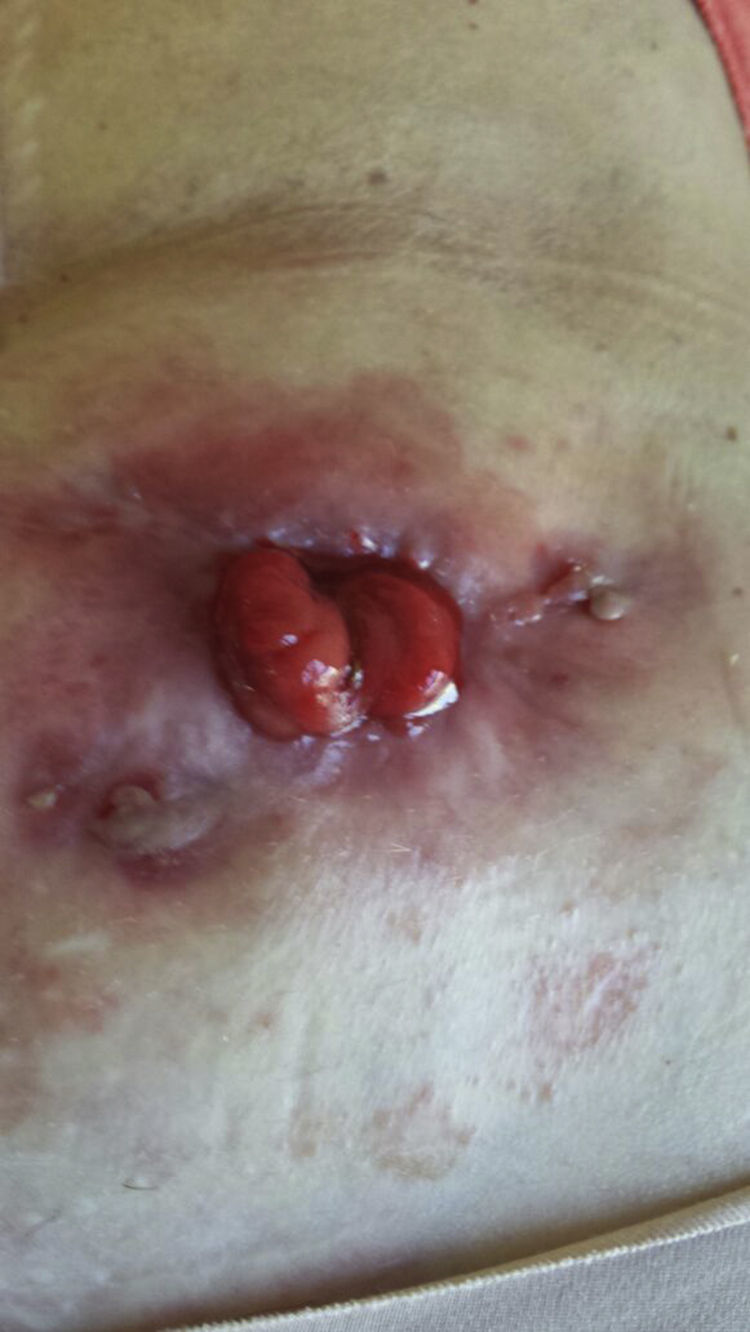
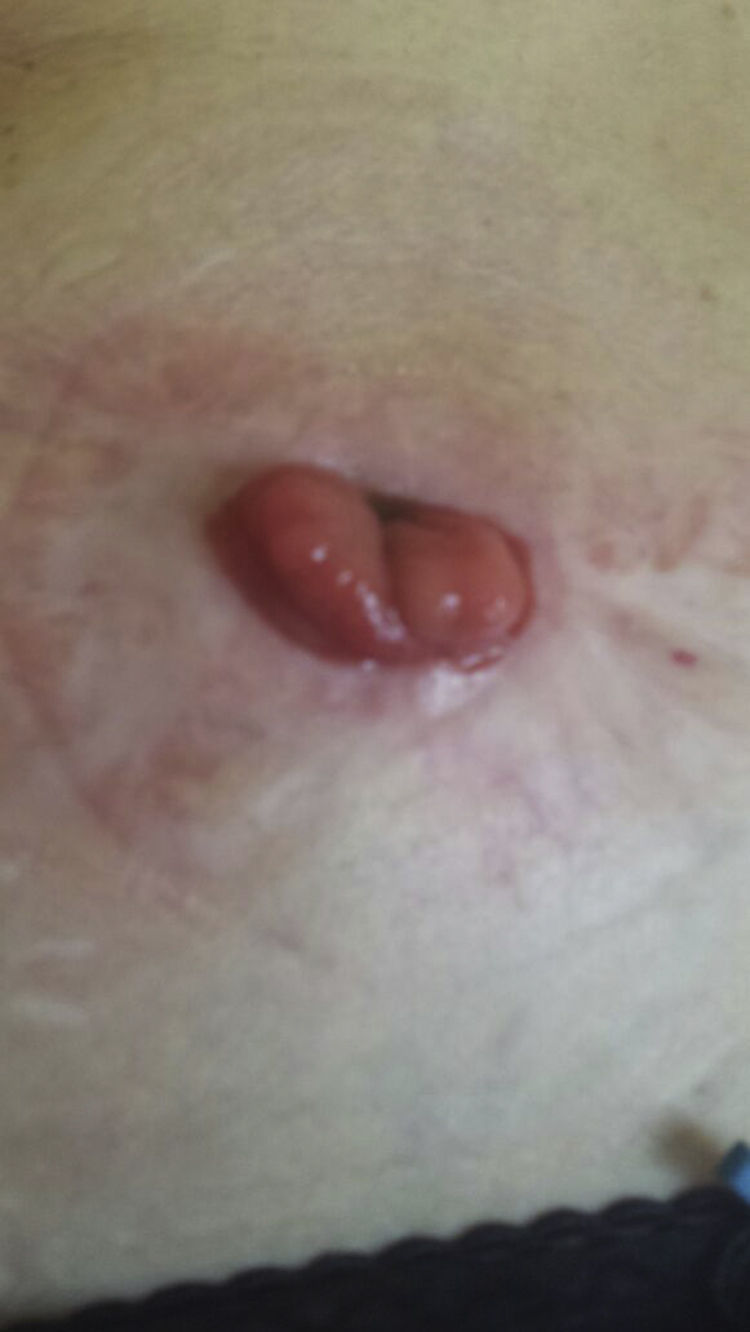
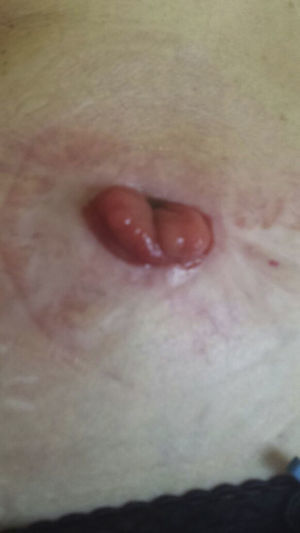
Tras consensuar con su oncólogo (adenocarcinoma rectal bien diferenciado estadio I) y la paciente (gran deterioro de la calidad de vida, importante impacto psíquico y compromiso del fracaso de la colostomía) se decide tratamiento con infliximab previa actualización de estudio previo anti-TNF alfa. Se informó a la paciente de la posibilidad potencial de recurrencia de la enfermedad oncológica y esta aceptó la relación beneficio-riesgo. Se introdujo infliximab a dosis habitual de 5mg/kg según esquema de inducción habitual (0, 2 y 6 semanas) observándose mejoría progresiva de la lesión hasta prácticamente desaparición tras la tercera infusión (fig. 2), decidiéndose tratamiento de mantenimiento cada 8 semanas durante 3 meses más, pudiendo retirar el tratamiento biológico y encontrándose sin lesiones a las 12 semanas de iniciar el tratamiento (fig. 3).
Como se indicó en la introducción, el PGP es una complicación invalidante, infrecuente y a menudo infradiagnosticada que exige una aproximación multidisciplinar. Se estima que afecta al 2-4,3% de pacientes con EII en los que se confecciona un estoma quirúrgico (en contraposición al 0,6% para estomas por todas las causas). De causa desconocida, una respuesta inmune alterada parece ser fundamental en su génesis. Afecta más al sexo femenino con una distribución etaria mayoritaria entre la segunda y quinta década. Aparece más en ileostomías (70%) frente a colostomías (30%); como es el caso de la paciente que presentamos). Su aparición sigue 2 patrones fundamentales: inmediato a la creación de la ostomía (dentro de la primera semana, más propio de la CU) y otro más subagudo en un período medio de 2 meses (más característico de la EC)3,4.
Si bien hay autores que señalan una frecuencia superior de la localización periestomal en EC sobre CU, no hay consenso sobre tal aseveración3,4.
El PGP no es patrimonio del estoma quirúrgico en el contexto de la EII, habiéndose descrito casos en neoplasias, diverticulitis o disfunciones neurológicas3,4. Un reciente estudio caso-control con una reducida muestra de pacientes con EII, ha señalado con las limitaciones del trabajo, que los factores de riesgo de aparición de PGP serían un IMC elevado, sexo femenino y otras alteraciones inmunes asociadas5. En nuestro caso coexisten la presencia de una EC y el sexo femenino.
El diagnóstico es fundamentalmente clínico (lesiones periestomales pustulares inicialmente, que se ulceran y se tornan dolorosas, de márgenes anfractuosos y eritemato-violáceos, con lechos necróticos que tienden a confluir). La histología no es imprescindible pero recomendable para la exclusión de otras entidades y se caracteriza por una infiltración masiva de neutrófilos sin infección microbiológica.
El tratamiento debe iniciarse con celeridad tras el diagnóstico, y engloba una vertiente de manejo general (control del dolor, del estado nutricional y corrección de anemia si existe), una local y otra sistémica debiendo ser llevado a cabo de forma multidisciplinar por gastroenterólogo, dermatólogo, cirujano y estomaterapeuta.
El aspecto local del tratamiento pasa por la limpieza y desbridamiento de las lesiones ulceradas, aplicación de dispositivos colectores adecuados y creación de un entorno que favorezca la aplicabilidad del tratamiento local que se decida.
Dentro de los tratamientos locales, son los corticoides tópicos los más utilizados mediante inyecciones intralesionales o apósitos oclusivos. Tacrolimus tópico parece ser superior a los corticoides en PGP de más agresividad y tamaño. En nuestro caso su aplicabilidad fue lastrada por el dolor intenso de la paciente a la manipulación. Salvo casos muy excepcionales no se recomienda reubicar el estoma por el elevado riesgo de reaparición.
En caso de refractariedad a las terapias locales y tópicas, curso rápido y agresivo de las lesiones, o actividad de la enfermedad subyacente hay que plantear tratamiento sistémico. No hay trabajos prospectivos de calidad para recomendar pautas establecidas de tratamiento sistémico. Los esteroides sistémicos son el tratamiento que en la literatura se ha mostrado efectivo con mayor consistencia en este contexto. Suelen emplearse a dosis de 1mg de prednisona/kg/día con reducción de la dosis cada 2 semanas. En caso de que se produzcan efectos secundarios no asumibles, corticodependencia o refractariedad al tratamiento se opta por agentes de segunda línea. La alternativa más usada en caso de refractariedad a esteroides es la ciclosporina a dosis de 3-5mg/kg/día durante un mes, habiendo demostrado su efectividad en casos aislados y pequeñas series de casos. Bien con la intención de ahorrar esteroides, bien en monoterapia otros inmunosupresores se han utilizado en el tratamiento de PGP: azatioprina, micofenolato mofetilo, dapsona, minociclina, metotrexato y talidomida con eficacia variable6–9.
Por último, las terapias biológicas se han añadido al arsenal terapéutico de esta entidad (mayoritariamente anti-TNF: infliximab, adalimumab, certolizumab y etanercept) y anecdóticamente se ha descrito efectividad de ustekinumab (anti-IL12 y anti-IL23)6–9.
En nuestro caso concurrían 2 hechos: la agresividad del pioderma periestomal con importante limitación de la calidad de vida y dolor crónico invalidante, y la neoplasia colorrectal recién diagnosticada y tratada. Por ello nuestra aproximación fue secuencial, intentando no recurrir al tratamiento biológico hasta al menos agotar el tratamiento local, los corticoides sistémicos y un inmunosupresor (ciclosporina). Hay una carencia de información en cuanto al período de ventana de seguridad hasta la reintroducción de un tratamiento biológico en tumores sólidos. Algunas sociedades hablan de 10 años libres de enfermedad10. Asimismo, y en los casos donde no existan otras alternativas terapéuticas, tampoco hay evidencia de calidad sobre la utilización del biológico en monoterapia o asociado a un inmunosupresor. En nuestro caso, dado el escaso periodo ventana desde el diagnóstico de la neoplasia hasta la introducción del biológico y la brevedad hasta la consecución de la respuesta, la asociación de un inmunomodulador no se planteó.