La reactivación de la infección por el VHB en pacientes con infección resuelta se detecta en pocas ocasiones, usualmente asociado a un tratamiento inmunosupresor y conlleva una morbilidad y mortalidad altas. Se ha publicado en la literatura médica algunos casos de reactivación de la infección por el VHB asociada al empleo de rituximab y nosotros presentamos otro paciente, con un linfoma no Hodgkin B, que tras recibir quimioterapia en combinación con rituximab sufrió una reactivación seguida de fallo hepático. Se revisa y comenta la literatura más reciente en relación a este tema.
Reactivation of hepatitis B virus infection in patients with resolved infection is rare and is usually associated with immunosuppressive therapy. Morbidity and mortality are high. Some cases of hepatitis B reactivation associated with the use of rituximab have previously been published. We present the case of a patient with B-cell non-Hodgkin lymphoma receiving combination chemotherapy with rituximab who showed hepatitis B reactivation followed by liver failure. The most recent literature on this topic is reviewed and discussed.
La reactivación de la infección por el virus de la hepatitis B (RHB) se define como la reaparición de una hepatopatía necroinflamatoria activa en una persona portadora inactiva de HBsAg o bien con una hepatitis B resuelta1. La reactivación en pacientes a los que se administra quimioterapia no está en cambio consensuada, pero desde un punto de vista práctico es útil considerarla si hay un aumento de los niveles séricos de ADN VHB mayor de 10 veces el valor basal, o bien se detecta ADN VHB en un paciente previamente negativo, habitualmente seguido de una elevación de ALT2–5.
La RHB en pacientes portadores VHB que muestran HBsAg positivo y que reciben quimioterapia o medicación inmunosupresora es un hecho bien conocido. La frecuencia de RHB en portadores HBsAg positivo que reciben quimioterapia por tumores sólidos, como por ejemplo el de mama, se ha calculado en torno al 20–40%, pero la tasa es mayor aún en enfermedades hematológicas malignas y receptores de transplante alogénico de progenitores hemopoyéticos, superando el 50%5,6–9.
Las manifestaciones clínicas de la reactivación abarcan un amplio espectro, desde cuadros anictéricos asintomáticos, o bien síntomas generales propios de una hepatitis (astenia, anorexia, náuseas), hasta un fallo hepático potencialmente mortal2,3. La aparición en un paciente HBsAg positivo de una RHB es una causa importante de morbilidad y mortalidad: por un lado, por la propia hepatitis y, por otro lado, porque suele requerir una interrupción prematura de la pauta de quimioterapia establecida por el oncólogo. Se ha estimado que la mortalidad asociada a la RHB oscila entre un 5–40%8,10.
El tratamiento de la RHB con antivirales es eficaz en pacientes que desarrollan un brote de hepatitis11. Pero hay argumentos para preferir la profilaxis de la reactivación por encima del tratamiento en todos los pacientes portadores HBsAg positivo12. La lamivudina es el antiviral con el que existe más experiencia. Su eficacia está bien establecida, la tasa de reactivación en un metaanálisis fue del 3–5% frente a un 40–50% en los controles, acompañando también un descenso de la mortalidad asociada a la hepatitis13. No hay estudios publicados con otros análogos de nucleósidos o nucleótidos. Las guías de las Asociaciones Europea y Americana del Hígado estimaron suficiente la lamivudina para los pacientes portadores HBsAg positivo con ADN VHB bajo, pero si fuera alto o la duración calculada superior al año, recomendaron otro análogo de nucleósido o nucleótido como entecavir o tenofovir, que tienen una alta potencia antiviral junto a una alta barrera genética1,14.
Hay poca información sobre la RHB en pacientes que se supone tienen una infección VHB pasada o resuelta, esto es, son HBsAg negativo, anti-HBc positivo y/o anti-HBs positivo. Aunque se considera que el VHB es aclarado totalmente durante una hepatitis aguda, a veces se ha detectado en suero muchos años después de que se hubiese curado la hepatitis, y a pesar de la presencia de anti-HBs en suero. Se cree que la persistencia de trazas de virus permite mantener la respuesta de los linfocitos T citotóxicos y mantener el virus bajo control, habitualmente de por vida15. El tratamiento inmunosupresor puede romper este equilibrio. En la RHB en estos casos se observa la aparición de HBsAg positivo y la detección de ADN VHB16.
Se describe a continuación el caso de un paciente con serología de infección VHB probablemente resuelta que sufrió una reactivación asociada al empleo de rituximab. Se revisa y comenta la literatura sobre el tema.
Observación clínicaHombre de 81 años que se diagnosticó de linfoma no Hodgkin B de bajo grado de la zona marginal en noviembre del 2008 tras la detección de múltiples adenopatías abdominales y torácicas. Los enzimas hepáticos eran normales. Recordaba un episodio autolimitado de ictericia mucocutánea a los 15 años de edad, pero siempre los análisis hepáticos fueron normales. El estudio viral fue el siguiente: HBsAg negativo, anti-HBs negativo, anti-HBc positivo, anti-HBc IgM negativo, HBeAg negativo, anti-HBe negativo y ADN VHB negativo (mediante PCR nested, sensibilidad 180UI/ml o 1.000copias/ml). El anti-VHC y anti-VIH fueron negativos. La ecografía y TC practicadas no detectaron alteración en el hígado.
Otros antecedentes personales fueron hipertensión arterial, dislipemia, hiperuricemia, bronquitis crónica, historia de úlcera duodenal, síndrome prostático e intervenciones de hernia inguinal y vesícula por litiasis. Recibía tratamiento crónico con lansoprazol, pravastatina, tamsulosina, furosemida, alopurinol e inhaladores.
Inició quimioterapia en noviembre de 2008, consistente en la pauta CVP-R (ciclofosfamida, vincristina, prednisona, rituximab) en 6 ciclos, alcanzando una respuesta parcial muy buena. En abril de 2009 recibió solo una dosis de rituximab. En este momento (4 meses después de iniciada la quimioterapia) los test hepáticos continuaban normales.
En mayo del 2009 se detectó alteración hepática: ALT 551UI/l, AST 440UI/l, FA 1.146UI/l, GGT 338UI/l, BT 2,2mg/dl, BD 1,58mg/dl. La serología de VHB fue la siguiente: HBsAg positivo, anti-HBs negativo, anti-HBc positivo, anti-HBc IgM negativo, HBeAg positivo, anti-HBe negativo. El ADN VHB fue positivo (PCR nested y branched ADN), en cuantía superior a 17.000.000UI/ml. El anti-VHA IgM y anti-VHC fueron negativos. Había recibido durante la quimioterapia una transfusión con 2 unidades de concentrados de hematíes y se estudió a los donantes, que resultaron de nuevo ADN VHB negativos en las siguientes donaciones. Inmediatamente tras el diagnóstico inició tratamiento con tenofovir, 300mg diarios.
Durante las semanas siguientes mantuvo una cifra de ALT en torno a 500UI/l y la bilirrubina fue progresivamente elevándose. En junio de 2009 ingresó por deterioro de su estado general, dolor abdominal y ascitis, comprobándose que tenía una peritonitis bacteriana espontánea. Destacaba también una hipoalbuminemia (3,3g/dl) y un descenso de la actividad de protrombina (63%), que fueron empeorando junto al estado general, desarrollando astenia muy marcada, alteración de la función renal, encefalopatía hepática y finalmente falleció en julio del 2009. Próximo al fallecimiento se recibió una determinación de ADN VHB, extraída cuando el paciente llevaba 2 meses de tratamiento con tenofovir, mostrando una reducción de la carga viral a 74.000UI/ml.
DiscusiónEl paciente presentado tenía una serología viral que es aceptada como indicativa de infección VHB resuelta, además el ADN VHB negativo indicaba que no estábamos ante una infección oculta. Asociado a la quimioterapia con rituximab desarrolló una RHB severa y murió a los 3 meses de un fallo hepático. El tratamiento con tenofovir fue iniciado precozmente y tiene interés reseñar que consiguió lo que se llama respuesta primaria (descenso del ADN VHB mayor de 1log10UI/ml a las 12 semanas), un efecto antiviral que desafortunadamente no se acompañó de eficacia clínica, pues la lesión hepática provocada por la reactivación condujo al fallo hepático y a la muerte.
La RHB es una situación clínica que cada vez está adquiriendo más relevancia por el empleo de medicación inmunosupresora potente en pacientes con procesos neoplásicos, y también cada vez más en patología no neoplásica, como por ejemplo en la enfermedad inflamatoria intestinal y el transplante de órganos. El mecanismo al que se atribuye la RHB está relacionado, primero, con un aumento de la replicación del VHB y de la expresión de sus antígenos en los hepatocitos durante la inmunosupresión, seguido de una destrucción de hepatocitos infectados mediada por linfocitos T durante la recuperación inmune. La intensidad de la replicación viral y el daño hepático subsiguiente parecen asociarse directamente con la potencia del tratamiento citotóxico o inmunosupresor17.
El rituximab se ha incorporado en los últimos años a la quimioterapia frente al linfoma no Hodgkin, mejorando los resultados. Se trata de un anticuerpo monoclonal anti-CD20, que es un antígeno expresado en muchos linfocitos B, incluyendo células linfomatosas B. Tiene una acción selectiva sobre los linfocitos B, induciendo una inmunosupresión específica sobre ellos, y además prolongada, pues puede durar tanto como un año. El control de la infección VHB, como se ha comentado arriba, se debe principalmente a los linfocitos T citotóxicos específicos de VHB, que destruyen los hepatocitos infectados, pero los linfocitos B son necesarios para la presentación de antígenos, por lo que una deficiencia de ellos (como sucede durante el tratamiento con rituximab) puede permitir al VHB escapar al control de los linfocitos T citotóxicos18.
En el año 2004, la FDA americana alertó respecto al peligro de disfunción hepática asociada al rituximab y efectivamente, se está describiendo un riesgo elevado de RHB en pacientes portadores HBsAg positivo que reciben rituximab19–21. Los corticoides actúan sobre el genoma del VHB facilitando la replicación, por tanto, aumentando los niveles de ADN VHB, y estos dos efectos sumados pueden explicar la mayor tasa de reactivación con los regímenes de tratamiento que contienen corticoides y rituximab.
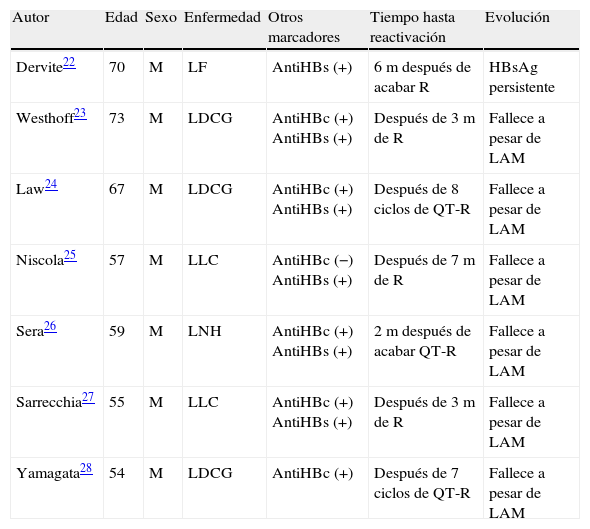
La RHB en pacientes HBsAg negativo es en general infrecuente, pero se han publicado varios casos que padecían enfermedades hematológicas, especialmente linfomas, y que habían recibido quimioterapia con rituximab22–28 (ver tabla 1). Sorprende que en 6 de los 7 pacientes publicados se desarrolló un fallo hepático que condujo al fallecimiento a pesar de iniciar tratamiento con lamivudina en el momento en que se detectó la reactivación. En una primera apreciación se podría considerar que los autores han comunicado los casos más llamativos, más graves y que la trascendencia de la RHB en estos pacientes HBsAg negativo puede estar sobrevalorada, además un final desgraciado quizás no represente la realidad.
RHB en pacientes HBsAg negativo con enfermedad hematológica asociado a rituximab
| Autor | Edad | Sexo | Enfermedad | Otros marcadores | Tiempo hasta reactivación | Evolución |
| Dervite22 | 70 | M | LF | AntiHBs (+) | 6m después de acabar R | HBsAg persistente |
| Westhoff23 | 73 | M | LDCG | AntiHBc (+) AntiHBs (+) | Después de 3m de R | Fallece a pesar de LAM |
| Law24 | 67 | M | LDCG | AntiHBc (+) AntiHBs (+) | Después de 8 ciclos de QT-R | Fallece a pesar de LAM |
| Niscola25 | 57 | M | LLC | AntiHBc (−) AntiHBs (+) | Después de 7m de R | Fallece a pesar de LAM |
| Sera26 | 59 | M | LNH | AntiHBc (+) AntiHBs (+) | 2m después de acabar QT-R | Fallece a pesar de LAM |
| Sarrecchia27 | 55 | M | LLC | AntiHBc (+) AntiHBs (+) | Después de 3m de R | Fallece a pesar de LAM |
| Yamagata28 | 54 | M | LDCG | AntiHBc (+) | Después de 7 ciclos de QT-R | Fallece a pesar de LAM |
LAM: lamivudina; LDCG: linfoma difuso de células grandes; LF: linfoma folicular; LLC: leucemia linfocítica crónica; LNH: linfoma no Hodgkin; QT-R: quimioterapia más rituximab; R: rituximab; RHB: reactivación de infección por virus de hepatitis B.
En un trabajo publicado recientemente se recogió la casuística de RHB en pacientes HBsAg negativo y anti-HBc positivo de numerosos centros, que consistió en 23 casos, 13 de ellos habían recibido tratamiento para un linfoma y en 9 pacientes el régimen de quimioterapia incluyó rituximab29. Recalcan los autores que de estas 9 reactivaciones asociadas a rituximab, 5 tuvieron un fallo hepático agudo y fallecieron, sin que un inicio precoz del tratamiento con lamivudina pudiera evitarlo.
Hay 2 publicaciones recientes que encuadran el problema desde otra perspectiva y revelan que la incorporación del rituximab al tratamiento del linfoma se asocia con el desarrollo de RHB. En una de ellas se estudiaron 244 pacientes con linfoma B que fueron HBsAg negativo y anti-HBc y/o anti-HBs positivo30. La frecuencia de RHB fue el 3,3%, pero si se examinan solo los pacientes que recibieron corticoides y rituximab la reactivación alcanzó el 12% (6 de 49). Tres pacientes sufrieron un fallo hepático agudo y uno falleció. En otra publicación se recogen 46 pacientes con linfoma B que eran HBsAg negativo y anti-HBc positivo y recibieron quimioterapia, un grupo con rituximab y otro grupo sin él31. Ningún paciente en el grupo sin rituximab tuvo reactivación, pero emergió en el 24% (5 de 21) de los que sí lo recibieron. Un paciente falleció de fallo hepático.
Las recomendaciones de las Asociaciones Europea y Americana del Hígado, ambas publicadas en el 2009, así como la de otros autores en pacientes HBsAg negativo con anti-HBc positivo y ADN VHB sérico indetectable es practicar controles de ALT y ADN VHB e iniciar tratamiento con un análogo de nucleósido o nucleótido solo si se detecta una reactivación1–4,14. La opinión de una reunión de expertos en EEUU fue que, aún en ausencia de información suficiente para recomendar la profilaxis, pero conociendo algunos casos de reactivación graves, el uso de un antiviral puede ser razonable, pero sin aportar más concreción32.
Nuestro caso, en el mismo sentido que los publicados, aporta información que creemos tiene interés. Primero, sabemos que la RHB en pacientes con linfoma e infección VHB probablemente resuelta que reciben un régimen de quimioterapia que incluye el rituximab es significativa, oscilando entre un 8–24%. Segundo, también sabemos que la probabilidad de que se desencadene un fallo hepático por este motivo es alta. Sin contabilizar las publicaciones de casos aislados, puede estar en torno al 30%, con fallecimiento en la mayoría de ellos. Y tercero, se percibe por las publicaciones que un comienzo rápido del tratamiento con lamivudina no consiguió bloquear el deterioro de la función hepática. Este aspecto ya era conocido en el caso del paciente HBsAg positivo, en el que la profilaxis es más eficaz que iniciar el tratamiento cuando se detecta ADN VHB en suero12.
De todo la anterior se puede inferir que en los pacientes HBsAg negativo y anti-HBc positivo con un mayor riesgo de reactivación, como es el caso de los tratados con corticoides y rituximab, la mejor opción puede ser realizar profilaxis con un antiviral. Esta decisión plantea varias controversias: en primer lugar, que supondría expandir la profilaxis a un número considerable de pacientes que atienden los hematólogos. Otra cuestión sería el fármaco a utilizar, pues aunque la lamivudina es un buen fármaco, de coste bajo y potente, plantea el problema de las resistencias. Sin embargo, en el uso como profilaxis en portadores HBsAg positivo la resistencia parece ser baja, el 3,3%, lejos del 32% en el primer año cuando se usa como tratamiento de la hepatitis crónica33. La duración de la profilaxis no está bien establecida en casos en que se use rituximab, pues aunque la recomendación actual es de 6 meses a 1 año1,14, otros sugieren prolongarla más tiempo5. Se ha planteado que se podría monitorizar las cifras de linfocitos CD20 y cuando estos alcanzasen su valor normal, sin que se detectase reactivación, podría suspenderse el antiviral, pero esta estrategia no se ha ensayado. Recientemente, el tratamiento de mantenimiento con rituximab está siendo incorporado al esquema de terapia del linfoma no Hodgkin de células B en un primer escalón, que lo recibirían entonces durante 2 años, con la consiguiente prolongación en el tiempo del riesgo de RHB. El entecavir y el tenofovir, con un coste superior, tienen ventajas potenciales sobre la lamivudina, derivadas de una mayor potencia antiviral y una alta barrera para la resistencia. En el caso de los pacientes HBsAg positivo con niveles altos de ADN VHB sérico o en los que se prevé una duración superior al año son de primera elección1,14, pero no hay experiencia de su uso como profilaxis de la reactivación en los pacientes HBsAg negativo y anti-HBc positivo.
Si en los pacientes HBsAg negativo y anti-HBc positivo se decide vigilancia con controles periódicos de serología VHB y ADN VHB en vez de profilaxis con un antiviral, se plantea un inconveniente, los intervalos de tiempo deben ser cortos porque en algunos casos publicados, como el nuestro, ha transcurrido poco tiempo entre la detección de la hepatitis y el fallo hepático, sin permitir que el antiviral consiga el efecto clínico deseado. Además, como en muchos centros la determinación de ADN VHB no se realiza y debe enviarse a un laboratorio de referencia, aumenta los costes de esta estrategia, sin entrar a considerar la demora en conocer los resultados de las determinaciones.
Probablemente, la RHB en pacientes HBsAg negativo y anti-HBc y/o anti-HBs positivo que reciben tratamiento con rituximab se va a convertir en un problema clínico común, por lo que se necesitan estudios con un mayor número de pacientes que nos permitan tomar una decisión bien sustentada en un futuro próximo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.