La budesonida oral es un glucocorticoide de acción fundamentalmente local. En la especialidad de Aparato Digestivo, se emplea sobre todo en la enfermedad inflamatoria intestinal, aunque también en otras indicaciones. Esta revisión aborda aspectos acerca de la farmacología, la farmacodinámica y el empleo terapéutico de la budesonida. Se contemplan sus indicaciones reconocidas y se especula acerca de otras situaciones en las que podría desempeñar un papel de interés, con el objeto de facilitar su uso y mejorar la exactitud de su prescripción.
Oral budesonide is a glucocorticoid of primarily local action. In the field of digestive diseases, it is used mainly in inflammatory bowel disease, but also in other indications. This review addresses the pharmacology, pharmacodynamics and therapeutic use of budesonide. Its approved indications are reviewed, as well as other clinical scenarios in which it could play a role, in order to facilitate its use and improve the accuracy of its prescription.
La budesonida (BUD) constituye la única alternativa farmacológica reconocida para el tratamiento de la enfermedad de Crohn (EC) ileal o ileocólica con actividad leve. A pesar de ello, desde los estudios controlados que permitieron su aprobación en esta indicación hace 2décadas, han sido relativamente escasas las publicaciones o las conferencias en cursos y congresos que se hayan centrado en actualizar su uso en la EC. Sus peculiaridades (indicación según localización y actividad inflamatoria de la enfermedad, esteroide con perfil de seguridad optimizado) la convierten en una rara avis dentro del arsenal terapéutico de la EC, más todavía en la era de los inmunosupresores (IS) selectivos. Por todo ello, en 2016, un grupo de expertos en EC nos reunimos con objeto de reevaluar el papel de la BUD en el manejo de la EC. En una segunda reunión celebrada en 2017, se decidió elaborar un documento que abordase distintos aspectos, tanto en relación con las indicaciones (aprobadas, sugeridas y potenciales) como con la forma de uso (dosis, pautas, uso de suplementos minerales y vitamínicos) de la BUD en la enfermedad inflamatoria intestinal (EII), que pudiese resultar de interés para la actualización de los gastroenterólogos.
El presente artículo tiene por objetivo revisar las características farmacológicas de la BUD y sus indicaciones aceptadas para el manejo de la EC, así como evaluar pautas y situaciones clínicas de uso potencial, desde el punto de vista de la evidencia disponible y la opinión de expertos.
Descripción y propiedades farmacológicas de la budesonidaLa BUD se considera el prototipo de los glucocorticoides de acción tópica de «segunda generación», caracterizados por una mayor potencia y una menor biodisponibilidad sistémica, y es el más estudiado en EII1. Ha demostrado una afinidad por el receptor de glucocorticoides 195 veces superior a la hidrocortisona y 15 veces superior a la prednisolona2,3, lo cual resulta en una equivalencia descrita de 5mg de BUD por 12mg de prednisolona4. Su rápida eliminación, gracias a un 90% de metabolismo hepático de primer paso, resulta en una baja biodisponibilidad sistémica que reduce sus efectos adversos (EA)5, algo que no ocurre en los pacientes que presentan un cortocircuito portosistémico, como, por ejemplo, aquellos con hipertensión portal. Sus metabolitos se excretan principalmente a través de la orina y, en menor medida, de las heces6-8.
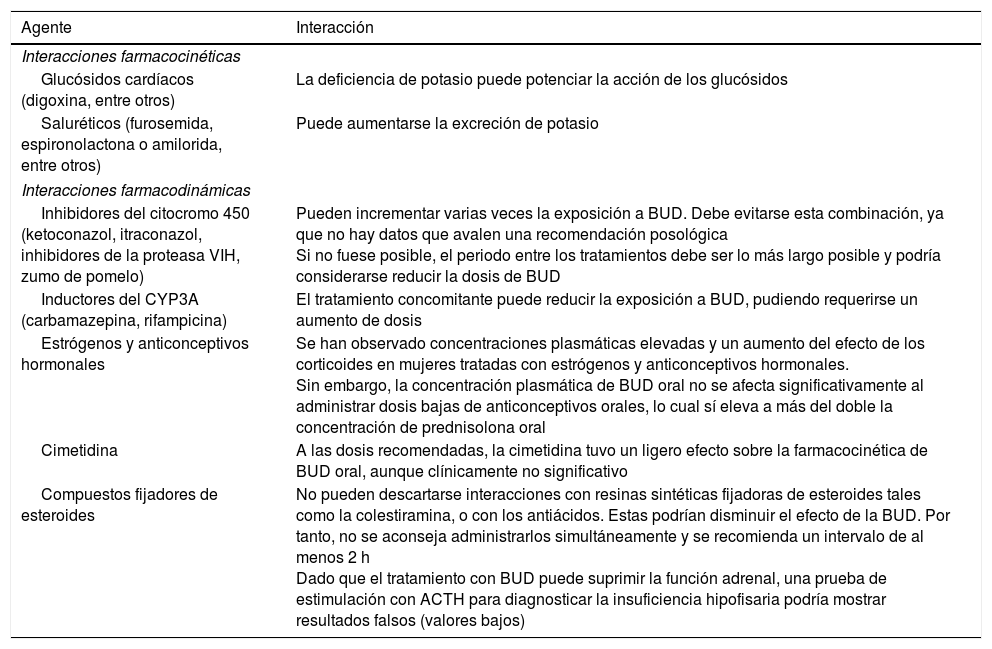
El metabolismo de la BUD, mediado principalmente por CYP3A4, puede verse afectado por diversos factores que interfieren en su aclaramiento y biodisponibilidad sistémica (tabla 1).
Interacciones farmacológicas descritas para la budesonida oral
| Agente | Interacción |
|---|---|
| Interacciones farmacocinéticas | |
| Glucósidos cardíacos (digoxina, entre otros) | La deficiencia de potasio puede potenciar la acción de los glucósidos |
| Saluréticos (furosemida, espironolactona o amilorida, entre otros) | Puede aumentarse la excreción de potasio |
| Interacciones farmacodinámicas | |
| Inhibidores del citocromo 450 (ketoconazol, itraconazol, inhibidores de la proteasa VIH, zumo de pomelo) | Pueden incrementar varias veces la exposición a BUD. Debe evitarse esta combinación, ya que no hay datos que avalen una recomendación posológica Si no fuese posible, el periodo entre los tratamientos debe ser lo más largo posible y podría considerarse reducir la dosis de BUD |
| Inductores del CYP3A (carbamazepina, rifampicina) | El tratamiento concomitante puede reducir la exposición a BUD, pudiendo requerirse un aumento de dosis |
| Estrógenos y anticonceptivos hormonales | Se han observado concentraciones plasmáticas elevadas y un aumento del efecto de los corticoides en mujeres tratadas con estrógenos y anticonceptivos hormonales. Sin embargo, la concentración plasmática de BUD oral no se afecta significativamente al administrar dosis bajas de anticonceptivos orales, lo cual sí eleva a más del doble la concentración de prednisolona oral |
| Cimetidina | A las dosis recomendadas, la cimetidina tuvo un ligero efecto sobre la farmacocinética de BUD oral, aunque clínicamente no significativo |
| Compuestos fijadores de esteroides | No pueden descartarse interacciones con resinas sintéticas fijadoras de esteroides tales como la colestiramina, o con los antiácidos. Estas podrían disminuir el efecto de la BUD. Por tanto, no se aconseja administrarlos simultáneamente y se recomienda un intervalo de al menos 2 h Dado que el tratamiento con BUD puede suprimir la función adrenal, una prueba de estimulación con ACTH para diagnosticar la insuficiencia hipofisaria podría mostrar resultados falsos (valores bajos) |
La BUD se encuentra disponible en distintas presentaciones que permiten su administración por vía nasal, oral o rectal9,10. En enfermedad digestiva, los comprimidos de liberación retardada y las formulaciones rectales se usan para tratar diversas enfermedades intestinales, incluyendo la EII y las colitis microscópicas, así como la hepatitis autoinmune. Los comprimidos bucodispersables están indicados para tratar la esofagitis eosinofílica9,10, aunque no están disponibles en España de momento.
La BUD está indicada para inducir la remisión en pacientes con EC leve o moderada que afecte al íleon, el colon ascendente o ambos. Cuenta para ello con una presentación en cápsulas de liberación modificada, en las que se encuentra protegida por un recubrimiento entérico (matriz de etilcelulosa) que se disuelve a pH> 5,57,8,11. De este modo, la mayor parte de la BUD (59-68%) se absorbe en el íleon y el ciego7,8,11. La dosis diaria recomendada para inducir la remisión en adultos es de 9mg, administrados en una única dosis matutina, durante un periodo de hasta 8 semanas, apreciándose su efecto completo en 2-4 semanas7,8. Existen 2presentaciones en España de BUD en esta indicación (Entocord® e Intestifalk®), que solo se diferencian en que el inicio de liberación de Entocord® es más proximal, aunque el pico de liberación de ambos es simultáneo, y en que Entocord® no lleva lactosa mientras que Intestifalk® sí7,8. La presentación de BUD en matriz MMX no está comercializada en España por el momento.
En la tabla 2 se resumen las recomendaciones existentes sobre el uso de BUD en las principales guías en EII12-18.
Recomendaciones de las guías sobre el uso de budesonida como tratamiento de inducción en la enfermedad inflamatoria intestinal (enfermedad de Crohn de localización ileal-ileocecal, colitis ulcerosa, proctitis ulcerosa)
| Guía | Recomendación/comentario |
|---|---|
| Guías adultos | |
| Guías EII British Society of Gastroenterology. Carter et al., 200412 | BUD presenta un beneficio terapéutico con menos toxicidad sistémica en EC ileocecal o CU BUD es algo menos eficaz que prednisolona, aunque es una opción adecuada para enfermedad colónica activa del íleon ascendente BUD 9 mg/día es adecuada en enfermedad ileocecal aislada y de actividad moderada, aunque algo menos eficaz que prednisolona (grado A) |
| Guías EC American College of Gastroenterology. Lichtenstein et al., 200913 | EC leve/moderada: BUD es más eficaz que mesalazina o que los esteroides convencionales (grado A). BUD (9 mg/día) es efectiva en casos de afectación ileal o colon derecho (grado A) Un ensayo clínico que analizó la combinación de ciprofloxacino (1 g/día) y metronidazol (1 g/día) añadidos a BUD (9 mg/día) no demostró beneficio adicional en los pacientes que recibieron antibióticos concomitantes, a pesar de observarse una «tendencia» en al análisis a posteriori a favor de la adición de antibióticos en pacientes con afectación colónica EC leve/moderada con afectación ileocólica o derecha: BUD 9 mg/día ha demostrado ser la mejor opción en cuanto a balance eficacia/seguridad a corto plazo en una serie de ensayos clínicos bien controlados. BUD es el tratamiento de 1.ª línea recomendado en estos pacientes |
| 3.er Consenso ECCO EC. Gomollón et al., 201614 | EC ileocecal leve: BUD oral es el tratamiento recomendado BUD 9 mg/día es el tratamiento preferente para inducir remisión en EC ileocecal leve, superior a placebo (RR 1,93; IC del 95%, 1,37-2,73). Aunque es inferior a los esteroides convencionales (RR 0,85; IC 95% 0,75–0,97), especialmente en enfermedad grave (CDAI> 300) (RR 0,52; IC del 95%, 0,28-0,95), presenta menos EA (RR 0,64; IC del 95%, 0,54-0,76) El 50-60% pacientes con EC ileocecal leve alcanzan remisión a las 8 semanas con BUD Un metaanálisis bayesiano ha confirmado que BUD es la opción preferente en EC ileocecal leve/moderada EC moderada: ni BUD ni prednisolona son apropiadas como tratamiento inicial de inducción. Prednisolona es muy eficaz, aunque con más EA que BUD. BUD 9mg ha demostrado un beneficio consistente en EC ileal/ileocólica activa, aunque es menos eficaz que prednisolona, especialmente en los casos graves La BUD de liberación ileal no es eficaz en EC colónica, a no ser que haya afectado primariamente al colon proximal. Se prefiere BUD a prednisolona en EC ileal/ileocecal BUD se sigue asociando a EA típicos de esteroides con una frecuencia inferior o similar a estos, aunque son menos graves que los de prednisolona. BUD reduce menos la densidad mineral ósea que prednisolona (media−1,04% vs.−3,84% durante 2 años en un ensayo aleatorizado con 272 pacientes, p=0,0084) |
| Consenso EII Pan American Crohn's and Colitis Organisation. Yamamoto-Furusho et al., 201715 | Se recomienda BUD 9 mg/día como tratamiento de 1.ª línea en EC leve ileocecal. Nivel de evidencia: 1a. Grado de acuerdo: 82% Tasa de remisión con BUD: 51-60% en 8-10 semanas Se ha demostrado que BUD es superior a placebo (RR 1,96; IC del 95%, 1,19-3,23) y mesalazina (RR 1,63; IC del 95%, 1,23-2,16). BUD es preferible a prednisolona por presentar menos EA (RR 0,64; IC del 95%, 0,28-0,95) BUD es una alternativa para los pacientes con reservoritis crónica (> 4 semanas) que no responden a antibióticos. Nivel de evidencia: 2. Grado de acuerdo: 91% En CU, está indicado el uso de BUD multimatriz (MMX) para inducir la remisión en CU leve o moderada de cualquier extensión que sea resistente a aminosalicilatos. Puede probarse esta opción antes de usar esteroides sistémicos. Nivel de evidencia: 1. Grado de acuerdo: 91% Estudios aleatorizados controlados con BUD MMX oral han demostrado una eficacia superior a placebo y similar a 5-ASA orales para inducir la remisión. Sin embargo, esto no se ha demostrado con otras presentaciones de BUD de liberación ileal, como Entocord® y Budenofalk®, cuya eficacia fue inferior a placebo y a los 5-ASA Respecto a los esteroides convencionales, BUD presenta menos EA sistémicos (33% vs. 55%) y no se ha asociado a una reducción significativa de la densidad mineral ósea Se sugieren los esteroides rectales como tratamiento de 2.ª línea para inducir la remisión completa en proctitis ulcerosa leve/moderada que no responde a 5-ASA tópicos. Nivel de evidencia: 1b. Grado de acuerdo: 91% |
| Consenso nacional francés EC. Peyrin-Biroulet et al., 201716 | Indicaciones en primera línea de tratamiento con BUD: a) EC con actividad leve; b) EC con actividad moderada no complicada sin factores de mal pronóstico. Definición de factores de mal pronóstico: daño gastrointestinal elevado, daño del intestino delgado, afectación ileal grave, afectación rectal grave, enfermedad perianal, lesiones graves endoscópicas (úlceras grandes o profundas) y edad juvenil al diagnóstico |
| Guías pediátricas | |
| Revisión sistemática EII pediátrica. British Society of Paediatric Gastroenterology, Hepatology, and Nutrition. Wilson et al., 201017 | Estudios: Levine 2003 (leve/moderada; 58% ileocecal, 27% ileocólica, 15% colitis; BUD 19, prednisolona 14): 9 mg/día BUD 8 semanas, seguida de reducción gradual 10 semanas. Resultados: remisión 12 semanas: BUD 47%, prednisolona 50%. EA: BUD 32%, prednisolona 71% (NS, p <0,05) Escher 2004 (EC ileal o colon ascendente; BUD 22-9mg 8 semanas, seguido de 6mg, prednisolona 1 mg/kg 4 semanas, seguido de reducción de dosis): finalizado prematuramente, con menos EA y mayores valores matutinos de cortisol con BUD. Resultados: remisión BUD 55%, prednisolona 71% Kundhal 2001 (EC: BUD 32, ileal 23, ileocecal 9): 9 mg/día BUD 8 semanas, seguidos de 6 mg/día. Sin tasa de remisión relevante Levine 2001 (EC leve/moderada sin excluir afectación colónica distal; BUD 62, prednisolona 58): 0,45mg BUD/kg/día, máximo 9 mg/día. Resultados: remisión BUD 48%, prednisolona 77%. Un caso de hipertensión craneal con BUD |
| BSPGHAN IBD Working Group. Kammermeier et al., 201618 | En EC ileocecal leve/moderada, BUD es una alternativa con menos EA típicos de los esteroides (máximo: 12 mg/día, reducción gradual de dosis 2–4 semanas) |
ACG: American College of Gastroenterology; BUD: budesonida; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; 5-ASA: ácido 5-aminosalicílico; RR: riesgo relativo.
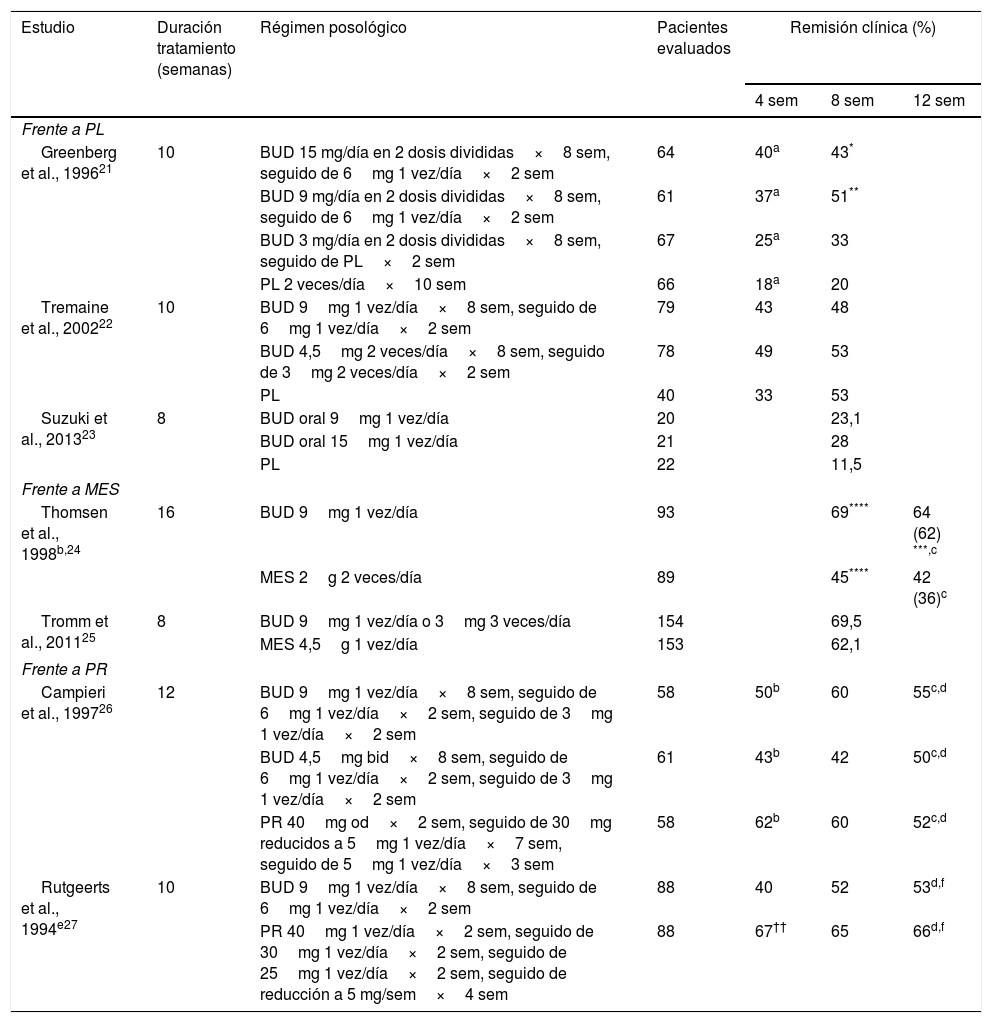
Diversos ensayos clínicos controlados han demostrado la eficacia de la BUD para inducir la remisión de la EC, donde se ha mostrado su superioridad frente a placebo y su equivalencia respecto a la prednisolona en el control de la EC de afectación ileal o ileocólica derecha y actividad leve o moderada6. Aunque su eficacia a corto plazo es menor que con los esteroides convencionales, particularmente en caso de enfermedad grave o afectación cólica más extensa, la probabilidad de EA y de supresión adrenal es menor con BUD19. Los principales estudios controlados de inducción de la remisión clínica en EC con BUD aparecen reflejados en la tabla 3.
Principales estudios controlados realizados con budesonida en adultos con enfermedad de Crohn
| Estudio | Duración tratamiento (semanas) | Régimen posológico | Pacientes evaluados | Remisión clínica (%) | ||
|---|---|---|---|---|---|---|
| 4 sem | 8 sem | 12 sem | ||||
| Frente a PL | ||||||
| Greenberg et al., 199621 | 10 | BUD 15 mg/día en 2 dosis divididas×8 sem, seguido de 6mg 1 vez/día×2 sem | 64 | 40a | 43* | |
| BUD 9 mg/día en 2 dosis divididas×8 sem, seguido de 6mg 1 vez/día×2 sem | 61 | 37a | 51** | |||
| BUD 3 mg/día en 2 dosis divididas×8 sem, seguido de PL×2 sem | 67 | 25a | 33 | |||
| PL 2 veces/día×10 sem | 66 | 18a | 20 | |||
| Tremaine et al., 200222 | 10 | BUD 9mg 1 vez/día×8 sem, seguido de 6mg 1 vez/día×2 sem | 79 | 43 | 48 | |
| BUD 4,5mg 2 veces/día×8 sem, seguido de 3mg 2 veces/día×2 sem | 78 | 49 | 53 | |||
| PL | 40 | 33 | 53 | |||
| Suzuki et al., 201323 | 8 | BUD oral 9mg 1 vez/día | 20 | 23,1 | ||
| BUD oral 15mg 1 vez/día | 21 | 28 | ||||
| PL | 22 | 11,5 | ||||
| Frente a MES | ||||||
| Thomsen et al., 1998b,24 | 16 | BUD 9mg 1 vez/día | 93 | 69**** | 64 (62) ***,c | |
| MES 2g 2 veces/día | 89 | 45**** | 42 (36)c | |||
| Tromm et al., 201125 | 8 | BUD 9mg 1 vez/día o 3mg 3 veces/día | 154 | 69,5 | ||
| MES 4,5g 1 vez/día | 153 | 62,1 | ||||
| Frente a PR | ||||||
| Campieri et al., 199726 | 12 | BUD 9mg 1 vez/día×8 sem, seguido de 6mg 1 vez/día×2 sem, seguido de 3mg 1 vez/día×2 sem | 58 | 50b | 60 | 55c,d |
| BUD 4,5mg bid×8 sem, seguido de 6mg 1 vez/día×2 sem, seguido de 3mg 1 vez/día×2 sem | 61 | 43b | 42 | 50c,d | ||
| PR 40mg od×2 sem, seguido de 30mg reducidos a 5mg 1 vez/día×7 sem, seguido de 5mg 1 vez/día×3 sem | 58 | 62b | 60 | 52c,d | ||
| Rutgeerts et al., 1994e27 | 10 | BUD 9mg 1 vez/día×8 sem, seguido de 6mg 1 vez/día×2 sem | 88 | 40 | 52 | 53d,f |
| PR 40mg 1 vez/día×2 sem, seguido de 30mg 1 vez/día×2 sem, seguido de 25mg 1 vez/día×2 sem, seguido de reducción a 5 mg/sem×4 sem | 88 | 67†† | 65 | 66d,f | ||
Localización en íleon o colon descendente, análisis por intención de tratar y tasas de remisión al final del tratamiento a no ser que se indique lo contrario. Remisión clínica definida como reducción del CDAI a ≤ 150.
BUD: budesonida; MES: mesalazina; PL: placebo; PR: prednisona; sem: semana.
Los glucocorticoides de administración sistémica se asocian a diversos EA, desde alteraciones estéticas como cara de luna llena, hirsutismo y acné, hasta alteraciones psíquicas (nerviosismo, insomnio) e incluso otras más permanentes y graves, como reducción de la velocidad de crecimiento, infecciones, hipertensión arterial, diabetes, osteoporosis y glaucoma28.
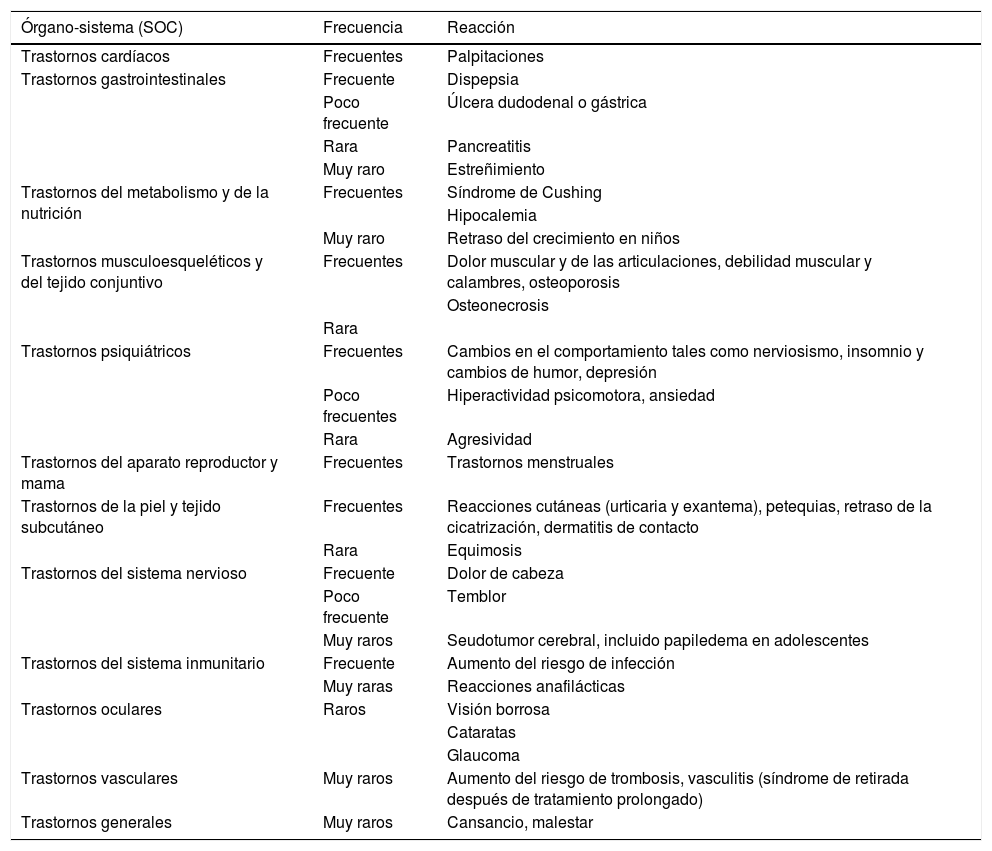
La BUD puede presentar efectos secundarios típicos de los glucocorticoides sistémicos (tabla 4). Sin embargo, la mayoría de los EA registrados en los ensayos clínicos fueron de intensidad leve a moderada y de carácter no grave. Con las cápsulas de liberación modificada de BUD, la frecuencia de EA asociados a los glucocorticoides se reduce aproximadamente a la mitad respecto a la prednisolona en dosis terapéuticamente equivalentes7. Además, la reducción de la densidad mineral ósea (DMO) parece ser menor con BUD que con prednisolona14,15.
Reacciones adversas descritas para budesonida oral en la indicación de enfermedad de Crohn
| Órgano-sistema (SOC) | Frecuencia | Reacción |
|---|---|---|
| Trastornos cardíacos | Frecuentes | Palpitaciones |
| Trastornos gastrointestinales | Frecuente | Dispepsia |
| Poco frecuente | Úlcera dudodenal o gástrica | |
| Rara | Pancreatitis | |
| Muy raro | Estreñimiento | |
| Trastornos del metabolismo y de la nutrición | Frecuentes | Síndrome de Cushing |
| Hipocalemia | ||
| Muy raro | Retraso del crecimiento en niños | |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Frecuentes | Dolor muscular y de las articulaciones, debilidad muscular y calambres, osteoporosis |
| Osteonecrosis | ||
| Rara | ||
| Trastornos psiquiátricos | Frecuentes | Cambios en el comportamiento tales como nerviosismo, insomnio y cambios de humor, depresión |
| Poco frecuentes | Hiperactividad psicomotora, ansiedad | |
| Rara | Agresividad | |
| Trastornos del aparato reproductor y mama | Frecuentes | Trastornos menstruales |
| Trastornos de la piel y tejido subcutáneo | Frecuentes | Reacciones cutáneas (urticaria y exantema), petequias, retraso de la cicatrización, dermatitis de contacto |
| Rara | Equimosis | |
| Trastornos del sistema nervioso | Frecuente | Dolor de cabeza |
| Poco frecuente | Temblor | |
| Muy raros | Seudotumor cerebral, incluido papiledema en adolescentes | |
| Trastornos del sistema inmunitario | Frecuente | Aumento del riesgo de infección |
| Muy raras | Reacciones anafilácticas | |
| Trastornos oculares | Raros | Visión borrosa |
| Cataratas | ||
| Glaucoma | ||
| Trastornos vasculares | Muy raros | Aumento del riesgo de trombosis, vasculitis (síndrome de retirada después de tratamiento prolongado) |
| Trastornos generales | Muy raros | Cansancio, malestar |
La eficacia y la seguridad demostradas por la BUD en las indicaciones clásicas establecidas incitan a explorar otras posibles utilidades del fármaco. A continuación, se exponen situaciones clínicas en las que podría plantearse su administración.
a. Alternativa o primera elección en situaciones especialesEl curso de la EC coincide en el tiempo con situaciones clínicas que pueden motivar cambios en el manejo habitual de la enfermedad, en las que la BUD puede cobrar relevancia. Una de estas es la existencia previa o actual de neoplasias. En pacientes con cáncer, clásicamente se ha tendido a evitar la administración de fármacos IS por su hipotético efecto negativo sobre la inmunovigilancia de los tumores y, por tanto, el mayor riesgo de facilitar su expansión o recidiva. Por este motivo, el uso de IS en pacientes con EII y neoplasia, actual o en los últimos 5 años, ha sido un tema intensamente debatido. En opinión de los expertos, en estos pacientes deberían evitarse los IS durante los primeros 2-5 años tras el diagnóstico de la neoplasia, aconsejándose en caso de actividad de la enfermedad su manejo con corticoides, nutrición enteral o aminosalicilatos29. En esta situación, la BUD presenta la ventaja de ser más eficaz que los aminosalicilatos y de poder administrarse de forma segura durante más tiempo que los corticoides clásicos30, por lo que debería constituir aquí la primera línea de tratamiento en EC ileal o ileocecal leve o de leve a moderada.
Más allá de los pacientes con neoplasia, existen otras situaciones especiales en las que la BUD constituye una alternativa muy atractiva. Es conocido que los IS y los corticoides clásicos incrementan el riesgo de infecciones y que este se halla aumentado en la tercera edad31. Por otra parte, la administración de IS y corticoides en edad pediátrica debe evitarse si no están claramente indicados, como puede ser en EC con actividad leve mantenida. Nuevamente, la BUD puede constituir una buena alternativa en estas circunstancias, ya que puede administrarse por periodos más prolongados que los corticoides clásicos y de forma mucho más segura.
Por último, aunque no existe mucha información sobre la administración de BUD oral durante el embarazo, tanto los datos disponibles con BUD inhalada como las guías ECCO, indican que constituye una buena alternativa en el tratamiento de la EC ileal activa durante la gestación32-34.
b. ReservoritisEn la colitis ulcerosa que precisa proctocolectomía total con reservorio ileoanal, la reservoritis aguda es la complicación más frecuente, pudiendo afectar a hasta la mitad de los pacientes 10años después de la cirugía35. El tratamiento inicial consiste en el uso de antibióticos pero, a pesar de ello, hasta un 15% de pacientes presentarán reservoritis crónica. Son escasos los estudios aleatorizados en esta situación, y en general la evidencia procede de series de casos (incluyendo la experiencia con anti-TNF). Las opciones farmacológicas siguen siendo pues limitadas para esta complicación. No existen prácticamente fármacos que hayan demostrado eficacia en ensayos clínicos excepto el probiótico VSL#3® para prevención de nuevos episodios, que no está financiado por el sistema nacional de salud.
La evidencia inicial sobre el uso de BUD oral en la reservoritis proviene de una pequeña serie de pacientes, de los que un 60% obtuvieron una respuesta clínica favorable36. Dos estudios posteriores confirmaron su eficacia; el uso de 9mg durante 8 semanas en la reservoritis refractaria al tratamiento con antibióticos alcanzó una tasa de remisión clínica y endoscópica del 75-80%37,38. En un grupo de pacientes con reservoritis y colangitis esclerosante primaria asociada también se observó una tasa de remisión endoscópica del 72%, aunque sin influencia sobre las pruebas de función hepática39. Un aspecto a destacar de todas las series es la baja tasa de EA relacionados con este tratamiento.
Queda por definir si la aplicación tópica del fármaco pudiera ser más adecuada y eficaz en este contexto, o incluso si podría plantearse un tratamiento combinado oral y rectal.
c. «Puente» hacia fármacos de inicio de acción lentoSe sabe que determinados fármacos como los IS tiopurínicos presentan un mecanismo de acción lento40, por lo que deben transcurrir 2-3 meses antes de valorar su efectividad. También es conocida esta situación con nuevos fármacos como vedolizumab, especialmente en EC donde se contempla la posibilidad de una administración adicional, tras la estándar de semanas 0, 2 y 6, si el paciente mejora parcialmente, en la semana 10. El inicio de un ciclo de BUD conjuntamente con estos fármacos podría mejorar los síntomas de forma segura, a la espera de que estos fármacos inicien su efecto, en la localización indicada y siempre que el brote no sea grave.
d. Alternativa a la intensificación de agentes biológicosEn los pacientes afectados de EC ileal o ileocecal que estén recibiendo tratamiento biológico con fármacos anti-TNF, podría plantearse el uso de BUD ante la pérdida de respuesta secundaria a los mismos. Un metaanálisis reciente concluye que un tercio de los respondedores a anti-TNF pierden respuesta con el tiempo41. En esta situación no existe consenso sobre la alternativa más eficaz. Habitualmente, se suele acortar el intervalo de administración o doblar la dosis de anti-TNF. También se ha sugerido que la asociación de un IS puede recuperar la respuesta al disminuir la formación de anticuerpos frente a fármacos anti-TNF y recientemente se han explorado estos mecanismos de sinergia entre tiopurinas e infliximab42. Por último, se ha planteado la posibilidad de realizar la reinducción con anti-TNF y el mantenimiento con la pauta previa43. Sin embargo, una opción no explorada sería intentar recuperar la respuesta con la administración temporal de BUD si la localización de la enfermedad lo permite. Por último, la adición temporal de BUD podría proporcionar rapidez de acción mientras consideramos intensificar el tratamiento o cambiar de agente biológico, particularmente si el paciente presenta actividad leve o leve-moderada.
e. Profilaxis de la recurrencia posquirúrgicaA pesar de que la BUD no se incluye habitualmente como alternativa en las guías clínicas y de que una revisión sistemática reciente44 concluyó que no reduce el riesgo de recurrencia endoscópica posquirúrgica de la EC (RR 0,86; IC del 95%, 0,61-1,22), también es cierto que una revisión Cochrane consideró que no se dispone de ensayos suficientes para alcanzar conclusiones sólidas sobre su utilidad en esta indicación. Se requiere, por tanto, un análisis cuidadoso de los ensayos clínicos existentes. En un primer estudio, de calidad óptima, doble ciego, aleatorizado y controlado45, se incluyó a 129 pacientes con resección ileocólica por actividad inflamatoria o complicación obstructiva, pero no por complicación perforante. Se administraron 6mg de BUD de liberación ileal controlada o placebo. La variable principal de evaluación (recurrencia endoscópica definida por un índice de Rutgeerts≥ i1) al año de la cirugía fue similar en ambos grupos (BUD 52% y placebo 58%). Al analizar solo los pacientes operados por actividad inflamatoria persistente, la recurrencia endoscópica al año fue menor en el grupo que recibió BUD (32% vs. 65%; p <0,047). En un segundo estudio46, con un diseño menos adecuado, se incluyó a 83 pacientes, tratados con 3mg diarios de BUD o placebo. La tasa de recurrencia endoscópica o clínica al año fue del 57% en el grupo tratado frente al 70% en el control (n. s.). Por tanto, los estudios incluyeron una población de riesgo medio o bajo de recurrencia, el tamaño muestral fue insuficiente y la dosis, probablemente, inadecuada. Sin embargo, algunos datos sugieren cierta eficacia en algunos subgrupos de pacientes. De todas formas, el uso de BUD no debería plantearse a largo plazo (como requiere la profilaxis de la recurrencia posquirúrgica) y, por tanto, su uso debería solo proponerse como tratamiento adicional (como ocurre con los fármacos imidazólicos).
f. Ileostomía de alto débito y enteropatía pierde-proteínasSe ha comunicado que la BUD puede ser eficaz en el tratamiento de pacientes operados por EC con ileostomía de alto débito47,48. Los mecanismos implicados no estarían ligados al efecto antiinflamatorio, sino al aumento de la absorción neta de agua47,48. Como es improbable que se realicen estudios aleatorizados en esta indicación, afortunadamente poco frecuente, conviene recordar este posible uso en estos pacientes cuya situación es difícil de manejar.
Asimismo, la BUD ha sido empleada con éxito en el tratamiento de la enteropatía pierde-proteínas asociada a la corrección de cardiopatías congénitas mediante la intervención de Fontán49.
g. Localizaciones distintas de la ilealSe desconoce si la BUD puede ser eficaz en localizaciones diferentes a la ileal. Dada su seguridad, podría plantearse en localizaciones yeyunales antes de la escalada terapéutica que puede suponer el tratamiento del brote en una EC de localización proximal, siempre de que se trate de lesiones no complicadas y de extensión limitada.
Aspectos controvertidos sobre el uso de la budesonidaa. ¿Existe la dependencia de budesonida en la enfermedad de Crohn?La dependencia de esteroides, situación clínica frecuente en la EII, se caracteriza por una recaída de los síntomas al reducir la dosis de esteroides o poco después de haberla suspendido en pacientes que inicialmente responden a estos fármacos. Ello hace necesario aumentar la dosis o reinstaurar el tratamiento para mantener la remisión. Una remisión sin esteroides es objetivo obligado en el tratamiento de la EII, dado que sus EA impiden su uso como terapia de mantenimiento a largo plazo14.
Aunque se ha propuesto el empleo de BUD en este contexto50,51, las tiopurinas cuentan con una evidencia muy sólida como primera línea terapéutica, puesto que evitan el uso de esteroides para mantener la remisión a largo plazo. Por otro lado, la dependencia de esteroides en EC se ha asociado a casos de afectación cólica y hábito tabáquico52. Además, se ha descrito una posible asociación entre los polimorfismos de los genes IL10 y ABCB1 (que codifica un transportador implicado en el metabolismo de esteroides) con la dependencia de esteroides en EC53.
Queda por determinar si la dependencia de BUD comparte características epidemiológicas y clínicas con la dependencia convencional de esteroides. Aunque parece ser común, ningún estudio hasta la fecha ha evaluado específicamente este aspecto. Los ensayos que abordan la eficacia de la BUD para inducir la remisión de la EC tienen un seguimiento inferior a 12 semanas22,26,27,54 y los principales ensayos de mantenimiento y cohortes de la vida real analizaron el efecto de dosis fijas de BUD durante un año54-56 o compararon pautas posológicas de BUD sin retirada gradual de la dosis21,57-61. En ninguno de ellos se describe la dependencia de BUD.
Podría estimarse la magnitud del problema a partir de aquellos pacientes tratados con las dosis más bajas de BUD que recayeron a los 3 o 6 meses en los ensayos de mantenimiento. Sin embargo, la heterogeneidad de estos ensayos (diferentes dosis usadas para la inducción, determinación en distintos puntos temporales) hace difícil precisar la frecuencia de dependencia de BUD. Sirve también como estimación indirecta que las tasas de recaída sean más altas en pacientes tratados con 3mg/día en comparación con aquellos tratados con 6mg/día. De igual modo, aunque no se han publicado cifras de dependencia de BUD en pacientes con hepatitis autoinmune y colitis microscópica, esta podría ocurrir hasta en un 60% de los pacientes con colitis microscópica tratados con este fármaco62,63.
Tampoco los estudios publicados abordan el tratamiento de pacientes con EC dependientes de BUD, por lo que las guías de práctica clínica no hacen recomendaciones específicas. En el entorno clínico, los pacientes con dependencia de BUD se tratan con esteroides convencionales o IS. Pero debe tenerse en cuenta que los esteroides convencionales (prednisona, metilprednisolona) solo han demostrado ser algo más efectivos que la BUD en los ensayos comparativos directos, incluso sin mostrar diferencias en los pacientes con baja actividad de la enfermedad64,65. Por tanto, es tentador especular que, en la dependencia de BUD, el valor añadido de los esteroides convencionales no sea significativo. Además, es posible que los mecanismos fisiopatológicos de resistencia y dependencia de la BUD coincidan con los de los esteroides clásicos.
Por otra parte, las guías ECCO recomiendan que los pacientes con recaída precoz (y podríamos incluir aquí aquellos con dependencia de BUD) inicien un tratamiento inmunomodulador14 para controlar la actividad de la enfermedad a largo plazo. Aunque un subgrupo de pacientes leves con L1-B1 (fenotipo ileal e inflamatorio) de la clasificación de Montreal no necesitará tratamiento de mantenimiento a corto/medio plazo tras un primer ciclo de BUD para inducir la remisión, la dependencia de este fármaco podría anticipar la necesidad de un tratamiento de mantenimiento a largo plazo. En cualquier caso, y aunque no se ha evaluado esta estrategia, el uso de BUD en pacientes con dependencia de esteroides clásicos, teniendo en cuenta su mejor perfil de seguridad, podría permitir una retirada gradual hasta que las tiopurinas alcancen su efecto.
b. ¿Puede ser útil una dosis superior a 9mg de budesonida?Los datos actualizados del metaanálisis Cochrane de referencia19 y las recomendaciones de las guías de práctica clínica y consensos1,16,17,66 confirman la práctica clínica habitual de que, en EC ileal o ileocólica leve o leve-moderada, BUD 9mg/día constituye la dosis de inducción de la remisión que ofrece un mayor beneficio sin asociarse a EA o complicaciones clínicas relevantes, sin diferencias respecto a placebo y menores que con prednisolona.
La eficacia clínica de dosis elevadas de BUD para inducir la remisión ha sido explorada en pocos ensayos aleatorizados y no se contempla en las guías de adultos. El estudio de Greenberg de 199454 es el único incluido en el metaanálisis Cochrane que analiza este aspecto. Está realizado en 258 pacientes con enfermedad ileal o ileocólica con extensión no más allá de la mitad del colon transverso y compara 3 dosis distintas (9, 6 y 3mg/día) de BUD de liberación controlada frente a placebo. Después de 8 semanas, la mejor tasa de remisión se consiguió en el grupo de 9mg (51%), aunque sin diferencias estadísticas respecto a la de 15mg (43%). Se observó una reducción dependiente de dosis del cortisol basal y del estimulado con corticotropina, aunque sin toxicidad clínica relevante con ninguna de las dosis. Del mismo modo, en 2013 Suzuki et al.23, al comparar en 77 pacientes la dosis de 9mg y 15mg, no hallaron diferencias en las tasas de remisión a las 8 semanas (el 23 y el 25%, respectivamente), aunque observaron tasas superiores de supresión del eje adrenal y de EA con la dosis de 15mg. Irvine et al., en 200067, tampoco hallaron diferencias en un estudio dirigido a valorar la calidad de vida en EC ileal o ileocecal. En un metaanálisis en red publicado recientemente, se observó la similitud de respuesta frente a placebo según dosis entre las dosis de 15 y 18mg/día (OR 3,28; IC: 1,4-7,5) vs. 9mg/día (2,93; IC 1,5-5,4)30.
Sin embargo, Herfarth et al., en un estudio realizado en 2004 con BUD de liberación dependiente del pH59 en EC ileocólica (inclusión no restrictiva de pacientes respecto a la actividad o extensión cólica), diseñado para comparar dosis de 6, 9 y 18mg con evaluación a las 6 semanas, encontraron tasas de remisión clínica dependiente de dosis del 36, el 55 y el 66%, respectivamente. Además, aunque consideraron que la dosis de 9mg fue suficiente en la mayoría de los pacientes, un subanálisis reveló una mejor respuesta con la dosis de 18mg frente a la estándar de 9mg en aquellos pacientes con mayor actividad (CDAI≥ 300) o con enfermedad ileocólica con manifestación distal a colon transverso. Estos resultados son similares a los hallados en un estudio pediátrico68 que incluyó también a pacientes sin exclusión de afectación cólica. Una dosis de inducción con 12mg durante el primer mes, seguida de una pauta estándar de 9mg, logró un descenso de la proteína C reactiva y una remisión significativamente mayor.
Las dosis superiores a 9mg se referencian únicamente en la reciente guía BSPGHAN pediátrica de 201618, que recomienda tratar la EC ileal o ileocólica con BUD en formas leve/moderada «en dosis máximas de 12mg/día, con un descenso de dosis en 2-4 semanas». La guía no comenta la evidencia en que se sustenta para incluir dosis superiores a 9mg.
La dosis de 12mg podría tener su nicho terapéutico y quizás ser explorada con mayor profundidad en nuevos estudios. Sería relevante en situaciones clínicas de actividad moderada en que se desee evitar el uso de corticoides por vía oral por cualquier motivo. Hay que considerar que la BUD reduce, de forma lineal dependiente de dosis, las concentraciones basal y estimulada de cortisol, y que el porcentaje de pacientes con efectos tóxicos se incrementa con dosis superiores a 9mg. No es previsible que la dosis de 12mg durante 4-8 semanas cause un perjuicio clínico significativo respecto a la de 9mg, ya que este no se ha asociado a dosis de 15-18mg. De todos modos, sería aconsejable realizar una vigilancia más estrecha de cada paciente, junto con una profilaxis de la pérdida ósea con calcio y vitamina D.
c. Pauta descendente de la budesonidaLa dosis estándar de 9mg de BUD durante 2 meses raramente suprime el eje adrenal-hipofisario, con escasa frecuencia de manifestaciones clínicas de hipercorticismo, y no parece asociarse a efectos de supresión de retirada brusca de esteroides19,65. No se conocen estudios que establezcan que una retirada progresiva sea preferible para evitar EA19,65. En estudios de seguridad en mantenimiento de hasta un año, no se han observado perjuicios significativos frente a placebo. Solo se han descrito casos de síndrome de retirada corticoidea brusca asociados al tratamiento prolongado con BUD69.
Tras alcanzar la remisión con una dosis estándar de 9mg/día durante 8 semanas, las guías y los consensos no coinciden en la necesidad ni en una pauta descendente específica para evitar posibles EA asociados a la retirada brusca. Esta ambigüedad se refleja en una práctica clínica variable. Por otro lado, se sabe que la farmacocinética de la BUD es proporcional en dosis entre 3 y 15mg (rangos de uso clínico) y que presenta una baja biodisponibilidad sistémica que minimiza EA respecto a los producidos por los corticoides sistémicos70. Sin embargo, la biodisponibilidad de la BUD se sitúa en un rango relativamente amplio (9-21%)70 y aumenta en caso de condicionantes como la ingesta de zumo de pomelo y fármacos inhibidores del citocromo CYPA3, o en pacientes con cirrosis. La supresión del cortisol plasmático a los 5 días de tratamiento (área bajo la curva) es significativa con BUD 9mg (45%), aunque menor que con prednisona 20mg (78%)10. También está claro que la supresión del eje adrenal ya ocurre con dosis bajas de 3 y 6mg, y se observa un efecto lineal dependiente de dosis que puede ser clínicamente significativo a partir de 9mg.
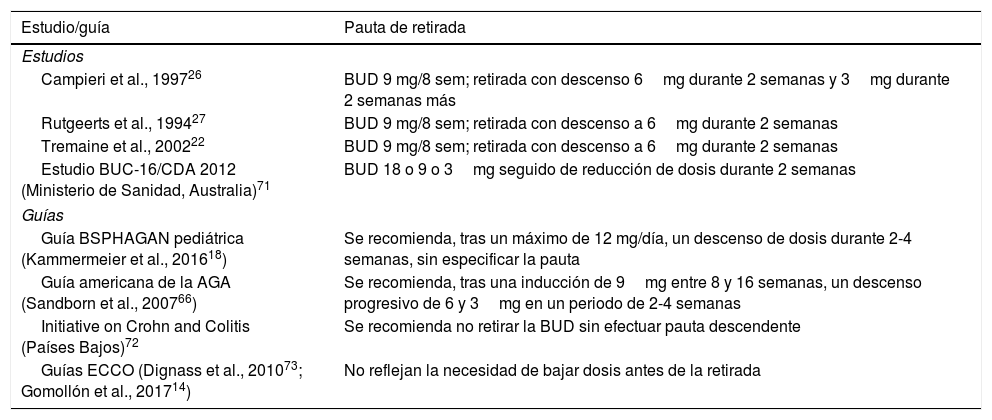
Todo lo anterior, y el hecho de que en la práctica diaria las variaciones individuales, idiosincrásicas o no, pueden ser imprevisibles, justificaría el recomendar una pauta descendente con BUD de forma sistemática en todos los casos, con una duración variable entre 2 y 4 semanas, al igual que se efectúa con los corticoides sistémicos. A este respecto, diversos estudios o consensos proponen utilizar una pauta descendente (tabla 5).
Pautas de reducción de las dosis de budesonida utilizadas en ensayos clínicos o recomendadas en las guías
| Estudio/guía | Pauta de retirada |
|---|---|
| Estudios | |
| Campieri et al., 199726 | BUD 9 mg/8 sem; retirada con descenso 6mg durante 2 semanas y 3mg durante 2 semanas más |
| Rutgeerts et al., 199427 | BUD 9 mg/8 sem; retirada con descenso a 6mg durante 2 semanas |
| Tremaine et al., 200222 | BUD 9 mg/8 sem; retirada con descenso a 6mg durante 2 semanas |
| Estudio BUC-16/CDA 2012 (Ministerio de Sanidad, Australia)71 | BUD 18 o 9 o 3mg seguido de reducción de dosis durante 2 semanas |
| Guías | |
| Guía BSPHAGAN pediátrica (Kammermeier et al., 201618) | Se recomienda, tras un máximo de 12 mg/día, un descenso de dosis durante 2-4 semanas, sin especificar la pauta |
| Guía americana de la AGA (Sandborn et al., 200766) | Se recomienda, tras una inducción de 9mg entre 8 y 16 semanas, un descenso progresivo de 6 y 3mg en un periodo de 2-4 semanas |
| Initiative on Crohn and Colitis (Países Bajos)72 | Se recomienda no retirar la BUD sin efectuar pauta descendente |
| Guías ECCO (Dignass et al., 201073; Gomollón et al., 201714) | No reflejan la necesidad de bajar dosis antes de la retirada |
BUD: budesonida; sem: semana.
Para realizar esta pauta caben 3opciones. En primer lugar, la definición de corticodependencia incluye la incapacidad de reducir los niveles de glucocorticoides (prednisolona 10mg o BUD 3mg en periodo de 3 meses)14,73, por lo que el tiempo de inducción no debería superar este periodo. Dada la equivalencia entre 5mg de BUD y 12mg de prednisolona, desde el punto de vista clínico, tras inducir la remisión con 9mg durante 8 semanas, si se desea eliminar la posibilidad de efectos de retirada brusca parece razonable realizar en todos los casos una reducción gradual de dosis: 6mg durante 15 días y posteriormente 3mg durante 15 días más. Otra opción sería emplear esta pauta solo en situaciones en que se decide prolongar, intercambiar o incrementar la dosis y la duración estándar del tratamiento con BUD:
- 1.
Pauta de inducción prolongada en la «guía de práctica clínica americana» de 9mg durante más de 8 semanas (8-16 semanas)66.
- 2.
Pacientes corticodependientes con EC inactiva en que se decida una estrategia de cambio (switch) desde corticoides sistémicos orales a BUD como puente hacia otros tratamientos, y con el fin de reducir los EA corticoideos50.
- 3.
En caso de optar por un mantenimiento de 6mg durante 3 meses como estrategia para retrasar la recaída60.
- 4.
Cuando se utilizan dosis de inducción superiores a 12mg.
Para prevenir el desarrollo de alteraciones de la DMO (ADMO) en pacientes bajo tratamiento con esteroides, distintas sociedades científicas74-76 recomiendan administrar suplementos de calcio (1-1,5g/día) y vitamina D (800 UI/día). La osteoporosis comporta unos costes elevados, tanto en calidad de vida del paciente como para el sistema sanitario, al incrementar el riesgo de fracturas, sobre todo en pacientes de edad avanzada. Sin embargo, en la patogenia de las ADMO en pacientes con EII todavía existen aspectos controvertidos como el impacto de la actividad inflamatoria sobre el metabolismo óseo, el tipo de esteroide utilizado, su dosis y vía de administración, el tiempo de exposición y la posible recuperación de la DMO tras su suspensión (especialmente en aquellos pacientes con un tiempo de exposición inferior a 3 meses).
Dada la baja biodisponibilidad sistémica de la BUD, esta debería tener un efecto sobre la DMO menor o incluso nulo; sin embargo, los datos son muy heterogéneos. En un estudio abierto y controlado en pacientes con EC activa ileal o de colon ascendente, aleatorizados para recibir prednisolona (40mg/día) o BUD (9mg/día), la pérdida de masa ósea a los 24 meses fue menor en el grupo de BUD tan solo en aquellos pacientes que no habían recibido nunca esteroides77. Respecto al desarrollo de fractura, tan solo se presentó una fractura vertebral asintomática en el grupo de prednisolona y 2 fracturas traumáticas en cada grupo. Cabe destacar que, de forma basal, el 44% de los pacientes expuestos previamente a esteroides y el 58% de los corticodependientes presentaban ADMO, frente al 34% de aquellos que no habían recibido nunca esteroides (p=0,006). Destaca que, por protocolo, no estuviera establecida la prevención de ADMO en ninguno de los 2grupos de tratamiento. Sin embargo, el calcio y la vitamina D que algunos pacientes recibían antes de ser incluidos en el estudio no se modificó y fue equiparable en ambos grupos (alrededor de un 15% vitamina D y un 50% calcio)77. Estos resultados son opuestos a los de otro estudio en EC inactiva en pacientes tratados con dosis bajas de BUD o prednisona durante un largo periodo. No se observaron diferencias en la DMO entre ambos grupos, si bien destaca que no se tratara de un estudio aleatorizado y que existieran grandes diferencias entre los grupos en cuanto a la localización de la enfermedad, la exposición previa a esteroides y la administración de calcio y vitamina D78.
Disponemos de pocos estudios en el ámbito de la EII que hayan evaluado si esta medida es eficaz o necesaria para preservar o mejorar la DMO79, y ninguno de ellos en el contexto del tratamiento con BUD.
En conclusión, ante la imposibilidad de estratificar el riesgo de ADMO en pacientes con EII (fuera de los factores poblacionales establecidos), y en concreto en los pacientes que reciben BUD, la administración de calcio y vitamina D es una medida segura y probablemente coste-efectiva. En la subpoblación de pacientes ancianos existen datos sólidos a favor de dicha medida, al reducirse la tasa de fracturas80-82 y haberse demostrado en un metaanálisis83 que los suplementos de vitamina D son efectivos para prevenir las caídas, al actuar a través de receptores del músculo esquelético aumentando su fuerza muscular84.
ConclusionesLa BUD representa una alternativa al tratamiento de la EC con esteroides clásicos, en determinadas condiciones de gravedad y localización de la misma. Aunque su posicionamiento dentro de los fármacos empleados en esta indicación es claro, pensamos que los prescriptores deben conocer las precisiones acerca de su uso que presentamos en esta revisión. También son interesantes las situaciones terapéuticas en las que el uso real ha dado mejor respuesta que la ficha técnica a los vacíos dejados en el desarrollo preclínico del fármaco. Esperamos haber contribuido a que un buen fármaco se emplee de manera más adecuada en pacientes que lo necesitan, y a que se comprenda el lugar que debe ocupar en la terapéutica de la EC y de otras enfermedades del tubo digestivo.
Conflicto de intereses- –
Antonio López-Sanromán: Asesorías, ponencias o ayudas para investigación de Abbvie, MSD, Tillotts, Ferring, FAES Farma, Shire, Hospira, Kern-Celltrion, Takeda, Pfizer.
- –
Joan Clofent: no declara conflicto de intereses.
- –
Esther Garcia-Planella: Asesorías, ponencias o ayudas para investigación de MSD, Abbvie, Kern, Gebro, Pfizer, Takeda, Janssen, Ferring, Shire Pharmaceuticals, Tillotts Pharma.
- –
Luís Menchén: asesorías, ponencias o ayudas para investigación de MSD, Abbvie, Takeda, Janssen, Pfizer, Tillotts Pharma, Dr. Falk Pharma, Shire, Ferring.
- –
Pilar Nos: asesorías, ponencias o ayudas para investigación de MSD, Otsuka, Abbvie, Takeda, Kern, Biogen y Ferring.
- –
Iago Rodríguez-Lago: Asesoría de Tillots Pharma.
- –
Eugeni Domènech: asesorías, ponencias o ayudas para investigación de Abbvie, MSD, Takeda, Hospira, Kern, Shire Pharmaceuticals, Ferring, Tillots Pharma, Otsuka Pharmaceuticals, Pfizer, Celgene, Grifols.