La enfermedad relacionada (ER) con la IgG4 es un proceso fibroinflamatorio relacionado con la inmumomediación. Los órganos que se ven afectados por esta enfermedad más frecuentemente son: páncreas, vía biliar, glándulas salivares mayores, lacrimales, retroperitoneo y linfáticos.
En las últimas décadas, esta enfermedad ha sido reconocida como un trastorno sistémico que engloba a muchas afecciones individuales de órganos, antes no relacionadas y conocidas como entidades independientes.
Las características comunes compartidas por las distintas entidades que componen la ER-IgG4 son: cifras elevadas de IgG4 sérica, alteraciones en las pruebas de imagen con tumefacción de aspecto neoplásico de los órganos afectados, características histopatológicas propias y en inmunotinción, buena respuesta al tratamiento con glucocorticoides.
En este trabajo, realizaremos una revisión de esta enfermedad con especial énfasis en las características de la pancreatitis autoinmune, colangitis esclerosante relacionada con IgG4, el compromiso del retroperitoneo y el mesenterio, y del tubo digestivo.
IgG4-related disease is a fibrous-inflammatory process related to immunomodulation. The most commonly affected organs are: the pancreas, bile duct, major salivary glands, lacrimal glands, retroperitoneum and lymphatic ducts.
In recent decades, this disease has been recognised as a systemic disorder that includes many single organ disorders, previously unrelated and known as independent entities.
The common characteristics shared by the different entities that make up the IgG4-related disease are: raised serum IgG4 levels, alterations in the imaging tests with neoplastic-like swelling of the affected organs, specific histopathological characteristics and in immunostaining, as well as good response to treatment with glucocorticoids.
In this work, we will review this pathology with a special emphasis on the characteristics of autoimmune pancreatitis, sclerosing cholangitis related to IgG4 and the involvement of the retroperitoneum, mesenterium and the digestive tract.
La enfermedad relacionada con la inmunoglobulina G4 (ER-IgG4) es un proceso fibroinflamatorio relacionado con la inmumomediación. Puede afectar a múltiples órganos, condicionar en ellos lesiones tumefactivas, destructivas y fracaso orgánico1,2. Los más frecuentemente afectados son el páncreas, la vía biliar, las glándulas salivares mayores, lacrimales, retroperitoneo y linfáticos.
En las últimas décadas, esta enfermedad ha sido reconocida como un trastorno sistémico unificado que enlaza muchas afecciones individuales de órganos, antes no relacionadas y conocidas como entidades diferentes.
Es, por tanto, una enfermedad reciente, de causa desconocida, que comprende un amplio espectro de alteraciones con características patológicas, serológicas y clínicas comunes. Es una enfermedad infradiagnosticada principalmente por ser poco conocida, siendo confundida frecuentemente con cáncer, infección u otras enfermedades autoinmunes como Sjögren o Wegener.
Las características comunes compartidas por las distintas entidades que componen la ER-IgG4 son:
- –
Tumefacción de aspecto neoplásico de los órganos afectados.
- –
Infiltrado linfoplasmocitario rico en células plasmáticas IgG4 positivas.
- –
Grado variable de fibrosis con patrón estoriforme.
- –
Además, en el 60-70% de los pacientes se encuentran cifras elevadas de IgG4 sérica.
- –
La gran mayoría de pacientes responden a glucocorticoides, sobre todo en las fases iniciales de la enfermedad3.
En el año 2001 se describió la asociación de la pancreatitis autoinmune (PAI) con cifras elevadas de IgG4 plasmáticas. Este hallazgo fue en adelante un criterio para el diagnóstico de la PAI tipo 1 y, con el tiempo, para la ER-IgG41.
En 2003 se observó que los pacientes con PAI tipo 1 tenían lesiones fibroinflamatorias ricas en células IgG4, tanto sincrónicas como metacrónicas, en otros órganos. Este hecho amplió el concepto de una enfermedad local a una enfermedad multiorgánica o sistémica.
Actualmente, esta afección ha sido descrita prácticamente en cualquier órgano: páncreas, árbol biliar, glándulas salivares, tejidos periorbitarios, hipófisis, riñones, pulmones, ganglios linfáticos, meninges, mama, próstata, tiroides, pericardio y piel. En todos ellos con similares características histológicas. Por tanto, las enfermedades que forman parte del espectro de ER-IgG4 son entre otras: la PAI, la colangitis esclerosante, la fibrosis retroperitoneal, el aneurisma inflamatorio de la aorta y la mesenteritis esclerosante4.
La nomenclatura de esta entidad ha ido evolucionando desde síndrome proliferativo multiorgánico relacionado con la IgG4, enfermedad esclerosante relacionada con IgG4, enfermedad sistémica relacionada con IgG4 hasta la elegida recientemente por un grupo de investigadores japoneses en octubre del 2011: enfermedad relacionada con IgG4. Este término, elegido en el simposio de Boston del 2011 por expertos de distintas especialidades, hace referencia a la ubicuidad de la IgG4 en los órganos afectados y sus cifras frecuentemente elevadas en plasma5.
EpidemiologíaLos datos epidemiológicos disponibles están sesgados porque se basan principalmente en publicaciones asiáticas. El estudio de la enfermedad es difícil por la escasa cantidad de estudios y datos recogidos, pues no hay publicaciones sobre esta enfermedad hasta 2003. Los estudios japoneses muestran una prevalencia de unos 100 casos por 10.000 personas. Sin embargo, se sabe que está infradiagnosticada6.
La ER-IgG4 tiene una mayor prevalencia en pacientes de sexo masculino (60,8-83%) y en mayores de 50 años de edad7-12. Se ha descrito una relación hombre/mujer de 2,8:1. Sin embargo, este dato proviene de cohortes de pacientes con pancreatitis autoinmunitarias y poblaciones asiáticas —como ya hemos anotado—, por lo que no es del todo extrapolable a otro tipo de poblaciones7.
Esta ratio de hombres con respecto a mujeres en la PAI tipo 1 contrasta con la ratio en las enfermedades autoinmunes clásicas, donde la predilección a padecer estas enfermedades por las mujeres es de 9:1.
No se conocen, de momento, casos familiares de la ER-IgG4. Tampoco hay suficientes estudios que incluyan datos como el origen étnico de los pacientes para extraer conclusiones sobre susceptibilidad genética3. Y no se ha documentado relación con el tabaco, el abuso de alcohol ni los hábitos alimenticios13.
Manifestaciones clínicas y diagnósticoAl ser una enfermedad que puede afectar a múltiples órganos, sus manifestaciones clínicas dependerán de si están afectados unos u otros, pudiendo ser la presentación inicial inespecífica o indicar otras enfermedades mucho más comunes14.
La clave para la sospecha diagnóstica es la afectación multiorgánica, una historia clínica previa de PAI o ambas. La evaluación más precisa de la ER-IgG4 se basa en una exhaustiva historia clínica, la exploración física, las pruebas de laboratorio seleccionadas, los hallazgos típicos en histopatología y los estudios radiológicos apropiados1,15.
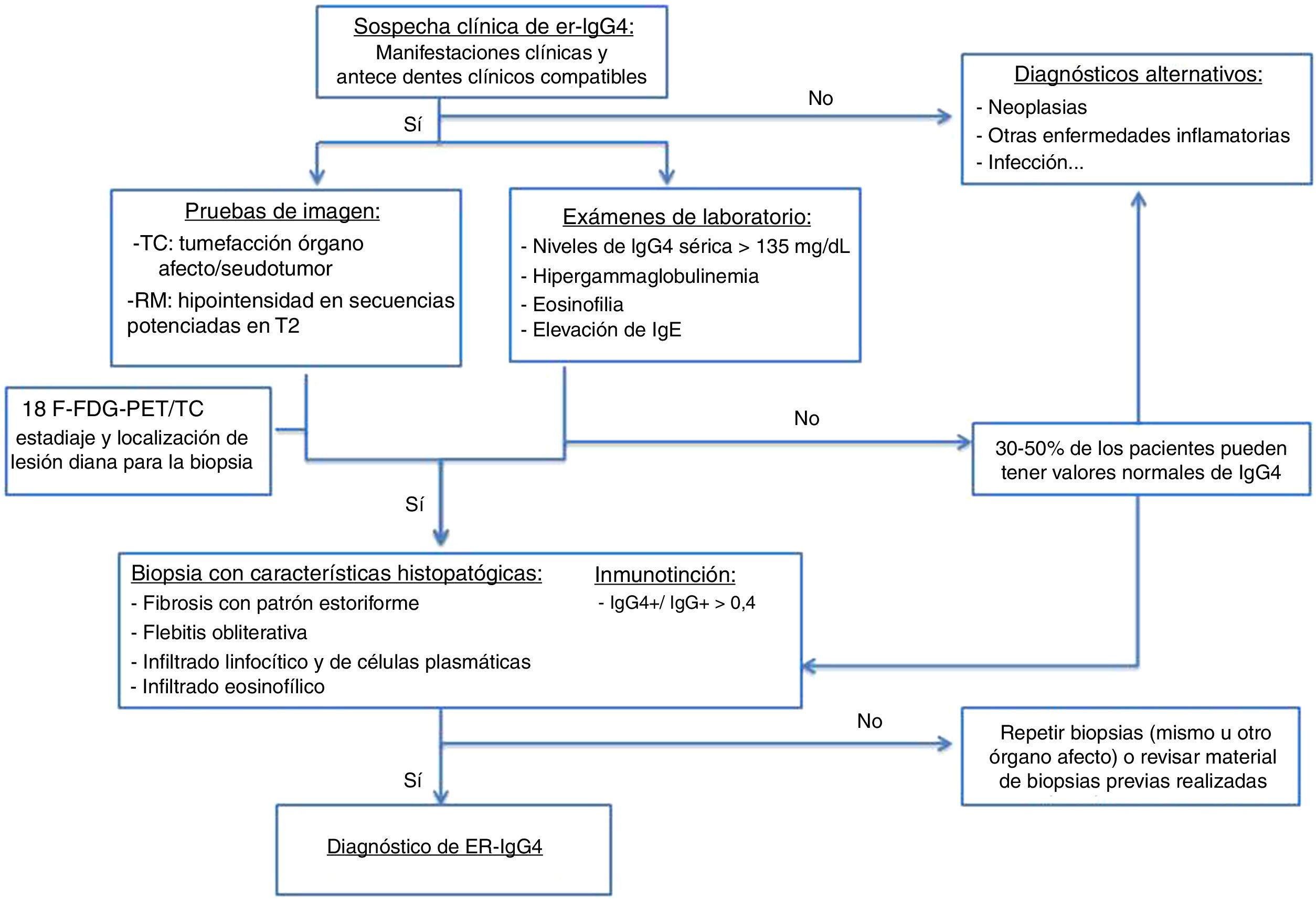
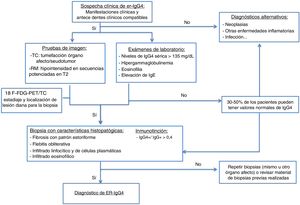
Las pruebas de imagen utilizadas para el diagnóstico de esta entidad son la tomografía computarizada (TC) y la resonancia magnética (RM). La tomografía por emisión de positrones-TC (PET-TC) es una técnica también útil en el diagnóstico. Se ha demostrado un aumento en la captación de fluorodexosiglucosa durante la fase activa de la enfermedad, con remisión de la misma tras el tratamiento corticoideo. Es útil, por tanto, para la estadificación inicial, para localizar el órgano diana para biopsiar y para evaluar su respuesta al tratamiento.
La medición de los SUV (valores de captación estándar, por sus siglas en inglés standard uptake value) entre el páncreas y el hígado podría ser de utilidad para diferenciar la PAI y el cáncer según estudios recientes. Es en este momento cuando se selecciona un órgano accesible a la biopsia (el más accesible tras valorar los estudios de imagen)13,16,17.
Se propone el algoritmo diagnóstico de la figura 115,18.
Test serológicosLos pacientes con esta enfermedad poseen unos niveles séricos elevados de IgG4, el 84% > 135mg/dl18,19.
Sin embargo, según varios estudios, existe variabilidad en la sensibilidad de la elevación de las cifras de la IGg4, existiendo entre un 3 y un 30% de pacientes con la enfermedad que tienen cifras plasmáticas normales.
Los factores de los que depende esta variabilidad son:
- –
Los medios de laboratorio utilizados.
- –
El número de órganos afectados por la enfermedad.
- –
El origen geográfico del paciente.
Por tanto, los niveles plasmáticos elevados de IGg4 no son necesarios ni suficientes para diagnosticar la enfermedad. Valores elevados de IGg4 también se dan en otras afecciones, por lo que como parámetro único no es válido para el diagnóstico de la enfermedad. Aunque el grado de elevación sí se correlaciona con el número de órganos implicados20,21.
La monitorización de la determinación sérica de IgG4 es útil en la determinación de actividad de algunos pacientes, pero su medida no es un parámetro único para decisiones terapéuticas. Sí se ha observado que su concentración desciende tras el tratamiento corticoideo en muchos pacientes22.
InmunotinciónNiveles altos de células plasmáticas IgG4 positivas (IgG4+) en los tejidos es un hallazgo distintivo de la entidad, aun cuando los niveles séricos de IgG4 sean normales.
Es importante tener en cuenta los siguientes matices:
- 1.
En la enfermedad por IgG4, las células plasmáticas IgG4+ se presentan de forma difusa por toda la lesión.
- 2.
El número absoluto de estas células plasmáticas IgG4+ debe ser interpretado según el tejido específico. Por ejemplo, en la PAI el valor de corte es de 50 células por alto campo; sin embargo, en la sialoadenitis el valor de corte es de 1003.
- 3.
El cociente IgG4+/IgG+ en células plasmáticas es una herramienta más específica para diagnosticar la enfermedad, dado que muchas entidades inflamatorias también elevan células plasmáticas IgG4, al elevar en general el pool de células plasmáticas.
Se ha propuesto que un cociente IgG4+/IgG+ en células plasmáticas > del 40% como un valor de corte adecuado en cualquier órgano. Aunque es típico el 70% o incluso más alto4.
Características histopatológicasLa histopatología actualmente es la clave del diagnóstico. Si bien no existen unos criterios histológicos establecidos por consenso, las 3características patológicas de la ER-IgG4 son:
- 1.
Infiltración linfoplasmocítica: la infiltración es por linfocitos y células plasmáticas. Los eosinófilos suelen estar presentes y la infiltración por neutróf1ilos es rara. La necrosis y los granulomas o los cambios xantogranulomatosos son atípicos, y si están presentes, sugieren otros diagnósticos.
- 2.
Fibrosis estoriforme: la fibrosis es un prerrequisito para el diagnóstico, incluso en pacientes al inicio de sus síntomas. Se caracteriza por fibras de colágeno dispuestas radialmente, que parecen trenzadas sobre el tejido, y es el patrón único de esta enfermedad. Este patrón tiene una distribución parcheada, lo que puede ocasionar un error de muestreo dependiendo del material obtenido mediante biopsia con aguja3.
- 3.
Flebitis obliterativa: es descrita como una obliteración parcial o completa de las venas de tamaño mediano, secundaria a la infiltración linfoplasmocitaria con obstrucción de la luz. Es un signo patognomónico de la PAI (aparece en el 90% de la tipo 1 y en el 57% de la tipo 2)16.
El diagnóstico histopatológico seguro suele requerir la presencia de 2de las 3características anteriormente descritas (habitualmente el infiltrado linfoplasmocitario denso y la fibrosis estoriforme). Los hallazgos histopatológicos descritos son comunes para todos los órganos4.
Pancreatitis autoinmuneLa PAI tipo 1 es el prototipo de ER-IgG4. Se estima que representa el 2% de los casos de pancreatitis crónicas7. Se caracteriza por un infiltrado periductal de células plasmáticas IgG4 que aboca a fibrosis periductal. Con el tiempo también se atrofian los acinos parenquimatosos, hay pérdida de la arquitectura lobular y evolución a la esclerosis. Clínicamente, no hay síntomas específicos respecto a otros cuadros de pancreatitis aguda, recurrente o crónica, así los pacientes pueden presentar ictericia obstructiva, diabetes de inicio, esteatorrea, pérdida de peso, etc.
Las formas de presentación pueden ser: un cuadro de ictericia obstructiva causada por una masa en la cabeza pancreática o por engrosamiento de la pared del colédoco (hasta en un 55% de los casos), similar a un cuadro tumoral; un aumento de tamaño del páncreas en las pruebas de imagen, de forma difusa o focal, con estrechamiento irregular del conducto pancreático, y algunas veces también del colédoco; simulando una pancreatitis aguda única o recurrente y evolucionar a pancreatitis crónica con calcificaciones e insuficiencia pancreática exocrina y endocrina17,23 (fig. 2).
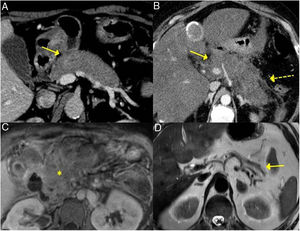
Diferentes formas de presentación y evolución de la PAI tipo 1. A) Imagen de TC, aumento difuso del tamaño pancreático (flecha continua) sin cambios inflamatorios peripancreáticos asociados. B) Imagen de TC, aumento difuso del tamaño pancreático (flecha continua) con cambios inflamatorios en la grasa peripancreática (flecha discontinua), indistinguible de una pancreatitis aguda. C) Imagen de RM secuencia potenciada en T1 con contraste, tejido fibrótico en topografía pancreática (asterisco). D) Imagen de RM potenciada en T2 severa atrofia pancreática (flecha continua) en paciente con insuficiencia pancreática endocrina y exocrina.
Es frecuente que se asocien otras afectaciones fibroinflamatorias y presentarse, por ejemplo, con lumbalgia secundaria a fibrosis retroperitoneal o hidronefrosis, contribuyendo estos hallazgos al diagnóstico de la entidad24.
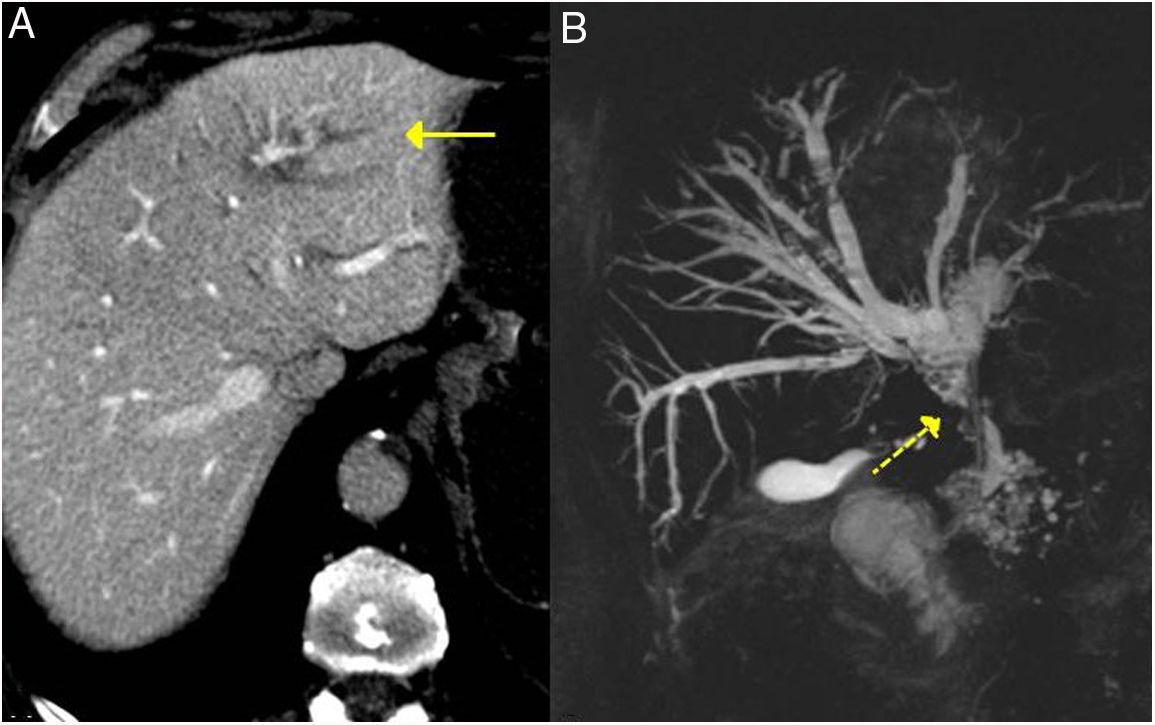
Vía biliar/colangitis esclerosante relacionada con IgG4La afectación de la vía biliar es la segunda más frecuente tras la PAI. Puede aparecer incluso en el 70% de los pacientes7. El 60-80% de los pacientes con PAI tipo 1 tienen afectado el sistema hepatobiliar (conductos biliares y vesícula biliar)25. Aunque la colangitis esclerosante IgG4 también se puede presentar sin alteración pancreática, siendo entonces muy difícil su diagnóstico17.
Puede afectar tanto a la vía biliar intrahepática como extrahepática, produciendo un denso infiltrado de células plasmáticas IgG4+ en los conductos biliares y posteriormente fibrosis26,27.
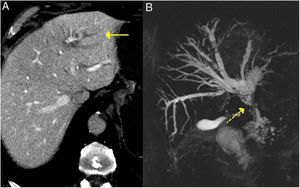
Estos hallazgos se aprecian con facilidad en la colangiopancreatografía retrógrada endoscópica o colangio-RM (fig. 3).
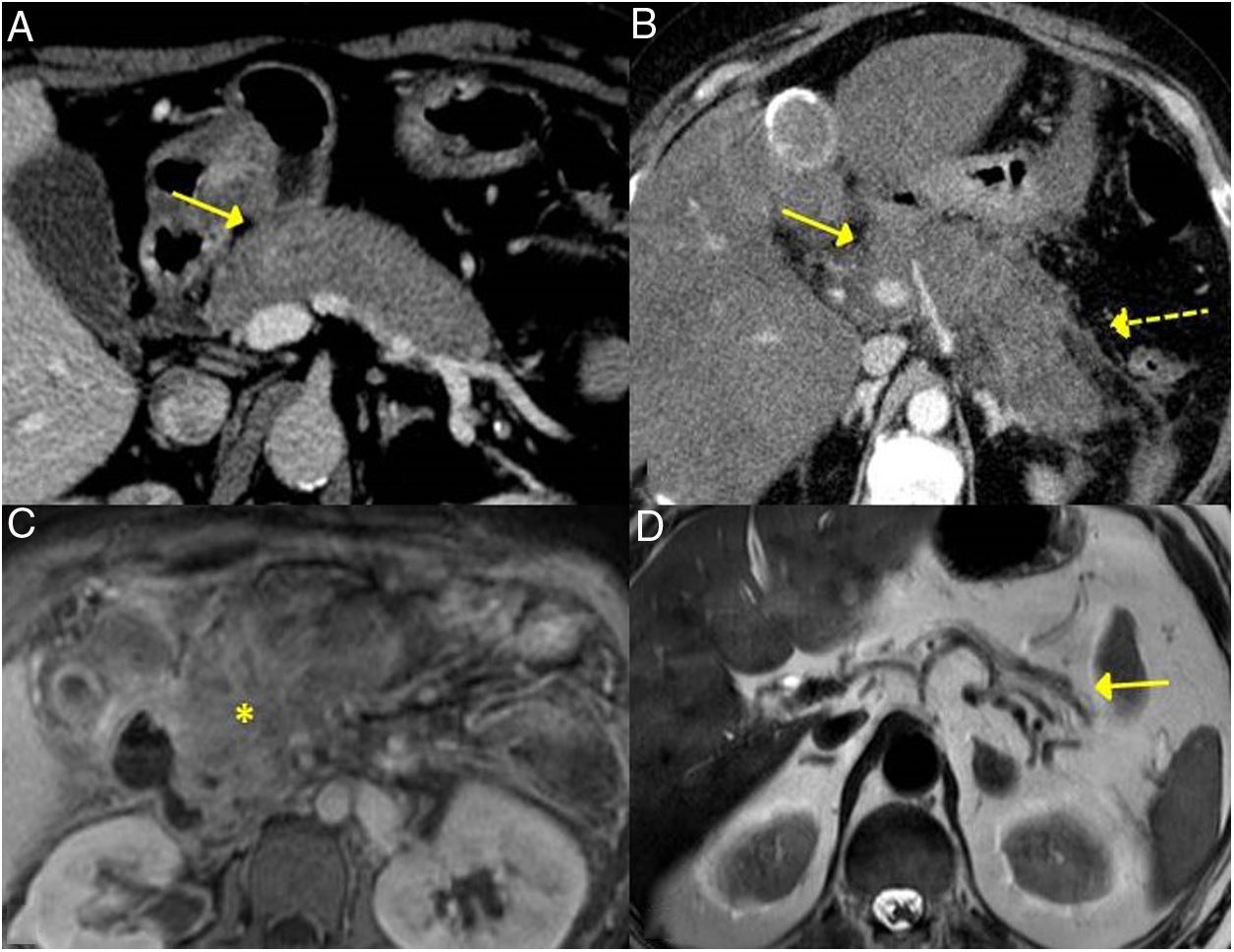
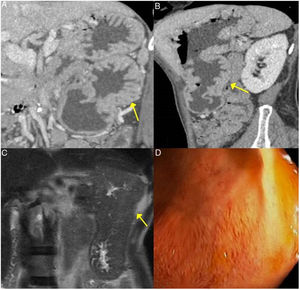
ER-IgG4 gástrica. A y B) Imágenes de TC reconstrucción coronal y sagital, respectivamente: se observa aumento del tamaño gástrico con gruesos y grandes pliegues (flechas). C) Imagen de RM secuencia potenciada en T2 coronal: se observa engrosamiento de los pliegues gástricos con marcada disminución de la luz gástrica. D) Imagen de gastroscopia: se observa hipertrofia mucosa con vascularización prominente.
El segmento más frecuentemente afectado es la porción intrapancreática del colédoco, debido a que la mayoría de veces esta entidad coexiste con la PAI, sumándose el engrosamiento de la pared del colédoco por la infiltración linfoplasmocitaria a la inflamación o edema del páncreas17. Condiciona dilatación de la vía biliar anterógrada con ictericia obstructiva. Suele cursar con una presentación clínica más aguda y una menor duración de los síntomas. Sin tratamiento puede ser autolimitada o evolucionar a cirrosis28. En las pruebas de imagen, como TC y RM, puede ser indistinguible al colangiocarcionoma28-32.
La afectación de la vesícula condiciona un engrosamiento difuso de su pared, por la infiltración transmural del infiltrado linfoplasmocitario. El engrosamiento de la pared de la vesícula se aprecia hipointenso en RM en las imágenes potenciadas en T2 y capta contraste de forma significativa con persistencia del realce en las fases tardías28.
La coexistencia de enfermedad extrabiliar, sobre todo pancreática y renal, es altamente indicativa de colangitis relacionada con IgG4.
Retroperitoneo y mesenterioLa afectación de retroperitoneo y mesenterio puede ser como: fibrosis retroperitoneal (más frecuente), como periaortitis o como mesenteritis esclerosante14.
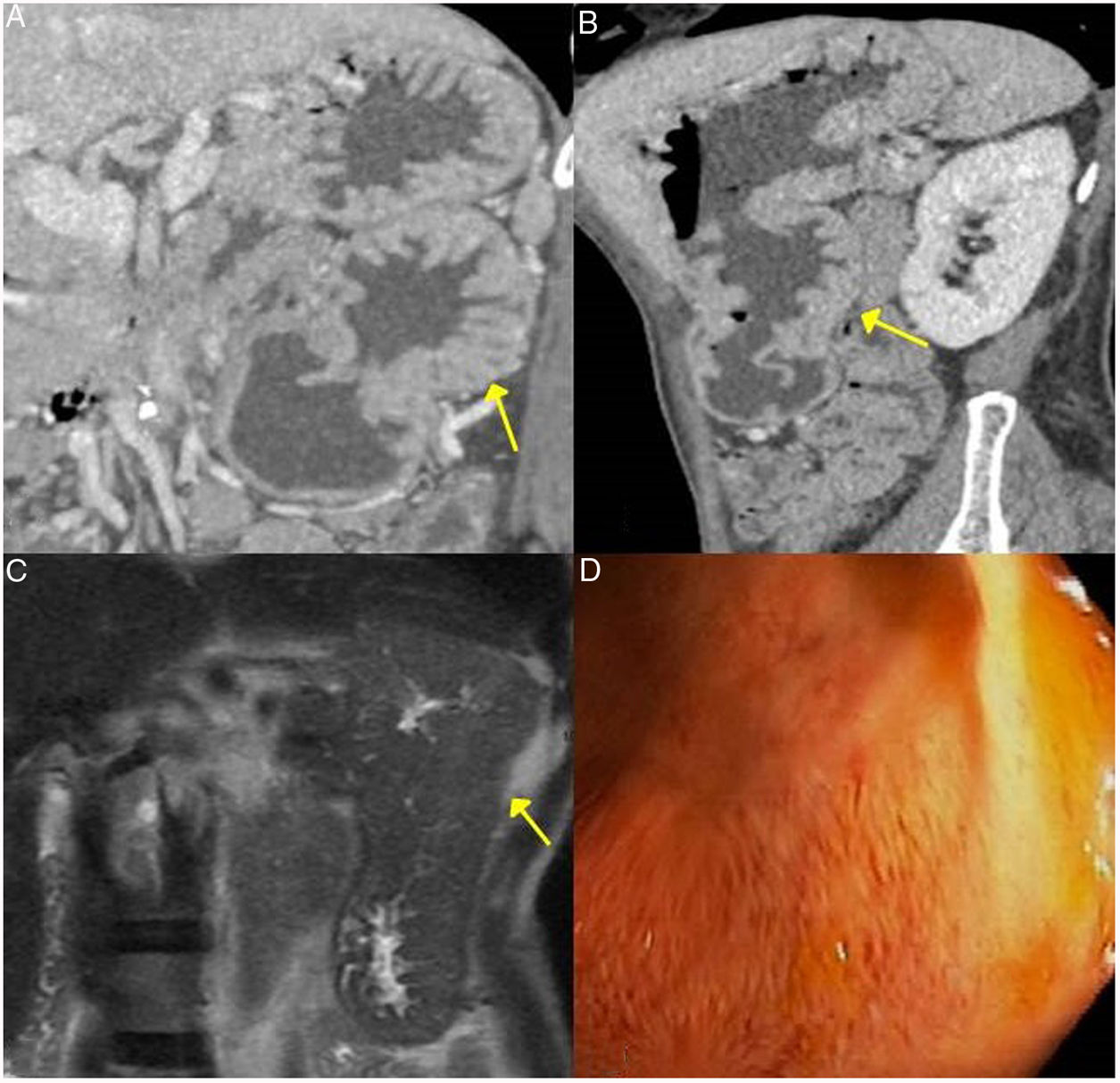
Fibrosis retroperitonealSe estima en un 10% de los pacientes con PAI desarrollan fibrosis peritoneal. Esta fibrosis relacionada con la enfermedad por IgG4 tiene los mismos hallazgos de imagen que la fibrosis retroperitoneal secundaria.
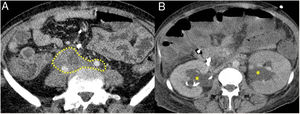
La presentación más habitual es como un tejido inflamatorio que rodea la aorta y sus ramas extendiéndose a retroperitoneo, englobando los uréteres y ocasionando hidronefrosis (a veces es la primera manifestación) (fig. 4). La lesión puede presentarse como una masa de partes blandas simulando malignidad.
Colangitis esclerosante relacionada con IgG4. A) Imagen de TC: se observa una dilatación de la vía biliar intrahepática izquierda (flecha continua). B) Imagen de colangio-RM: se observa una dilatación de la vía biliar intrahepática izquierda y derecha y de la extrahepática, con estenosis en el tercio medio del colédoco (flecha discontinua).
El diagnóstico es más sencillo si coexisten otras lesiones (como la afectación pancreática). No es infrecuente que aparezca en los controles de seguimiento de una PAI33.
Muchas de las fibrosis retroperitoneales consideradas primarias, tras el establecimiento de los criterios de la ER-IgG4, son consideradas ahora como parte de esta entidad, son las fibrosis que tienen buena respuesta al tratamiento esteroideo34.
Afectación vascularLa afectación vascular suele ser en forma de periaortitis. Es característico el engrosamiento de la pared del vaso con realce del mismo. Si no se trata, puede evolucionar a disección o a formación de un aneurisma.
La afectación por IgG4 es indistinguible del resto de aortitis no infecciosas, como las que ocurren en enfermedades reumatológicas sistémicas, como en la artritis reumatoide, la enfermedad de Behçet, de células gigantes o en la arteritis de Takayasu. Dichas enfermedades cursan, al igual que la enfermedad por IgG4, con prominente infiltrado linfoplasmocitario33.
Mesenteritis esclerosanteEs un trastorno poco frecuente y crónico que engloba el mesenterio del intestino delgado con varios grados de lipodistrofia, inflamación, fibrosis y necrosis. La enfermedad idiopática se ha relacionado con antecedente de cirugía abdominal previa, neoplasias o enfermedades autoinmunes7. En su variante asociada a la ER-IgG4, suele presentarse como una lesión tumefactiva que engloba y estrecha los vasos mesentéricos. Esta masa mesentérica se puede presentar en contigüidad con las lesiones de la PAI y, menos frecuente, también con la colangitis esclerosante o la fibrosis retroperitoneal. Puede infiltrar las asas y condicionar una obstrucción parcial o total intestinal17.
Tubo digestivoLa afectación del tracto gastrointestinal en la enfermedad por IgG4 es poco frecuente. Hay pocos casos recogidos en la literatura y son sobre todo referidos al estómago y el intestino delgado35,36.
Aunque se ha descrito una infiltración por células plasmáticas IgG4+ en la mucosa gástrica y colónica, y la papila mayor en algunos pacientes con PAI, hasta el año 2013 se cuestionaba si eran lesiones relacionadas con la ER-IgG4 o si podría existir una entidad propia como enfermedad gastrointestinal relacionada con IgG4, dado que no siempre cumplían los criterios de fibrosis densa o flebitis obliterativa37.
Sin embargo, actualmente se ha confirmado su existencia, a pesar de que las series de casos recogidas son muy escasas. Lim et al. refirieron 15 casos de afectación gástrica en 2018 (de ellos, 11 con afectación asilada y 4 con coexistencia de PAI)22.
EstómagoLas distintas manifestaciones gástricas descritas son:
- –
Infiltración difusa en mucosa gástrica por células plasmáticas IgG4+, sin el resto de criterios histológicos de la enfermedad; relacionada con algunos casos de PAI y que desaparece tras el tratamiento corticoideo. En ocasiones, está infiltración ha condicionado nódulos en la mucosa gástrica de hasta 15mm37.
- –
Lesiones focales polipoideas o masas focales, de hasta 3cm, y que sí cumplen todos los criterios.
- –
Úlcera gástrica.
- –
Engrosamiento difuso de la pared (fig. 5).
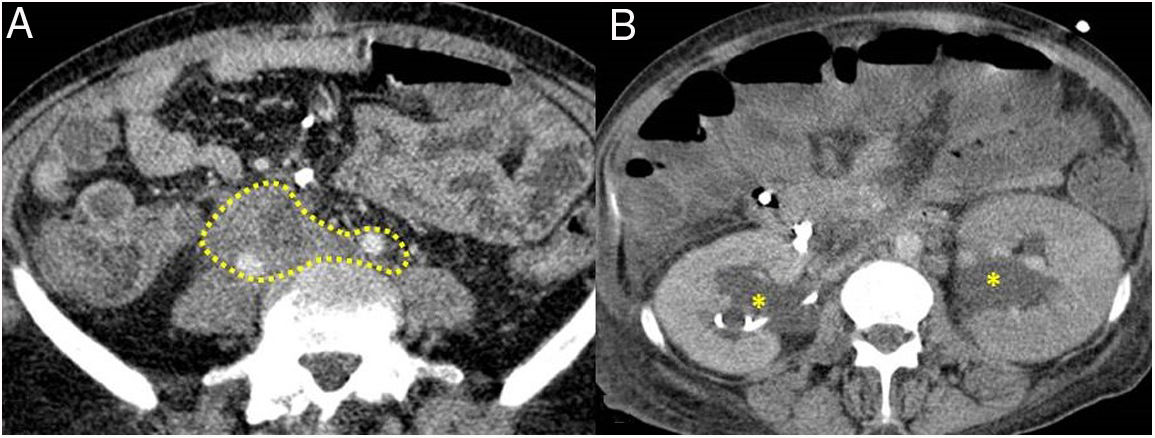
Figura 5.Fibrosis retroperitoneal. Imágenes de TC. A) Tejido de densidad partes blandas (incluido en flechas discontinuas) que rodea las estructuras de retroperitoneo, como son ambos uréteres y las arterias ilíacas comunes, correspondiente con fibrosis retroperitoneal. B) Mismo paciente que en A en el que dicha fibrosis ocasiona hidronefrosis proximal bilateral (asteriscos).
(0.1MB). - –
Asociación con adenopatías locales.
Estos hallazgos son muchas veces indistinguibles por imagen de la enfermedad gástrica maligna (sobre todo el carcinoma gástrico primario o el linfoma gástrico)37-40.
EsófagoSe han descrito casos de esofagitis relacionada con IgG4 en los que se ha observado un engrosamiento de la pared esofágica que condicionaba disfagia y pérdida de peso, demostrándose en la biopsia las características propias de la enfermedad37,39.
Papila duodenal mayorSuele estar afectada en un 41-61% de los pacientes con PAI, con tumefacción e infiltrado linfoplasmocitario IgG4 +, hallazgos que además revierten tras el tratamiento esteroideo41. Por tanto, su biopsia y estudio con inmunotinción es una herramienta interesante para diagnosticar PAI.
Lesiones colónicasAl igual que en el estómago, en ocasiones en pacientes con PAI se encuentra una infiltración por células plasmáticas IgG4+ en la mucosa colónica, pero sin fibrosis densa o flebitis obliterativa.
También se ha descrito poliposis colónica en paciente con PAI y con marcada reducción de los pólipos tras el tratamiento esteroideo.
Otras formas de manifestación de la ER-IgG4 son como lesiones nodulares esclerosas y circunscritas en ciego y colon sigmoide, con abundante infiltración por células plasmáticas IgG4 +, sin enfermedad en otros órganos37.
Afecciones no relacionadas con la ER-IgG4 que cursan con un aumento de células positivas para IgG4- –
Afecciones inflamatorias: enfermedades inflamatorias orales, colangitis esclerosante primaria, artritis reumatoide.
- –
Linfoma: deben excluirse los linfomas de células B de bajo grado en los casos de posible ER-IgG4 con floridos infiltrados linfoplasmocitarios. Los que simulan esta entidad suelen ser sobre todo el linfoma de la zona marginal extranodal y algunas veces linfomas foliculares y angioinmunoblásticos. Encontrar células CD20+ y restricción de cadenas ligeras de inmunoglobulinas, así como agregados de linfocitos B, apoya el diagnóstico de linfoma.
- –
Malignas: el tejido cancerígeno puede estar infiltrado con células plasmáticas IgG4+ en distintos grados. Es más frecuente en cánceres pancreatobiliares, aunque también se puede ver en otros tumores. La infiltración por IgG4 en tejidos malignos suele ser parcheada y no asocia al resto de características propias de la enfermedad, como el patrón estoriforme o la flebitis4.
Es importante, una vez diagnosticada la enfermedad, iniciar el tratamiento lo antes posible, con el objetivo de prevenir el desarrollo de fibrosis y mantener el tratamiento una vez conseguida la remisión para evitar las recaídas. La ER-IgG4 se trata principalmente con glucocorticoides sistémicos. Aunque hay estudios con propuestas para el tratamiento de la enfermedad, no hay establecido un manejo de la misma de forma exhaustiva. En parte, es debido a que la clínica depende de los órganos implicados, el consenso actual se basa en el tratamiento de la PAI 1, como entidad representativa de la enfermedad42.
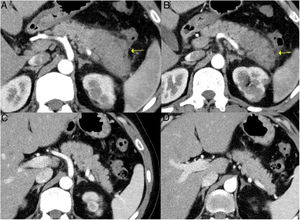
Inducción de remisiónLa inducción de la remisión se logra con éxito con esteroides hasta en un 90% de los pacientes con PAI tipo 1 (fig. 6). Tanto las guías japonesas como el consenso internacional proponen los esteroides como primera línea de tratamiento. Incluso en pacientes asintomáticos que presenten imagen de masa pancreática persistente o que presenten colangitis esclerosante-IgG4 con anomalías de la función hepática en las pruebas serológicas. Cuando existen contraindicaciones a los esteroides, el rituximab puede inducir remisión como tratamiento único también1,43.
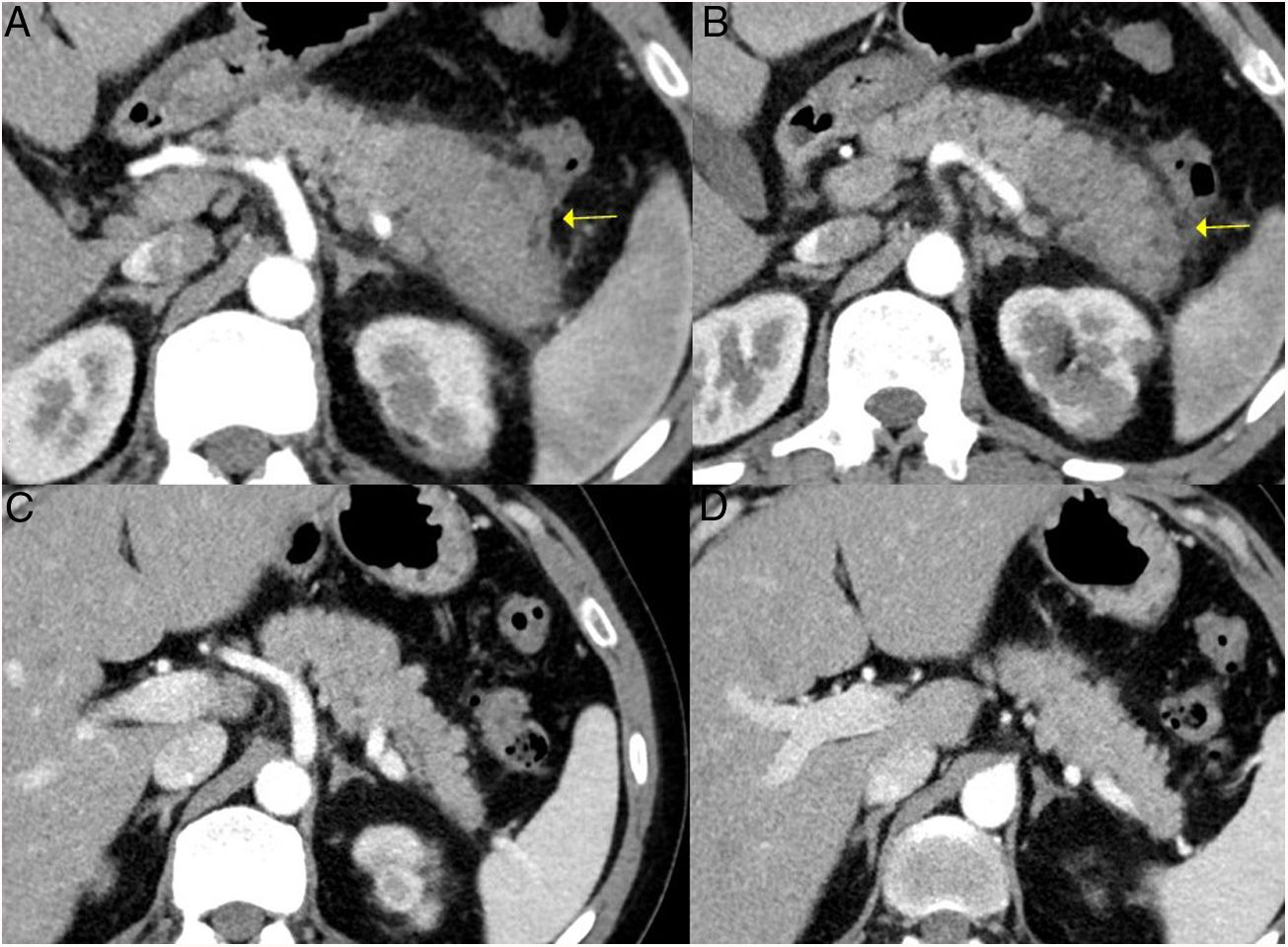
Remisión de un PAI tipo 1 focal de la cola pancreática tras tratamiento corticoideo. A y B) Imágenes de TC de un paciente con pancreatitis focal de la cola pancreática (flechas) con aumento del tamaño focal, pérdida de las hendiduras pancreáticas y halo hipodenso periférico característico, en el contexto de una ER-IgG4. C y D) Imágenes de la TC de control a los 3 meses tras haber recibido el paciente tratamiento corticoideo: se observa una resolución completa de la afectación focal de la cola pancreática, que se muestra de tamaño normal y con hendiduras pancreáticas normales conservadas.
Las recaídas de la PAI 1 ocurren hasta en un 30-50%. Los estudios japoneses sugieren que las recaídas están relacionadas con la afectación difusa del páncreas, con niveles plasmáticos elevados de IgG4, o que bajan poco con el tratamiento, así como la asociación de la PAI 1 con colangitis esclerosante-IgG4, sobre todo cuando es de tipo proximal. Además, proponen estos hallazgos como predictores tempranos de recaídas.
En las recaídas el tratamiento inicial con corticoides sigue siendo de utilidad, aunque hay menos consenso. El consenso internacional propone la readministración de corticoides o subir su dosis o asociar agentes inmunodepresores o rituximab1,43.
Tratamiento de mantenimientoLa terapia de mantenimiento consiste en bajas dosis de corticoides, existiendo estudios (la mayoría asiáticos) que sugieren esta monoterapia para la prevención de recaídas. Otras alternativas para el tratamiento de mantenimiento son el rituximab (con diferentes estrategias terapéuticas en cuanto a dosis y duración del tratamiento de mantenimiento)44-46 y los inmunomoduladores como la azatioprina, 6-mercaptopurina o el micofenolato mofetilo. En los casos con alteración focal pancreática, bajos niveles plasmáticos de IgG4, sin enfermedad extrapancreática y con resolución de imagen de los hallazgos tras el tratamiento de inducción, no estaría indicado en tratamiento de mantenimiento42,43. En los casos de daño orgánico severo, puede ser necesaria la cirugía o la radioterapia42.
PronósticoAunque la remisión es lo habitual en los casos de PAI 1, con resolución de la clínica, la evolución a largo plazo no está muy estudiada. Un 10% evoluciona a pancreatitis crónica con calcificaciones e insuficiencia exocrina.
Los factores de riesgo relacionados con recaídas son:
- –
Ictericia obstructiva.
- –
Afectación extrapancreática biliar.
- –
Estenosis ductales proximales intra o extrahepáticas.
- –
Remisión incompleta de los hallazgos radiológicos o serológicos durante el período de mantenimiento.
- –
Aumento del volumen pancreático difuso basal7.
Parece existir mayor riesgo de cáncer (gástricos, pulmón, próstata, colon, linfoma no Hodgkin, de vía biliar y tiroides) en pacientes con pancreatitis relacionadas con la IgG4, especialmente en el año tras el diagnóstico, lo que apuntaría a que en algunos pacientes esta enfermedad podría ser un síndrome paraneoplásico. Se ha demostrado la presencia de mutaciones k-ras significativas en muestras de tejido de páncreas y biliares, de pacientes con PAI, que indica la posibilidad de que esta entidad sea un factor de riesgo para el desarrollo de tumores pancreáticos y biliares47.
ConclusionesLa ER-IgG4 puede afectar a múltiples órganos simultáneamente o en períodos diferentes. Sus manifestaciones clínicas dependerán de los órganos afectados y pueden simular otras enfermedades como, por ejemplo, neoplasias. Se necesita conocer esta enfermedad, sospecharla y realizar un diagnóstico apropiado, pudiendo evitar cirugías innecesarias y el desarrollo de fibrosis irreversibles con los consiguientes fallos orgánicos graves.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.