Helicobacter pylori es un bacilo espiral gramnegativo que coloniza el estómago humano y desempeña un papel clave en la patogénesis de diferentes enfermedades gastroduodenales. Sin embargo, cuando se expone a condiciones de estrés ambientales, tales como el aumento de la tensión de oxígeno, la incubación prolongada o la exposición a antibióticos, Helicobacter pylori entra en un estado viable pero no cultivable, en el cual la bacteria modifica su morfología de una forma bacilar a una cocoide como manifestación de adaptación celular a estas condiciones adversas. En el tejido gástrico, las formas cocoides viables pueden permanecer latentes durante mucho tiempo y retener factores de virulencia, por lo que estas formas posiblemente puedan contribuir a los fracasos del tratamiento y la recurrencia de la infección y de las enfermedades gastroduodenales también. En esta revisión se discutirán varios aspectos de la adaptación celular y supervivencia de Helicobacter pylori, la susceptibilidad a los antibióticos y la virulencia de las formas cocoides y su participación en la recrudescencia.
Helicobacter pylori is a spiral Gram-negative bacillus, which colonizes the human stomach and plays a key role in the pathogenesis of a number of gastroduodenal diseases. However, when expose to environmental stressed conditions, such as increased oxygen tension, extended incubation and exposure to antibiotics, Helicobacter pylori is able to entering the viable but nonculturable state, in which the bacterium modifies its morphology from a spiral to coccoid form, as a manifestation of cell adaptation to these adverse conditions. In gastric tissues, viable coccoid forms may remain latent for long time and retain virulence factors, so these forms possibly contribute to the treatment failures and recurrence of Helicobacter pylori infection and gastroduodenal diseases as well. In this review, we will discuss several aspects of cellular adaptation and survival of Helicobacter pylori, antibiotic susceptibility and virulence of coccoid forms and its involvement with recrudescence.
Helicobacter pylori (H. pylori) es una bacteria microaerófila gramnegativa, cuyo hábitat natural es el estómago. Se caracteriza por su forma bacilar con varios flagelos en un extremo, pero al someterse a condiciones ambientales desfavorables adapta una forma de aspecto cocoide1,2.
H. pylori representa un importante factor etiológico de la gastritis crónica activa, la úlcera péptica, el linfoma MALT gástrico y el cáncer gástrico. Se estima que esta bacteria está presente en la mucosa gástrica de la mitad de la población mundial, pero la enfermedad solo se produce en aproximadamente el 15-20% de los individuos colonizados2,3.
Con los diferentes esquemas de tratamiento más comúnmente utilizados se logra una tasa de erradicación de alrededor del 85% en muchas áreas geográficas4–6. Sin embargo, la eficacia de estos esquemas ha sido comprometida, especialmente en los últimos años, por la rápida aparición de cepas resistentes a los antibióticos y por la mala adherencia al tratamiento por parte de los pacientes5,7.
Es importante tener en cuenta que del éxito de la erradicación de H. pylori depende la curación de la gastritis crónica activa y la úlcera péptica, y la de algunas formas del linfoma MALT gástrico de bajo grado, así como la prevención de sus complicaciones. Más aún, garantizar el éxito de la erradicación de H. pylori en todas sus formas biológicas y sostenerlo en el tiempo evita la recrudescencia de la infección y, por lo tanto, las recaídas de estas enfermedades.
El propósito de esta revisión es realizar un enfoque general sobre la forma cocoide de H. pylori haciendo hincapié sobre su perfil microbiológico, susceptibilidad antibiótica y grado de virulencia; también analizaremos su involucración en la enfermedad gástrica y hasta qué punto se asocia con la recrudescencia de la infección y las recaídas.
Supervivencia y adaptación celular de Helicobacter pyloriConsideraciones generalesTodos los organismos vivos están equipados con mecanismos que permiten su supervivencia en ambientes adversos. Para algunos de ellos, esta respuesta implica, además de adaptaciones metabólicas, cambios en la morfología celular8,9. Diversos microorganismos poseen la capacidad de diferenciarse a un estado viable pero no cultivable (VNC) en respuesta a un entorno empobrecido para su crecimiento y supervivencia. Esta estrategia es ampliamente conocida en especies como Salmonella, Campylobacter y Escherichia, entre otras10,11.
Generalmente, en el estado VNC, las bacterias disminuyen su tamaño y cambian de forma convirtiéndose en cuerpos esféricos y pequeños. Reducen la tasa de respiración y transporte de nutrientes, cambian la expresión de genes y la síntesis molecular, y no se detectan por las técnicas de cultivo convencionales. Sin embargo, de acuerdo con los cambios en las condiciones ambientales dadas, estos microorganismos pueden «resucitarse» y pasar de nuevo a su estado activo o, de lo contrario, degenerarse10–13.
Del mismo modo, al someterse a circunstancias ambientales perjudiciales para él tanto dentro como fuera de su hábitat natural, H. pylori cambia su clásica forma bacilar y entra en un estado VNC que conduce a cambios morfológicos, metabólicos y en el comportamiento del crecimiento14,15.
Estado viable pero no cultivable de Helicobacter pyloriAunque al principio algunos autores intentaron demostrar que la conversión de las formas bacilares a cocoides es un proceso pasivo que resulta de su muerte celular y, por lo tanto, estas últimas son restos degenerados de bacterias muertas16,17, en la actualidad se habla de 3 formas de H. pylori: la forma bacilar viable y cultivable, considerada la más virulenta, la forma cocoide VNC, menos virulenta que la primera, y la forma degenerativa no viable18–20.
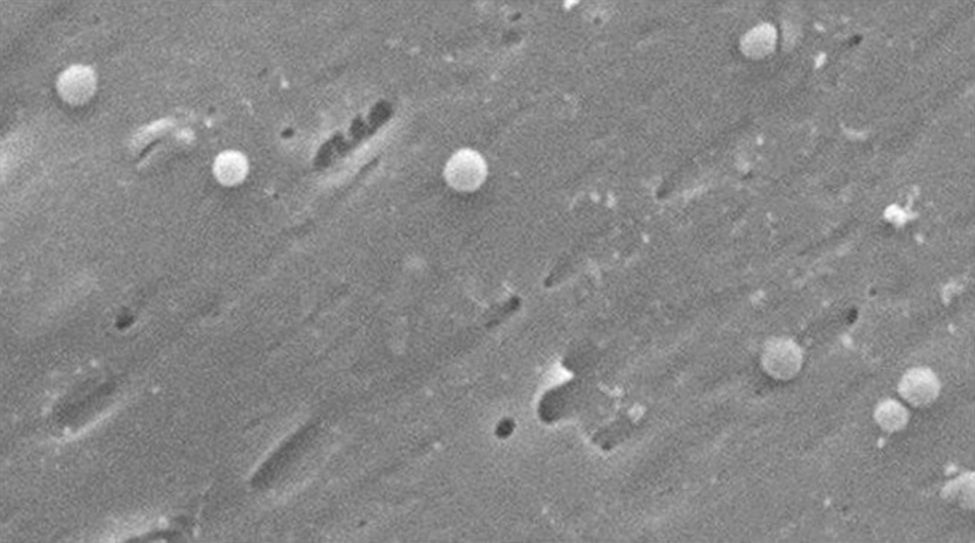
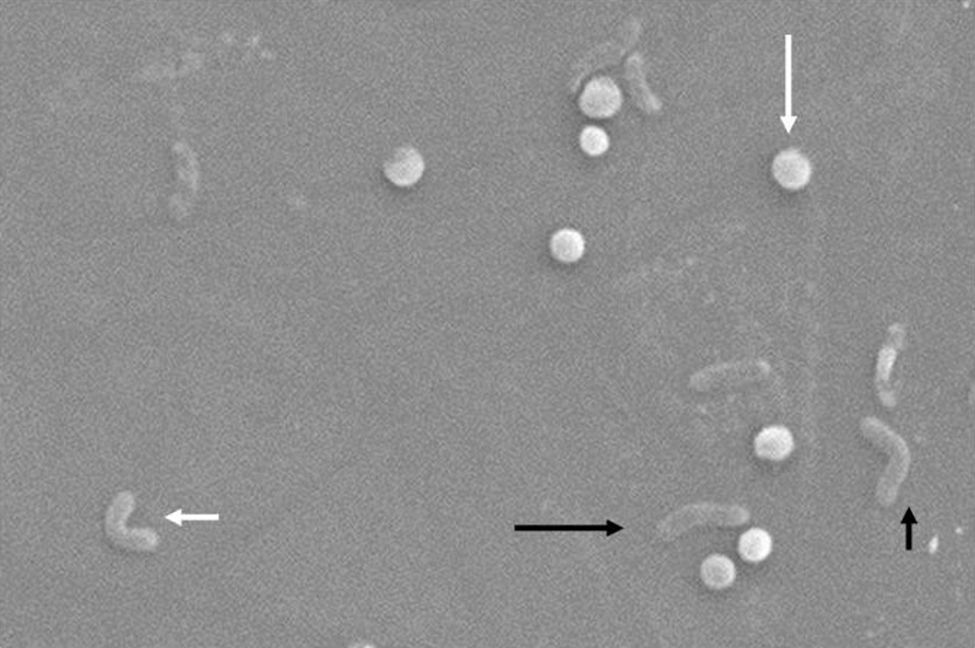
Morfológicamente, la conversión de la forma bacilar a la cocoide ocurre a través de formas intermedias en «V" y en «U»13,14 (figs. 1 y 2), donde estructuras celulares como el citoplasma y la membrana celular se mantienen intactas15,21, y los flagelos tienden a enrollarse sobre la estructura celular cocoide, dificultando su visualización. La existencia de otras modificaciones ultraestructurales permite clasificar la forma cocoide a su vez en 2 tipos: A y B. El tipo A presenta bordes irregulares con una superficie rugosa y se considera una célula muerta, mientras que el tipo B es de superficie más suave, de tamaño más pequeño, y se considera una célula viva21,22.
Cambios morfológicos de Helicobacter pylori. Forma espiral (flecha negra y larga), forma de «V" (flecha negra y corta), forma de «U» (flecha blanca y corta), forma cocoide (flecha blanca y larga). Micrografía electrónica de barrido por gentileza del Dr. Nuno F. Azevedo. LEPABE-Departamento de Ingeniería Química de la Facultad de Ingeniería de la Universidad de Oporto (Portugal).
En un análisis con microscopia electrónica (ME) de la capa de gel superficial de pacientes infectados con H. pylori y con cáncer gástrico, Ogata et al. observaron la coexistencia de ambas formas, la bacilar y la cocoide, en dicho gel23. Otros investigadores han confirmado la presencia de las formas cocoides tanto en el estómago como en el duodeno de humanos24–26, aunque parece que el porcentaje de las formas cocoides es mayor en el duodeno que en el estómago; hasta en algunas biopsias duodenales puede observarse exclusivamente la forma cocoide26,27. Esto puede indicar que las condiciones biológicas en el duodeno de alguna manera obligan a H. pylori a adaptarse a este medio, o estas condiciones son ideales para refugiarse en el estado VNC.
Por medio de diferentes experimentos tanto in vitro como in vivo se ha demostrado que en condiciones desfavorables como aerobiosis28,29, pH alcalino29,30, temperatura alta31, incubación extendida29,32, incubación prolongada en agua33, tratamiento con inhibidores de la bomba de protones32 o tratamiento con antibióticos34, el fenotipo cocoide puede mantener cierta actividad metabólica ya que expresa una amplia variedad de genes presentes en la forma bacilar35, mantiene niveles detectables de la actividad de la ureasa36, continúa sintetizando proteínas aunque en mínimas cantidades (menor del 1% de la cantidad de proteínas sintetizadas por la forma bacilar)37 y produce pequeñas cantidades de ADN; dicha producción se mantiene aun después de 3 meses de almacenamiento en solución salina fisiológica a 4°C29,38. Todos estos datos subrayan que los cambios biológicos de H. pylori que ocurren en respuesta a estímulos perjudiciales representan, durante la vida útil del microorganismo, una poderosa habilidad para la preservación de la especie.
Formación de biopelículasAl igual que otras bacterias, la capacidad de H. pylori de persistir como una entidad infecciosa y resistir el arsenal de los antimicrobianos empleados para su erradicación se debe a la variabilidad genética que le aporta resistencia bacteriana. No obstante, esta importante estrategia de supervivencia se enfatiza cuando las células bacterianas forman las llamadas biopelículas20. Estas son una especie de organización microbiana en «comunidades», donde las bacterias se adhieren firmemente a superficies bióticas o abióticas por medio de una matriz de producción propia constituida por sustancias poliméricas extracelulares39,40 para crear un ambiente que proporciona una fuerte tolerancia a los agentes antimicrobianos y una resistencia a la fagocitosis, permitiendo de esa manera evadir varios mecanismos de defensa del huésped y hacer que esa organización sea difícil de erradicar. Además, las biopelículas son consideradas un verdadero sistema dinámico y complejo que facilita la transferencia horizontal de genes entre las bacterias, confiriendo así una población bacteriana con nuevos genomas modificados que contribuye significativamente a la resistencia bacteriana, a la variabilidad de las cepas y a la adaptabilidad41–43.
En un estudio realizado con biopsias de pacientes en que había sido erradicado previamente, se aisló, por medio de cultivo, H. pylori en 7 de las 21 biopsias estudiadas, mientras que mediante el análisis de la expresión de genes se detectaron células viables de H. pylori en la mayoría de las biopsias analizadas, y la ME mostró bacterias cocoides agrupadas en una biopelícula microbiana, lo que evidencia que las formas cocoides podrían favorecer la persistencia y la resistencia a los antibióticos44.
Susceptibilidad de la forma cocoide a los antibióticosMuchos estudios han demostrado que H. pylori puede pasar de forma bacilar a cocoide bajo la exposición, in vitro, a diversos agentes antimicrobianos. Diferentes concentraciones de amoxicilina, claritromicina, metronidazol y eritromicina, entre otros antibióticos, pueden inducir esta transformación morfológica34,35,45. El mayor efecto de inducción fue visto por la amoxicilina27,34,46. Se sabe que este antibiótico tiene un efecto potente contra H. pylori in vitro; sin embargo, si se toman en cuenta las observaciones morfológicas de los cultivos, resulta evidente que el número de las formas bacilares disminuye a expensas de la aparición y el aumento de las formas cocoides34,46. En este sentido, Faghri et al. lograron efectos bactericidas en más del 60% de las formas cocoides con metronidazol usando una concentración inhibitoria mínima (CIM) ×2, y en el 80 al 90% con claritromicina a CIM. No obstante, el tratamiento con amoxicilina con una CIM y una CIM ×2 no inhibió las formas cocoides viables47. Del mismo modo, Berry et al. observaron que la amoxicilina a CIM ×10 «eliminó» la forma bacilar de H. pylori, pero indujo a cambio, la formación de formas cocoides34. Perkins et al. observaron, en gatos infectados de forma natural por H. pylori, que 6 semanas después del tratamiento de erradicación, el análisis del jugo gástrico era positivo para H. pylori en un solo gato, pero mediante la reacción en cadena de la polimerasa se identificó la presencia de material genético de H. pylori en todos los gatos tratados. Las lesiones histológicas eran compatibles con gastritis crónica con la presencia de folículos linfoides, aunque los bacilos de H. pylori fueron detectados en un solo gato48.
Teniendo en cuenta estos datos microbiológicos y de investigación básica, en un estudio anterior realizado con pacientes infectados con H. pylori donde se determinó previamente la sensibilidad de las cepas aisladas a amoxicilina, la terapia dual (inhibidores de la bomba de protones y amoxicilina) consiguió una tasa de curación para las cepas sensibles a amoxicilina del 66% solamente. Esto demuestra la presencia de importantes factores adicionales e independientes de la resistencia bacteriana que se relacionan con el éxito del uso de este antibiótico49, en especial si tomamos en cuenta que no parece posible que las formas cocoides sean sensibles a los antibióticos β-lactámicos porque tienen diferentes perfiles de proteínas de unión a penicilina en comparación con las formas bacilares50. Es probable, entonces, que no todos los organismos de H. pylori se eliminen completamente luego del tratamiento de erradicación, sino que algunos de ellos pueden transformarse en formas cocoides y volverse resistentes a los fármacos antibacterianos, lo que tal vez contribuya al fracaso del tratamiento y a la recrudescencia13,34,45.
Vale destacar que estudios muy recientes demostraron que los ácidos grasos libres, como el ácido linolénico y el ácido linolénico liposomal, poseen un efecto bactericida sobre ambas formas, independientemente de su estado de resistencia a otros antibióticos. Por lo tanto, estas moléculas pueden tener un potencial efecto antimicrobiano eficaz para tratar la infección por H. pylori, en especial en su forma cocoide51,52.
Virulencia y patogenicidad de la forma cocoideLos factores de virulencia de la forma bacilar de H. pylori y los mecanismos por los cuales estas bacterias se involucran en el desarrollo de enfermedades gastrointestinales están extensamente estudiados1,3,4. Sin embargo, es poco lo que se sabe acerca de la virulencia y la patogenicidad de la forma cocoide; a continuación revisaremos las evidencias más relevantes sobre este tema.
Al igual que la forma bacilar, la forma cocoide expresa importantes genes de virulencia, como ureA, ureB, hpaA, vacA y cagA, cagE y BabA35,53,54. Esta expresión ocurre por un largo tiempo, y probablemente juegue un rol importante en la enfermedad crónica y severa del estómago.
Sabemos que la adhesión de H. pylori al epitelio gastroduodenal es un paso importante en la inducción de la inflamación crónica activa de la capa mucosa. Estudios de ME hallaron que la forma cocoide de H. pylori puede presentarse en la superficie de la membrana plasmática de las células epiteliales gástricas y, al igual que las formas bacilares, tienen la capacidad de invadirlas15,55. Si la invasión celular ocurre, las formas cocoides se encierran en vesículas de membrana de doble capa y las células epiteliales gástricas aparecen hinchadas y líticas, evidenciando la erosión de la capa mucosa56. Teniendo en cuenta que la forma cocoide tiene menor susceptibilidad a los antibióticos, se cree que estas formas latentes en la membrana plasmática pueden extenderse para infectar otras células epiteliales vecinas en ausencia de una concentración eficaz de antibiótico57.
También es sabido que la infección por H. pylori induce una respuesta inmune local incapaz de erradicar la bacteria, permitiendo así la cronicidad de la enfermedad gástrica. La respuesta inmune puede ser determinada por medio de la detección de anticuerpos usando métodos serológicos desarrollados a base de la forma bacilar de H. pylori58. De hecho, la presencia de estos anticuerpos específicos se puede utilizar como un indicador epidemiológico de la infección y también para confirmar el éxito del tratamiento; no obstante, no existen métodos serológicos para detectar las formas cocoides. Para determinar si las formas cocoides tienen algún impacto en la respuesta inmune en individuos colonizados, Figueroa et al. establecieron una técnica específica de ensayo por inmunoabsorción ligado a enzimas para evaluar y comparar la respuesta inmune a las formas cocoides y bacilares contra un panel de sueros de individuos infectados sintomáticos y asintomáticos. Los investigadores revelaron que las formas cocoides de H. pylori son capaces de inducir una respuesta inmune humoral similar a la inducida por las formas bacilares en los individuos infectados59. En otro estudio realizado en pacientes niños con dolor epigástrico, se examinó el papel probable de la forma cocoide en la infección por H. pylori mediante el uso de ensayo por inmunoabsorción ligado a enzimas con antígenos preparados a partir de células de la forma bacilar y de la forma cocoide. Se encontró que el 13,3% de ellos eran seropositivos para antígenos de la forma bacilar y el 55,8% lo eran para antígenos de la forma cocoide, en contraste con la seropositividad de solo el 7,0 y el 26,5%, respectivamente, en niños asintomáticos. Esa diferencia de alrededor de 4 veces en la seropositividad entre los antígenos de las formas cocoide y bacilar en niños sintomáticos y asintomáticos indicaría un posible rol infectivo de la forma cocoide de H. pylori60.
En un modelo de ratones BALB/c, Cellini et al. inocularon por vía intragástrica concentraciones de H. pylori en su forma cocoide. H. pylori se aisló 2 semanas después, los cambios histopatológicos se produjeron al mes de la inoculación y todos los ratones colonizados mostraron una respuesta de anticuerpos sistémica a H. pylori61. Otros experimentos con animales inoculados con formas cocoides desarrollan cambios patológicos significativos a nivel del estómago, como la aparición de lesiones erosivas e infiltración de células inflamatorias en la mucosa gástrica36. She et al. inocularon por vía intragástrica a un grupo de ratones BALB/c con la forma bacilar de H. pylori y a otro grupo con la forma cocoide con el propósito de comparar la virulencia y la infectividad de ambas formas. En el examen con ME de las muestras tomadas de ambos grupos, los investigadores notaron la adherencia tanto de la forma bacilar como de la cocoide a las células epiteliales de la pared gástrica y la presencia de flagelos en las formas cocoides. El examen histológico mostró la aparición de diferentes grados de lesiones de la mucosa gástrica, desde infiltración de células inflamatorias leve hasta erosiones y ulceraciones. La lesión de la mucosa fue más leve en los ratones infectados por la forma cocoide y no se obtuvo resultado positivo en el grupo control que recibió agua estéril53. Rabelo-Gonçalves et al. mostraron que las formas cocoides de H. pylori fueron capaces de inducir una respuesta inflamatoria aguda en el estómago de ratones desde los períodos iniciales de la infección62. Estos resultados ponen de manifiesto la capacidad de las formas cocoides de colonizar e infectar la mucosa gástrica in vivo.
Varios estudios revelaron la presencia de la forma cocoide en agua33,63; en este sentido, en un experimento realizado por nosotros, hemos encontrado que la administración prolongada de agua de pozo y agua de red desde el momento del destete de ratones Wistar provocó el desarrollo de un proceso inflamatorio crónico con formación de placas linfocitarias y presencia de bacilos compatibles con H. pylori, en comparación con el grupo control, al cual se le administró agua estéril y biodestilada64.
Según lo mencionado anteriormente, sería lógico suponer que en condiciones desfavorables H. pylori se encuentra obligado a refugiarse en una etapa «quiescente», en la cual modifica su clásica forma bacilar a cocoide sin generar cambios degenerativos en su genoma, pero con la capacidad de volver de nuevo a la forma bacilar si las condiciones del entorno, o de su hábitat natural, mejoran.
Participación de la forma cocoide en la recrudescenciaLa recurrencia de H. pylori después de una erradicación exitosa es rara en los países desarrollados y es más frecuente en los países en vías de desarrollo, registrando una tasa de recurrencia anual del 2,67 y del 13%, respectivamente65,66.
Existen 2 tipos de recurrencia de la infección por H. pylori: la recrudescencia, cuando la cepa de la bacteria que causó la recurrencia es idéntica genéticamente a la aislada previamente a la erradicación, y la reinfección, cuando la recurrencia es producida por una cepa distinta67. Para diferenciar recrudescencia de reinfección se requiere la identificación de las cepas bacterianas mediante la reacción en cadena de la polimerasa o el análisis de polimorfismos genéticos67,68, métodos que no se suelen realizar de forma rutinaria, lo que, a su vez, hace que sea imposible, en términos absolutos, diferenciar entre recrudescencia y reinfección en la práctica clínica.
La recurrencia de H. pylori es clínicamente relevante debido a que la recaída de la úlcera péptica puede observarse en una proporción considerable de estos pacientes, y la reaparición de algunos microorganismos explicaría algunas recurrencias de linfoma MALT posteriores al tratamiento69. Se cree que factores ambientales como el agua potable, enfermedad dental y gingival, amigdalitis recurrente, pacientes internados, instrumental odontológico y médico y miembros de la familia influyen en la recurrencia de H. pylori70–72. También, se han propuesto como factores asociados a la recurrencia de la infección la menor edad, los jóvenes diabéticos, los bajos ingresos anuales y la inhibición a largo plazo de la secreción de ácido gástrico después de la erradicación73–76.
La recrudescencia se considera la razón más probable de recurrencia durante el primer año posterior a la erradicación, mientras que la reinfección puede darse después de un largo plazo68,77. En los países desarrollados muchos casos de recurrencia se deben en realidad a la recrudescencia, mientras que en los países en vías de desarrollo la reinfección es más común, ya que, aparentemente, las personas están constantemente expuestas a H. pylori65,78.
Por medio de técnicas de electroforesis de proteínas en geles de poliacrilamida, Costas et al. encontraron en pacientes que tuvieron recurrencia de la infección 4 semanas después de haber recibido un tratamiento de erradicación, que en realidad no fueron infectados con una cepa diferente de H. pylori, sino que la cepa que causó al principio la infección no se eliminó completamente durante el tratamiento y dio como resultado la recrudescencia de la infección79. Por lo tanto, es importante tener en cuenta la eficacia del esquema terapéutico, ya que la recurrencia de H. pylori es más frecuente en los pacientes tratados con terapia de baja eficacia, pero es excepcional cuando se utilizan terapias de alta eficacia. Con respecto a este concepto, en un estudio realizado sobre la incidencia de la recurrencia de H. pylori en España, Gisbert et al. encontraron que la recurrencia de H. pylori a los 6 meses de la erradicación fue del 8,2% en pacientes previamente tratados con terapias de baja eficacia, y solo del 1,7% cuando se utilizaron terapias de alta eficacia80.
En un estudio realizado en Corea en el cual se analizaron, de 2007 a 2010, las tasas de recurrencia de H. pylori después de 6 meses del éxito de las terapias de erradicación de primera y de segunda línea con un seguimiento anual por medio de pruebas de aliento, biopsia de estómago o test rápido de ureasa hasta finalizar el período del estudio, se halló que las tasas de recurrencia anual durante y después de 2 años de seguimiento fueron del 9,3 y 2,0%, respectivamente, luego de la terapia de primera línea, y del 4,5 y 2,9%, respectivamente, después de la terapia de segunda línea. Los autores concluyeron que las tasas de recurrencia anual de H. pylori mostraron un fuerte descenso después de 2 años de seguimiento luego de la erradicación; es necesario un intervalo de tiempo suficiente después del tratamiento para confirmar la erradicación y, por último, no sería fácil distinguir entre la recurrencia y la recrudescencia antes de los 2 años sin identificar las cepas de H. pylori81.
Consideraciones finales y conclusionesComprendiendo la capacidad de H. pylori de entrar en un estado VNC cuando se somete a condiciones desfavorables dentro o fuera de su hábitat, es razonable suponer entonces que, en algunos casos, el régimen de tratamiento antibiótico utilizado con el propósito de erradicar la forma bacilar de H. pylori podría inducir formas cocoides VNC capaces de sobrevivir durante mucho tiempo en el medio gástrico y duodenal, donde pueden tener un potencial directo e indirecto de patogenicidad que conlleva la recrudescencia de la infección y, como consecuencia, los fracasos del tratamiento, las recaídas de las infecciones y, finalmente, la recurrencia de la enfermedad gastroduodenal. Es decir, para el éxito de la erradicación, puede ser esencial no solo la erradicación de las formas bacilares, sino también la eliminación de las formas cocoides y/o el asegurarse de evitar la inducción de las mismas.
Debemos tener en cuenta que los métodos rutinarios implementados actualmente en la práctica clínica para confirmar la erradicación de H. pylori no logran detectar las formas cocoides, por lo tanto, el huésped podría ser diagnosticado incorrectamente como libre de infección; además, estos métodos pueden no ser suficientes para proporcionar evidencias totales del potencial clínico de los fármacos que se utilizan para la erradicación de H. pylori. Entonces, para considerar el éxito de la erradicación sería recomendable un seguimiento anual con técnicas no invasivas, especialmente en las zonas de alta prevalencia y en los pacientes con factores de riesgo de recurrencia de la infección, o bien, de disponerse, utilizar métodos moleculares para determinar si las bacterias han sido completamente eliminadas después del tratamiento.
Finalmente, resulta de gran interés conocer con profundidad la forma cocoide VNC de H. pylori, su capacidad patogénica, hasta qué punto está involucrada en la infección y en la recrudescencia y qué importancia tiene en la formación de biopelículas en el estómago y en otras localizaciones dentro del huésped, con el objetivo de desarrollar protocolos de diagnóstico más eficaces que eviten subestimar la colonización de H. pylori y diseñar nuevas estrategias terapéuticas destinadas a eliminar las formas cocoides y «desarmar» las biopelículas que forman.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Dr. Nuno F. Azevedo, del Departamento de Ingeniería Química de la Facultad de Ingeniería de la Universidad de Oporto (Portugal), por brindarnos las imágenes publicadas en este artículo.