El síndrome de hipersensibilidad a anticomiciales es una reacción adversa grave e impredecible, inicialmente descrita con antiepilépticos aromáticos, como la carbamacepina, la fenitoína y el fenobarbital. Suele caracterizarse por presencia de fiebre, eosinofilia, erupción cutánea y afectación de uno o más órganos internos. No existen criterios diagnósticos ni normas de tratamiento claramente establecidos. Es necesario un alto índice de sospecha para identificar esta entidad como un verdadero síndrome, suspender precozmente el fármaco implicado y evitar nuevas exposiciones. A continuación comunicamos un ilustrativo caso clínico y revisamos la literatura médica publicada.
Anticonvulsant hypersensitivity syndrome is an unpredictable, potentially fatal drug reaction to aromatic anticonvulsants such as carbamazepine, phenytoin and phenobarbital. The hallmark features include fever, eosinophilia, rash and involvement of one or more internal organs. Clearly established diagnostic criteria and treatment guidelines are lacking. A high index of suspicion is required to identify this syndrome, allowing early withdrawal of the drug and avoiding re-exposure. We report an illustrative case of anticonvulsant hypersensitivity syndrome and review the published literature.
El síndrome de hipersensibilidad a los anticomiciales es una reacción secundaria a los productos del metabolismo de este grupo de fármacos (fundamentalmente carbamacepina, fenitoína y fenobarbital), conocidos como arene óxidos. Fue descrito por primera vez en la década de 1950 por Chaiken y desde entonces las publicaciones sobre éste en la literatura médica internacional son escasas. Este hecho, unido a la gran variabilidad clínica de presentación, hace que la verdadera incidencia de esta entidad sea desconocida. En la mayoría de los casos cursa con fiebre, eosinofilia, rash y adenopatías, acompañado frecuentemente de fallo multiorgánico1. Presentamos un caso clínico ilustrativo y a continuación revisamos sus características fisiopatológicas y clínicas e incidimos en las distintas alternativas terapéuticas.
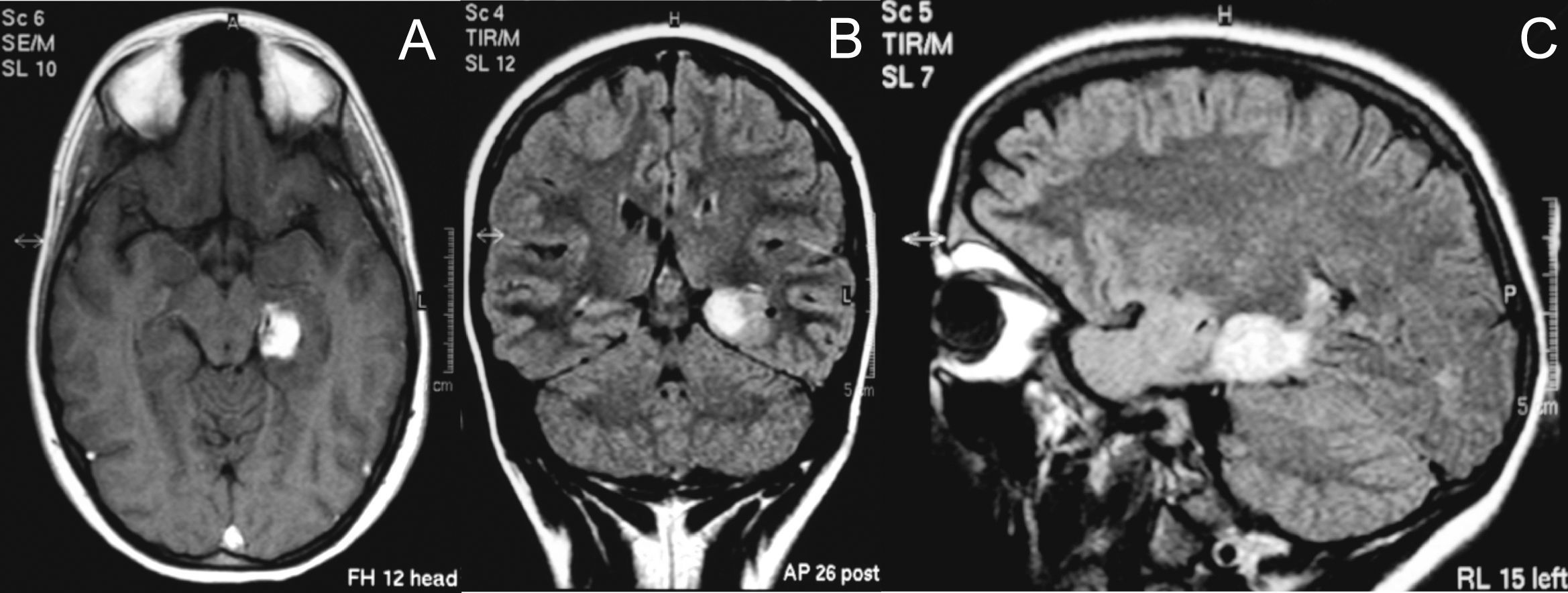
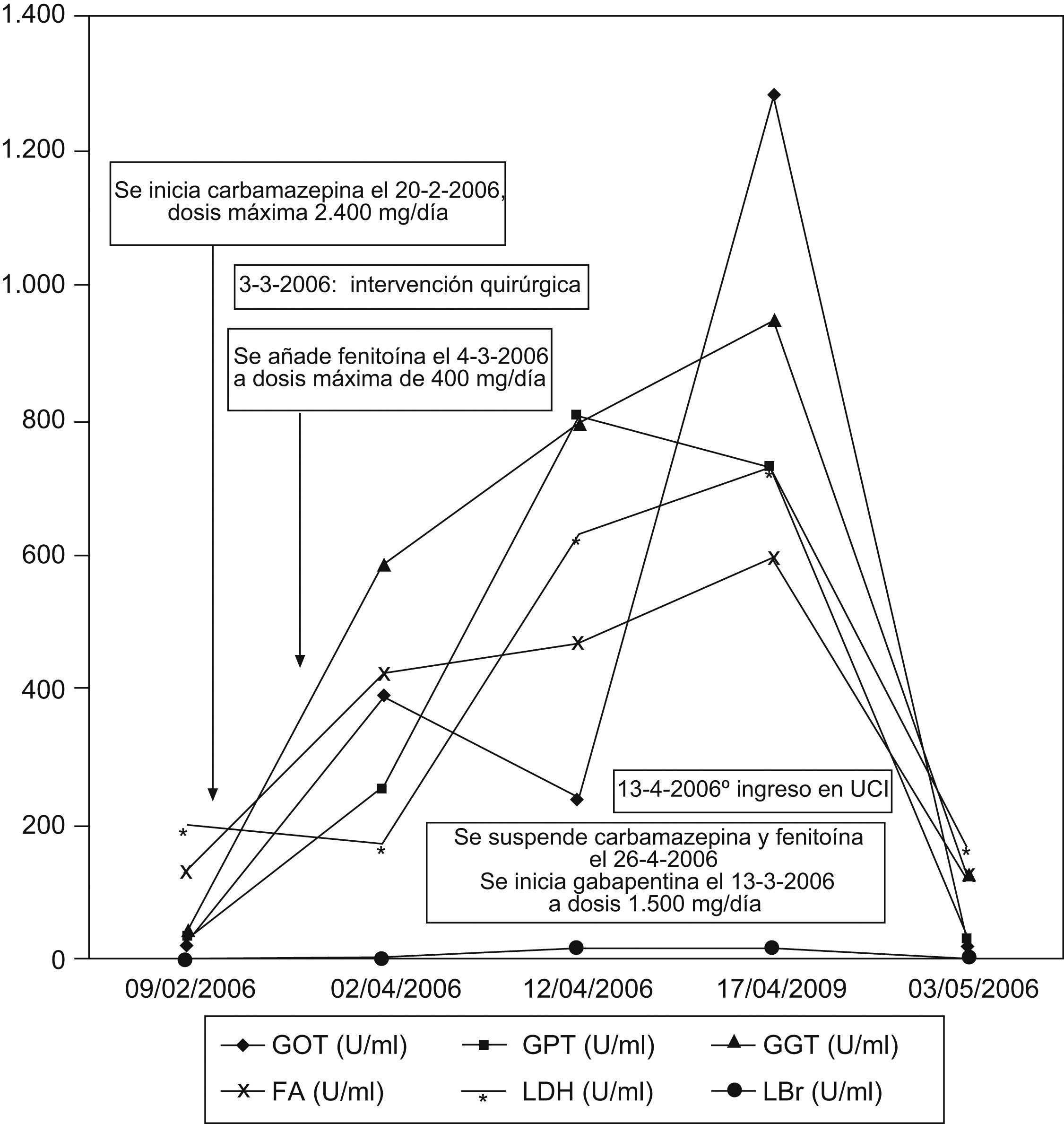
Observación clínicaMujer de 15 años sin antecedentes personales de interés que ingresó en neurología en febrero de 2006 por presentar desde hacía 6 meses episodios diarios de desconexión con el medio y movimientos anormales. La exploración física general y neurológica no evidenció hallazgos patológicos. Una analítica completa, incluyendo perfil hepático, hemograma y estudio de coagulación, no mostró alteraciones. Se realizó una RMN craneal, en la que se identificó una lesión sólida localizada en el parahipocampo izquierdo indicativa de gangliocitoma (fig. 1). Se realizaron estudios neurofisiológicos (electroencefalograma [EEG] en vigilia y registro vídeo-EEG durante vigilia y sueño), y se evidenció un fenómeno crítico compatible con crisis parciales complejas de origen temporal izquierdo. Se inició tratamiento con carbamacepina el 20 de febrero de 2006, y se aumentó la dosis de manera progresiva hasta un máximo de 2.400mg diarios. La paciente se operó el 3 de marzo de 2006, y se le realizó extirpación parcial de la lesión por ser muy sangrante y presentar infiltración vascular. El análisis de la pieza quirúrgica reveló que se trataba de un xantoastrocitoma pleomórfico. El día posterior a la cirugía se añadió fenitoína en dosis de 400mg diarios. El postoperatorio no presentó incidencias y se le dio de alta 20 días después de la intervención. El 2 de abril de 2006 ingresó nuevamente por un cuadro de fiebre de hasta 39°C, lesiones dérmicas pruriginosas y adenopatías laterocervicales y submandibulares intensamente dolorosas. La exploración neurológica no evidenció focalidad. La bioquímica hepática presentaba los siguientes valores: aspartato aminotransferasa (GOT/AST): 396U/l (rango de normalidad entre 4–50U/l), alanina aminotransferasa (GPT/ALT): 253U/l (rango de normalidad entre 5–40U/l), gammaglutamil transpeptidasa (GGT): 592U/l (rango de normalidad entre 10–50U/l), lactato deshidrogenasa (LDH): 428U/l (rango de normalidad entre 140–240U/l), fosfatasa alcalina (FA): 172U/l (rango de normalidad entre 53–128U/l), con bilirrubina (Br) normal (gráfico 1). Asimismo, presentaba leucocitopenia: 1,94×103μl y leve trombocitopenia: 127,0×103μl. La hemostasia no mostró alteraciones. Se descartó mediante las pruebas habituales un posible foco infeccioso subyacente (hemocultivos, orina elemental, urocultivo y radiografía simple de tórax). Ante la posibilidad de que se tratase de una reacción adversa en coincidencia temporal con la administración de carbamacepina o fenitoína, se suspendieron ambos fármacos el 12 de abril de 2006 y se inició tratamiento con ácido valproico. Tras este cambio, el perfil hepático incluso empeoró, por lo que el 13 de abril de 2006 todo el tratamiento previo se suspendió y se sustituyó por gabapentina en dosis de 1.500mg diarios. En ese momento presentaba un exantema maculopapular con formación de pústulas y seudovesículas, confluente en el área centrotorácica e interescapular, que respetaba las palmas y las plantas y no asociaba afectación ocular ni oral. Se realizó una biopsia de la piel del brazo, que fue compatible con toxicodermia, tras lo que se inició tratamiento esteroideo tópico e i.v. (1mg/kg/día i.v.). Se decidió iniciar tratamiento antibiótico empírico con ciprofloxacino y cloxacilina, que se sustituyeron después por vancomicina y cefepime. El perfil hepático empeoró (GOT: 239U/l, GPT: 809U/l, GGT: 809U/l, LDH: 633U/l y Br: 16,32mg/dl) y los eosinófilos subieron al 5%. Asimismo, la cifra de plaquetas disminuyó hasta las 2,0 plaquetas×103μl. La coagulación se alteró ligeramente (actividad de protrombina: 66%, INR: 1,4) y la cifra de leucocitos ascendió hasta alcanzar los 38,0×103μl, a expensas de neutrófilos (76%). En ese momento la paciente ingresó en la unidad de cuidados intensivos (13 de abril de 2006) con el diagnóstico de síndrome de hipersensibilidad a anticomiciales en forma de hepatitis tóxica y toxicodermia. Los anticuerpos no organoespecíficos, las hormonas tiroideas y las serologías para virus de la hepatitis A (VHA), virus de la hepatitis B (VHB), virus de la hepatitis C (VHC), virus de la hepatitis D (VHD), virus de la hepatitis E (VHE), citomegalovirus (CMV), virus de Epstein-Barr (VEB), virus del herpes simple (VHS), virus de la varicela zoster (VVZ), virus de la inmunodeficiencia humana (VIH), sífilis y toxoplasma fueron negativas. La alfafetoproteína y las inmunoglobulinas se encontraron dentro de los rangos normales, así como los valores de alfa-1-antitripsina, cobre, ceruloplasmima, crioglobulinas, anticuerpos no organoespecíficos, hierro, ferritina e índice de saturación de la transferrina. La ecografía abdominal identificó un parénquima hepático normal. El 17 de abril de 2006 se trasladó a la planta de gastroenterología, donde la bioquímica hepática alcanzó la mayor elevación (GOT: 1.292U/l, GPT: 735U/l, GGT: 955U/l, FA: 527U/l y Br: 15mg/dl). La cifra de eosinófilos llegó al 7% y a partir de ahí descendió progresivamente. En ese momento se solicitó valoración al servicio de hematología al presentar aumento de LDH, descenso de la haptoglobina, reticulocitos altos y test de Coombs directo e indirecto negativo, y se diagnosticó de hemólisis secundaria a tratamiento con fenitoína. Tres semanas después (3 de mayo de 2006), la paciente presentaba normalización de las alteraciones hematológicas y del perfil hepático, salvo GGT (130U/l) y Br (2,9mg/dl). Al alta (5 de mayo de 2006) habían desaparecido las lesiones cutáneas y se encontraba neurológicamente estable. En agosto de 2006 se le realizó radiocirugía sobre el resto del xantoastrocitoma, con resección completa. En septiembre y octubre de 2008 se revisó en consultas de neurocirugía y gastroenterología, respectivamente, y se encontró asintomática, sin nuevas crisis comiciales desde que inició el tratamiento con gabapentina, sin datos de recidiva tumoral en la RMN y con un perfil hepático rigurosamente normal.
A) Corte horizontal. B) Corte coronal. C) Corte sagital de la RMN craneal, en la que se observa una lesión sólida de 2×2cm localizada en el parahipocampo izquierdo con ligero edema adyacente e intensa captación de contraste. El análisis de la pieza quirúrgica identificó una tumoración glial con características histológicas e inmunohistoquímicas compatibles con xantoastrocitoma pleomórfico.
El síndrome de hipersensibilidad a fármacos es una reacción adversa grave con formas de presentación clínica muy variadas, aunque suele definirse por la presencia de fiebre, eosinofilia, reacción cutánea, adenopatías dolorosas y afectación de uno o más órganos (el hígado, el riñón, la piel, etc.)1,2. Los criterios diagnósticos de esta entidad no están bien definidos, aunque consideramos que podrían ser superponibles a los del síndrome de hipersensibilidad por alopurinol (tabla 1)3. Se ha descrito asociado a fármacos anticomiciales aromáticos (fenitoína, fenobarbital y carbamacepina, más frecuentemente), antibióticos, dapsona, minociclina y alopurinol, entre otros4,5. El síndrome de hipersensibilidad a anticomiciales es similar desde el punto de vista clínico a los 3 fármacos mencionados en primer lugar, aunque se han reportado más casos relacionados con carbamacepina y fenitoína. La elevada incidencia de reacciones cruzadas entre estos 3 antiepilépticos (hasta el 80%) desaconseja su uso en pacientes que hayan presentado este efecto indeseado6. También se han documentado casos asociados a anticomiciales no aromáticos, como el ácido valproico y la lamotrigina7. Igualmente, se han descrito casos de síndrome de hipersensibilidad por gabapentina. La gabapentina se elimina por vía renal, por lo que el riesgo de que se produzcan metabolitos reactivos es bajo. Por este motivo, muchos autores lo consideran como tratamiento de elección en pacientes con este antecedente8. En nuestro caso clínico, antes de recurrir a la gabapentina, se instauró tratamiento con ácido valproico. Es difícil discernir si el ácido valproico pudo empeorar la situación clínica o simplemente se trataba de la evolución natural secundaria a la toxicidad por carbamacepina o fenitoína. Si bien son pocos los casos de toxicidad asociada a valproico, no podemos descartar totalmente esta posibilidad. La asociación de fenitoína a carbamacepina puede producir cambios impredecibles en los niveles plasmáticos de ambos anticomiciales. Por un lado, la fenitoína es un potente inductor del metabolismo de la carbamacepina. Generalmente las concentraciones plasmáticas de carbamacepina son más altas en pacientes que toman sólo carbamacepina que en los que la toman en asociación a fenitoína. Por otro lado, el efecto de la carbamacepina sobre los niveles de fenitoína es menos predecible, y se ha descrito tanto aumento como disminución de los niveles séricos. La verdadera incidencia de esta entidad es desconocida, sin embargo, se estima que ocurre en una de cada 1.000 o 10.000 exposiciones. Los primeros síntomas, tal y como ocurrió en nuestra paciente, suelen comenzar a las 2–6 semanas de haberse iniciado el tratamiento. Este comienzo relativamente tardío de la sintomatología puede disminuir nuestro índice de sospecha y provocar un retraso en la suspensión del fármaco implicado, que podría ser mortal para el paciente9. La tríada de presentación clásica incluye fiebre, erupción cutánea y afectación de los órganos internos (usualmente el hígado y el riñón). Ya que es frecuente que uno de los órganos implicados sea el dominante desde un punto de vista clínico, es posible que esta entidad no sea reconocida inicialmente como un verdadero síndrome, con lo que se retrasa su diagnóstico y su tratamiento. Otros síntomas de presentación incluyen malestar general, mialgias, astenia, anorexia, faringitis y adenopatías cervicales. La fiebre puede llegar a ser de 40°C y usualmente cursa en forma de picos, lo que puede orientar erróneamente a descartar un proceso infeccioso. Suele ser el signo inicial, está presente en la mayoría de los pacientes, y especialmente en las formas más graves puede continuar varias semanas después de haberse suspendido el fármaco implicado. La afectación cutánea puede variar desde un exantema maculopapular leve hasta casos de síndrome de Stevens-Johnson y necrolisis epidérmica tóxica10,11. Típicamente, la cara, las palmas y las plantas aparecen respetadas, lo que ayuda al diagnóstico diferencial con otras entidades. Cuando las lesiones son ampollosas o pustulosas, se aconseja realizar una biopsia, cuyos hallazgos típicos evidencian una dermatitis espongiótica asociada a infiltrado linfocítico perivascular. Las adenopatías suelen ser dolorosas y de localización submandibular o laterocervical12. Analíticamente, es frecuente identificar linfocitosis atípica, eosinofilia y en ocasiones trombocitopenia, agranulocitosis o anemia. Se han descrito casos, aunque escasos, de síndrome de hipersensibilidad a anticomiciales asociados a anemia hemolítica con test de Coombs negativo, tal y como reportamos en nuestra comunicación12,13. La alteración de los parámetros hepáticos (aumento de aminotransferasas, enzimas de colestasis, hiperbilirrubinemia o coagulopatía) está presente hasta en el 50% de los pacientes. La mortalidad global cuando el hígado se encuentra implicado oscila entre el 18–40% y el fallo hepático agudo es la principal causa de fallecimiento. Las hepatitis ictéricas tienen un peor pronóstico que las anictéricas14. Las enzimas hepáticas pueden continuar en ascenso incluso tras haber suspendido el fármaco implicado, y la recuperación completa puede tardar hasta un año6,12. En nuestro caso clínico las enzimas hepáticas continuaron en ascenso a pesar de la suspensión de carbamacepina, fenitoína y ácido valproico, si bien se normalizaron completamente en menos de 3 meses. Otros órganos afectados con menor frecuencia son el riñón (nefritis intersticial y vasculitis), el SNC (encefalitis o meningitis aséptica), el pulmón (vasculitis, neumonitis intersticial y distrés respiratorio), la tiroides (hipotiroidismo y tiroiditis autoinmunitaria), el páncreas (pancreatitis aguda) y el colon (enterocolitis y colitis eosinofílica)10. En la tabla 2 se exponen las principales entidades por considerar para un preciso diagnóstico diferencial.
Criterios diagnósticos del síndrome de hipersensibilidad a alopurinol. Proponemos que esta misma jerarquización se utilice como herramienta diagnóstica en el síndrome de hipersensibilidad a anticomiciales
| 1. Historia documentada de ingesta de alopurinol |
| 2. Ausencia de ingesta de otro fármaco diferente al alopurinol que pudiera ocasionar un cuadro clínico similar |
| 3. Presencia de al menos 2 criterios mayores o un criterio mayor y un criterio menor |
3.1 Criterios mayores
|
| 3.2 Criterios menores: fiebre, adenopatías, eosinofilia y leucocitosis |
Diagnóstico diferencial del síndrome de hipersensibilidad a anticomiciales
|
VIH: virus de la inmunodeficiencia humana.
La patogenia del síndrome de hipersensibilidad a anticomiciales es desconocida. Es posiblemente multifactorial y además muestra una gran variabilidad individual6. En la mayor parte de los casos parece que los metabolitos reactivos de una molécula, más que el fármaco nativo, son los causantes finales, motivo por el que esta entidad también se ha denominado síndrome de metabolito reactivo. En el caso de los anticomiciales, el metabolito reactivo es un epóxido. Un déficit de epóxido hidrolasa provocaría un desequilibrio entre la formación y la detoxificación de estos metabolitos. De todos modos, esta hipótesis se ha puesto en duda, y se ha postulado que no existen alteraciones en los genes que regulan la actividad epóxido hidrolasa en todos los pacientes con historia de hipersensibilidad a los anticomiciales15,16. Como alternativa surgió la hipótesis de los haptenos, según la cual los metabolitos reactivos se unirían covalentemente a proteínas, cuya conformación quedaría alterada y serían reconocidas como extrañas por el sistema inmunitario del individuo afectado, lo que desencadenaría una respuesta inmunitaria patológica17–19. De todos modos, no todos los fármacos que forman metabolitos reactivos se han asociado a una mayor incidencia de reacciones idiosincrásicas, tal y como intenta explicarse mediante la teoría del daño. Esta teoría indica que el sistema inmunitario no diferencia simplemente las moléculas como propias o ajenas, sino que sólo responde ante una molécula ajena en caso de que ésta se asocie a una señal de alarma (muerte o estrés celular). El daño celular inducido por otros factores, como una cirugía o infecciones virales (especialmente VIH), parece incrementar también el riesgo de presentar una reacción idiosincrásica a fármacos20,21. El tratamiento de estos pacientes exige una suspensión precoz del fármaco implicado22. El papel de los esteroides sistémicos es controvertido, aunque su uso en dosis de 1–2mg/kg/día, en combinación o no con corticoides tópicos, es frecuente. En nuestro caso, tras una valoración sopesada, nos decantamos por su uso, asociado a tratamiento antibiótico empírico. Si se decide iniciar el tratamiento con esteroides, éste debe hacerse lo más precozmente posible, en altas dosis y por cortos períodos de tiempo. De todos modos, algunos autores no son partidarios de su utilización al considerar que aumentan el riesgo de infecciones cutáneas y sepsis10,22. Si la afectación cutánea es grave, se necesitarán cuidados meticulosos de las lesiones para evitar infecciones, adecuada hidratación y soporte nutricional. No hay estudios que demuestren una mayor supervivencia en los pacientes cubiertos con antibióticos empíricamente. Deben monitorizarse los parámetros hematológicos, renales y hepáticos de manera estrecha, pues pueden empeorar a pesar de haber suspendido el fármaco implicado. Por otro lado, ya que presenta una herencia genética autosómica dominante, los familiares de primer grado del caso índice tienen un riesgo incrementado de presentarla, por lo que deberán ser advertidos23. Un estudio reciente ha evaluado el papel de los test con parches cutáneos (patch tests) como herramienta diagnóstica complementaria en esta entidad. Esta técnica debería realizarse entre 2 y 6 meses después de haberse superado el síndrome de hipersensibilidad. Los casos de síndrome de hipersensibilidad a anticomiciales que más se beneficiarán de esta técnica son los provocados por carbamacepina y fenitoína y aquellas reacciones más graves24.
En conclusión, el síndrome de hipersensibilidad a anticomiciales es una reacción adversa de naturaleza idiosincrásica de etiopatogenia desconocida. Se han implicado con mayor frecuencia la fenitoína, la carbamacepina y el fenobarbital. Dado que su presentación clínica es muy variada, es preciso un detallado conocimiento de esta entidad para mantener un alto índice de sospecha clínica. La suspensión precoz del fármaco implicado sigue siendo la piedra angular del tratamiento.