INTRODUCCION
Tacrolimus (FK-506) es un antibiótico macrólido de gran acción inmunosupresora1,2. A pesar de sus diferencias estructurales con ciclosporina3, presenta un mecanismo de acción idéntico, actuando mediante la inhibición de la calcineurina y, por tanto, dando lugar a un bloqueo de la transcripción del gen de la IL-2, necesaria para la activación y la proliferación de linfocitos T4. Cuando se compara con ciclosporina, se observa que tacrolimus presenta una mejor absorción intestinal (independiente de la presencia de inflamación de la mucosa intestinal y de la existencia de flujo biliar), una potencia inmunosupresora 100 veces mayor y un menor número de efectos secundarios. Todo ello se une a la posibilidad de su administración inicial por vía oral5.
No obstante, la única indicación actualmente aprobada para su utilización consiste en la profilaxis y el tratamiento del rechazo del trasplante de órganos sólidos6. Sin embargo, en la literatura médica hay varias publicaciones que evalúan su utilización en otras enfermedades, principalmente con un sustrato autoinmune7, entre ellas la enfermedad inflamatoria intestinal (EII)8.
Nuestro objetivo primario ha sido evaluar la eficacia de tacrolimus en la EII luminal (tanto colitis ulcerosa [CU] como enfermedad de Crohn [EC]) principalmente corticorrefractaria, y en la gran mayoría de pacientes como puente a inmunosupresores de acción más lenta, como azatioprina y metotrexato. También, como objetivos secundarios hemos pretendido evaluar los requerimientos de cirugía en el período de seguimiento, la seguridad del tratamien to y el porcentaje de pacientes en que se consiguió la suspensión de corticoides. En los pacientes en que no se produjo la suspensión de corticoides, se analizó la reducción de éstos y la dosis media empleada en el segui miento.
PACIENTES Y MÉTODO
Pacientes
Desde febrero de 2001, momento en que iniciamos en nuestro centro el empleo de tacrolimus en casos de EII refractaria, se ha empleado este fármaco en 19 pacientes.
De ellos, 13 presentan una CU frente a 6 con EC. El diagnóstico fue establecido por los criterios clínicos, endoscópicos, radiológicos e histológicos estandarizados.
Todos los pacientes habían dado su consentimiento informado para la administración de tacrolimus después de discutir otras alternativas terapéuticas.
Antes de iniciar el tratamiento, se descartó la presencia de colitis infecciosa mediante la realización seriada de coprocultivos y determinación de la toxina de Clostridium difficile en heces.
En ninguno de los pacientes se encontró evidencia serológica o histológica de infección aguda por citomegalovirus.
Características del tratamiento
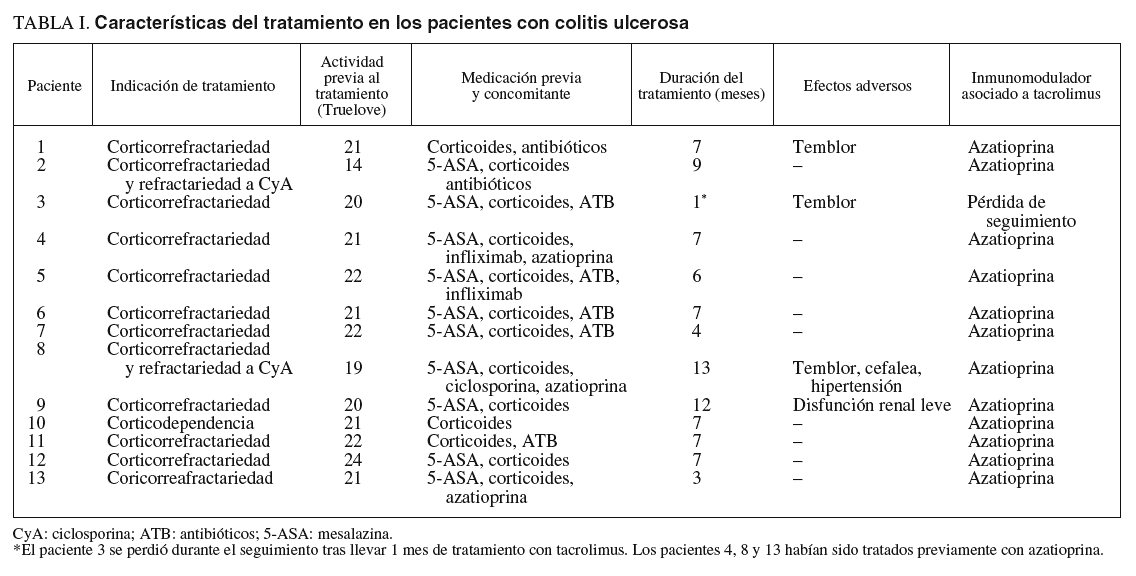
La dosis inicial empleada de tacrolimus fue de 0,15 mg/kg/día divididas en 2 tomas y administrada por vía oral (en un solo paciente se empleó por vía intravenosa en dosis de 0,015 mg/kg/día por presentar intolerancia digestiva durante 2 días). Posteriormente, la dosis se ajustó en relación con los valores en sangre total obtenidos, considerándose dentro del rango terapéutico los situados entre 5 y 15 ng/ml. La determinación de los valores se llevó a cabo cada 3 días la primera semana de tratamiento, semanalmente el mes posterior, y cada 2 semanas el resto del seguimiento. A su vez, y con la misma periodicidad, se monitorizaron los valores séricos de magnesio y colesterol relacionados con la presencia de neurotoxicidad producida por anticalcineurínicos. Se consideró corticorrefractarios a los pacientes que no respondieron a la administración de corticoides intravenosos a dosis de 1 mg/kg, al menos durante 7-10 días. Por otra parte, para catalogar de corticodependiente a un paciente, se utilizó la definición preconizada por Munkholm et al9 en publicaciones previas. Se empleó tacrolimus con el objetivo de servir como tratamiento puente hacia la instauración de inmunosupresores de acción más lenta (azatioprina/6-mercaptopurina y metotrexato). La administración de azatioprina se inició una vez conocidas las concentraciones de tiopurinmetiltransferasa (TPMT).
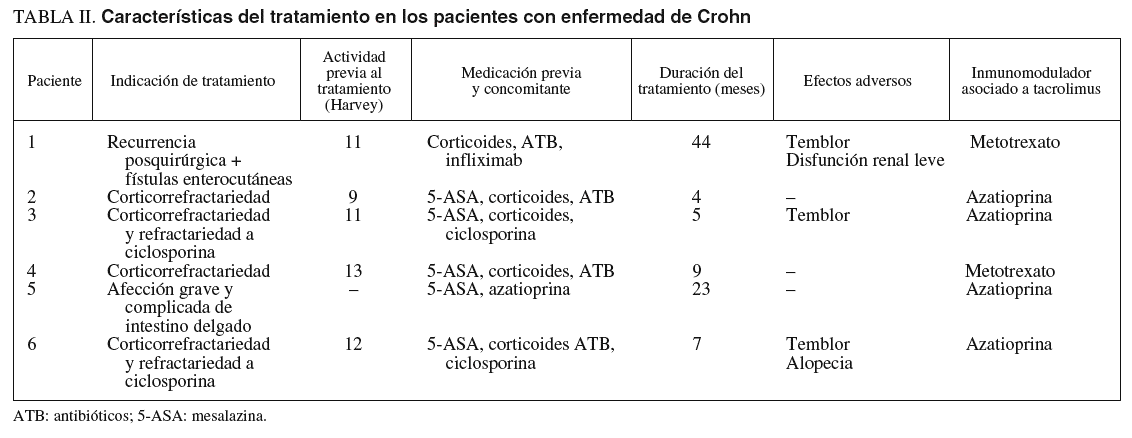
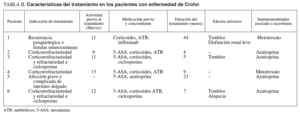
La indicación mayoritaria fue la corticorrefractariedad (16 pacientes), 4 de ellos refractarios a su vez a ciclosporina. En uno de los 3 pacientes restantes se instauró tacrolimus por presentar corticodependencia, en otro por una recurrencia grave posquirúrgica con enfermedad fistulosa enterocutánea, y en otro por una afección grave y difusa del intestino delgado.
La actividad clínica previa al tratamiento fue valorada mediante el índice de Truelove modificado en los pacientes con CU y por medio del indice de Harvey-Bradshaw para la EC; todos los pacientes presentaron una actividad moderada-grave. La duración media del tratamiento fue de 11 meses (3-13) en el grupo de CU frente a 15 meses (4-44) en el grupo de EC.
Medicación previa y concomitante
Los fármacos previamente utilizados y asociados a tacrolimus en los pacientes con CU fueron corticoides (100%), mesalazina (76%) y antibióticos (53%). Dos pacientes fueron refractarios a su vez a ciclosporina y en 3 pacientes se había empleado azatioprina previamente. En dos pacientes se empleó una infusión de infliximab10,11 de 5 mg/kg de rescate por presentar un deterioro clínico tras la mejoría inicial.
En el grupo de EC se asociaron corticoides (83%), antibióticos (66%) y mesalazina (83%). Dos pacientes fueron refractarios a ciclosporina y en uno se había empleado infliximab previamente.
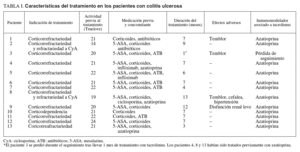
En las tablas I y II se resumen las características fundamentales del tratamiento en ambos grupos de pacientes.
Valoración de la eficacia
La eficacia de tacrolimus (principal objetivo de este estudio descriptivo y retrospectivo) en nuestra serie de pacientes fue valorada de la siguiente manera. Se analizó a los pacientes que se encontraban en remisión a las 4, 8 y 24 semanas del inicio del tratamiento; entendiendo remisión como la normalización del índice de actividad utilizado de forma basal (Truelove modificado en la CU e índice clínico de Harvey-Bradshaw en la EC) junto a la valoración conjunta de parámetros analíticos considerados reactantes de fase aguda (PCR y VSG). En la valoración a las 24 semanas, buena parte de los pacientes ya no toman tacrolimus y están en tratamiento con inmunomoduladores de acción más lenta (azatioprina, 6-mercaptopurina o metotrexato) como consecuencia de la estrategia inicial que pretendíamos (tacrolimus como fármaco puente).
Asimismo, como objetivos secundarios se valoraron el porcentaje de pacientes en los que se consiguió suspender los corticoides, la seguridad del tratamiento y el porcentaje de pacientes que precisaron cirugía. En caso de no conseguir la suspensión de la terapia esteroidea, se analizó la reducción de requerimientos de estos fármacos y la dosis media en el seguimiento.
RESULTADOS
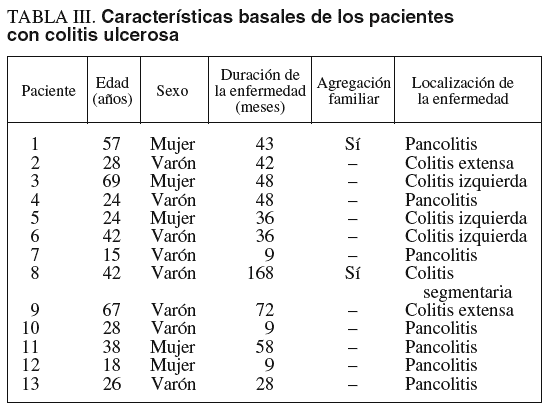
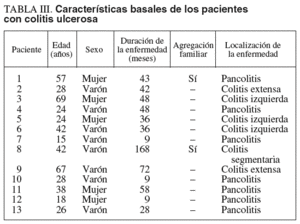
Las características basales de los pacientes con CU se recogen en la tabla III. De los 13 pacientes con CU, hubo un predominio del sexo masculino (8 varones frente a 5 mujeres), situándose la edad media en 36 años (rango, 16-69). La duración media de la enfermedad se situó en 46 meses (rango, 9-168), observándose una agregación familiar en 2 casos. Las colitis extensas y pancolitis supusieron las localizaciones principales de la enfermedad.
Las características basales de los pacientes con EC se recogen en la tabla IV.
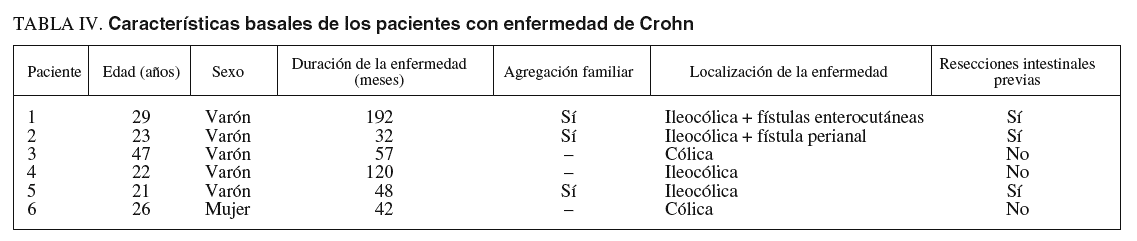
En el grupo de pacientes con EC también hubo un predominio del sexo masculino (5 varones/1 mujer), que presentaba una edad media de 28 años (rango, 21-47) y una duración media de la enfermedad de casi 89 meses (rango, 32-192). Había una agregación familiar en 3 casos y 3 de los pacientes habían sido sometidos a resección intestinal. La localización de la enfermedad fue mayoritariamente ileocólica (4 pacientes, uno de ellos con fístulas enterocutáneas), y los 2 pacientes restantes presentaban una afección cólica (uno de ellos con enfermedad perianal asociada).
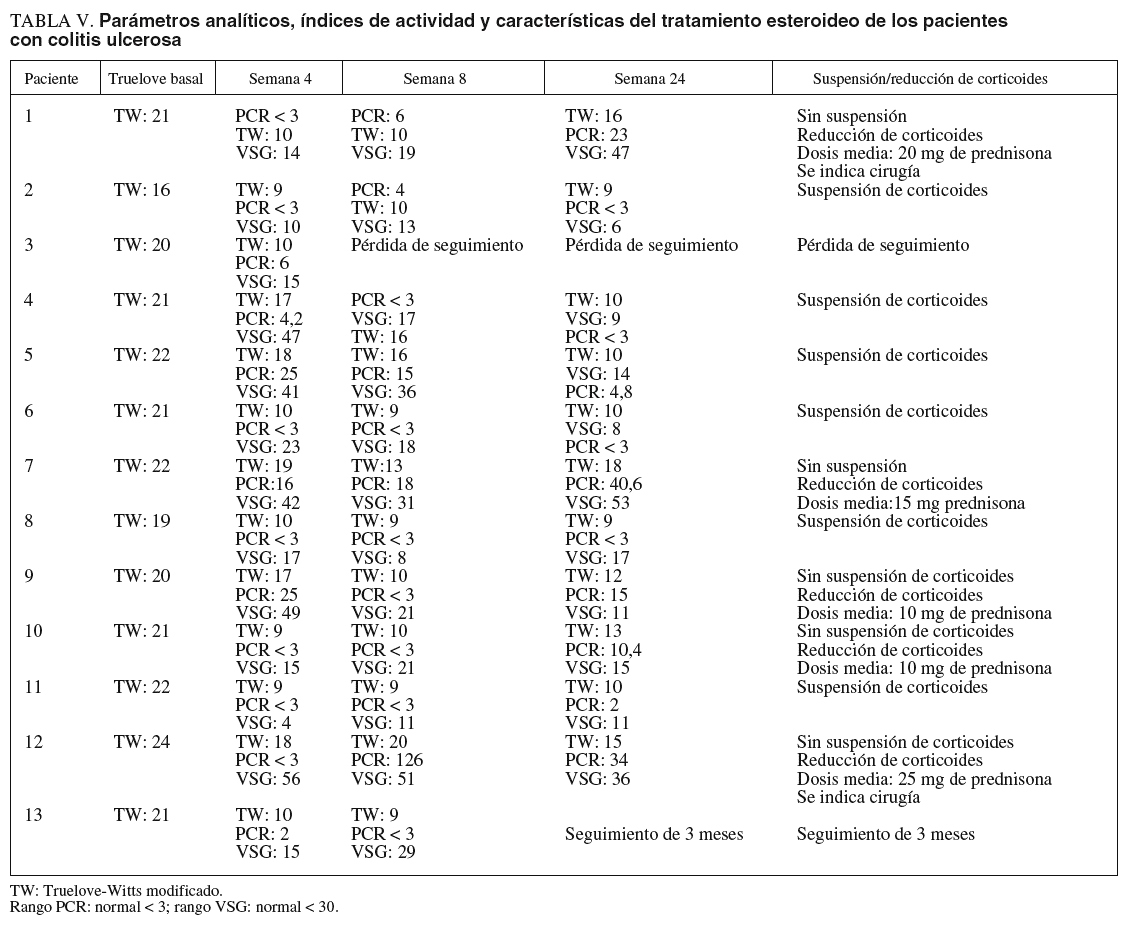
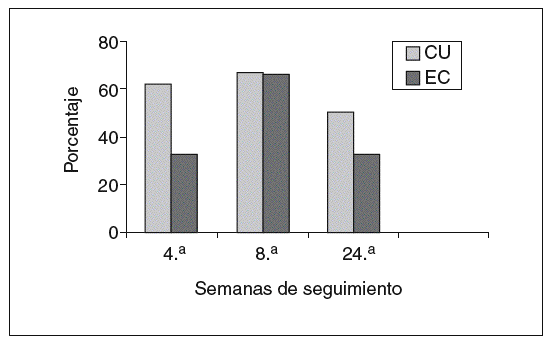
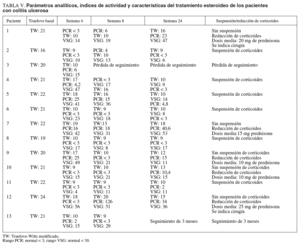
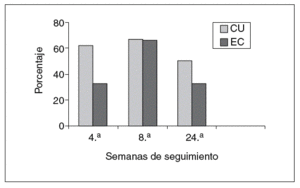
En el grupo con CU el 62, el 67 y el 50% de los pacientes se encontraban en remisión a las 4, 8 y 24 semanas, respectivamente. La retirada de corticoides se consiguió en un 55% de los pacientes con CU. En el resto de pacientes en que no se pudo retirar los esteroides, se redujo la dosis de éstos con una media de 16 mg/día de prednisona (rango, 10-25). La cirugía en este grupo se indicó en 2 (15%) pacientes con un seguimiento medio de 15 meses. En uno de los pacientes se realizó una proctocolectomía total con reservorio ileoanal a los 11 meses del inicio de tacro limus. En el otro paciente se ha indicado cirugía por refractariedad a tacrolimus y azatioprina (cirugía programada).
En la tabla V se describen los parámetros analíticos, los índices de actividad y las características del tratamiento esteroideo de los pacientes con CU.
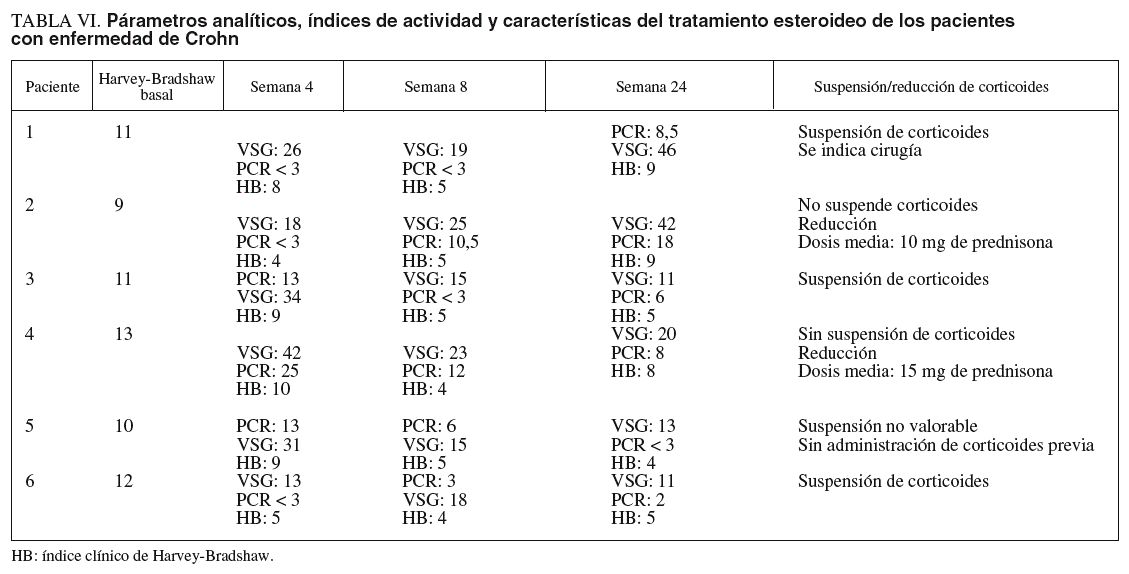
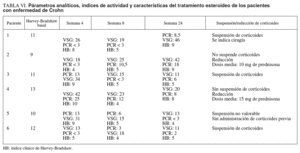
En los pacientes con EC (tabla VI), el 33, 66 y el 33% de los pacientes estaban en remisión en las semanas 4, 8 y 24, respectivamente. La suspensión de los corticoides pudo llevarse a cabo en el 60% de los pacientes. En el resto de pacientes en que no se supendieron los esteroides, se pudo disminuir en una dosis media de 12,5 mg de prednisona/día (rango, 10-15) en el período en cuestión. Un 16% (1 paciente) requirió cirugía en un seguimiento medio mayor al grupo de pacientes con CU (38 meses). El paciente presentaba una enfermedad extremadamente agresiva, refractaria tanto a tacrolimus como al resto de tratamientos empleados; se realizó una nueva resección de anastomosis ileocólica y surgió como complicación la presencia de fístulas enterocutáneas (cuarta intervención realizada desde el comienzo de la enfer-medad).
De forma global, considerando ambos grupos de pacientes, se observó el 47, el 66 y el 41% de remisiones a las 4, 8 y 24 semanas, respectivamente, desde el inicio de tratamiento. En cerca de la mitad de los pacientes los corticoides pudieron ser retirados y un 16% requirió cirugía en un seguimiento medio de 26 meses.
Efectos adversos
El 44% de los pacientes presentó efectos adversos relacionados con la administración del fármaco. Todos ellos fueron considerados leves y se manejaron de forma conservadora en todos los casos. Por su frecuencia destaca la afección neurológica manifestada en forma de temblor (6 pacientes), que mejoró con la disminución de la dosis. Otros efectos adversos menos frecuentes fueron hipertensión arterial (1 paciente), cefalea (1 paciente), alopecia (1 paciente) y disfunción renal leve (2 pacientes). No se han documentado infecciones oportunistas12 en el seguimiento ni la necesidad de retirada del fármaco en relación con efectos adversos graves.
DISCUSION
En un intento por ampliar el arsenal terapéutico disponible en el tratamiento de la EII refractaria, y extrapolando la experiencia y los resultados de tacrolimus en otras entidades autoinmunes, así como en el campo del trasplante de órganos, desde hace una década se han publicado diversos estudios abiertos en los que se relatan series cortas de pacientes afectados de EC y CU (generalmente refractarios a corticoides), donde se ha empleado este anticalcineurínico. Con estas publicaciones se pretendía hacer frente a tres incógnitas sobre la utilización de este fármaco en el ámbito de la EII: efectividad, seguridad y evitación de cirugía a corto y largo plazo.
Sandborn et al13 publicaron los 3 primeros casos de EC tratados con tacrolimus por vía oral en dosis de 0,15-0,29 mg/kg/día ajustadas para conseguir valores plasmáticos de 10-20 ng/ml. Se asistió a una rápida mejoría sintomática de los pacientes. Los 3 pacientes presentaron efectos adversos reversibles en relación con la dosis recibida. Fellermann et al14,15 compararon las vías oral e intravenosa en 38 pacientes con CU refractaria. En este estudio se administró tacrolimus en dosis de 0,01-0,02 mg/kg/día en el caso de tratamiento intravenoso, o 0,1-0,2 mg/kg/día por vía oral. Se utilizó tacrolimus como tratamiento puente a azatioprina, y no se observaron diferencias entre las dos vías de administración. En cuanto a la seguridad, a pesar de una apreciable frecuencia de efectos adversos (50%), la mayoría de ellos fueron reversibles al reducir la dosis y se evitó la colectomía en la mitad de los casos (seguimiento de 2 años).
Baumgart et al16 presentaron una serie de 31 casos de enfermedad inflamatoria refractaria tratados con dosis bajas de tacrolimus (0,1 mg/kg/día) por via oral (6 EC, 23 CU y 2 pouchitis) con un período de seguimiento de 12 meses (rango, 1-137). El 90% experimentó una mejoría clínica y biológica, y el 64,5% consiguió la remisión. Se produjeron efectos adversos en 9 pacientes (30%); todos ellos reversibles al disminuir la dosis. A 3 pacientes con CU se les realizó una colectomía.
Bousvaros et al17,18 utilizaron también tacrolimus en la población pediátrica en un estudio abierto y multicéntrico, donde se recogen 14 pacientes con EC y CU grave. Se administró tacrolimus en dosis bajas (0,1 mg/kg/día). El 69% de los pacientes respondieron inicialmente, manteniendo respuesta sólo un 38% de los pacientes al año de seguimiento.
Hogenauer et al19 publicaron 9 casos con CU refractaria tratada con tacrolimus en dosis de 0,15 mg/kg/día como puente a azatioprina, con mejoría sintomática en el 67% de los pacientes. En este estudio hubo efectos secundarios en todos los pacientes, que fueron graves en 2 de ellos (trombocitopenia y bicitopenia). Tras un seguimiento de 21 meses, 3 pacientes precisaron colectomía.
Un único estudio ha evaluado la respuesta a tacrolimus sin la asociación a inmunosupresores de inicio de acción lenta. En dicho artículo, Ierardi et al20-22 tratan a 13 pacientes con EC corticorrefractaria con tacrolimus en dosis de 0,1-0,2 mg/kg/día por vía oral, empleando como medicación concomitante mesalazina o nutrición enteral. En 11 de los 13 casos se produjo una mejoría significativa, que persistía al año de seguimiento en 9 casos (69%). Se produjeron efectos adversos en el 46% de los pacientes, reversibles al disminuir la dosis. Únicamente en un caso la medicación tuvo que suspenderse por persistencia de temblores incapacitantes.
Por último, en el ámbito de la enfermedad perianal, Lowry et al23 publicaron 11 casos de pacientes con EC perianal tratados con dosis de tacrolimus de 0,15-0,31 mg/kg/día por vía oral, asociado a azatioprina. Todos los pacientes mejoraron y consiguieron una respuesta completa en 7 casos, con un seguimiento de 13,5 meses. Sandborn et al24 han publicado el único estudio controlado sobre el empleo de tacrolimus en la EC fistulizante. Se incluyó a 48 enfermos con EC perianal o fístulas en-terocutáneas. Fueron aleatorizados a recibir tratamiento con tacrolimus (0,2 mg/kg/día) por vía oral frente a placebo durante 10 semanas. Todos los pacientes seguían tratamiento concomitante con azatioprina u otros inmunosupresores en dosis estables durante, al menos, 12 semanas. El 43% de los pacientes tratados con tacrolimus mejoraron con respecto al 8% de los tratados con placebo. No hubo diferencias en el cierre de fístulas en los dos grupos (el 10 frente al 8%). La práctica totalidad de los pacientes tratados con tacrolimus presentó efectos adversos, que fueron reversibles con la reduccion de la dosis.
Fig. 1. Representación gráfica de porcentajes de pacientes en remisión. CU: colitis ulcerosa; EC: enfermedad de Crohn.
De Oca et al25 publicaron los resultados de un estudio en que se incluía a 19 pacientes con EC perianal y rectal, reservoritis y cuffitis con afección grave de la función del reservorio ileoanal. La duración media del trata miento fue de 9 meses observándose en el grupo de enfermedad perianal un 66% de respuestas completas y un 33% de respuestas parciales, con desaparición de inflamación, estenosis y úlceras. En los pacientes con re ser-voritis y cuffitis se puso de manifiesto globalmente un 77% de respuestas parciales y completas. Los efectos adversos fueron mínimos y se controlaron regulando la dosis.
En nuestra serie de pacientes, abierta y no controlada, utilizamos tacrolimus en la mayoría de los pacientes con enfermedad inflamatoria luminal corticorrefractaria como tratamiento puente a inmunosupresores de inicio de acción más lenta (azatioprina y metotrexato). En cuanto a la eficacia, las cifras alcanzadas son similares a las descritas en los estudios previos, observándose una respuesta más precoz a tacrolimus en el caso de los pacientes con CU. Esta respuesta discretamente más rápida en la CU parece razonable, al tratarse como ciclosporina, de un anticalcineurínico (muestra una menor efectividad en pacientes con EC luminal). Es llamativa a su vez la respuesta en 4 de los pacientes que previamente habían sido refractarios a ciclosporina. Si bien las tasas de remisión en la semana 8 tras el tratamiento son casi identicas en pacientes con CU y EC (el 67 frente al 66%), la remisión precoz en la semana 4 y el porcentaje de pacientes que se encuentran en remisión a las 24 semanas es inferior en el grupo de pacientes con EC. También es apreciable la consecución de la retirada de esteroides en casi la mitad de los pacientes, y la reducción de la posología en los pacientes en que no se consiguió su suspensión completa. En cuanto a los efectos adversos, en los estudios previos destacó la presencia de alteraciones de la esfera neurológica manifestada en forma de temblor (6 pacientes). De ellos, el temblor fue el principal efecto adverso: apareció en 6 pacientes y mejoró con la disminución de la dosis. Aunque su aparición se relaciona con la sobredosificación, el temblor ha aparecido en pacientes con valores considerados óptimos, pero no así en pacientes con valores sanguíneos del fármaco más elevados. Es probable que la neurotoxicidad dependa, además de los valores alcanzados por el fármaco, de algún tipo de susceptibilidad individual no conocida. El aumento de las cifras de creatinina sérica se apreció en 2 pacientes y no se observaron infecciones oportunistas graves. Como se recoge en la bibliografía, los efectos adversos mejoraron con la disminución de la dosis y no se tuvo que suspender tacrolimus por la presencia de éstos. Tres de los pacientes fueron sometidos a colectomía en el período de seguimiento, 2 de ellos con CU (se guimiento de 15 meses) y uno con EC (seguimiento de 38 meses).
De forma global, las cifras de eficacia obtenidas animan a seguir evaluando tacrolimus de una forma controlada y en series con mayor número de pacientes en la EII refractaria luminal, principalmente como puente a la actuación de inmunosupresores de inicio de acción lento. El empleo de otra estrategia, esto es, utilizar tacrolimus sin asociación con otros inmunosupresores, como plantean Ierardi et al, parece también prometedora a tenor de los resultados que comunican.