En los últimos años, tras la introducción del tratamiento antirretroviral de gran actividad, las hepatopatías, especialmente las relacionadas con VHC, han emergido como una de las causas de muerte más frecuentes en los pacientes con infección por VIH (VIH+). Ello ha llevado a la creciente indicación de trasplante hepático en esta población. La supervivencia postrasplante de los pacientes VIH+ con hepatopatías no asociadas a VHC es correcta y similar a la de pacientes VIH−. En cambio, la supervivencia en pacientes coinfectados VIH-VHC es modesta (aproximadamente, 50% a 5 años del trasplante). La principal causa de muerte en estos pacientes es la recidiva de hepatitis C. La infección por VIH se mantiene adecuadamente controlada con tratamiento antirretroviral de gran actividad después del trasplante en la práctica totalidad de pacientes. Otros aspectos de interés son la selección de candidatos para trasplante y la interacción entre el tratamiento antirretroviral de gran actividad y los inmunosupresores.
During the few last years, after the introduction of high activity antiretroviral therapy (HAART), liver diseases, particularly those related to HCV infection, have emerged as one of the most important causes of mortality in patients with HIV infection. Consequently, liver transplantation is increasingly indicated in this population. Post-transplantation survival in HIV-positive patients with non-hepatitis C virus (HCV) liver diseases is adequate and similar to that in HIV-negative patients. In contrast, survival in patients coinfected with HIV and HCV is only moderate (around 50% at 5 years after transplantation). The main cause of mortality in these patients is HCV recurrence. In almost all patients, HIV infection remains controlled with HAART after liver transplantation. Other issues of interest in this setting are the selection of liver transplantation candidates and the frequent interactions between HAART and immunosuppressive drugs.
Aunque los pacientes con infección por VIH pueden presentar una gran variedad de enfermedades hepáticas1–3 (tabla 1), las más frecuentes son la cirrosis y el hepatocarcinoma, predominantemente en relación con la coinfección por VHC y, en menor medida, por VHB.
Enfermedades hepáticas en pacientes con infección por VIH
Infecciones
|
Tumores
|
Hepatotoxicidad
|
Otras
|
En España, a principios de la década del 2000 se estimaba que aproximadamente el 50–60% de pacientes con infección por VIH estaban coinfectados con el VHC4, debido a que las vías de transmisión de ambos virus son similares. Sin embargo, en los últimos años, debido al descenso de la drogadicción por vía parenteral, la coinfección por VHC ha disminuido de forma paralela, siendo su incidencia de alrededor del 20% en los nuevos pacientes infectados por VIH5. En pacientes con coinfección por VIH-VHC, la hepatitis C presenta una evolución acelerada en comparación a la de pacientes monoinfectados por VHC, de forma que la progresión a cirrosis es más rápida1,6–8. Tras el desarrollo de cirrosis, estos pacientes presentan una evolución más rápida que la de los pacientes cirróticos monoinfectados por VHC, con una supervivencia después del primer episodio de descompensación clínica de la hepatopatía más corta que la de pacientes monoinfectados por VHC9,10. Las razones para estos hechos son varias, pero las más relevantes son el papel del VIH como potenciador de la agresividad del VHC y la menor tasa de respuesta sostenida al tratamiento antiviral anti-VHC en pacientes coinfectados por VIH6,11–14. Otros factores contributorios podrían ser el consumo de alcohol y cannabis (relativamente frecuente en pacientes con infección por VIH)15–17 y la posible hepatotoxicidad de determinados agentes antirretrovirales18,19.
Alrededor del 5–7% de pacientes con infección por VIH de nuestro país presentan coinfección por VHB4,20. El impacto de la coinfección VIH-VHB es menor que el de la coinfección VIH-VHC debido a que distintos fármacos antirretrovirales también poseen acción antiviral contra el VHB, de manera que la replicación del VHB se puede controlar mucho más fácilmente, enlenteciendo de forma muy importante la progresión de la hepatopatía causada por este virus.
El desarrollo de hepatocarcinoma y su posterior evolución en pacientes con infección por VIH podrían ser más acelerados que en pacientes no infectados por VIH21,22, aunque estos hechos todavía no están bien establecidos.
Dado que una proporción notable de pacientes con infección por VIH acaban presentando hepatopatía crónica terminal o hepatocarcinoma, la posibilidad de trasplante hepático en pacientes con infección por VIH se plantea cada vez con mayor frecuencia. A continuación, se comentan los resultados obtenidos con el trasplante hepático en pacientes con infección por VIH.
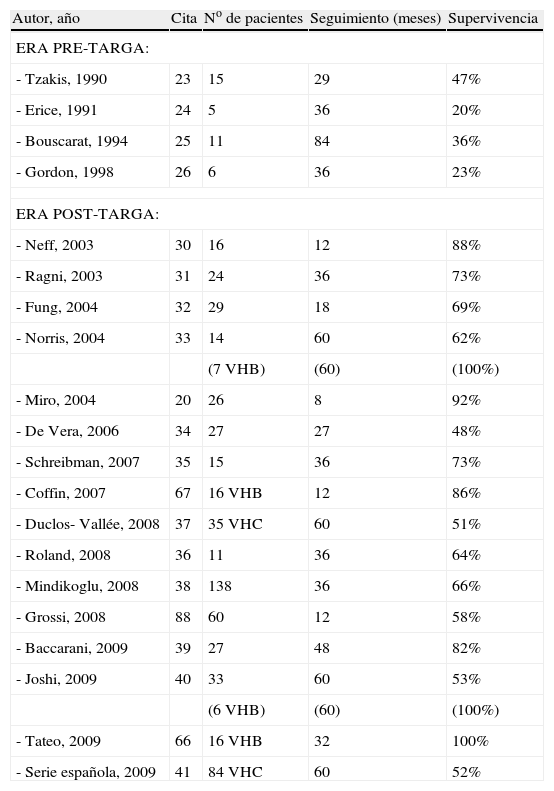
Trasplante hepático en pacientes con infección por VIHEn las décadas de los 80 y 90, algunos centros empezaron a realizar trasplantes hepáticos en pacientes con infección por VIH. Sin embargo, los resultados obtenidos fueron insatisfactorios, reportándose una sobrevida postrasplante a mediano plazo (seguimiento: 2–7 años) que fluctuó entre el 20–47%23–26 (tabla 2). La principal causa de esta supervivencia reducida fue el desarrollo de SIDA después del trasplante, con la consiguiente mortalidad asociada a este hecho. Por ello, durante bastantes años se consideró la existencia de infección por VIH como una contraindicación formal para el trasplante hepático. No obstante, con la introducción del tratamiento antirretroviral de gran actividad (TARGA) en el año 1996, se logró detener o lentificar mucho la progresión de la infección por VIH en numerosos pacientes. Ello ha comportado dos hechos de relevancia en el contexto del trasplante hepático. Por un lado, se ha asistido a una importante disminución de mortalidad por SIDA, lo que ha permitido que los pacientes con infección por VIH tengan tiempo de desarrollar hepatopatías severas. De hecho, en la actualidad las enfermedades hepáticas, especialmente las relacionadas con infección por VHC, representan una de las causas de mortalidad más frecuentes en estos pacientes27–29. Por otro lado, existe la posibilidad de controlar la infección por VIH mediante TARGA antes y después del trasplante y, por tanto, sin riesgo significativo aparente de desarrollo postrasplante de SIDA, lo que abriría expectativas de supervivencia mucho mejores que en la era previa al TARGA.
Supervivencia en la era pre y post TARGA
| Autor, año | Cita | No de pacientes | Seguimiento (meses) | Supervivencia |
| ERA PRE-TARGA: | ||||
| - Tzakis, 1990 | 23 | 15 | 29 | 47% |
| - Erice, 1991 | 24 | 5 | 36 | 20% |
| - Bouscarat, 1994 | 25 | 11 | 84 | 36% |
| - Gordon, 1998 | 26 | 6 | 36 | 23% |
| ERA POST-TARGA: | ||||
| - Neff, 2003 | 30 | 16 | 12 | 88% |
| - Ragni, 2003 | 31 | 24 | 36 | 73% |
| - Fung, 2004 | 32 | 29 | 18 | 69% |
| - Norris, 2004 | 33 | 14 | 60 | 62% |
| (7 VHB) | (60) | (100%) | ||
| - Miro, 2004 | 20 | 26 | 8 | 92% |
| - De Vera, 2006 | 34 | 27 | 27 | 48% |
| - Schreibman, 2007 | 35 | 15 | 36 | 73% |
| - Coffin, 2007 | 67 | 16 VHB | 12 | 86% |
| - Duclos- Vallée, 2008 | 37 | 35 VHC | 60 | 51% |
| - Roland, 2008 | 36 | 11 | 36 | 64% |
| - Mindikoglu, 2008 | 38 | 138 | 36 | 66% |
| - Grossi, 2008 | 88 | 60 | 12 | 58% |
| - Baccarani, 2009 | 39 | 27 | 48 | 82% |
| - Joshi, 2009 | 40 | 33 | 60 | 53% |
| (6 VHB) | (60) | (100%) | ||
| - Tateo, 2009 | 66 | 16 VHB | 32 | 100% |
| - Serie española, 2009 | 41 | 84 VHC | 60 | 52% |
TARGA: Tratamiento anti-retroviral de gran actividad
Todo ello ha llevado a que, en la presente década, distintos centros hayan vuelto a realizar trasplantes hepáticos en pacientes con infección por VIH con resultados aceptables (tabla 2). Aunque una buena parte de estudios publicados al respecto son retrospectivos, con pocos pacientes o con seguimiento de corta duración20,30–35, en la actualidad empiezan a obtenerse resultados de estudios prospectivos, generalmente multicéntricos, realizados en distintos países (como Estados Unidos, Francia, Italia y España), con un número elevado de pacientes y con seguimiento postrasplante prolongado36–41. Hasta el momento de la redacción de este artículo, estos estudios, tomados globalmente, muestran los siguientes resultados a destacar: a) en la gran mayoría de pacientes trasplantados, la indicación de trasplante es la existencia de cirrosis asociadas a infección por VHC y, en menor grado, a infección por VHB; b) la frecuencia de indicación de trasplante por hepatocarcinoma es variable de una serie a otra, fluctuando entre el 6–20%; c) la supervivencia a corto plazo es elevada, de alrededor del 80% al año del trasplante, que es una cifra comparable a la obtenida en pacientes sin infección por VIH y con hepatopatías similares, y d) esta buena supervivencia se mantiene elevada a largo plazo en receptores de trasplante por hepatopatías de etiologías distintas del VHC, como hepatopatías causadas por VHB o alcohol, pero la supervivencia a mediano y largo plazo decae gradualmente de forma notable cuando se analizan solamente pacientes con coinfección VIH-VHC, de forma que, en estos pacientes, la probabilidad de supervivencia a los 5 años es de aproximadamente 50%.
En los siguientes apartados del artículo, se comentan diversas particularidades del trasplante hepático en pacientes con infección por VIH y que, en cierta medida, representan aspectos diferenciales entre estos pacientes y los pacientes no infectados por VIH.
Aspectos pretrasplante hepáticoSelección de candidatos para trasplante hepáticoLos criterios utilizados actualmente en la selección de candidatos para trasplante hepático portadores de infección por VIH son similares en todos los grupos que realizan trasplantes en este tipo de pacientes42,43. En España se utilizan los criterios establecidos conjuntamente por las autoridades sanitarias y los distintos centros participantes en un estudio prospectivo iniciado en 200142. Estos criterios son los siguientes (tabla 3):
- 1.
En relación a la enfermedad hepática. Se utilizan los mismos criterios y la misma metodología de evaluación de candidatos que para los pacientes sin infección por VIH. Esencialmente, las indicaciones para trasplante hepático son: a) cirrosis avanzada, con algún signo de descompensación clínica y puntuación elevada en el Child-Pugh score o el MELD score; b) hepatocarcinoma con criterios de Milán, o c) otras enfermedades hepáticas que comprometan la vida del paciente. Para más detalles, consultar diversos documentos de consenso publicados por la Sociedad Española de Trasplante Hepático44–46.
- 2.
En relación a la infección por VIH. El criterio fundamental es que esta infección esté controlada, lo que implica que: a) la carga viral sea indetectable o que, al menos, exista posibilidad de tratamiento antirretroviral efectivo después de trasplante; b) cifra de linfocitos CD4+ igual o superior a 100/mm3 (o 200/mm3 si hay el antecedente de infecciones oportunistas), y c) ausencia de eventos C definitorios de SIDA para los que no haya tratamiento eficaz.
- 3.
En relación a las contraindicaciones para el trasplante hepático. Son las mismas que para pacientes sin infección por VIH. No obstante, hay que resaltar que un porcentaje notable de pacientes con infección por VIH presentan historia de toxicomanías o una situación socio-familiar inestable. Por ello, se recomienda que estos pacientes sean sometidos a una evaluación pisco-social rigurosa valorando especialmente las conductas adictivas y el periodo de abstinencia de cada tóxico, la posibilidad de trastornos psicopatológicos importantes subyacentes y la posibilidad de marginalidad social o abandono socio-familiar. Es aconsejable que esta evaluación la efectúe un equipo multidiscipliario con psicólogos, psiquiatras y trabajadores sociales47.
Criterios de selección de candidatos para trasplante hepático con infección por VIH
| En relación a la hepatopatia | Idem. Pacientes sin infección por VIH |
| En relación al VIH | Carga viral indetectable (<50copias/ml) o posibilidad postrasplante de TARGA eficaz |
| CD4+ ≥100/mm (≥200 si antecedentes de infección oportunista) | |
| Ausencia de eventos C* | |
| En relación a la valoración psicosocial | No problemas psicopatológicos y/o socio-familiares importantes. |
| No consumo activo de drogas, periodo de abstinencia específico para cada tóxico** |
La tasa de aceptación para trasplante de los candidatos con infección por VIH es baja, de alrededor del 25%48–51, en claro contraste con la tasa de aceptación en candidatos sin infección por VIH, que suele alcanzar un mínimo del 65%52. Un motivo importante de no aceptación de candidatos con infección por VIH para el trasplante es un estadio demasiado precoz de la enfermedad hepática48,53,54. A pesar de ello, todos los equipos de trasplante hepático recomiendan referir estos pacientes en fases tempranas de su hepatopatía para su evaluación pretrasplante, pues su evolución, como se ha comentado con anterioridad, suele ser acelerada. Otras razones frecuentes de no aceptación para trasplante son contraindicaciones relacionadas con la infección por VIH y problemas psicosociales48,53,54.
Lista de espera para trasplante hepáticoDistintos estudios han mostrado que la mortalidad de los pacientes con infección por VIH en lista de espera para trasplante hepático es elevada, aproximadamente tres veces mayor que la de los pacientes sin infección por VIH53,54–56, lo que podría comportar que la probabilidad de recibir un trasplante fuera menor en pacientes con infección por VIH en comparación a sus homónimos sin infección por VIH. Ello es coherente con los resultados de otros estudios en donde se ha mostrado que los pacientes coinfectados por VIH-VHC presentan una supervivencia libre de trasplante menor que la de pacientes monoinfectados por VHC9,10,57. Se han identificado diversos parámetros con valor pronóstico en pacientes cirróticos con infección por VIH, como el MELD score, la puntuación de Child-Pugh, la administración de TARGA y la cifra de linfocitos CD4+10,57. De forma interesante, en un estudio reciente, al comparar la supervivencia libre de trasplante en distintos grupos de pacientes estratificados según su MELD score, se observó que, para valores similares de MELD score, la supervivencia fue menor en pacientes con infección por VIH que en pacientes sin infección por VIH10. Si se confirmara este hallazgo, se podría llegar a plantear la posibilidad de otorgar puntos adicionales de MELD a los pacientes con infección por VIH con objeto de igualar sus opciones de recibir el trasplante a las de los pacientes sin infección por VIH.
En los pacientes con infección por VIH y hepatocarcinoma en lista de espera de trasplante hepático se aplican los mismos criterios de priorización y el mismo control y tratamiento antitumoral que en los pacientes sin infección por VIH.
Pacientes coinfectados por VIH-VHCComo se ha mencionado anteriormente, la mayor parte de trasplantes hepáticos en pacientes con infección por VIH son motivados por hepatopatías asociadas con infección por VHC. También se ha comentado que la supervivencia postrasplante a corto plazo en estos pacientes es satisfactoria, pero, posteriormente, se reduce de forma importante. Así, distintos estudios han reportado supervivencias de alrededor de 50% a los 3–5 años del trasplante lo que, si bien puede considerarse como aceptable, no llega a ser del todo satisfactorio33,34,37,38,40,41. En este mismo sentido, en un estudio reciente se ha mostrado que la coinfección por VIH es un factor predictivo independiente de menor supervivencia en pacientes trasplantados por hepatopatías por VHC37. La causa principal de muerte en estos pacientes es la recidiva de la hepatitis C.
La menor supervivencia y la elevada tasa de mortalidad por recidiva de hepatitis C en los pacientes coinfectados por VIH-VHC podrían explicarse por diversos motivos. Por un lado, la progresión acelerada de la recidiva postrasplante de hepatitis C, observada con frecuencia en pacientes monoinfectados por VHC, podría estar aún más acelerada en pacientes con coinfección VIH-VHC. Los resultados de un estudio reciente constituyen un ejemplo ilustrativo de esta posibilidad37. En este estudio, que comparó la evolución postrasplante de receptores coinfectados VIH-VHC y monoinfectados VHC, se evidenció una progresión más rápida de fibrosis del injerto y una mayor incidencia de hepatitis graves (generalmente, hepatitis colestásica fibrosante) en los pacientes coinfectados. Otros autores han reportado resultados similares34. Otra posible razón para la menor supervivencia postrasplante en los pacientes coinfectados VIH-VHC podría radicar en que estos pacientes presentan una respuesta al tratamiento antiviral anti-VHC postrasplante más baja que la obtenida en pacientes monoinfectados VHC. En la mayoría de estudios con pacientes trasplantados y coinfectados por VIH-VHC se han reportado tasas de respuesta virológica sostenida a la combinación de interferon, generalmente pegilado, y ribavirina de 0–15%1,32,33,37,49,58, mientras que la respuesta virológica sostenida postrasplante se alcanza en alrededor del 30% en pacientes monoinfectados por VHC59. Una posible razón para esta baja tasa de respuesta virológica sostenida postrasplante en pacientes coinfectados sería la disminución de las dosis de interferon y/o ribavirina o su retirada anticipada debido a efectos secundarios del tratamiento anti-VHC, especialmente a nivel hematológico, al igual que se ha evidenciado en pacientes trasplantados y monoinfectados por VHC60. No obstante, en la actualidad el impacto clínico de los efectos secundarios hematológicos del tratamiento antiviral en el contexto del trasplante hepático parece ser menos relevante por cuanto estos efectos adversos pueden ser debidamente manejados o prevenidos mediante el uso de factores de crecimiento (derivados de eritropoyetina y filgastrim)61. Otro posible motivo de baja tasa de respuesta virológica es que el tratamiento se inicie cuando la lesión hepatítica esté en fases muy avanzadas, por lo que algunos autores preconizan empezar precozmente el tratamiento con interferon y ribavirina58,62. De forma similar a los pacientes no trasplantados y pacientes con trasplante hepático y recidiva de hepatitis C, la tasa de respuesta al tratamiento antiviral en pacientes trasplantados y coinfectados VIH-VHC depende del genotipo del VHC, de manera que los genotipos 1 y 4 muestran tasas de respuesta más bajas que los genotipos 2 y 3. En un estudio reciente, la tasa de respuesta sostenida fue del 14% para genotipos 1 y 4 y del 50% para genotipos 2 y 3 (JM Miró: Comunicación personal, 14th Conference on Retrovirus and Opportunistic Infections, 2007). Un aspecto que podría ser de interés y, por tanto, objetivo de investigación, sería la administración de ciclosporina como inmunosupresor de mantenimiento en el momento del tratamiento antiviral anti-VHC, en base a algunos datos de la literatura donde se sugiere un efecto benéfico coadyuvante de este inmunosupresor debido a su actividad anti-VHC63,64.
Finalmente, hay que indicar que cabe la posibilidad de que los pacientes trasplantados con coinfección VIH-VHC no constituyan un grupo homogéneo sino una población que pueda ser clasificada en distintos subgrupos cuya supervivencia postrasplante sea muy diferente de un subgrupo a otro (JM Miró, resultados no publicados). Ello, obviamente, podría tener implicaciones relevantes en la selección de estos pacientes como candidatos para trasplante hepático y en su manejo postrasplante, especialmente en lo referente al tratamiento antihepatitis C.
Pacientes coinfectados VIH-VHBLa cirrosis y el hepatocarcinoma relacionados con la infección por VHB constituyen el 5–10% de las indicaciones de trasplante de hígado en pacientes infectados por VIH, aunque también se han reportado casos de trasplante por hepatitis B que cursan con insuficiencia hepática aguda65.
La supervivencia postrasplante en pacientes coinfectados VIH-VHB es muy satisfactoria, de 80–100% a los 5 años33,38,40,66,67, que son cifras similares a las obtenidas actualmente en pacientes monoinfectados por VHB68. Ello se debe principalmente a que, en pacientes coinfectados VIH-VHB, el TARGA incluye agentes antivirales efectivos contra ambos virus (lamivudina, tenofovir y emtricitabina), lo que, por un lado, permite que el estado de replicación viral del VHB sea bajo en el momento del trasplante y, por otro, previene la recidiva de la infección por VHB y la consiguiente lesión hepatítica en el injerto35,65,66. La tasa de resistencias del VHB a los antivirales suele ser baja, probablemente debido al uso de combinaciones de fármacos y/o a que las dosis de los agentes antivirales anti-VHB son habitualmente más elevadas que las utilizadas en pacientes monoinfectados por VHB.
Pacientes con hepatocarcinomaLas series publicadas hasta la actualidad señalan que el hepatocarcinoma constituye la indicación del trasplante hepático en el 6–20% de pacientes con infección por VIH, la mayoría con coinfección VIH-VHC32,34,35,37,38. Existen aún pocos datos acerca de los resultados postrasplante en estos pacientes. En un estudio, se reportó una supervivencia de pacientes e injertos del 86%, sin recidiva tumoral, aunque el seguimiento fue muy corto (media de menos de 1 año)51. La impresión global es que la incidencia de recidiva del hepatocarcinoma es similar en pacientes con y sin infección por VIH y que esta complicación no representa un problema significativo en los pacientes con infección por VIH si se selecciona adecuadamente a los candidatos.
Inmunosupresión y rechazoNo hay recomendaciones específicas en relación al uso de determinados esquemas de inmunosupresión en estos pacientes. De hecho, en la mayoría de centros, los regímenes inmunosupresores utilizados son similares a los usados en pacientes sin infección por VIH. En la actualidad, no hay datos concluyentes sobre la incidencia de rechazo en pacientes con infección por VIH debido al escaso número de pacientes incluidos en las distintas series publicadas. En 2 estudios, con 11 y 35 pacientes a quienes se administraron pautas convencionales de inmunosupresión (inhibidor de calcineurina, micofenolato y corticoides), la frecuencia de presentación de rechazo fue de 9 y 31%, respectivamente36,37. En otro estudio que incluyó 4 pacientes con una pauta de inmunosupresión no habitual (un inhibidor de calcineurina y un anticuerpo anti-CD25) la incidencia de rechazo fue del 25%69. Todas estas cifras caen dentro de los márgenes habituales de incidencia de rechazo en pacientes sin infección por VIH.
Hasta la actualidad, no hay evidencias que los efectos adversos de los inmunosupresores, como, por ejemplo, nefrotoxicidad o neurotoxicidad, muestren distinta incidencia o intensidad en pacientes con y sin infección por VIH.
Infección por VIH postrasplanteLa infección por VIH se suele mantener adecuadamente controlada en el período postrasplante utilizando el mismo tratamiento antirretroviral que era eficaz en la fase previa al trasplante. Siguiendo esta norma, la carga viral sigue indetectable y la cifra de linfocitos CD4+ no se modifica sustancialmente después del trasplante20,30–40,66,67,69,70. Por otra parte, los pacientes con trasplante hepático e infección por VIH controlada con TARGA presentan una incidencia de infecciones oportunistas y tumores similar a la de pacientes trasplantados sin infección por VIH36,37. Las pautas de profilaxis anti-infecciosas usadas en los pacientes trasplantados con infección por VIH suelen ser iguales a las de los pacientes sin infección por VIH, aunque la profilaxis contra Pneumocystis jirovecci se mantiene indefinidamente.
Los inmunosupresores podrían ejercer un efecto benéfico general sobre la infección por VIH al disminuir la activación y proliferación linfocitaria, necesarias para la replicación del VIH, lo que sería especialmente evidente en el caso de micofenolato71. Además, algunos inmunosupresores han mostrado efectos específicos a distintos niveles del ciclo viral del VIH. Ejemplos de ello son la unión de ciclosporina con la ciclofilina A, la cual es necesaria para la replicación del VIH72, o la inhibición de sirolimus sobre la transcripción de CCR-5, que es un co-receptor que facilita la entrada del VIH al linfocito T73. Por el contrario, se ha descrito que azatioprina tendría una acción negativa en el sentido que este inmunosupresor exacerbaría la replicación del VIH72. No obstante, en pacientes cuya infección por VIH se halla controlada con TARGA, los efectos adicionales de los inmunospresores sobre la replicación del VIH son irrelevantes.
TARGA después del trasplante hepáticoDespués de la interrupción del TARGA durante los primeros días postrasplante, este tratamiento se reintroduce siguiendo generalmente el mismo esquema que se seguía en la fase pretrasplante. No obstante, después del trasplante hay que tener en cuenta una serie de consideraciones, especialmente la posibilidad de interacciones farmacológicas entre el TARGA y otros fármacos frecuentemente utilizados en el trasplante hepático, especialmente inmunosupresores y ribavirina, y la posibilidad de efectos tóxicos del TARGA.
Interacción farmacológica del TARGA a nivel del citocromo P450Este fenómeno tiene especial relevancia clínica ya que el citocromo P450 (CP450), es el principal elemento que interviene en el metabolismo de ciclosporina y tacrolimus, los dos principales inmunosupresores en el trasplante hepático, y también en el metabolismo de sirolimus y everolimus72,74,75. Así, los agentes antirretrovirales inductores del CP450 aumentan el metabolismo de los inmunosupresores mencionados, con disminución de la concentración sanguínea de los mismos y necesidad de aumento de dosis para prevenir adecuadamente el rechazo. Los principales agentes antirretrovirales con efecto inductor del CYP3A4 de relevancia clínica son los inhibidores no-nucleósidos de la transcriptasa inversa del VIH, entre los que destaca efavirenz porque es fármaco muy utilizado en pacientes trasplantados74,75.
Por el contrario, los antirretrovirales inhibidores del CYP3A4 reducen el metabolismo de los inmunosupresores que se eliminan a este nivel, con el consiguiente aumento de su concentración sanguínea y del riesgo de toxicidad, lo que comporta la necesidad de reducir su dosis. Los agentes antirretrovirales de mayor importancia en este sentido son los inhibidores de la proteasa del VIH, destacando la combinación lopinavir-ritonavir (Kaletra®) ya que es muy utilizada y posee una gran potencia inhibitoria del CP450. Como ejemplo ilustrativo, cuando se utiliza esta combinación es habitual tener que reducir de forma drástica la dosis de tacrolimus, que puede llegar a ser solamente del 1–20% de la dosis habitual76,77.
Por estas razones, cuando se administran conjuntamente los inmunosupresores indicados anteriormente y agentes antirretrovirales que pueden afectar el CP450 se debe monitorizar de forma estricta la concentración sanguínea de los inmunosupresores con adecuación de la dosis a administrar para asegurar en lo posible un tratamiento inmunosupresor efectivo y seguro.
Otros agentes antirretrovirales clásicos tienen también efectos sobre el metabolismo de los inmunosupresores, pero su impacto clínico es de poca trascendencia. Las interacciones entre la mayoría de los agentes antirretrovirales de introducción más reciente y los fármacos inmunosupresores aún no se han podido establecer de forma clara, aunque la combinación de dos análogos de nucleósidos inhibidores de la transcriptasa inversa y un inhibidor de la integrasa, como el raltegravir, puede llegar a ser una pauta muy utilizada en el futuro por la carencia de interacciones con el CP45078.
Interacción del TARGA con la ribavirinaLa administración conjunta de ribavirina y didanosina puede producir un aumento de las concentraciones de didanosina fosforilada, lo que conlleva un aumento importante de riesgo de toxicidad por este antirretroviral81. Por este motivo, se recomienda evitar la administración de didanosina en pacientes que hayan de recibir tratamiento anti-VHC con ribavirina81–83. También se ha recomendado precaución en caso de asociarse ribavirina con zidovudina dado que ambos fármacos producen anemia84.
Por otra parte, la ribavirina también presenta interacciones con otros agentes antirretrovirales, especialmente con los inhibidores nucleósidos de la transcriptasa inversa del VIH. Así, se ha descrito que la ribavirina disminuye la fosforilación intracelular de zidovudina, estavudina y zalcitabina con reducción de formación de los compuestos activos de estos fármacos y, en consecuencia, de su eficacia antirretroviral32,85, y aumento de riesgo de toxicidad mitocondrial por estavudina y zalcitabina.
Toxicidad del TARGAEn general, los agentes antirretrovirales provocan escasos efectos tóxicos a nivel del injerto hepático. No obstante, se han descrito casos de hepatoxicidad marcada cuyo mecanismo patogénico se basa en toxicidad mitocondrial. Las manifestaciones más importantes de este cuadro son acidosis láctica y microesteatosis hepática, con alteraciones clínicas y analíticas variables, que pueden abarcar desde cuadros asintomáticos hasta fracaso del injerto con muerte del paciente79,80. Los fármacos antirretrovirales más frecuentemente involucrados en problemas de hepatotoxicidad son los inhibidores nucleósidos de la transcriptasa inversa del VIH, en particular estavudina, zidovudina y didanosina80.
Tenofovir, un agente eficaz contra el VIH y VHB, puede ser nefrotóxico86 y, por tanto, podría contribuir al desarrollo de disfunción renal en pacientes trasplantados hepáticos que reciben tratamiento inmunosupresor con inhibidores de calcineurina, que también son fármacos con marcado potencial para producir nefrotoxicidad.
En los pacientes con infección por VIH es práctica habitual la determinación del HLA-B*5701, el cual se asocia a riesgo elevado de hipersensibilidad al abacavir, cuyo uso ha de evitarse en los pacientes portadores de este alelo87. Por ello, en el trasplante hepático dicha determinación es recomendable en el donante del injerto ya que si este poseyera el HLA-B*5701 sería posible que se produjera una reacción de hipersensibilidad al abacavir en el receptor.
ConclusionesDesde la introducción del TARGA en pacientes con infección por VIH, la mortalidad por SIDA se ha visto drásticamente reducida. Por el contrario, las hepatopatías graves, fundamentalmente asociadas a coinfección por VHC y, en menor grado, por VHB, han emergido como una de las causas de muerte más frecuentes en estos pacientes. Por ello, la indicación de trasplante hepático va en ascenso en esta población de enfermos.
La supervivencia postrasplante de los pacientes con infección por VIH a corto y mediano plazo es correcta y similar a la de los pacientes trasplantados sin infección por VIH, con cifras de alrededor del 80–100%. Dicha supervivencia sigue siendo buena a más largo plazo en pacientes con infección por VIH trasplantados por enfermedades hepáticas de etiología distinta al VHC. En cambio, la supervivencia a largo plazo en pacientes trasplantados por hepatopatías asociadas al VHC decrece sustancialmente, siendo solamente de alrededor del 50% a los 5 años en la mayoría de series publicadas. La causa de mortalidad más frecuente es la recidiva de la hepatitis C. Por este motivo, diversos autores han propuesto que el tratamiento antihepatitis C se instaure precozmente Por otra parte, cabe esperar que los nuevos agentes anti-VHC, actualmente en fase de investigación, puedan mejorar estos resultados.
Es importante señalar que la infección por VIH se mantiene estabilizada y adecuadamente controlada con TARGA después del trasplante en la inmensa mayoría de casos. No obstante, el TARGA puede dificultar el tratamiento inmunosupresor por las interacciones entre determinados agentes antirretrovirales y una buena parte de fármacos inmunosupresores, lo que exige una monitorización farmacocinética estricta de estos últimos.
Finalmente, hay que señalar que el trasplante hepático en pacientes con infección por VIH debe ser considerado todavía como un campo clínico experimental, ya que los resultados obtenidos hasta la actualidad son prelimares por cuanto se basan en series con un número escaso de pacientes y con seguimientos aún demasiado cortos. Habrá que esperar los resultados de estudios de cohortes que se están realizando actualmente en distintos países para obtener conclusiones fehacientes al respecto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.