La fibrosis hepática (FH) es el depósito progresivo de matriz extracelular en el parénquima hepático que precede al desarrollo de cirrosis. El conocimiento de las bases celulares y moleculares de la FH ha aumentado considerablemente en las dos últimas décadas. Se han descrito factores ambientales y genéticos que influyen en su progresión, así como métodos no invasivos que permiten estimar el grado de fibrosis sin necesidad de realizar una biopsia hepática. En la actualidad, el único tratamiento claramente efectivo para atenuar o revertir la FH es la eliminación del agente causal. En los casos en los que esto no es posible, se recomienda identificar y tratar factores profibrogénicos (como la resistencia a la insulina, la obesidad, el consumo de alcohol, el consumo de cannabis, etc.). Se han descrito diversos agentes capaces de reducir la FH en modelos experimentales de daño hepático crónico. No obstante, apenas existen estudios clínicos controlados que evaluen la eficacia y la seguridad de estos agentes, por lo que no existe suficiente evidencia científica para indicarlos como tratamiento antifibrogénicos. La eficacia de los inhibidores del sistema renina-angiotensina como fármacos antifibrogénicos se está evaluando en la actualidad.
Liver fibrosis is the progressive deposition of extracellular matrix in the liver parenchyma that precedes the development of cirrhosis. In the last few years, knowledge of the cellular and molecular bases of liver fibrosis has increased considerably. Environmental and genetic factors have been described that influence the progression of liver fibrosis, while non-invasive methods have been developed that allow the grade of fibrosis to be estimated without the need for liver biopsy. Currently, the only clearly effective treatment to attenuate or reverse liver fibrosis is elimination of the causative agent. When this is not feasible, fibrogenic factors (such as insulin resistance, obesity, alcohol intake, cannabis consumption, etc.) should be identified and treated. However, several agents are able to reduce liver fibrosis in experimental models of chronic liver damage. Few controlled clinical trials have been performed that evaluate the efficacy and safety of these agents and consequently the level of evidence supporting their use as anti-fibrogenic therapy is still low. The efficacy of the anti- fibrogenic drugs, renin-angiotensin system inhibitors, is currently being evaluated.
La fibrosis hepática (FH) es un campo de gran interés clínico, pues su aparición es clave en la progresión de las hepatopatías crónicas. La fibrosis consiste en el depósito progresivo de colágeno y de otras proteínas de matriz extracelular que se observa en la mayoría de las enfermedades hepáticas crónicas1. La aparición de fibrosis avanzada es un prerrequisito para el desarrollo de cirrosis, que además incluye nódulos de regeneración y alteraciones en la microcirculación hepática2. Las principales causas de FH son la infección crónica por el virus de la hepatitis C (VHC) y por el virus de la hepatitis B, el consumo abusivo de alcohol y la esteatohepatitis no alcohólica (EHNA). El conocimiento de las bases celulares y moleculares de la FH ha aumentado considerablemente en las dos últimas décadas. Se han descrito factores ambientales y genéticos que influyen en la progresión de la fibrosis, en especial en los pacientes con hepatopatía secundaria al VHC. Asimismo, se han descrito recientemente métodos no invasivos que permiten estimar el grado de fibrosis sin necesidad de realizar una biopsia hepática.
Diversos estudios realizados durante la década de 1990 en pacientes y en animales de experimentación han demostrado que la FH es potencialmente reversible, lo que ha estimulado la investigación con el fin de identificar tratamientos antifibrogénicos3. En la actualidad, el único tratamiento claramente efectivo para atenuar o revertir la FH es la eliminación del agente causal (p. ej.: curación de la hepatitis crónica C). Sin embargo, hay diversos agentes capaces de reducir la FH en modelos experimentales de daño hepático crónico4. Se han realizado escasos estudios clínicos controlados que evalúen la eficacia y la seguridad de estos agentes, por lo que el valor de las pruebas para indicarlos como tratamiento antifibrogénico es todavía bajo.
En este artículo se revisa la historia natural de la FH en diferentes enfermedades hepáticas, así como las diversas estrategias terapéuticas disponibles en la actualidad.
Fibrosis hepática: conceptos básicosLa FH se considera en la actualidad como un proceso de reparación tisular altamente complejo que aparece ante un daño hepatocelular mantenido y en el que intervienen de manera activa diversos tipos celulares y citocinas profibrogénicas4. Ante una necrosis hepática autolimitada (p. ej.: una hepatitis aguda), el hígado tiene una gran capacidad de regeneración hepatocítica que sustituye en poco tiempo el tejido necrótico y reestablece la arquitectura hepática normal1. Durante este proceso reparativo hay una reacción inflamatoria junto a un depósito de matriz extracelular constituido por colágeno no fibrilar, que servirá de tejido de sostén para los hepatocitos regenerados y que contribuye a recomponer el lobulillo hepático dañado. Sin embargo, si la necrosis hepática se mantiene, este proceso reparativo se perpetúa. Con el tiempo, la capacidad de regeneración hepática disminuye, mientras que aumenta considerablemente la producción de matriz extracelular, que se deposita de manera desorganizada en el lobulillo hepático. En fases avanzadas, la población normal de hepatocitos se ha sustituido parcialmente por abundante matriz extracelular formada por colágeno fibrilar y otras proteínas como la fibronectina y diversos glucosaminglucanos. La distribución de este material fibroso en el lobulillo hepático depende del tipo de hepatopatía. En las hepatopatías por virus B o C, la fibrosis se localiza inicialmente en la zona periportal, mientras que en la hepatopatía alcohólica aparece en la zona perisinusoidal y pericentral. En fases avanzadas, las bandas de colágeno son muy evidentes y unen varios espacios porta, que se denominan «puentes de fibrosis». Esta condición precede a la formación de nódulos de regeneración y, por tanto, al desarrollo de cirrosis.
Uno de los avances más importantes en el conocimiento de la patogenia de la FH ha sido el descubrimiento de las HSC (hepatic stellate cells, ‘células estrelladas hepáticas’) como el principal tipo celular causante del exceso de síntesis de colágeno en el hígado fibrótico5. En el hígado normal, la función más importante de las HSC es el almacenamiento de la vitamina A. Sin embargo, en el curso de las hepatopatías crónicas, las HSC tienen una transformación fenotípica o «activación celular» caracterizada por la adquisición de funciones típicas de los miofibroblastos, como la contractilidad celular y la secreción de citocinas proinflamatorias y de matriz extracelular. Las sustancias que regulan la transformación fenotípica y la proliferación de las HSC en los focos de reparación tisular derivan en su mayoría de los hepatocitos dañados, de las células de Kupffer activadas y del propio infiltrado inflamatorio1. Así, diversos factores de crecimiento (TGFβ [transforming growth factor beta 'factor de transformación del crecimiento beta'] y PDGF [platelet-derived growth factor 'factor de crecimiento derivado de las plaquetas']), sustancias vasoactivas (trombina, angiotensina II y endotelina 1) y adipocinas (leptina) contribuyen a la acumulación de las HSC activadas y ejercen, por tanto, una acción profibrogénica en las hepatopatías crónicas. Por el contrario, las sustancias vasodilatadoras (óxido nítrico) y diversas citocinas como el interferón (IFN)-α y el factor de crecimiento insulínico (IGF) son potentes inhibidores de la activación de las HSC. Los mecanismos moleculares causantes de la activación y proliferación de las HSC incluyen proteínas de membrana (canales de calcio, intercambiador de sodio/potasio) y diversas vías de señalizacion intracelular (MAP cinasas, PI3 cinasa/AKT), así como el estrés oxidativo debido a la formación de radicales libres. La modulación farmacológica de estas citocinas o de sus vías intracelulares atenúa la progresión de fibrosis en diversos modelos experimentales al evitar la acumulación de HSC activadas en el hígado.
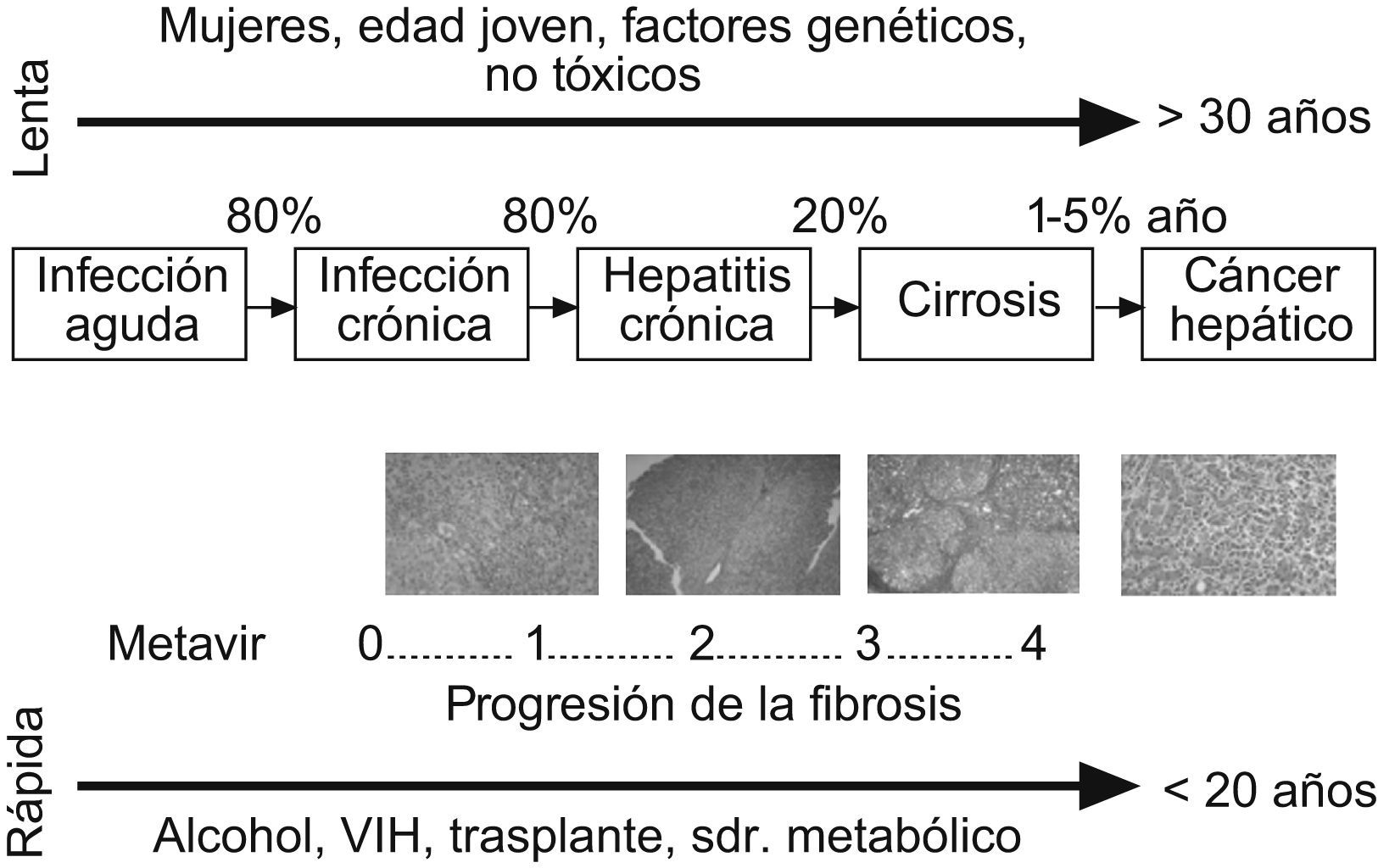
Aunque la FH es una entidad patológica bien caracterizada, su historia natural se ha descrito con detalle recientemente6. En particular, numerosos estudios han investigado la evolución de la fibrosis en los pacientes con infección crónica por VHC. El descubrimiento del virus C hace dos décadas y el seguimiento de un gran número de pacientes en estudios prospectivos han permitido determinar con exactitud el tiempo de evolución de la hepatopatía en numerosos pacientes (p. ej.: pacientes con historia de transfusión sanguínea) y la descripción de los factores que influyen en la progresión de la fibrosis7. Hoy se sabe que la evolución de la FH es un proceso muy lento en la mayoría de los pacientes. El tiempo medio de evolución de la cirrosis en un paciente con hepatitis crónica por VHC es de 30 años. Los factores que se asocian a una evolución más rápida de la fibrosis incluyen la edad de adquisición de la infección mayor de 40 años, la obesidad, la resistencia a la insulina, el consumo abusivo de alcohol, la coinfección por virus de la inmunodeficiencia humana y el sexo masculino (fig. 1). Asimismo, hay factores genéticos individuales que influyen en la progresión de la fibrosis. Los pacientes que presentan varios de estos factores pronósticos pueden evolucionar a cirrosis en menos de 10 años, mientras que en otros casos la fibrosis progresa muy lentamente y nunca progresa a cirrosis. En los pacientes con cirrosis terminal que son trasplantados, la reinfección del injerto por el virus C es prácticamente universal. La evolución de la fibrosis en el injerto infectado es rápida, por lo que se desarrolla una cirrosis hepática a 5 años en más de un tercio de los pacientes. Se sabe que el genotipo vírico de tipo 1, la presencia de episodios de rechazo y un mayor uso de inmunosupresores se asocian a un curso más agresivo de la fibrosis en estos pacientes8. Los factores que influyen en la evolución de la fibrosis en otros tipos de hepatopatías son menos conocidos.
La evaluación del grado de FH es importante para decidir el tratamiento y establecer el pronóstico de los pacientes con hepatopatías crónicas. Hasta hace unos años era necesaria la realización de una biopsia hepática para estudiar el grado de fibrosis. Sin embargo, en la actualidad se dispone de diversos métodos no invasivos para estimar el grado de fibrosis9. Estos métodos comprenden pruebas de imagen (p. ej.: FIBROTAC), marcadores bioquímicos simples (p. ej.: índice de Forns), marcadores de fibrogénesis (TGFβ1, TIMP1 [tissue inhibitor of metalloproteases 1, inhibidor tisular de las metaloproteasas tipo 1], PIIIP [péptido aminoterminal del procolágeno III] y ácido hialurónico) y más recientemente la elastografía. Estos métodos permiten estimar con una aceptable precisión el grado de fibrosis, aunque su utilidad para evaluar cambios moderados tras un tratamiento no está bien demostrada. En la actualidad, la biopsia hepática está indicada cuando, además de querer determinar el grado de fibrosis, se tengan dudas diagnósticas y se precise de una información exacta del tipo de infiltrado inflamatorio (p. ej.: pacientes trasplantados de hígado).
Efecto de la eliminación del agente causal sobre la fibrosis hepáticaRecientes observaciones experimentales y clínicas indican que la FH es un proceso potencialmente reversible10. En diversos modelos de hepatopatía crónica en ratas, la eliminación del agente causal se asocia a una progresiva desaparición de la matriz extracelular que se había acumulado en el tejido hepático11. Este proceso se asocia a un aumento en la actividad de las colagenasas que degradan la matriz extracelular existente, así como una desaparición de las HSC mediante su apoptosis. En las hepatopatías humanas, la eliminación del agente hepatotóxico VHB no sólo frena la progresión de la fibrosis, sino que puede asociarse a una disminución e incluso a una desaparición de ésta12–16. Esta observación se ha descrito en los pacientes con hepatitis crónica de origen vírico, enfermedad hepática inducida por alcohol, cirrosis biliar secundaria, EHNA, etc. Sin embargo, el tiempo para lograr una regresión significativa puede llevar años y varía de acuerdo con la causa subyacente y con la gravedad de la enfermedad hepática. Es posible que los factores genéticos del paciente influyan en su capacidad de degradar la matriz extracelular acumulada en el hígado. Cuando el tratamiento se establece en fases precoces, puede lograrse una desaparición total del tejido fibroso y puede restaurarse la arquitectura hepática normal. El grado de reversibilidad de estadios avanzados de la fibrosis no se conoce con exactitud. En la cirrosis hepática hay áreas avasculares, nódulos de regeneración, alteraciones de la microcirculación y cross-linking del colágeno, que son fenómenos difícilmente reversibles. Por tanto, aunque hay pruebas de que la fibrosis es reversible, es posible que la reversibilidad de la cirrosis establecida sea limitada.
La hepatitis crónica C es la enfermedad más extensamente estudiada. La respuesta virológica mantenida en los pacientes que han recibido IFN-α y ribavirina disminuye la progresión de la fibrosis. Incluso una proporción de los pacientes con fibrosis avanzada o cirrosis puede revertir de manera significativa el estadio de fibrosis14. Así, un estudio reciente muestra que los enfermos tratados con diferentes pautas de IFN y ribavirina presentan una mejoría de la fibrosis en un tercio, una estabilización de ésta en un 60%, mientras sólo un 10% muestra progresión de la fibrosis a pesar de la eliminación vírica16. Un hecho destacable es que los pacientes con fibrosis más grave tienen peor respuesta al tratamiento antivírico. Es posible que los mecanismos fibrogénicos intrahepáticos puedan modular la respuesta antivírica. De manera similar, la eliminación de la replicación del VHB por medio del tratamiento antivírico se asocia a una regresión del grado de FH en casi la mitad de los pacientes. Este efecto se ha descrito en diversos fármacos como la lamivudina, el adefovir, el entacavir y el tenofovir17–19. Se desconoce si algunos de estos fármacos podría tener una acción antifibrogénica y, por tanto, estar indicado en los pacientes con fibrosis avanzada. Hay poca información acerca de los efectos de la abstinencia alcohólica sobre la fibrosis existente en la enfermedad hepática inducida por el alcohol14. Es necesaria la realización de nuevos estudios para evaluar el efecto del descenso de ingesta alcohólica o de la abstinencia en estos pacientes, así como los factores que regulan la regresión de la fibrosis. Hay pruebas recientes que indican que la pérdida de peso tras la cirugía bariátrica se asocia a una mejoría histológica de la EHNA, con una disminución de la fibrosis20. Este efecto beneficioso se correlaciona con la normalización de parámetros metabólicos y se ha descrito incluso con enfermos con fibrosis avanzada. Por último, la fibrosis secundaria a obstrucción biliar se revierte tras resolver el cuadro quirúrgicamente12. Todas estas observaciones clínicas indican que la eliminación del agente causal conlleva una mejoría de la FH, independientemente de la causa.
Los mecanismos celulares y moleculares causantes de la reversibilidad de la FH en humanos son desconocidos, así como los factores ambientales y genéticos que regulan la degradación del colágeno21. Es posible que tras un seguimiento prolongado, la fibrosis pueda revertirse totalmente en algunos enfermos. El concocimiento de los mecanismos involucrados en la regresión de la fibrosis podría ayudar a desarrollar tratamientos coadyuvantes para los enfermos que responden al tratamiento etiológico, con el fin de favorecer la degradación de la matriz extracelular acumulada.
Uso de fármacos antifibrogénicosLos estudios existentes en pacientes no permiten recomendar el uso de ningún fármaco antifibrogénico por el momento22. Sin embargo, numerosos estudios experimentales en roedores han demostrado la utilidad de diversos fármacos en modelos de daño hepático crónico (tabla 1). La mayoría de estos fármacos, sin embargo, no se han investigado en estudios controlados en humanos. La escasez de estudios controlados se debe a varias razones. Por una parte, es necesario realizar biopsias hepáticas seriadas que evalúen en forma exacta los cambios de la FH, puesto que la utilidad de marcadores no invasivos en estudios longitudinales es dudosa. Por otra parte, debido a la lenta progresión de la FH se aconseja realizar estudios de al menos 4 años de duración. Las características ideales que debe tener un fármaco antifibrogénico son su bajo coste, un buen perfil de seguridad para tratamientos prolongados y escaso potencial hepatotóxico.
Fármacos con una potencial utilidad en el tratamiento de la fibrosis hepática
| Agente | Efectos antifibróticos en las células estrelladas hepáticas | Efectos antifibróticos en la fibrosis experimental | Estudios en humanos |
| Inhibidores de la angiotensina | Resultados consistentes positivos | Resultados consistentes positivos | Estudio retrospectivo |
| Colchicina | No probada | Resultados limitados | Resultados discrepantes |
| Corticosteroides | Resultados limitados | Resultados limitados | Efectivo en hepatitis autoinmunitaria |
| Inhibidores de la endotelina | No probados | Resultados limitados | No probado |
| Interferón-α | Resultados consistentes positivos | Resultados consistentes positivos | Estudiado en la hepatitis crónica C |
| Interleucina-10 | Resultados limitados | Resultados consistentes positivos | Estudio único en la hepatitis crónica C |
| Pentoxifilina | Resultados consistentes positivos | Resultados consistentes positivos | No probado |
| Fosfatidilcolina | Resultados limitados | Resultados consistentes positivos | No eficaz en fibrosis inducida por alcohol |
| Antagonistas de PPAR | Resultados consistentes | Resultados consistentes positivos | Estudios aislados en EHNA |
| S-adenosil-metionina | No probados | No probado | Estudiado en la fibrosis inducida por alcohol |
| Sho-saiko-to (hierba asiática) | Resultados consistentes positivos | Resultados consistentes positivos | Estudios aislados en la hepatitis crónica C |
| Inhibidores de TGFβ | Resultados consistentes positivos | Resultados consistentes positivos | No probado |
| Tocoferol | Resultados consistentes positivos | Resultados limitados | Estudios aislados en la EHNA |
| Ghrelina | Resultados consistentes positivos | Resultados consistentes positivos | Datos epidemiológicos |
| Antagonistas CB1 | Resultados consistentes positivos | Resultados consistentes positivos | Datos epidemiológicos |
CB1: receptor cannabinoide tipo 1; EHNA: esteatohepatitis no alcohólica; PPAR: peroxisome proliferator-activated receptor, receptor activado del proliferador del peroxisoma; TGFβ: transforming growth factor beta ‘factor de transformación del crecimiento beta’.
Para los pacientes con hepatitis crónica C que no responden al tratamiento antivírico, se ha indicado que el IFN-α en bajas dosis podría favorecer una disminución del grado de fibrosis. Esta hipótesis se debe a estudios experimentales que han demostrado una acción antifibrogénica propia para el IFN-α. Los resultados del estudio HALT-C y los datos preliminares del estudio COPILOT indican que esta estrategia no es efectiva y se asocia a efectos secundarios23. Únicamente en el subgrupo de los pacientes con cirrosis, el uso del INF-α se asocia a un descenso inicial de la presión portal, aunque la relevancia clínica de este efecto es dudosa. La estrategia más prometedora para los enfermos no respondedores es el uso de fármacos que inhiban el sistema renina-angiotensina, en especial los antagonistas de los receptores tipo 1 de la angiotensina II (AT1)24. Así, un estudio retrospectivo mostró que la FH progresa más lentamente en los pacientes trasplantados que reciben un inhibidor de la enzima conversiva de la angiotensina o un antagonista del receptor de la angiotensina II para el tratamiento de la hipertensión arterial25. Asimismo, un estudio piloto realizado en este Centro (Colmenero et al, manuscrito enviado), en el que se administró losartán durante 18 meses a pacientes que tenían contraindicaciones para el tratamiento antivírico, mostró que el losartán es bien tolerado en los pacientes con hepatitis crónica C y disminuye la expresión de genes fibrogénicos. En la actualidad se está realizando un estudio controlado en Francia con la administración de candesartán durante 3 años. Los resultados de este estudio permitirán obtener datos más concluyentes sobre la eficacia de esta estrategia terapéutica.
Los estudios con fármacos antifibrogénicos en pacientes con hepatopatía alcohólica no son concluyentes, en parte debido a la mejoría de los pacientes que reciben placebo pero que abandonan la ingesta abusiva de alcohol. Se ha estudiado el efecto de la colchicina, el S-adenosilmetionina y la fosfatidilcolina, así como diversos antioxidantes, pero no fue posible demostrar de manera consistente su eficacia antifibrogénica26–28. Recientemente se han realizado numerosos estudios que evalúan diversos fármacos para el tratamiento de la fibrosis en pacientes con EHNA29. Hay ciertos resultados prometedores, aunque la mayoría de los estudios son de corta duración e incluyen un bajo número de pacientes. Así, los fármacos que aumentan la sensibilidad a la insulina como las tiazolidendionas y las estatinas tienen efectos beneficiosos sobre la afectación histológica de estos pacientes, con una disminución del grado de fibrosis30–33. Se requiere de estudios a gran escala para confirmar estos resultados y poder establecer unas pautas claras sobre el tipo de fármacos a utilizar y sus indicaciones precisas. Por último, hay cierta controversia sobre la eficacia del ácido ursodesoxicólico para enlentecer el curso histológico de los pacientes con cirrosis biliar primaria34. Estudios recientes indican que el uso continuado de este fármaco desde fases iniciales de la enfermedad disminuye la progresión de la fibrosis.
Estudios experimentales han demostrado que diversas sustancias tienen un efecto antifibrogénico marcado y son, por tanto, candidatos a ser ensayados en los pacientes con hepatopatías crónicas. Así, el bloqueo de los receptores tipo 1 de los canabinoides (CB1) tiene un marcado efecto antifibrogénico35. Los antagonistas de este receptor tienen además efectos beneficiosos sobre la esteatosis hepática y el síndrome metabólico, por lo que su perfil parece adecuado para el tratamiento de la EHNA. Sin embargo, un estudio multicéntrico a gran escala tuvo que ser recientemente suspendido debido a efectos adversos serios (depresión). El uso de péptidos con capacidad hepatoprotectora y antifibrogénica es otra posible estrategia para el tratamiento de la FH. Agentes como la cardiotrofina y la grelina son producidos localmente en el hígado y protegen los hepatocitos del daño celular (Bustos36 y Moreno et al, manuscrito enviado). La ghrelina, además, tiene un potente efecto antifibrogénico en modelos experimentales y modula la progresión de la fibrosis en los pacientes con hepatitis crónica C. Se requiere de estudios clínicos para evaluar la seguridad y la eficacia de estos fármacos en los pacientes con hepatopatías crónicas.
Hay muchos otros candidatos para tratar la FH, como los inhibidores de citocinas profibrogénicas como el TGFβ1 y el PDGF, los antagonistas de receptores de quimiocinas, interleucina-10, etc. Aunque estas estrategias se han mostrado útiles en animales de experimentación, su aplicación en humanos está limitada por los posibles adversos37. Por ejemplo, una inhibición mantenida del TGFβ1 podría favorecer el desarrollo de carcinoma hepatocelular, mientras que la interleucina-10 es un potente inmunosupresor. Es, pues, recomendable centrarse en estrategias susceptibles de emplearse en humanos y que no interfieran con mecanismos moleculares clave en la respuesta inmunitaria ni en la defensa del organismo contra el cáncer.