La globalización y los movimientos migratorios hacen que la hepatitis crónica B Age+ (HCBe+) cobre cada día mayor relevancia en nuestro entorno.
ObjetivoAnalizar las características epidemiológicas, evolución y respuesta al tratamiento con antivirales orales (AO) de los pacientes con HCBe+.
Material y métodosSe analizaron 436 casos de infección crónica por el virus de la hepatitis B atendidos en el Hospital Universitario Ramón y Cajal desde 1990 hasta junio del 2012.
ResultadosSesenta y cinco (14,9%) presentaban HCBe+. Siete pacientes en fase de tolerancia inmune no fueron tratados; los 58 restantes, sí. Fueron excluidos 4: 2 hepatitis agudas graves, una coinfección por VHC y otro por virus Delta. De los 54 restantes, 19 recibieron interferón con o sin AO y 35 solo AO. Dos tratados durante menos de un mes no fueron incluidos en el análisis. Este se realizó finalmente en 33 pacientes. Duración media del tratamiento: 46,81 meses (6-138). Lamivudina fue el fármaco más prescrito (39,39%), seguida de tenofovir (24,24%) y entecavir (21,21%). Edad media: 42,08±14 años; varones 75,75% (25/33). El 57,57% (19/33) seroconvirtió el antígeno e y el 27,27% (9/33) eliminó el antígeno de superficie. No se objetivó la reaparición de este último tras un seguimiento medio de 35,6 meses. Resistencias: 8 casos en 7 pacientes, 7 a lamivudina y uno a adefovir.
ConclusionesEl 15% de las HCB en nuestro medio son e+. El tratamiento con AO logra una elevada tasa de seroconversión (57,57%) y un considerable porcentaje de pérdida del antígeno de superficie (27,27%).
Due to globalization and migratory movements, HBeAg+ chronic hepatitis B is becoming increasingly important in Spain.
ObjectiveTo analyze the epidemiological features, progression, and treatment response to oral antiviral agents (OA) in HBeAg+ chronic hepatitis B patients in our area.
Material and methodsWe analyzed 436 patients with chronic hepatitis B infection followed up at the Ramón y Cajal Hospital from 1990 to June 2012.
ResultsSixty-five patients (14.9%) had HBeAg+ chronic hepatitis B. Seven patients in the immunotolerant phase were not treated, while the remaining 58 received treatment.
Four patients were excluded: two due to severe acute hepatitis, one due to hepatitis C virus coinfection and another because of a Delta virus coinfection. Of the remaining 54 patients, 19 received interferon with or without OA, and 35 received only OA. Two patients treated for less than 1 month were not included in the analysis. The analysis was finally performed in 33 patients. The mean duration of treatment was 46.81 months (6-138). Lamivudine was the most frequently prescribed drug (39.39%) followed by tenofovir (24.24%) and entecavir (21.21%). The mean age was 42.08±14 years and 75.75% (25/33) of the patients were male. Nineteen of 33 patients (57.57%) achieved seroconversion to anti-HBe, and 27.27% (9/33) showed clearance of HBsAg. There was no evidence of HBsAg reversion after a mean follow-up of 35.6 months. There were 8 cases of resistance in 7 patients: 7 to lamivudine and 1 to adefovir.
ConclusionsApproximately 15% of chronic hepatitis B patients in our area are HBeAg+. Treatment with OA achieves a high seroconversion rate (57.57%) and a considerable percentage of HBsAg clearance (27.27%).
La hepatitis crónica B (HCB) constituye un problema de salud a nivel mundial debido a su amplia distribución y prevalencia1,2. En los países occidentales, sin embargo, los recientes avances terapéuticos y la generalización del uso de vacunas han contribuido a disminuir el impacto sociosanitario de esta enfermedad.
España ha sido considerada un área de prevalencia intermedia, con aproximadamente un 2-7% de portadores del antígeno superficie3. No obstante, recientes estudios epidemiológicos indican una disminución de la proporción de individuos infectados por el VHB en nuestro medio4.
La infección crónica por VHB se desarrolla en distintas fases que no siempre se suceden de forma consecutiva2,5. Tras el primer contacto con el virus, factores inmunológicos, epidemiológicos y relacionados con el huésped condicionan la cronificación o no de la infección y determinan su curso clínico.
Inicialmente, el virus se replica de forma activa, lo que da lugar a unos niveles de ADN-VHB muy elevados. El antígeno e (HBeAg) es positivo y las transaminasas suelen ser normales. Esto es debido a que el sistema inmunitario todavía no es capaz de reconocer al VHB y poner en marcha la respuesta responsable de la lesión hepatocitaria. Esta fase de inmunotolerancia ocurre de forma predominante en pacientes infectados durante la época perinatal por madres e+. Es más frecuente en los países asiáticos y se asocia mayoritariamente al genotipo C5. La duración de este periodo es variable y, en algunos casos, puede prolongarse hasta 30-40 años.
La HCB e+ sucede a la etapa anterior cuando el virus es reconocido por el sistema inmunitario. Los niveles de transaminasas aumentan y el ADN viral continúa elevado, por lo que durante este periodo los pacientes se consideran altamente contagiosos. Esta fase es más frecuente y se alcanza más rápidamente en los sujetos infectados durante la edad adulta, puede prolongarse semanas o años y concluye con la negativización del HBeAg6. La tasa de aclaramiento espontáneo de dicho antígeno es variable y oscila entre el 3 y el 12% al año según los diversos estudios5,7–10.
La seroconversión del HBeAg y el desarrollo de anticuerpos anti-HBe se asocian a una marcada disminución de la carga viral y una menor probabilidad de progresión de la enfermedad hepática5,11. Tras este hecho, el paciente puede convertirse en un portador inactivo de VHB o desarrollar una HCB e–.
La situación de portador inactivo se caracteriza por unos niveles de ADN muy bajos (< 2000 U/ml) o indetectables y transaminasas normales. La biopsia hepática no muestra alteraciones o, en ocasiones, un mínimo grado de fibrosis. Este estado se relaciona con un buen pronóstico y una disminución del riesgo de hepatocarcinoma, cirrosis y desarrollo de complicaciones. A pesar de ello, algunos autores han demostrado que este riesgo sigue siendo superior al de la población general12, por lo que estos pacientes requieren revisiones periódicas de forma indefinida.
La prevalencia de la HCB e– ha aumentado en la última década debido al envejecimiento de la población infectada por el VHB y al predominio de ciertos genotipos específicos2. En la actualidad, constituye la variante más frecuente tanto en España como en Europa1,2. Sin embargo, la globalización y los movimientos migratorios han condicionado también un aumento del número de casos de HCB e+ en nuestras consultas. Los datos publicados hasta la fecha sobre la evolución y el tratamiento de estos pacientes en España son escasos. Por este motivo, presentamos la experiencia recogida a lo largo de 22 años de práctica clínica en el Hospital Ramón y Cajal de Madrid, con el objetivo de analizar las características, la evolución y la respuesta al tratamiento en este tipo de pacientes.
Material y métodosPoblación de estudioSe incluyó a 436 pacientes diagnosticados de HCB que fueron seguidos en el Servicio de Gastroenterología del Hospital Universitario Ramón y Cajal de Madrid entre 1990 y junio del 2012.
Una vez iniciado el tratamiento, los pacientes suelen ser vistos a los 3 meses y revisados posteriormente cada 6 meses por los mismos facultativos con un control analítico y serológico. Según la situación basal (presencia de cirrosis o no), además se realiza un seguimiento ecográfico cada 6 o 12 meses.
DiseñoSe llevó a cabo un estudio descriptivo de tipo serie de casos clínicos.
VariablesLa información analizada se obtuvo a través de las historias clínicas y la base informática de datos analíticos del hospital.
Se recogieron datos demográficos basales de los pacientes (edad, sexo y comorbilidades asociadas), así como información referente al tratamiento recibido: fármacos prescritos (inicialmente y durante el seguimiento), duración, finalización del mismo y aparición de resistencias.
Con respecto a la evolución de la enfermedad, se recogieron las siguientes variables: mortalidad, diagnóstico de carcinoma hepatocelular, realización de biopsia hepática, seroconversión del HBeAg, negativización del HBsAg y tiempo transcurrido hasta la negativización de dichos antígenos.
En cuanto a los parámetros analíticos, se registraron los niveles de transaminasas, HBeAg, HBeAc, HBsAg y ADN-VHB, tanto al inicio del seguimiento como en las sucesivas revisiones clínicas.
Determinaciones serológicasLos marcadores serológicos para el virus B: HBsAg, HBeAg y anticuerpos HBc, HBs, y HBe se determinaron mediante inmunoanálisis automatizado (ELISA) AXSYM y, posteriormente, mediante Architect I-2000 (Abbott Diagnostics, Chicago, EE. UU.).
El ADN del VHB se cuantificó mediante reacción en cadena de la polimerasa a tiempo real con un rango de sensibilidad de 0 a 170.000.000 U/ml (Taqman, Roche Diagnostics, New Jersey, EE. UU.). El genotipo (A-H) y el estudio de mutaciones se llevaron a cabo por hibridación reversa (INNO-LIPA HBV DR v2 y INNO-LIPA HBV DR v3, Innogenetics, N.V. Gante, Bélgica), siguiendo las instrucciones del fabricante. Este método amplifica un fragmento en la región de la retrotranscriptasa entre los dominios B y E, detectando mutaciones que confieren resistencia a adefovir, lamivudina, tenofovir, entecavir y emtricitabina.
Análisis estadísticoSe realizó mediante el programa SPSS versión 20.0. Las variables continuas se expresaron con la media o la mediana según su distribución, y las categóricas mediante porcentajes.
ResultadosEl 14,9% de los pacientes (65/436) presentaban inicialmente el antígeno e positivo. Siete casos en fase de tolerancia inmune no fueron tratados.
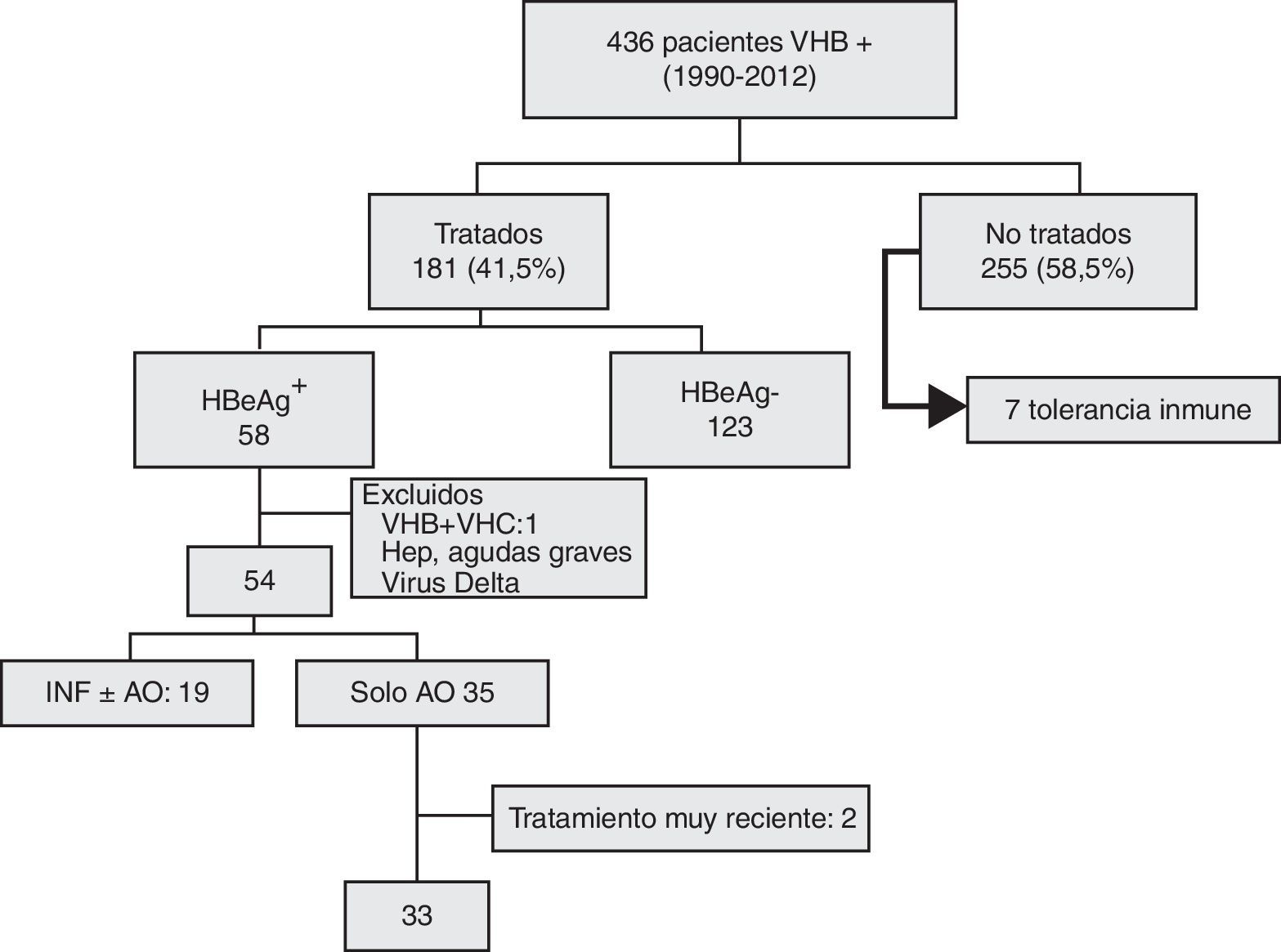
Del grupo de 58 pacientes HBeAg+ que recibieron tratamiento, se excluyó a 2 con hepatitis aguda grave, uno coinfectado por el virus de la hepatitis C y otro por el virus Delta. De los 54 restantes: 19 recibieron interferón, con o sin antivirales orales (AO), y 35 solo AO. Dos casos que habían recibido menos de un mes de tratamiento al concluir el estudio fueron excluidos del análisis evolutivo. Este se realizó finalmente en 33 pacientes (fig. 1).
Diagrama de inclusión de los pacientes en el estudio: 436 pacientes eran inicialmente portadores del antígeno de superficie. Sesenta y cinco presentaban el HBeAg+ pero 7 no fueron tratados por encontrarse en fase de tolerancia inmune. Treinta y tres recibieron únicamente antivirales orales.
La edad media del grupo fue de 42,08±14 años. El 75,75% (25/33) eran varones.
Doce pacientes eran de nacionalidad extranjera: 7 procedían de China, 3 de Rumanía, uno de Paraguay y otro de Bulgaria.
Con respecto a las comorbilidades asociadas, cabe destacar: 3 casos de linfoma no Hodgkin, una gammapatía monoclonal, un paciente son síndrome de Down y obesidad mórbida, un caso de leucoencefalopatía multifocal progresiva, un síndrome de ovarios poliquísticos, un tumor vesical, 3 pacientes con hipertensión arterial, un paciente con cardiopatía isquémica, que además presentaba signos de hipertensión portal, y otro con enfermedad pulmonar obstructiva crónica.
Los parámetros analíticos principales al inicio del tratamiento se muestran en la tabla 1. El genotipo D fue el más prevalente (8/33), si bien en 11 casos la determinación del genotipo no fue realizada.
Características basales de los pacientes HBeAg+ tratados con antivirales orales
| Características basales de los pacientes HBeAg+(N=33) | |
| AST | 160,29 U/l (media) |
| ALT | 193,36 U/l (media) |
| ADN VHB (al inicio) | 27.776.180 U/ml (mediana) |
| Genotipo | A: 5, D: 8, no determinado: 11, B: 2, E: 1, C: 3, F: 3 |
| Biopsias disponiblesa | Fibrosis II (metavir): 3 pacientesFibrosis III (metavir): 4 pacientes |
El tratamiento se prescribió en 2 casos como profilaxis de la reactivación del VHB en pacientes que iban a recibir quimioterapia; el resto de ellos fueron tratados al cumplir los criterios establecidos en las sucesivas guías de práctica clínica para la HCB2,3,13.
Se realizaron 9 biopsias, identificándose en 2 de ellas hallazgos histológicos característicos de cirrosis hepática. Otros 3 pacientes en los que no se realizó biopsia presentaron signos clínicos, analíticos o en pruebas de imagen de cirrosis.
El fármaco más utilizado como terapia inicial fue lamivudina (13 enfermos, 39,39%), seguida de tenofovir8, entecavir7 y adefovir5. La duración media global del tratamiento fue de 46,81 meses±36,70 (desviación típica). La duración específica del tratamiento según el fármaco utilizado, así como los cambios que se realizaron, se muestran en la tabla 2. Desde 2008 todos los pacientes recibieron tenofovir o entecavir.
Fármacos utilizados, duración del tratamiento y cambios realizados a lo largo del seguimiento de los pacientes que recibieron AO
| Fármaco inicial | Pacientes tratados | Duración media del tratamiento | Cambios realizados |
| Adefovir | 5 | 40,6 meses | En 2 casos a tenofovir: en un paciente por seguridad y en otro por aparición de resistencias |
| Entecavir | 7 | 29,1 meses | En un caso se cambia a tenofovir ante la no seroconversión del Ag e |
| Lamivudina | 13 | 73 meses | En 7 pacientes por resistencias:– Se añade adefovir en 5 casosa– Se cambia a adefovir en 2bEn un caso a entecavir por seguridad |
| Tenofovir | 8 | 16,75 meses | Ninguno |
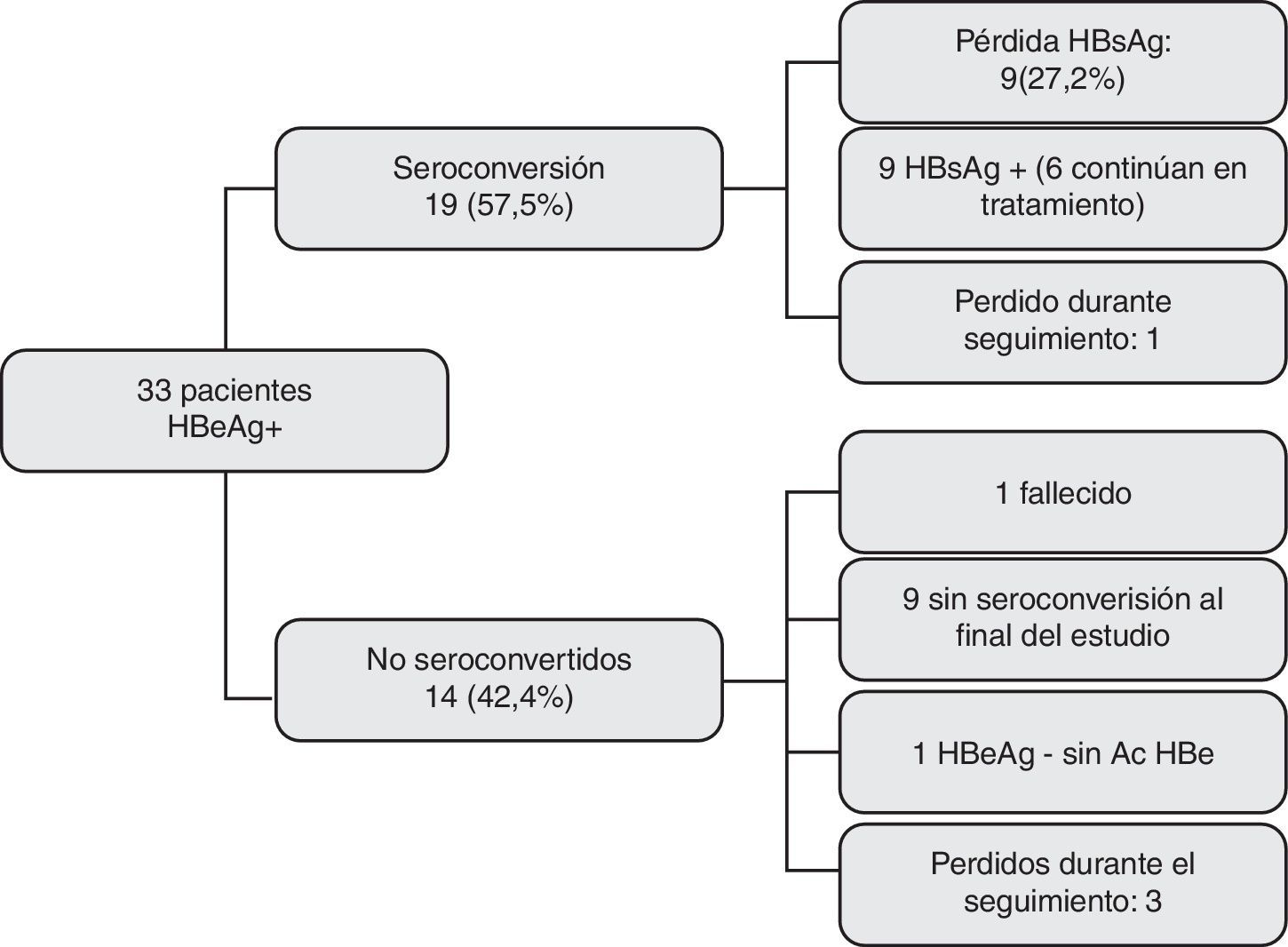
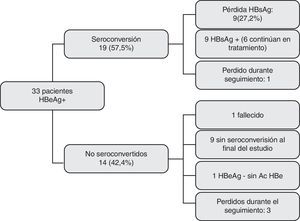
Al final del estudio (junio del 2012), 19 de los 33 pacientes tratados con AO (57,57%) habían seroconvertido el HBeAg (ADN indetectable, HBeAg– y HBeAc +). El tiempo medio transcurrido hasta la seroconversión fue de 14,62 meses3–46. Solo 2 pacientes presentaron posteriormente transaminasas elevadas y ADN mayor de 20 U, aunque en ningún caso la carga viral fue superior a 2.000 U.
Evolución de los pacientes HBeAg+. De los 33 pacientes que recibieron AO, 19 (57,5%) seroconvirtieron el HBeAg y 14 (42,4%) no lo hicieron. En total, 4 casos se perdieron durante el seguimiento, 3 sin seroconversión y uno tras ella. Nueve pacientes (27,27%) eliminaron el antígeno de superficie.
Siete pacientes recibían tratamiento con lamivudina cuando se produjo la seroconversión, 5 tenofovir, 3 entecavir, 3 adefovir y el último lamivudina más adefovir por aparición de resistencias. En un caso se perdió el seguimiento transcurridos 21 meses desde la seroconversión.
No se objetivó la reversión del HBeAg en ningún caso, excepto en un paciente en el que se observaron 2 seroconversiones: primero con lamivudina y posteriormente con adefovir. Se trataba de un varón de 45 años, que seroconvirtió tras 2 años de tratamiento con lamivudina. A los 5 meses de suspender este fármaco, mostró de nuevo positividad para el HBeAg y resistencia posterior a lamivudina. Se cambió a adefovir, seroconvirtiendo más tarde otra vez el HBeAg. Actualmente, se encuentra, por seguridad, en tratamiento con tenofovir.
A pesar de la aparición de resistencias durante el tratamiento, 3 pacientes lograron seroconvertir el HBeAg: en un caso, se pautó lamivudina, seguida de adefovir y finalmente tenofovir antes de la seroconversión, y en otros 2 se añadió adefovir a la lamivudina.
De los 14 pacientes que no seroconvirtieron el HBeAg, 3 se perdieron durante el seguimiento y uno falleció por complicaciones derivadas de su enfermedad hepática. El antígeno e se negativizó sin seroconversión anti e posterior en un paciente, mientras que en los 9 restantes, el HBeAg continuaba siendo positivo al finalizar el estudio. En este último grupo, 7 presentaban transaminasas normales y ADN negativo.
Negativización del antígeno de superficie de la hepatitis B (fig. 2)El HBsAg se negativizó en 9 pacientes (27,27% del total, 47,36% de los que seroconvirtieron); sus características basales se muestran en la tabla 3. Tres de ellos habían sido tratados con lamivudina, 3 con tenofovir, uno con entecavir y otro con adefovir. El noveno caso recibía terapia combinada con lamivudina y adefovir por aparición de resistencias a lamivudina.
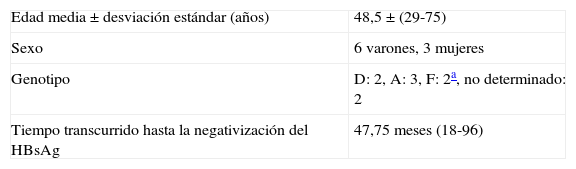
Características de los pacientes HBeAg+ en los que se negativizó el antígeno de superficie
| Edad media±desviación estándar (años) | 48,5±(29-75) |
| Sexo | 6 varones, 3 mujeres |
| Genotipo | D: 2, A: 3, F: 2a, no determinado: 2 |
| Tiempo transcurrido hasta la negativización del HBsAg | 47,75 meses (18-96) |
El tiempo medio transcurrido hasta la pérdida del HBsAg fue de 47,75 meses desde el inicio del tratamiento (rango 18-96) y 24,55 meses desde la seroconversión del HBeAg (rango 3-50). Solo en 2 casos los AO fueron suspendidos 2 meses y 2 años antes, respectivamente, antes de la negativización; en todos los demás, se mantuvo el tratamiento tras la seroconversión hasta la pérdida del HBsAg.
Dos pacientes con resistencias al tratamiento (uno, primero a lamivudina y después a adefovir, en el que se pautó tenofovir, y otro al que se añadió adefovir por resistencias a lamivudina) lograron negativizar el antígeno de superficie.
Cinco de los 9 pacientes (55,5%) que negativizaron el HBsAg desarrollaron anticuerpos frente al mismo. En un caso, el anti-HBs continúa negativo, y en 3 no se dispone de información a este respecto.
Tras un seguimiento medio de 35,6 meses (6-78) no se ha objetivado la reaparición del HBsAg en ningún caso.
Finalización del tratamientoDurante el periodo analizado, se suspendieron los AO en 12 casos. Siete tras la negativización del HBsAg y 5 transcurridos 6-12 meses después de la seroconversión anti e. Dos de estos últimos eliminaron el HBsAg después de suspender el tratamiento.
Al final del estudio (junio del 2012), continuaban en tratamiento con AO 16 pacientes (9 seroconvertidos) y se desconocía la situación de 4 por pérdida del seguimiento durante más de un año. Estos pacientes fueron controlados en la consulta durante una media de 10,25 meses ± 11,026 (desviación típica) antes de abandonar el seguimiento. Uno de ellos seroconvirtió el HBeAg tras 5 meses de tratamiento con lamivudina y acudió a las revisiones durante 25 meses.
Se diagnosticó un caso de carcinoma hepatocelular desarrollado 6 años después del inicio del tratamiento. El paciente falleció por complicaciones derivadas de su enfermedad hepática y nunca llegó a producirse la seroconversión del HBeAg. Inicialmente, fue tratado con lamivudina, aunque a los 16 meses se cambió a adefovir por aparición de resistencias. Tras 18 meses con adefovir, se prescribió tenofovir por seguridad. La carga viral en el momento del fallecimiento era 575 U.
ResistenciasSe objetivaron 8 casos de resistencias en 7 pacientes: 6 estaban en tratamiento con lamivudina y otro desarrolló resistencia primero a lamivudina y posteriormente a adefovir.
La aparición de resistencias se sospechó en todos aquellos casos en los que se produjo un aumento de la carga viral superior a 1 log10 U/ml en relación con el valor más bajo de ADN detectado durante el tratamiento. Ante esta situación, se investigó, en primer lugar, el grado de adherencia mediante entrevista personal en la consulta y a través de los registros informatizados de recogida y entrega de medicación de la farmacia hospitalaria.
Tras descartar una falta de adherencia al tratamiento, se llevó a cabo un estudio de mutaciones relacionadas con la aparición de resistencias a los AO. Se añadió adefovir en 5 casos y se cambió a adefovir en uno. El paciente con resistencia primero a lamivudina y después a adefovir fue finalmente tratado con tenofovir.
El tiempo transcurrido desde el inicio del tratamiento hasta la aparición de resistencias fue de 23,75 (7-62) meses.
El porcentaje global de resistencias a lamivudina a lo largo del estudio fue del 53,84% (7/13).
Las mutaciones detectadas en los 7 pacientes fueron L180M+M204V y N236T, que confieren resistencia a lamivudina y adefovir, respectivamente.
Seguridad y efectos adversosNo se objetivó ningún efecto secundario grave que obligara a la suspensión de los AO. Únicamente cabe destacar el aumento de las cifras de creatinina (1,8mg/dl) en un paciente cirrótico tratado con lamivudina y adefovir (por resistencia a lamivudina) a los 8 meses de su inicio. Este hecho hizo que se modificara la posología de los fármacos, que pasaron a ser administrados en días alternos, manteniéndose la creatinina entre 1,38 y 1,79mg/dl. Actualmente, dicho paciente continúa en tratamiento con tenofovir, manteniendo unas cifras de creatinina estables en torno a 1,36-1,47mg/dl.
Una paciente fue tratada con AO durante el embarazo en 2 ocasiones: la primera vez (año 2007) con lamivudina, añadiéndose adefovir durante el último mes por presentar una elevada carga viral. En el segundo embarazo (año 2008), lamivudina y adefovir fueron sustituidos por tenofovir en el primer trimestre manteniéndose en la actualidad dicho tratamiento. En ambos casos, se consiguió el parto a término de niños sanos.
DiscusiónLa HCB HBeAg negativa es la más prevalente, tanto en España como en gran parte de Europa2,14,15, mientras que los pacientes en fase de inmunorreactividad (HBeAg+) constituyen un grupo menos numeroso en nuestro entorno. Estudios basados en modelos matemáticos de Markov estimaron que, en 2005, existirían aproximadamente 65.308 casos de HCB e+ en nuestro país, lo que supondría un 13% de la cohorte de pacientes analizada16. Posteriores trabajos españoles sustentados en la práctica clínica real han mostrado porcentajes de prevalencia de la HCB e+ del 12,39%17, similares a los obtenidos en nuestro estudio.
En la actualidad, el tratamiento de la HCB tiene como objetivo ideal la pérdida del HBsAg. Sin embargo, este hecho es infrecuente18, sobre todo en la HCB e–, por lo que en la práctica habitual se intentan establecer metas más realistas. Alcanzar y mantener unos niveles normales de transaminasas y una respuesta viral sostenida (ADN negativo) una vez finalizado el tratamiento, se considera un resultado satisfactorio y se asocia a una mejoría significativa del pronóstico2.
En la HCB e+, la seroconversión del HBeAg se considera un hecho clave en la historia natural de la infección. Tanto es así que muchos autores sugieren que transcurridos 6-12 meses tras la seroconversión (fase de consolidación), sería posible suspender el tratamiento si no existe cirrosis ni fibrosis significativa. Sin embargo, diversos trabajos coinciden en señalar que un considerable porcentaje de estos pacientes no logra mantener una respuesta viral sostenida y requieren de nuevo tratamiento19–24. Por este motivo, una mayor duración de la terapia de consolidación tras la seroconversión podría aumentar los porcentajes de remisión a largo plazo25,26.
Diversas investigaciones realizadas con el objetivo de analizar la eficacia de los fármacos antivirales disponibles hasta la fecha muestran unos porcentajes de seroconversión anti-e a los 12 meses desde su inicio del 16-18% para lamivudina27–31, el 12-18% para adefovir32,33 y el 21% para tenofovir33 y entecavir30,34–36.
Se ha observado que la tasa de seroconversión aumenta a medida que se prolonga la duración del tratamiento37–46. Así, en el estudio de Chang et al., este porcentaje alcanza el 47% en una cohorte de pacientes que recibieron lamivudina y fueron seguidos durante 4 años45. Por su parte, Marcellin et al., tras un seguimiento de 5 años en pacientes tratados con adefovir46, describen una tasa de seroconversión del 48%.
No obstante, este potencial incremento del éxito terapéutico al aumentar el periodo de tratamiento se ve contrarrestado por la aparición de resistencias a largo plazo, fundamentalmente en el caso de lamivudina y adefovir19. En la actualidad, este hecho se ha visto superado con los antivirales de alta barrera genética (tenofovir y entecavir), que demuestran elevadas tasas de seroconversión y muy bajos o nulos porcentajes de resistencia. Así, Marcellin et al., en un reciente trabajo, presentan una tasa de seroconversión del 40% con tenofovir tras 5 años de seguimiento47. No se ha comunicado hasta la fecha ningún caso de resistencia a dicho fármaco.
Por otra parte, diversos autores han demostrado que la supresión del ADN-VHB a largo plazo con los fármacos de última generación puede, además, inducir la reversión de la fibrosis/cirrosis47–49.
Los estudios de práctica clínica real, como también lo es el nuestro, incluyen grupos heterogéneos de pacientes y circunstancias, pero aportan datos más próximos a la realidad que los obtenidos en los ensayos clínicos. Esto se debe a que los estudios aleatorizados y controlados restringen las características de los sujetos participantes, de tal forma que, en ocasiones, las poblaciones estudiadas son muy diferentes a las realmente atendidas en nuestras consultas50.
En España, estudios basados en la práctica habitual, como el publicado por Buti et al., muestran un porcentaje de pérdida del HBeAg del 26% y una tasa de seroconversión anti-e del 22% tras 48 semanas de tratamiento con entecavir36. En este trabajo, se incluyó a 190 pacientes diagnosticados de HCB que nunca habían sido tratados con análogos de nucleósidos. El 30% eran HBeAg+ y, de los 12 que seroconvirtieron, 4 lo hicieron antes de la semana 24 y 8 entre la semana 24 y la 48.
El porcentaje de seroconversión que obtuvimos en nuestro trabajo fue mayor que el presentado por Buti et al. (57,57%, 19/33). Este hecho significativo, podría estar relacionado con una mayor duración del tratamiento en nuestro caso: 46,81 meses de media vs. un máximo de 48 semanas en el estudio de Buti et al. Por otra parte, también podría contribuir el elevado porcentaje de adherencia al tratamiento en nuestro grupo, circunstancia que analizamos en un trabajo previo, el cual incluía a la mayoría de los casos analizados en el presente estudio51. Hay que tener en cuenta, además, que la utilización de distintos antivirales a lo largo del periodo de seguimiento hace difícilmente comparables los resultados con otras publicaciones. Finalmente, el número limitado de pacientes con HCB e+ en nuestro medio y el diseño retrospectivo del análisis podrían limitar el significado de los resultados obtenidos.
Con respecto a la pérdida del HBsAg, en el estudio anteriormente comentado de Buti et al. se objetivaron solo 2 casos tras 48 semanas de tratamiento con entecavir. Por nuestra parte, 9 de los 33 pacientes tratados con diversos AO consiguieron eliminar dicho antígeno tras una media de 47,75 meses de tratamiento (18-96). En ningún caso se constató la reaparición del HBsAg tras un seguimiento medio de 35,6 meses (6-78) desde su desaparición.
Esta elevada tasa de pérdida del HBsAg podría estar relacionada, en parte, con todos los factores comentados anteriormente respecto a la seroconversión. Por otra, puede estar influida por el hecho de que se mantuvo el tratamiento en la mayoría de los pacientes (7/9) tras la pérdida del HBeAg y el desarrollo de anticuerpos. Este hecho apoyaría las conclusiones de otros autores, que indican que el mantenimiento de la terapia de consolidación más de un año podría aumentar los porcentajes de remisión a largo plazo en determinados casos25,26. Recientemente, Invernizzi et al. llevaron a cabo un estudio en el que siguieron durante 44 meses (12-117) a 27 pacientes (48% HBeAg+) tratados con AO que eliminaron el antígeno de superficie. Mostraron que es seguro finalizar el tratamiento al perder dicho antígeno si se generan anti-HBs, o tras un periodo de consolidación de 12 meses aún sin la producción de anticuerpos52. La durabilidad del aclaramiento del HBsAg tras el tratamiento con AO también ha sido recientemente analizada. Kim et al. estudiaron a un grupo de 4.578 pacientes, de los cuales 121 eliminaron el HBsAg tras recibir lamivudina o entecavir. Incluyeron a 58 de estos pacientes tras excluir por diversas razones a 63, siendo el 47% de los casos finalmente analizados HBeAg+. La reaparición del HBsAg ocurrió en 5 pacientes (8,6%), 3 de los cuales consiguieron eliminar de nuevo el antígeno de superficie de forma espontánea sin tratamiento53.
Tres pacientes con resistencias al tratamiento farmacológico en nuestro estudio consiguieron seroconvertir el HBeAg y 2 de ellos incluso eliminaron el HBsAg. Aunque existen pocas comunicaciones acerca de este hecho, cabe destacar la publicación de Fung et al. sobre el uso de tenofovir en pacientes con resistencia previa demostrada a lamivudina. Estos autores objetivan en dicho grupo una tasa de pérdida del HBeAg y HBsAg del 15% (10/65) y el 11% (7/65), respectivamente, con lo que demuestran que tenofovir es una opción segura y eficaz en aquellos casos con resistencias previas a lamivudina2,54.
Otros trabajos con pacientes procedentes de la práctica real y tratamiento prolongado ofrecen resultados muy similares al nuestro. Es el caso de la reciente publicación presentada por Lampertico, en la que se incluye a 418 pacientes que recibieron entecavir durante 52 meses (2-66). El 17% (71 pacientes) eran HBeAg+. La tasa de seroconversión y pérdida del HBsAg fue incrementando de forma progresiva hasta el 60 y el 25%, respectivamente, a los 5 años55.
Por último, objetivamos un porcentaje global de resistencias del 21,21% (7/33). La mayoría se produjo con lamivudina y, como era previsible, en ningún paciente tratado con tenofovir, ni tampoco con entecavir.
La tasa de desarrollo de variantes resistentes a lamivudina fue del 53,84% (7/13) y el tiempo medio de tratamiento transcurrido en estos casos fue de 23,75 meses. Este elevado porcentaje de aparición de resistencias a lamivudina es un hecho constatado en investigaciones previas2, y la principal limitación del uso de este fármaco a largo plazo. Se ha demostrado que este porcentaje aumenta progresivamente por cada año de tratamiento, siendo del 24% a los 12 meses y alcanzando el 70% a los 5 años.
Como conclusión, nuestro estudio muestra que el tratamiento a largo plazo con AO de los pacientes con HCB e+ permite alcanzar una elevada tasa de seroconversión anti-e y una considerable proporción de pérdida del HBsAg. Los resultados apoyan una mayor duración del tratamiento de consolidación tras la seroconversión con el objetivo de mantener una respuesta viral sostenida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.