La acalasia es una enfermedad esofágica poco frecuente que se acompaña de una importante alteración de la calidad de vida de los pacientes. Su etiología no está totalmente aclarada y sus características clínicas principales son la disfagia y la regurgitación. El tratamiento de la acalasia continúa siendo paliativo y está dirigido al alivio funcional y sintomático mediante la abertura del esfínter esofágico inferior. Se hará una descripción y valoración de los tratamientos más utilizados en la práctica clínica, tanto médicos como quirúrgicos, tras la importante modificación en el esquema terapéutico que ha significado la introducción de la cirugía mínimamente invasiva. En el momento actual el planteamiento inicial más acertado es el quirúrgico, efectuado por laparoscopia, mientras que las dilataciones neumáticas y la inyección de toxina botulínica deben considerarse como técnicas de recurso en casos seleccionados.
Achalasia is an infrequent esophageal disease that severely impairs the quality of life of affected individuals. The etiology of this entity is not well defined and its main clinical features are dysphagia and regurgitation. The treatment of achalasia continues to be palliative and is aimed at providing functional and symptomatic relief through opening of the lower esophageal sphincter. The present article describes and evaluates the medical and surgical treatments most commonly used in clinical practice after the introduction of minimally invasive surgery, which has represented an important addition to the therapeutic alternatives. Currently, the most appropriate initial option is laparoscopic surgery, while pneumatic dilatation and botulinum toxin injection should be reserved for selected patients.
La acalasia es un trastorno motor esofágico primario infrecuente que tiene una incidencia de un caso por cada 100.000 habitantes en el mundo occidental. Afecta a ambos sexos por igual a cualquier edad y presenta una prevalencia mayor entre los 20 y los 50 años.
Sir Thomas Williams la describió por primera vez en 1672, la llamó «cardioespasmo» y la trató con un hueso de ballena como dilatador. No fue hasta comienzos de este siglo cuando Hurst observó que habitualmente en la acalasia hay una relajación inadecuada del esfínter esofágico inferior (EEI) combinado siempre con ondas peristálticas simultáneas, generalmente de tono bajo, lo que conlleva una dificultad en el paso de los alimentos (tanto sólidos como líquidos), una disminución del aclaramiento esofágico y, con el paso del tiempo, un fracaso de las estructuras musculares y la consiguiente dilatación del esófago.
EtiologíaSu etiología continúa siendo desconocida, aunque hay una alteración, disminución o pérdida de células ganglionares inhibitorias de los plexos mioentéricos del esófago. También se observa una disminución significativa en la síntesis de óxido nítrico o péptido vasoactivo intestinal. Estas 2 sustancias son los principales moduladores de la relajación del EEI1,2. El estímulo de la reacción inflamatoria que afecta estas células no es bien conocido; sin embargo, se ha descrito una asociación con el antígeno DQw1 del sistema de antígenos de histocompatibilidad II mostrando la posibilidad de un mecanismo autoinmune3.
La causa secundaria más frecuente de la acalasia es la enfermedad de Chagas, producida por Trypanosoma cruzi, protozoario endógeno de América del Sur y de América Central. Este parásito produce a largo plazo una disfunción autonómica de las neuronas intramurales del esófago que inducen los síntomas de la acalasia3.
En toda sospecha clínica de acalasia, pero sobre todo en pacientes por encima de los 50 años, debe descartarse mediante endoscopia la posible presencia de procesos neoplásicos que afecten el EEI (sobre todo cáncer de cardias), la denominada seudoacalasia. Además, también mediante una correcta historia clínica se debe considerar la posibilidad de tratamientos previos, tales como colocación de bandas gástricas o fundoplicaturas ajustadas4.
Clínica y diagnósticoEl síntoma que conduce a la sospecha diagnóstica de acalasia es la disfagia, que suele ser en sus inicios para sólidos, pero no tarda en aparecer también para líquidos y suele ser lentamente progresiva. En fases más avanzadas aparece la regurgitación de alimentos. A estos 2 síntomas básicos se pueden añadir otros, tales como dolor torácico, pérdida de peso, hiperreactividad bronquial, broncoaspiración, etc. La calidad de vida de los enfermos se ve muy afectada conforme avanza la enfermedad.
Es importante resaltar que algunos pacientes con acalasia pueden, en sus inicios y cuando no hay dilatación del esófago, simular una clínica de reflujo gastroesofágico (RGE). Fisiológicamente, el sistema nervioso central puede interpretar el estímulo de la distensión esofágica como «acidez» o pirosis y confundir el diagnóstico, especialmente cuando la clínica es atípica4.
La evaluación diagnóstica ha de incluir una serie de estudios radiológicos, endoscópicos y manométricos. En casos avanzados, en una radiografía simple de tórax se pueden visualizar una acalasia por la falta de burbuja gástrica y la dilatación esofágica en el mediastino con o sin niveles hidroaéreos. La endoscopia se debe realizar para descartar procesos inflamatorios o neoformativos, como la infiltración de la unión gastroesofágica (UGE). Los hallazgos más frecuentes de la endoscopia son la retención de saliva o comida no digerida con un esófago dilatado. Sin embargo, la negatividad de estas pruebas pueden dar información errónea, ya que en fases iniciales pueden ser normales.
El tránsito esofgico revela en muchas ocasiones la típica estenosis en «cola de ratón» o «punta de lápiz», consecuencia de la falta de relajación del EEI. En fases iniciales, la radiología baritada puede interpretarse como normal. Blam et al5 encontraron una pobre correlación entre los síntomas y los resultados de estudios radiológicos con contraste, lo que conllevó una demora diagnóstica, particularmente en aquellos pacientes con síntomas atípicos (pirosis, pérdida de peso, tos, hiperreactividad bronquial). En su estudio, un 34% de los pacientes presentó este tipo de síntomas, lo que resultó en una demora de 30 meses hasta el diagnóstico definitivo de acalasia comparado con los sólo 11 meses que demoraron los pacientes con presentación clínica típica (disfagia y regurgitación). A pesar de estas posibles dificultades de la videofluoroscopia baritada, el autor de este artículo cree que se debería practicar sistemáticamente, ya que en un gran número de pacientes orienta de forma correcta el diagnóstico por la observación de una estenosis funcional en la unión cardioesofágica y la presencia de un esófago dilatado, flácido y no peristáltico5.
El método de referencia diagnóstico de la acalasia es la manometría ya que posee la mayor sensibilidad. Además, la manometría es especialmente útil en la fase temprana de la enfermedad, cuando el resto de las pruebas son negativas. Las características típicas de la manometría esofágica en el diagnóstico de acalasia son las siguientes: a) relajación inadecuada del EEI en las degluciones (relajación incompleta o ausente), sin embargo, la observación de relajaciones completas, sobre todo en sus inicios, no descarta acalasia; b) ondas peristálticas simultáneas en prácticamente todas las degluciones y habitualmente de bajo tono, y c) frecuente aumento del tono basal del EEI.
En un estudio con 26 pacientes, Shi et al6 observaron que la presión de relajación residual del EEI era el criterio manométrico diagnóstico más adecuado. Se estableció que, si la presión residual es superior a 12mmHg, la sensibilidad diagnóstica es del 92% y si esta presión es superior a 10mmHg y se asocia a aperistalsis, la sensibilidad y el valor predictivo positivo alcanzan el 100%.
Sin embargo, el autor de este artículo piensa que el criterio manométrico más específico es la presencia de ondas simultáneas en prácticamente todas las degluciones. Un subtipo de pacientes con acalasia presenta ondas de contracción simultánea de amplitud normal e incluso hipertensas por una función muscular preservada, la llamada «acalasia vigorosa»4.
Actualmente, la manometría de alta resolución y la impedancia endoluminal con múltiples canales permiten precisar algo mejor las características motoras del esófago4.
Al ser una enfermedad crónica sin etiología definida, el tratamiento es paliativo y ha de ser dirigido al alivio de la sintomatología mediante la disminución del grado de obstrucción del EEI con el menor número de acciones terapéuticas posibles para mejorar la calidad de vida.
Tratamiento farmacológicoNo hay ningún tipo de relajante muscular específico del EEI. Sin embargo, se ha evaluado la acción terapéutica de los antagonistas de los canales de calcio y los nitratos en la acalasia3,7. Los nitratos producen una disminución más marcada y más rápida de la presión del EEI con un tiempo de alcance del efecto máximo más corto que los antagonistas cálcicos (nifedipino). Los resultados con ambos fármacos son pobres y sólo se contemplan en el tiempo de espera para escoger un tratamiento más definitivo. Además, tienen efectos colaterales, como hipotensión, cefaleas y edemas periféricos7.
Toxina botulínicaLa toxina botulínica (TB) es una neurotoxina producida por Clostridium botulinum, con una acción farmacológica que consiste en la parálisis muscular. La acción paralítica es debida a la unión presináptica de los terminales neuronales colinérgicos e impide la liberación de acetilcolina, que produce finalmente una denervación funcional. De esta manera se disminuye la presión basal del EEI a niveles normales1.
Se han publicado diversos estudios con respecto a la eficacia de la inyección endoscópica de esta toxina. La primera publicación (Pasricha et al8) se realizó en 31 pacientes a los que se les inyectaron 80 U de TB. Se apreció una disminución del 45% en el tono del EEI con una mejoría inicial de la sintomatología en un 90% de los pacientes al primer mes de seguimiento. Esta mejoría se redujo al 55% a los 6 meses. Estos resultados son similares a los de Martinek et al9 publicados en el año 2003. Se les inyectaron 100 U de TB a 40 enfermos y se observó una mejoría del 93% al primer mes y del 55% pasados los 12 meses.
Por tanto, la mayoría de los pacientes debe recibir repetidas sesiones de inyección de toxina o derivarse a dilatación o cirugía cuando no hay contraindicación.
Zaninotto et al10 publicaron los resultados de un ensayo clínico que comparaba un grupo tratado con 2 inyecciones de TB (100U) con un mes de diferencia con otro grupo tratado quirúrgicamente mediante una miotomía de Heller laparoscópica y una fundoplicatura. Cada grupo contaba con 40 pacientes, en los que no hubo mortalidad (sólo se observó una leve complicación para el grupo quirúrgico). Los resultados después de 2 años de seguimiento fueron que en el 66% de los pacientes con TB recidivó la sintomatología mientras que ésta sólo se observó en el 13,5% de los intervenidos quirúrgicamente. La causa del fracaso del tratamiento con TB estaría explicada por la formación de anticuerpos contra la TB, aunque la regeneración nerviosa de los terminales bloqueados podría ser otro factor implicado.
Por estos motivos, se considera que la administración de TB en el tratamiento de la acalasia estaría indicada en pacientes ancianos o pluripatológicos que son malos candidatos a procedimientos más invasivos o en los que se desestime la cirugía.
Dilatación endoscópicaLa dilatación neumática (DN) endoscópica es el tratamiento no quirúrgico más efectivo para el tratamiento de la acalasia. El objetivo de este tratamiento es la rotura controlada de las fibras de músculo liso del EEI, que alivia la obstrucción funcional esofágica distal y mejora la sintomatología. Durante las últimas décadas, se ha producido un gran avance en el tipo de dilatadores; actualmente, los controlados por presión son los más utilizados, ya sean tipo Rigiflex (bajo visión fluoroscópica) o tipo Witzel (bajo visión endoscópica)3,4. La DN tiene la ventaja de ser un procedimiento ambulatorio.
Aunque el procedimiento no está totalmente estandarizado, la técnica más eficaz y segura consiste en la insuflación de 1 a 3min a una presión controlada de 300mmHg (10 a 12psi), lo que permite reducir la presión basal del EEI a menos de 10mmHg o, al menos, reducir el 50% de la presión predilatación3,11.
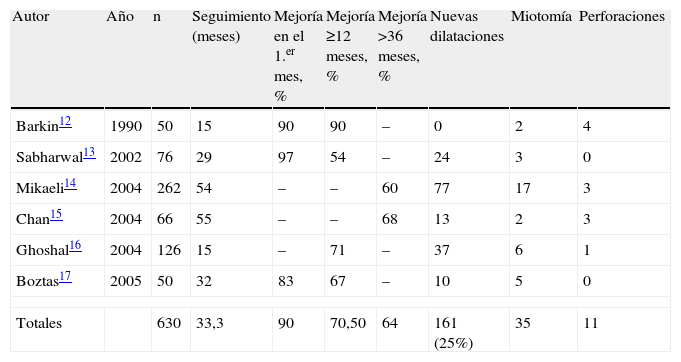
En la tabla 1 se resumen los estudios prospectivos y retrospectivos de los pacientes a los que se les realizó una DN con un número de casos mayor a 50 y un seguimiento superior a los 12 meses12–17. De un total de 630 pacientes con un seguimiento medio de 33,3 meses (15 a 55 meses) se observó una mejoría del 90% en la sintomatología al primer mes tras la DN, pero que se redujo progresivamente y se observó a largo plazo (>36 meses) sólo el 64% de mejoría. Además, se debió dilatar a 168 pacientes en reiteradas oportunidades y en 35 se indicó la cirugía. Sólo se produjeron 11 perforaciones esofágicas (2%), que requirieron cirugía urgente (tabla 1).
Resultados obtenidos con dilatación neumática
| Autor | Año | n | Seguimiento (meses) | Mejoría en el 1.er mes, % | Mejoría ≥12 meses, % | Mejoría >36 meses, % | Nuevas dilataciones | Miotomía | Perforaciones |
| Barkin12 | 1990 | 50 | 15 | 90 | 90 | – | 0 | 2 | 4 |
| Sabharwal13 | 2002 | 76 | 29 | 97 | 54 | – | 24 | 3 | 0 |
| Mikaeli14 | 2004 | 262 | 54 | – | – | 60 | 77 | 17 | 3 |
| Chan15 | 2004 | 66 | 55 | – | – | 68 | 13 | 2 | 3 |
| Ghoshal16 | 2004 | 126 | 15 | – | 71 | – | 37 | 6 | 1 |
| Boztas17 | 2005 | 50 | 32 | 83 | 67 | – | 10 | 5 | 0 |
| Totales | 630 | 33,3 | 90 | 70,50 | 64 | 161 (25%) | 35 | 11 | |
Dağlı et al, en una publicación reciente18, observaron en una serie de 111 pacientes que los factores predictivos de mal resultado de la dilatación eran los siguientes: a) edad menor a 37,5 años; b) tono basal del EEI predilatación superior a 30,5mmHg; c) tono del EEI después de la primera dilatación superior a 17,5mmHg, y d) necesidad de más de 2 sesiones.
Los factores que no predicen un buen resultado son el grado de dolor por parte del paciente, la presencia de sangre en el dilatador tras el procedimiento y la duración de la insuflación19. Por otro lado, el diámetro del balón estaría relacionado con la tasa de perforación y, como ésta es más propensa a suceder en la primera sesión, se aconseja la utilización de balones de pequeño calibre preferentemente bajo una visión endoscópica directa2.
De todas las complicaciones de la DN, la más importante es la perforación esofágica, que oscila entre el 1 y el 8% según la experiencia técnica. El RGE posdilatación no es frecuente (1 al 7%). Sin embargo, en los pacientes en los que ocurre puede ser grave y dada la aperistalsis esofágica, el RGE puede inducir una esofagitis grave11,13,14, aunque habitualmente se controla bien con dosis adecuadas de inhibidores de la bomba de protones (IBP).
Tratamiento quirúrgicoErnest Heller describió el abordaje quirúrgico de la acalasia en 1913, que incluía una miotomía anterior y otra posterior. Posteriormente lo modificó y se efectuó únicamente una miotomía anterior1. El abordaje puede ser transtorácico o transabdominal, ya sea de forma abierta o laparoscópica. Sin embargo, desde los comienzos de la década de 1990 se ha recomendado el acceso mínimamente invasivo, preferentemente abdominal, ya que se acompaña de menos dolor postoperatorio, una estancia hospitalaria más corta y menos morbilidad3. El tratamiento quirúrgico de la acalasia se acompaña de una serie de controversias o puntos de discusión que se analizan a continuación:
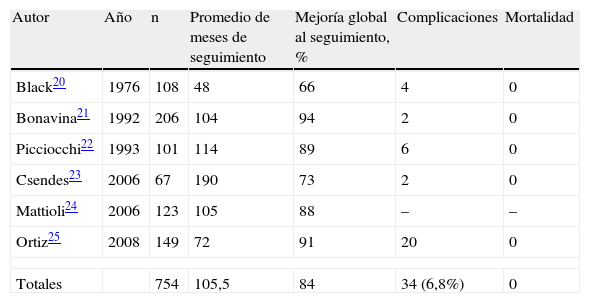
Cirugía abiertaLa miotomía esofágica efectuada de forma abierta se considera un tratamiento muy efectivo, con resultados satisfactorios a largo plazo, incluso tras 15 años de seguimiento. Por esto, sus resultados se deben utilizar como referencia con la que se debe comparar cualquier nueva alternativa. En la tabla 2 se resumen los trabajos con una casuística superior a los 50 pacientes20–25.
Resultados obtenidos con miotomía por laparotomía
| Autor | Año | n | Promedio de meses de seguimiento | Mejoría global al seguimiento, % | Complicaciones | Mortalidad |
| Black20 | 1976 | 108 | 48 | 66 | 4 | 0 |
| Bonavina21 | 1992 | 206 | 104 | 94 | 2 | 0 |
| Picciocchi22 | 1993 | 101 | 114 | 89 | 6 | 0 |
| Csendes23 | 2006 | 67 | 190 | 73 | 2 | 0 |
| Mattioli24 | 2006 | 123 | 105 | 88 | – | – |
| Ortiz25 | 2008 | 149 | 72 | 91 | 20 | 0 |
| Totales | 754 | 105,5 | 84 | 34 (6,8%) | 0 | |
El abordaje laparoscópico reproduce los resultados clínicos de la cirugía abierta, aunque no hay estudios prospectivos aleatorizados que comparen ambas opciones técnicas, ya que los buenos y reproducibles resultados del abordaje laparoscópico impiden éticamente su realización.
Cirugía abierta frente a cirugía laparoscópicaEn 1995, Ancona et al26 publicaron el primer estudio retrospectivo en el que comparaban 17 enfermos intervenidos por vía abierta y 17 por vía laparoscópica. Los resultados demostraron que tras la cirugía mínimamente invasiva (CMI) se requería menos analgesia, se recuperaba antes el peristaltismo, se reducía la estancia hospitalaria (4 días frente a 10 días) y se observaba una más rápida recuperación de las actividades diarias (16 días frente a 30 días). Otro estudio comparativo entre las 2 técnicas realizado en este centro27 mostró similares resultados. Se comparó un grupo de 13 pacientes intervenidos de forma convencional con otro de 18 pacientes intervenidos por vía laparoscópica. Los resultados demostraron que la miotomía de Heller efectuada mediante abordaje laparoscópico es tan efectiva como la realizada mediante abordaje abierto y que se acompaña de una recuperación más benigna y de una mayor satisfacción estética27.
Abordaje toracoscópico frente a abordaje laparoscópicoLos resultados clínicos de la miotomía toracoscópica han demostrado ser inferiores a los del abordaje laparoscópico. Una reciente revisión3 de 10 estudios que incluían 204 pacientes intervenidos por toracoscopia y 15 estudios con 499 pacientes operados por laparoscopia reveló una mejoría en los síntomas del 76% frente al 94%, respectivamente. Además, se observó RGE en el 35% de los enfermos del grupo toracoscópico con respecto al 13% tras el abordaje laparoscópico. Todo esto se explicaría por la dificultad que conlleva el abordaje torácico para extender la miotomía adecuadamente en la vertiente gástrica y la imposibilidad de realizar un procedimiento antirreflujo.
Extensión de la miotomíaLa miotomía debe ser amplia y realizarse unos 5 a 10cm por encima de la UGE, lo que depende del síntoma principal. Si predomina el dolor torácico se debe aumentar la sección 10 a 12cm, pero si predomina la disfagia, 5cm son suficientes28. No obstante, no es infrecuente que se produzcan seudodivertículos epifrénicos si la extensión proximal es extensa y la submucosa no queda cubierta por un procedimiento antirreflujo4.
Distalmente, la miotomía debe llegar de 1 a 3cm por debajo la UGE para dividir las fibras oblicuas del estómago, ya que la causa más común de disfagia posquirúrgica es una extensión caudal corta28. Oelschlager et al29 compararon 52 pacientes tratados con una miotomía distal de 1,5cm con 58 pacientes a los que se les realizó una miotomía extendida de 3cm. La presión postoperatoria del EEI fue menor en el grupo con la miotomía extendida que en el grupo con la miotomía estándar (9,5mmHg frente a 15,8mmHg). Además, mejoró la disfagia y la extensión no se acompañó de una mayor incidencia del RGE, valorado mediante pHmetría de 24h.
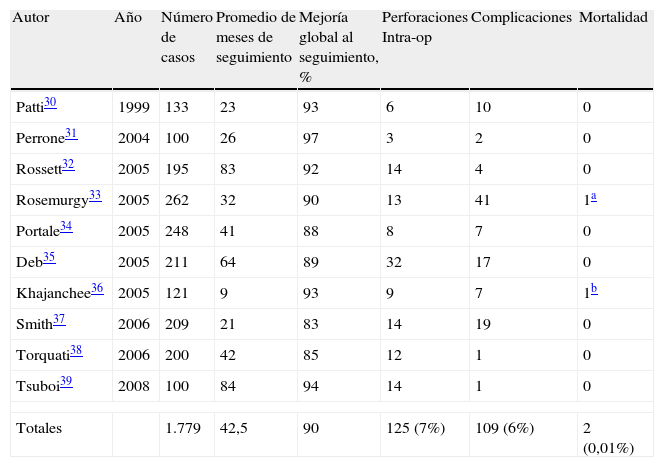
Resultados del abordaje mínimamente invasivoEn la tabla 3 se resumen los resultados a medio y largo plazo de la miotomía laparoscópica. Se han seleccionado aquellos estudios con una muestra mayor a 100 pacientes30–39. Tras una media de seguimiento de 42,5 meses (de 9 a 84) de 1.779 enfermos, el 90% de los pacientes mantenía resultados satisfactorios en contraposición con la DN. La incidencia de perforación fue del 7%, similar a la que se observa tras la dilatación. Sin embargo, en la mayoría de las ocasiones se reconoció y reparó durante el mismo acto quirúrgico. La mortalidad fue mínima: se reportaron 2 casos no relacionados con el procedimiento. La necesidad de conversión del abordaje laparoscópico a cirugía abierta fue muy baja; la perforación, la hemorragia o las adherencias son la causa más frecuente (cuando no se puede solucionar por vía laparoscópica)4.
Resultados obtenidos con miotomía laparoscópica
| Autor | Año | Número de casos | Promedio de meses de seguimiento | Mejoría global al seguimiento, % | Perforaciones Intra-op | Complicaciones | Mortalidad |
| Patti30 | 1999 | 133 | 23 | 93 | 6 | 10 | 0 |
| Perrone31 | 2004 | 100 | 26 | 97 | 3 | 2 | 0 |
| Rossett32 | 2005 | 195 | 83 | 92 | 14 | 4 | 0 |
| Rosemurgy33 | 2005 | 262 | 32 | 90 | 13 | 41 | 1a |
| Portale34 | 2005 | 248 | 41 | 88 | 8 | 7 | 0 |
| Deb35 | 2005 | 211 | 64 | 89 | 32 | 17 | 0 |
| Khajanchee36 | 2005 | 121 | 9 | 93 | 9 | 7 | 1b |
| Smith37 | 2006 | 209 | 21 | 83 | 14 | 19 | 0 |
| Torquati38 | 2006 | 200 | 42 | 85 | 12 | 1 | 0 |
| Tsuboi39 | 2008 | 100 | 84 | 94 | 14 | 1 | 0 |
| Totales | 1.779 | 42,5 | 90 | 125 (7%) | 109 (6%) | 2 (0,01%) | |
Recientemente se ha publicado la mayor serie de casos intervenidos de miotomía de Heller por vía laparoscópica. Zaninotto et al40 estudiaron prospectivamente 407 pacientes de los que 394 (97%) tuvieron una mediana de seguimiento de 30 meses y 177 (45%) tuvieron un seguimiento superior a los 60 meses. Se observó una diferencia significativa en la mejoría de la sintomatología, del descenso de la presión basal del EEI y del diámetro esofágico en el 90% de los casos. Sólo 39 pacientes (9,6%) se consideraron fracasos quirúrgicos y de éstos, 25 recidivaron en los primeros 12 meses tras la cirugía. Además, observaron que la posibilidad de estar libre de disfagia a los 5 años era del 87,3%; en los primeros 177 pacientes con un seguimiento mayor a 5 años, esta probabilidad era de un 82%.
Resultados de la miotomía a largo plazoNo se han publicado estudios que analicen los resultados de la miotomía laparoscópica a más de 10 años. No obstante, sí se conocen los resultados clínicos de la miotomía abierta con un seguimiento medio de 15,8 años. Csendes et al23 realizaron un estudio prospectivo de 30 años en un grupo de 67 pacientes a los que se les realizó una esofagomiotomía abierta con fundoplicatura anterior tipo Dor. De estos 67, 3 fallecieron por causas ajenas a la enfermedad de base. Al resto de los pacientes se los dividió en 3 grupos según el período de seguimiento: un primer grupo de 13 pacientes con un seguimiento de 7 a 10 años, otro de 34 pacientes con un seguimiento de 10 a 20 años y el último, de 17 pacientes, con un seguimiento de más de 20 años. A todos los pacientes se los evaluó mediante un cuestionario de sintomatología, manometría, endoscopia con toma de biopsias y pHmetría de 24h. Se evidenciaron excelentes o buenos resultados clínicos en el 73% de todos los pacientes tras una media de 15,8 años. La sintomatología de los pacientes empeoró mientras más lejano era el seguimiento, pero sin significación estadística. Los resultados clínicamente pobres o las miotomías que fracasaron sumaron el 22,4% de los pacientes 15 pacientes. Sólo en uno de ellos se observó una miotomía incompleta que se reintervino. En los otros 14 pacientes se desarrollaron complicaciones por RGE grave, de los que se reintervino a 2; el resto se manejó con IBP35. Los valores manométricos realizados durante el control de los pacientes se mantuvieron bajos y sin cambios después de la cirugía.
Otro estudio reciente publicado por Ortiz et al25 muestra los resultados de un seguimiento de 149 pacientes tratados mediante una intervención tipo Heller y fundoplicatura parcial posterior por laparotomía tras una media de 6 años (1 a 27 años), y de los que se siguió a 53 por más de 10 años y a 36 por más de 15. Los resultados fueron similares a los de Csendes. Un 90% de los pacientes tuvo una mejoría satisfactoria a los 5 años, pero que fue disminuyendo hasta llegar al 75% pasados los 15 años (p<0,001) debido a pirosis o disfagia. No hubo cambios manométricos postoperatorios en la presión del EEI durante el seguimiento. También se observó que, a muy largo plazo, más de un 40% de los pacientes presentó esofagitis o enfermedad por RGE.
Laparoscopia frente a dilataciónAdemás de la evidencia comentadas anteriormente (las que demuestran unos resultados más favorables a la laparoscopia), hay un ensayo clínico aleatorizado recientemente publicado por Kostic et al41 en el que se observaron unos resultados más favorables tras la CMI que tras la dilatación. En este estudio se compararon 2 grupos, uno de 26 pacientes dilatados neumáticamente de forma primaria con otro de 25 pacientes en los que se realizó una miotomía laparoscópica asociada a una fundoplicatura posterior. Tras un seguimiento de 12 meses se observó un mayor fracaso terapéutico tras la dilatación que tras la cirugía (p=0,04); éste se estableció por lo siguiente: a) control incompleto de la sintomatología, que requirió más de 3 procedimientos en 12 meses; b) 2 sesiones de dilatación en 7 o 10 días; c) efectos adversos del procedimiento, o d) indicación médica de cambio de tratamiento, previo consentimiento del tribunal del ensayo.
Seudoacalasia y enfermedades asociadasMás allá de los resultados clínicos, la cirugía laparoscópica ofrece una ventaja adicional sobre la dilatación, que es la posibilidad de diagnosticar o tratar otras condiciones asociadas o que simulen una acalasia. En nuestra serie publicada de 81 pacientes diagnosticados de acalasia y a los que se les realizó una intervención tipo Heller por laparoscopia, se asociaron otras 9 enfermedades gastrointestinales: 3 pacientes con seudoacalasia, 3 pacientes con hernia de hiato paraesofágica, 2 casos de divertículo esofágico y un caso de vólvulo gástrico42. El abordaje laparoscópico permitió realizar, junto con la miotomía, la reparación de la hernia de hiato de los 3 pacientes, la exéresis del divertículo en un paciente y la asociación de la pexia para el paciente que presentaba el vólvulo gástrico.
Procedimiento antirreflujo, ¿es necesario?Como se ha comentado previamente, la complicación postoperatoria más frecuente, sobre todo a largo plazo, es el RGE, que puede llegar al 30% de los pacientes. Richards et al43 demostraron en un estudio aleatorizado doble ciego en una serie de 43 pacientes, en el que a un grupo de 21 pacientes sólo se le realizó una miotomía y a otro de 22 pacientes se le añadió una fundoplicatura anterior tipo Dor, que la presencia de RGE en el grupo sin antirreflujo fue del 47,6% y en el segundo del 9,1% (p=0,005).
Sin embargo, no hay consenso sobre el tipo de procedimiento antirreflujo que realizar. La fundoplicatura posterior (Toupet) prevendría de la reaproximación de los bordes de la miotomía al fijar los bordes de ésta; pero se realiza una mayor disección retroesofágica, lo que incrementa el riesgo de disfagia postoperatoria por la angulación de la UGE, por lo que no se recomienda cuando hay dilatación esofágica porque puede significar un obstáculo al vaciado esofágico28. Por otro lado, la fundoplicatura anterior (Dor) también previene la aproximación de los bordes de la miotomía, protege la mucosa esofágica al apoyarse sobre la miotomía, evita posibles complicaciones por fístulas o la aparición de seudodivertículos, preserva el espacio esofágico posterior y es más fácil de realizar3.
Rossetti et al32 han demostrado que también es factible la realización de una fundoplicatura de 360° tipo Nissen con excelentes resultados (91,8% de satisfacción con un seguimiento promedio de 84 meses), sin que afecte el vaciamiento esofágico y sin detectar reflujo gástrico patológico en ninguno de los pacientes. No obstante, en una publicación reciente, Rebecchi et al44 observaron en un ensayo clínico aleatorizado a 138 pacientes a los que se dividió en 2 grupos, uno de 71 pacientes (51%) a los que se les realizó una intervención tipo Heller-Dor y otro de 67 pacientes (49%) a los que se les efectuó una intervención tipo Heller-Nissen. Aunque no hubo diferencia significativa en cuanto a la aparición de RGE, sí hubo en cuanto a la recurrencia de la disfagia (2,8 frente al 15% p significativa).
¿Por qué fracasa la miotomía?Zaninotto et al45 observaron en 10 de 113 pacientes en los que se realizó una intervención tipo Heller-Dor que el fracaso de la miotomía dentro del primer año tras la intervención era consecuencia de una miotomía incompleta o fibrosis en el extremo distal de ésta. Estos pacientes tenían una longitud de su EEI mayor a los pacientes asintomáticos, pero con presiones basales dentro del límite de la normalidad. Se realizó una DN a baja presión con una tasa de éxito del 80%.
Otra razón de fracaso a largo plazo es el desarrollo de una enfermedad por RGE complicada con estenosis o transformación a un esófago de Barret. También el desarrollo de un divertículo sobre la porción miotomizada puede disminuir la mejoría de los pacientes4.
El tratamiento endoluminal previo, ¿dificulta la miotomía?El impacto del tratamiento endoscópico previo sobre los resultados de la miotomía es controvertido. Smith et al37, en una serie de 209 pacientes compararon 154 pacientes a los que se trató de forma endoscópica previamente a la cirugía (a 100 se los dilató, a 33 se les inyectó TB y a 21 se les realizaron los 2 procedimientos) con 54 pacientes que se intervinieron sin tratamiento endoscópico previo, y observaron una mayor incidencia de complicaciones operatorias y postoperatorias inmediatas en el grupo tratado endoscópicamente (p<0,05). Además, se observó un fracaso en la miotomía en casi un 20% de estos pacientes, bien por persistencia o recurrencia de la sintomatología, necesidad de nuevas intervenciones endoscópicas, remiotomía o esofaguectomía (p<0,05). Los factores causantes de estos malos resultados fueron la mayor dificultad en la disección del plano submucoso y las adherencias mediastínicas.
No obstante, en otros estudios34,46-48 se observó que solamente la inyección de TB en más de 2 ocasiones, o sumada a una dilatación, disminuiría el éxito de la miotomía quirúrgica. La dilatación como tratamiento previo a la cirugía no afecta de manera significativa los resultados a largo plazo, aunque éstos pueden verse disminuidos. Los pacientes incluidos en el tratamiento quirúrgico en primera instancia tuvieron las mejores tasas de mejoría a largo plazo.
Predicción de resultadosLos factores con capacidad predictiva de resultados se han evaluado mayoritariamente para la DN. Los que afectan negativamente el resultado de la DN se han detallado previamente. Como evidencian Dağlı et al18, los pacientes jóvenes (menores de 40 años) responden peor a la dilatación, por lo que son buenos candidatos para la cirugía en primer término. En otro estudio19 se evidenció que los pacientes dilatados en los que la reducción de la presión del EEI era inferior o igual a 10mmHg tenían mayor probabilidad de permanecer libres de disfagia a largo plazo (5 años o más). La disfagia presentaba recurrencias en un menor plazo mientras más alta era la presión residual del esfínter.
En un estudio prospectivo que comparó los resultados de los pacientes que requirieron una miotomía después de una dilatación fallida con los pacientes que respondieron bien a la dilatación primaria, Gockel et al49 encontraron que, a menor edad, había mayor probabilidad de que la opción quirúrgica fuera la indicada. Por medio de la utilización de la odds ratio para determinar el riesgo de una miotomía, los autores encontraron que un paciente diagnosticado a los 70 años tenía una probabilidad de necesitar una miotomía de un 8%, mientras que a los 40 era de un 35% y a los 15 años de un 70%44.
Una presión esfinteriana basal prequirúrgica alta es un predictor independiente de la mejoría de la disfagia. Torquati et al38 lo confirmaron en una serie de 200 pacientes. Ellos encontraron que los pacientes con una presión preoperatoria superior a 35mmHg tenían 21,3 veces mas posibilidades de mejorar su disfagia que aquéllos con una presión menor a esa cifra.
Los resultados del beneficio de la cirugía en pacientes con megaesófago son difíciles de predecir, ya que no sólo hay una dificultad para el paso del bolo por el EEI, sino que la tortuosidad del esófago retrasa el flujo alimenticio. Patti et al50 demostraron en una serie de 66 pacientes con varios grados de dilatación esofágica que incluso en los pacientes con un diámetro esofágico de más de 6cm y tortuosidad se observaban resultados satisfactorios.
Calidad de vida y acalasiaLos análisis de calidad de vida en enfermos de acalasia en las diversas series estudiadas sólo se centran en la mejora de la sintomatología clínica y subestiman las consecuencias físicas, psíquicas y sociales de esta enfermedad. No hay ningún test de calidad de vida específico para acalasia. Decker et al51 utilizaron el GIQLI (Gastrointestinal Quality of Life Index) en un estudio prospectivo con 71 pacientes intervenidos de miotomía más fundoplicatura controlados durante una mediana de 30 meses como test para valorar la calidad de vida de los pacientes en todas las esferas. En el estudio resalta una mejoría significativa no sólo de la sintomatología, sino también de la disfunción social, emocional y social en los pacientes intervenidos, incluso en los pacientes con dilatación masiva del esófago.
¿Hay nuevos abordajes para la acalasia?Los nuevos avances técnicos que han seguido a la revolución laparoscópica también se han aplicado en el tratamiento de la acalasia. La utilización de un robot tipo Da Vinci se ha demostrado como factible y potencialmente útil para efectuar las delicadas maniobras de manipulación del esófago al efectuar la miotomía, aunque no hay una comparación con el abordaje laparoscópico convencional. También está la propuesta técnica para efectuar la miotomía mediante un abordaje endoluminal. Es posible efectuar la miotomía de forma transesofágica tras acceder al espacio submucoso por vía endoluminal, aunque esta opción técnica corresponde únicamente a un modelo experimental52,53.
ConclusiónNo hay ningún tratamiento médico o quirúrgico que pueda normalizar la motilidad esofágica. La cirugía laparoscópica se acompaña de mayores tasas de éxito a corto y a largo plazo con muy baja morbilidad. Se debe asociar un procedimiento antirreflujo a la miotomía y ésta debe extenderse distalmente para conseguir los mejores resultados. Las DN son útiles como opción ante el fracaso de la cirugía y ante las contraindicaciones de ésta. La administración de TB o el tratamiento médico únicamente se aceptan ante la imposibilidad de llevar a cabo algún otro tipo de procedimiento.