La infección por citomegalovirus (CMV) es muy frecuente en la población general, con una seroprevalencia basada en la IgG positiva del 83%1. En pacientes inmunocompetentes normalmente cursa de forma asintomática o produce un cuadro seudogripal. Sus complicaciones más frecuentes son la hepatitis aguda, la esplenomegalia y puede haber riesgo de rotura esplénica. La trombosis venosa mesentérica ha sido descrita como una complicación rara de la infección aguda por CMV2.
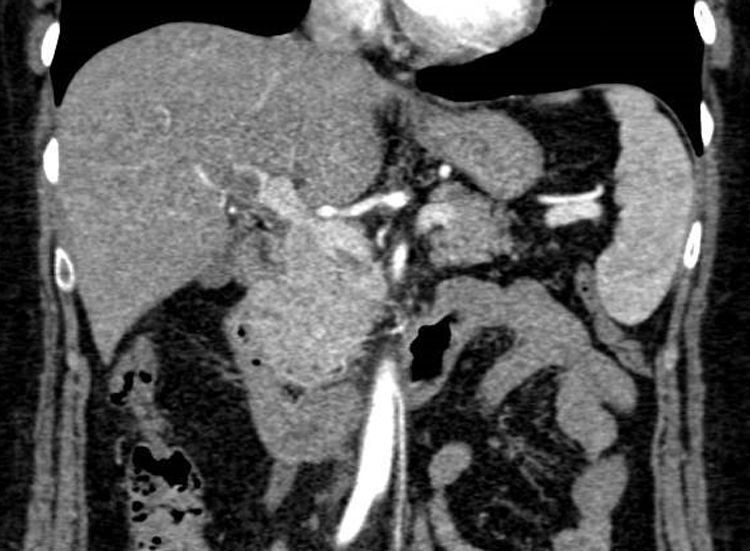
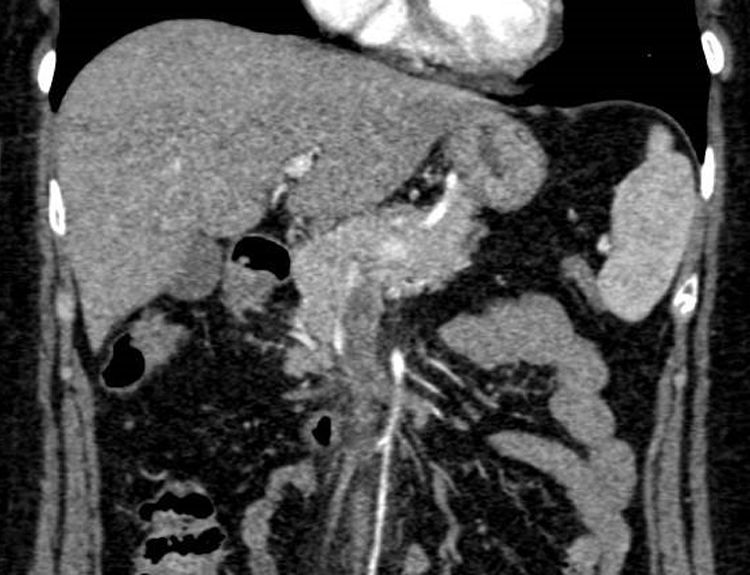
Presentamos el caso de una mujer de 55 años que ingresó por astenia, cefalea y molestias epigástricas tipo distensión. Al ingreso la analítica mostraba 11.650 leucocitos/μl (63,2% linfocitos/μl), proteína C reactiva de 21,2mg/l, aspartato aminotransferasa de 119U/l, alanina aminotransferasa de 120U/l, gamma-glutamil transferasa de 113U/l, fosfatasa alcalina de 179U/l, bilirrubina total de 0,5mg/dl y lactato deshidrogenasa de 357U/l. A su llegada se realizó una ecografía de abdomen donde se objetivó hiperecogenicidad de los vasos portales sugerente de edema, ausencia de señal con eco-doppler en la vena porta y material hiperecogénico en la vena mesentérica superior, compatible con trombosis. Se completó el estudio con una tomografía computarizada (TC) de abdomen, que demostró un defecto de repleción en la vena porta derecha intrahepática y en el interior de la vena mesentérica superior compatibles con trombosis. Tras los resultados de la TC, se comenzó tratamiento con enoxaparina a dosis de 1,5mg/kg/día (figs. 1 y 2). El estudio de hipercoagulabilidad con determinación de anticuerpos anticardiolipina, anti-β2-glicoproteina, anticoagulante lúpico, resistencia de la proteína C activada, proteína C y S, homocisteína, antitrombina funcional, mutación para el factor V de Leyden y mutación G20210A, fue negativo. El estudio de autoinmunidad, estudio hematológico con frotis, proteinograma, ß2-microglobulina y mutación para JAK2 fueron negativos y la serología para hepatitis virales y causas infecciosas incluyéndose Brucella, Salmonella, Rickettsia conorii, Leishmania, Coxiella burnetii, virus de Epstein-Barr y CMV, fue únicamente positiva para la IgM del CMV. Se completó el estudio con una gastroscopia y una resonancia magnética craneal sin hallazgos. Ante la sospecha del CMV como causa principal de la trombosis, se realizó la reacción en cadena de la polimerasa (PCR) para el CMV en sangre que cuantificó 16.600copias/ml, confirmándose la infección aguda por CMV. Por la forma de presentación agresiva, se decidió de forma conjunta con el grupo de enfermedades infecciosas, la administración de valganciclovir 900mg/12horas durante 14 días. La paciente evolucionó bien, con mejoría de los síntomas tras varios días de tratamiento antiviral. Tras 6 meses de anticoagulación con enoxaparina, se realizó una TC de abdomen de control con resolución completa de la trombosis venosa y posteriormente se repitió el estudio de hipercoagulabilidad que volvió a ser negativo, así como una nueva PCR para el CMV en sangre que fue negativa. Tras la resolución de la trombosis y del cuadro viral que la precipitó, en ausencia de otro factor protrombótico, se decidió finalizar el tratamiento anticoagulante. Posteriormente la paciente ha permanecido asintomática, sin datos de recidiva trombótica a los 6 meses de la suspensión de la anticoagulación.
La trombosis venosa del eje esplenoportal (TVEP) habitualmente se produce en el contexto de una causa subyacente que debe ser investigada y tratada. Las principales causas de trombosis se dividen en causas sistémicas, como la trombofilia hereditaria, síndromes mieloproliferativos, hemoglobinuria paroxística nocturna, infecciones sistémicas o tratamiento hormonal. Dentro de las casusas locales, los tumores o quistes que comprimen el tracto venoso pueden dar lugar a una trombosis3. Cuando se diagnostica la TVEP, es importante la búsqueda de los factores de riesgo trombóticos más frecuentes, ya que en muchas ocasiones la causa es multifactorial, pero la propia infección aguda por CMV puede producir la trombosis. Aunque es infrecuente, se han descrito casos de pacientes inmunocompetentes con trombosis portal y/o de la vena mesentérica, en el contexto de una infección aguda por CMV sin otra causa predisponente, al igual que ocurría en nuestro caso2.
De forma general, las infecciones virales se han relacionado con un mayor riesgo trombótico, ya que dan lugar a una respuesta inflamatoria sistémica que activa la coagulación a través de la producción de citoquinas. En concreto para el CMV se ha descrito que el 6,4% de los pacientes hospitalizados con infección aguda por CMV presentan una trombosis venosa, siendo las localizaciones más frecuentes la trombosis venosa esplénica y el infarto esplénico, aunque también se han observado casos con tromboembolismo pulmonar y trombosis venosa profunda4. Esta predisposición trombótica es compartida por otros virus de la familia Herpesviridae (herpes tipo 1 y 2) ya que, a parte de la inflamación sistémica, tienen un efecto procoagulante intrínseco. En su estructura viral constan de una cubierta con expresión de fosfolípidos procoagulantes que son capaces de ensamblar los factores de la coagulación Xa y Va en protombinasa, por lo que son capaces de producir trombina. Además, tienen expresión en superficie del factor tisular con la consiguiente activación del factor X5. Por tanto, el CMV per se actúa como activador de la cascada de la coagulación, predisponiendo de esta forma a la formación de trombos a cualquier nivel. Además, se ha visto que durante la infección aguda por CMV parece producirse una elevación transitoria de anticuerpos antifosfolípido, que tras resolverse la infección sus niveles disminuyen o se negativizan, predisponiendo también de esta forma el estado protrombótico durante la infección2,4.
Como conclusión, resaltamos la relación del CMV con los eventos trombóticos, que muchas veces pasa desapercibida y la importancia de la infección aguda por CMV en el diagnóstico diferencial de la TVEP.