El carcinoma colorrectal (CCR) puede inducir una respuesta inmunitaria antitumoral mediada por linfocitos T, que expresan el CD3.
ObjetivosAnalizar el valor pronóstico de la expresión tisular de CD3 intraepitelial (CD3I) globalmente y en los estadios tumorales menos avanzados.
MétodosRevisamos 251 CCR resecados, con evolución controlada, estudiando inmunohistoquímicamente la expresión de CD3I. Determinamos mediante análisis multivariante las variables con valor pronóstico independiente sobre la supervivencia del CCR. Analizamos la expresión de CD3I (+), en relación con la supervivencia y la progresión tumoral, globalmente y en los pacientes en estadio pTNM (I-II), estableciendo su sensibilidad, especificidad, valor predictivo positivo (VP+) y negativo y precisión diagnóstica.
ResultadosUn 25,9% de los CCR fueron CD3I (+). Tras un seguimiento medio de 74 meses, la expresión CD3I (+) mostró un valor pronóstico favorable para la supervivencia en el análisis multivariante (p=0,045). Las curvas de supervivencia y no progresión tumoral resultaron más favorables en los casos CD3I (+), tanto globalmente (p=0,009 y p=0,004, respectivamente), como en estadio I-II (p=0,029 y p=0,015). La especificidad (E) y valor predictivo positivo (VP+) de la expresión de CD3I (+) fueron: supervivencia global, E=0,89; VP+=0,91. Estadio (I-II): E=0,94; VP+=0,98. Sin progresión tumoral global: E=0,89; VP+=0,88. Estadio (I-II): E=0,92; VP+=0,96.
ConclusionesLa expresión de CD3I conlleva un valor pronóstico favorable independiente, con porcentajes significativamente superiores de supervivencia y de no progresión tumoral, manteniéndose este mejor pronóstico en los estadios menos avanzados (I-II) y presentando unas elevadas tasas de especificidad y valor predictivo positivo.
Colorectal cancer (CRC) can induce an anti-tumoral immune response mediated by T-lymphocytes, which express CD3.
ObjectivesTo analyze the prognostic value of tissue expression of intraepithelial CD3 (CD3I) both overall and in the early tumoral stages.
MethodsWe revised 251 patients with resected CRC and favorable clinical course. CD3I expression was analyzed by immunohistochemistry. Multivariate analysis was used to analyze the variables independently associated with survival. We analyzed CD3I(+) expression in relation to survival and tumoral progression, both overall and in patients with pTNM(I-II) stage tumors. The sensitivity, specificity, positive and negative predictive values and diagnostic accuracy of CD3I expression were analyzed.
ResultsA total of 25.9% of patients with CRC were CD3I(+). After a mean follow-up of 74 months, CD3I(+) expression showed a favorable prognostic value for survival in the multivariate analysis (p=0.045). Survival curves and absence of tumoral progression were more favorable in CD3I(+) cases, both overall (p=0.009 and p=0.004, respectively), and in stages I-II (p=0.029 and p=0.015). The specificity and positive predictive value of CD3I(+) were as follows: Survival: overall: specificity =0.89; positive predictive value =0.91. Stage (I-II): specificity =0.94; positive predictive value =0.98. Absence of tumoral progression: overall: specificity=0.89; positive predictive value =0.88. Stage (I-II): specificity =0.92; positive predictive value =0.96.
ConclusionsCD3I expression has an favorable independent prognostic value, with statistically significantly higher percentages of survival and absence of tumoral progression. This more favorable outcome is maintained in the less advanced stages (I-II). CD3I expression shows high specificity and positive predictive value.
El carcinoma colorrectal (CCR) supone un problema sociosanitario de primer orden1, habiendo motivado la implantación de programas de cribado poblacionales para intentar prevenirlo o al menos mejorar su pronóstico mediante un diagnóstico más precoz2,3. En la actualidad, el CCR ha pasado a ocupar el primer lugar como causa de muerte por cáncer en España y Europa occidental, si sumamos los sexos masculino y femenino4,5. La supervivencia del CCR presenta una gran variabilidad individual en el momento del diagnóstico, habiéndose propuesto numerosos factores relacionados con el pronóstico de esta neoplasia, basados fundamentalmente en criterios clínico-histológicos6–9. Aunque en los últimos años se han incorporado nuevos parámetros anatomopatológicos predictivos como el budding y el microenvironment tumoral6,10, todavía se sigue considerando la estadificación del tumor tras el estudio de pieza quirúrgica (pTNM) como la prueba de referencia para el pronóstico de los pacientes6,11,12.
En el desarrollo del CCR es muy importante el efecto acumulativo de alteraciones genéticas secuenciales, que conducen a la expresión de antígenos asociados al tumor con capacidad de inducir una respuesta celular antitumoral13. Esta respuesta inmunitaria antitumoral del huésped se manifiesta en forma de infiltración tumoral linfocítica13, que puede observarse mediante técnicas de inmunohistoquímica. En los últimos años está cobrando una notable importancia el estudio de la infiltración tumoral linfocítica, como posible factor de buen pronóstico en el CCR14–20. La respuesta inmunitaria antitumoral está mediada por linfocitos T13. La totalidad de estos linfocitos T expresan CD3, que es una proteína de superficie asociada al receptor de células T21, considerándose al CD3 como el «pan-marcador» de linfocitos T13. Por ello, se ha propuesto el estudio de la expresión tisular de CD3 por inmunohistoquímica como un método de estudio de la respuesta del huésped frente al tumor y por tanto como posible factor predictivo del pronóstico del paciente11,13,16,17,22,23. Los trabajos referidos al valor pronóstico de CD3 en el CCR son relativamente escasos y presentan algunos resultados discordantes, no habiendo encontrado estudios realizados sobre este tema en nuestro país. Por todo ello hemos planteado este trabajo, con el objetivo de analizar el posible valor pronóstico independiente de la expresión tisular de CD3 en el epitelio del CCR resecado. Adicionalmente, hemos querido estudiar su relación con la supervivencia y la no progresión tumoral posquirúrgica en el subgrupo de pacientes diagnosticados en fases menos avanzadas de crecimiento tumoral: estadios I-II, así como determinar la sensibilidad, especificidad, el valor predictivo positivo y negativo y la precisión diagnóstica de la expresión de CD3I, considerándolo como parámetro de buen pronóstico en el CCR resecado.
Material y métodosEfectuamos un análisis retrospectivo, observacional y longitudinal de 251 casos de CCR, resecados de modo consecutivo, durante el periodo de enero de 1999 a diciembre de 2003. Los pacientes tuvieron una evolución clínica controlada y respondieron a una encuesta que incluía su autorización para revisar sus datos.
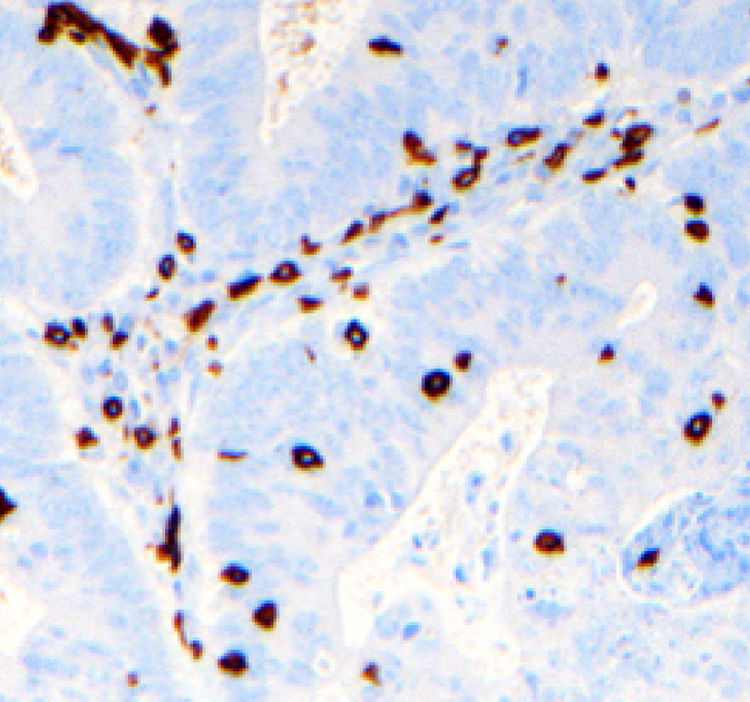
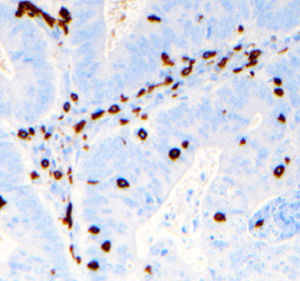
El estudio histológico e inmunohistoquímico del CD3I fue revisado por un único patólogo, para evitar diferencias interobservador, y se realizó con el sistema automatizado Benchmark XT. Los cortes histológicos se incubaron con el anticuerpo monoclonal de ratón: clon 2gv6 (Ventana Medical System, USA), incluyendo un control positivo. Se valoró la tinción tisular de CD3 de modo cualitativo, estableciendo un cociente entre la presencia de linfocitos CD3 marcados en el epitelio tumoral y en los bordes sin tumor de la pieza quirúrgica. Se consideraron como positivos los casos en los que la tinción de linfocitos intraepiteliales CD3 fue tres veces superior con respecto al epitelio no tumoral, por campo de gran aumento.
El análisis de los posibles factores relacionados con la supervivencia tras la resección quirúrgica del tumor ha incluido las siguientes variables: a) rasgos clínicos del paciente: sexo, edad, consumo de alcohol y tabaco (sí/no), índice de masa corporal < 21 (bajo peso), 21-24,9 (normopeso), 25-29,9 (sobrepeso) y ≥ 30 (obesidad), antecedentes personales y familiares de primer grado de CCR; b) características del tumor: CEA>10ng/ml al diagnóstico, localización colónica o rectal, presencia de lesiones neoplásicas sincrónicas, tipo histológico, grado de diferenciación, estadio pTNM24, y estudio inmunohistoquímico de la expresión tisular de CD3I, y c) realización de cirugía con intención curativa y administración de tratamiento oncológico adyuvante.
Para determinar el posible valor pronóstico de las diferentes variables, hemos llevado a cabo un estudio univariante ajustando curvas de supervivencia de Kaplan-Meier, comparadas con el test de log rank. Las variables que mostraron una p<0,05 en el análisis univariante fueron incluidas en un modelo de riesgos proporcionales de Cox multivariante (stepwise). Se han calculado las razones de tasas: hazard ratio (HR) y los intervalos de confianza al 95% (IC 95%). Dado que el factor de interés en este estudio es el CD3I, se han incluido el resto de variables como variables de ajuste y además se ha evaluado si el efecto de CD3I sobre la supervivencia difería en función del resto de categorías mediante términos de interacción.
Se estudió la frecuencia de expresión tisular (+) de CD3I en relación con la supervivencia y la presencia de progresión tumoral posquirúrgica al final del seguimiento, tanto en el global de la serie como en los pacientes en estadio pTNM I-II. Incluimos como progresión tumoral los casos con crecimiento tumoral locorregional y/o metástasis a distancia.
Empleamos el test de Student para la comparación de variables continuas y los de Fisher y ji al cuadrado para las cualitativas, calculando la odds ratio (OR) y su IC 95%. Todos los análisis estadísticos se efectuaron con los programas SPSS 17 y R 2.9.2
Considerando la expresión de CD3I como una prueba predictiva, determinamos la sensibilidad, especificidad, valor predictivo positivo y negativo y precisión diagnóstica de la tinción tisular (+) de CD3I, con respecto a la supervivencia y a la progresión o no del tumor, en la totalidad de la serie y en los casos en estadio (I-II).
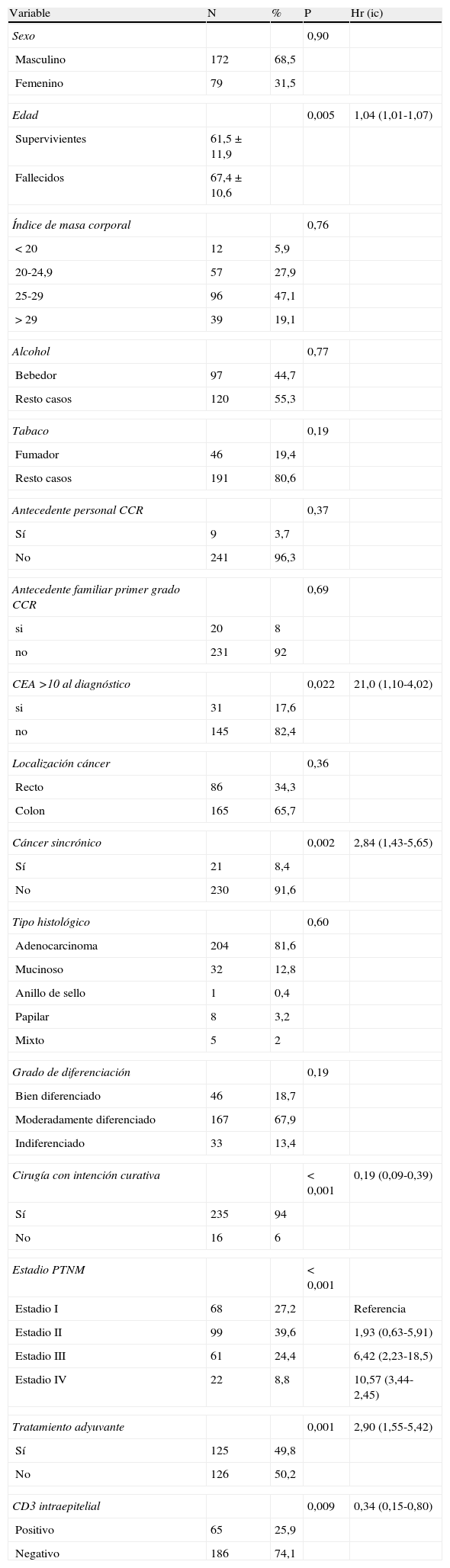
ResultadosEn la Tabla I se recoge el análisis descriptivo de las características de nuestra serie. El periodo de seguimiento ha sido de 74±34,5 meses y la supervivencia media fue del 78,5%.
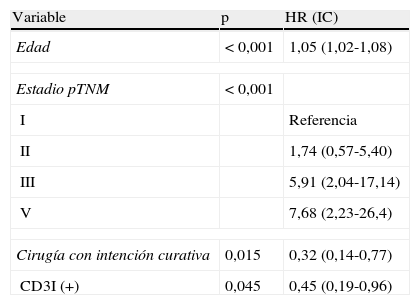
Los resultados del análisis univariante de las diversas variables posiblemente relacionadas con la mortalidad del CCR se resumen en la tabla 1. En el análisis multivariante efectuado, los parámetros que alcanzaron un valor pronóstico independiente favorable para la supervivencia fueron: la mayor edad del paciente, el estadio tumoral pTNM, la cirugía con intención curativa y la expresión (+) de CD3I. Las interacciones de todas las variables con el CD3I resultaron no significativas. El diagnóstico del modelo de Cox indica que la hipótesis de proporcionalidad se cumple para todas estas variables, cuyos valores de p, HR e IC al 95% se detallan en la tabla 2. La administración de tratamiento oncológico adyuvante pierde significación pronóstica en el modelo multivariante (p=0,64) debido a estar asociada con el estadio tumoral (p < 0,001).
Estudio descriptivo de las variables y análisis univariante con respecto a la supervivencia
| Variable | N | % | P | Hr (ic) |
| Sexo | 0,90 | |||
| Masculino | 172 | 68,5 | ||
| Femenino | 79 | 31,5 | ||
| Edad | 0,005 | 1,04 (1,01-1,07) | ||
| Supervivientes | 61,5±11,9 | |||
| Fallecidos | 67,4±10,6 | |||
| Índice de masa corporal | 0,76 | |||
| < 20 | 12 | 5,9 | ||
| 20-24,9 | 57 | 27,9 | ||
| 25-29 | 96 | 47,1 | ||
| > 29 | 39 | 19,1 | ||
| Alcohol | 0,77 | |||
| Bebedor | 97 | 44,7 | ||
| Resto casos | 120 | 55,3 | ||
| Tabaco | 0,19 | |||
| Fumador | 46 | 19,4 | ||
| Resto casos | 191 | 80,6 | ||
| Antecedente personal CCR | 0,37 | |||
| Sí | 9 | 3,7 | ||
| No | 241 | 96,3 | ||
| Antecedente familiar primer grado CCR | 0,69 | |||
| si | 20 | 8 | ||
| no | 231 | 92 | ||
| CEA >10 al diagnóstico | 0,022 | 21,0 (1,10-4,02) | ||
| si | 31 | 17,6 | ||
| no | 145 | 82,4 | ||
| Localización cáncer | 0,36 | |||
| Recto | 86 | 34,3 | ||
| Colon | 165 | 65,7 | ||
| Cáncer sincrónico | 0,002 | 2,84 (1,43-5,65) | ||
| Sí | 21 | 8,4 | ||
| No | 230 | 91,6 | ||
| Tipo histológico | 0,60 | |||
| Adenocarcinoma | 204 | 81,6 | ||
| Mucinoso | 32 | 12,8 | ||
| Anillo de sello | 1 | 0,4 | ||
| Papilar | 8 | 3,2 | ||
| Mixto | 5 | 2 | ||
| Grado de diferenciación | 0,19 | |||
| Bien diferenciado | 46 | 18,7 | ||
| Moderadamente diferenciado | 167 | 67,9 | ||
| Indiferenciado | 33 | 13,4 | ||
| Cirugía con intención curativa | < 0,001 | 0,19 (0,09-0,39) | ||
| Sí | 235 | 94 | ||
| No | 16 | 6 | ||
| Estadio PTNM | < 0,001 | |||
| Estadio I | 68 | 27,2 | Referencia | |
| Estadio II | 99 | 39,6 | 1,93 (0,63-5,91) | |
| Estadio III | 61 | 24,4 | 6,42 (2,23-18,5) | |
| Estadio IV | 22 | 8,8 | 10,57 (3,44-2,45) | |
| Tratamiento adyuvante | 0,001 | 2,90 (1,55-5,42) | ||
| Sí | 125 | 49,8 | ||
| No | 126 | 50,2 | ||
| CD3 intraepitelial | 0,009 | 0,34 (0,15-0,80) | ||
| Positivo | 65 | 25,9 | ||
| Negativo | 186 | 74,1 | ||
HR: hazard ratio; IC: índice de confianza al 95%; N: número de casos; %: frecuencia de presentación; p: test de log rank.
Variables con valor pronóstico independiente en el análisis multivariable
| Variable | p | HR (IC) |
| Edad | < 0,001 | 1,05 (1,02-1,08) |
| Estadio pTNM | < 0,001 | |
| I | Referencia | |
| II | 1,74 (0,57-5,40) | |
| III | 5,91 (2,04-17,14) | |
| V | 7,68 (2,23-26,4) | |
| Cirugía con intención curativa | 0,015 | 0,32 (0,14-0,77) |
| CD3I (+) | 0,045 | 0,45 (0,19-0,96) |
HR: hazard ratio; IC: índice de confianza al 95%; p: modelo de Cox, stepwise.
Un 25,9% de los CCR mostró expresión tisular positiva de CD3I (fig. 1). La duración media del seguimiento ha sido similar entre los casos CD3I (+): 76,4±34,4 y CD3I (−): 73,2±34,5 meses, p=0,52. No encontramos diferencias en cuanto a frecuencia de expresión de CD3I (+) en razón del sexo de los pacientes: masculino=24,4%, femenino=29,1% (p=0,43); de su edad: < 65 años=24%, ≥ 65=27,7% (p=0,50); ni de la localización del tumor: colon=24,2%, recto=26,7% (p=0,81). Tampoco registramos diferencias significativas en la frecuencia de expresión (+) del CD3I entre los tumores en estadio II que recibieron tratamiento adyuvante (33,3%) y los que no lo recibieron (45,8%) (p=0,26).
Un 72,1% de los pacientes no presentaron progresión tumoral tras la resección. En los casos con progresión registramos crecimiento locorregional, sin metástasis, en el 19,4% y metástasis a distancia en el 80,6%. Ambos tipos de progresión tumoral se presentaron preferentemente en los CCR de localización distal al ángulo esplénico (64,2 y 65,5% respectivamente). La proporción de casos con CD3 intraepitelial (+) fue similar entre pacientes con progresión locorregional (14,3%) y con metástasis (10,3%) (p=0,65).
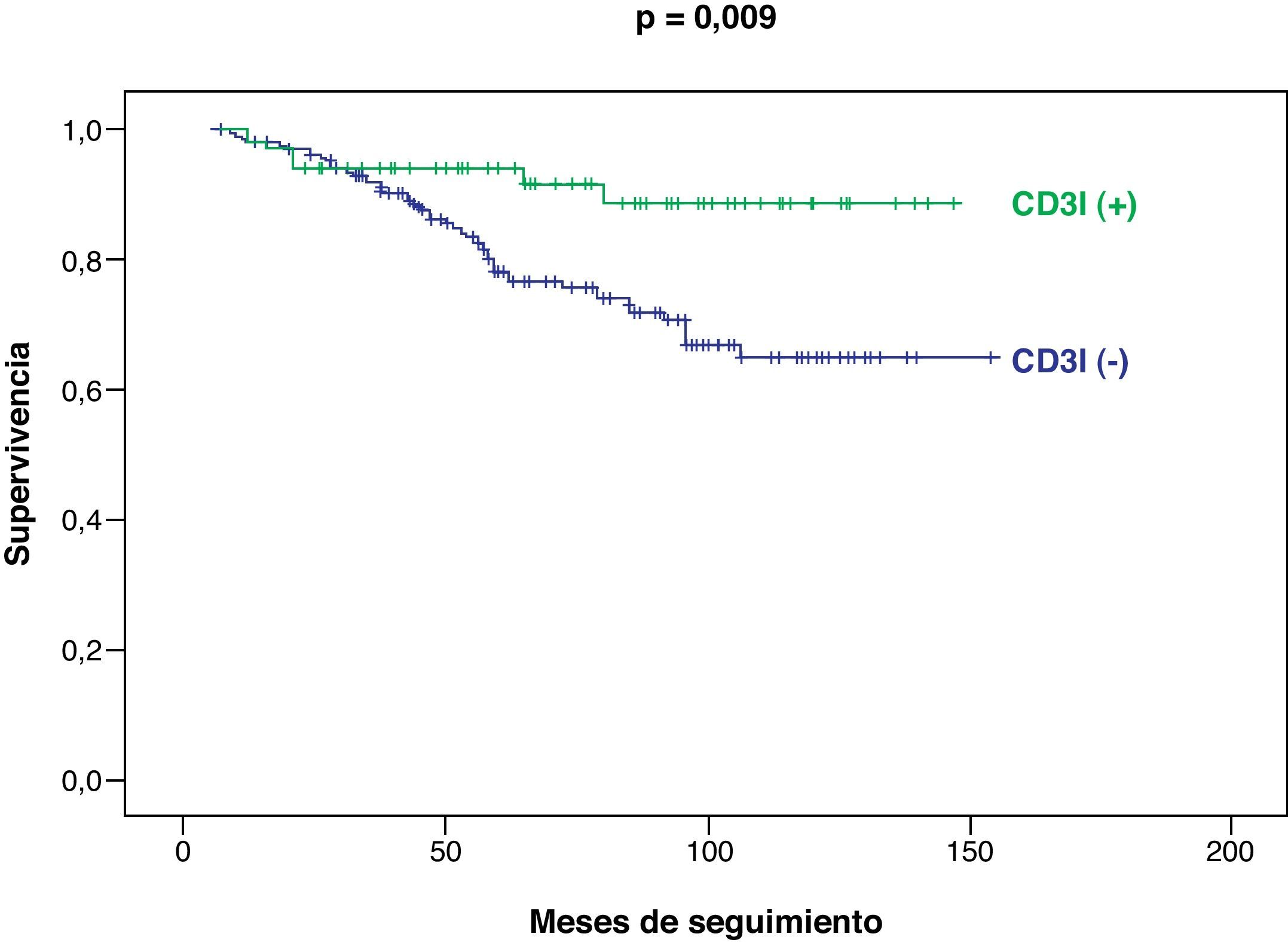
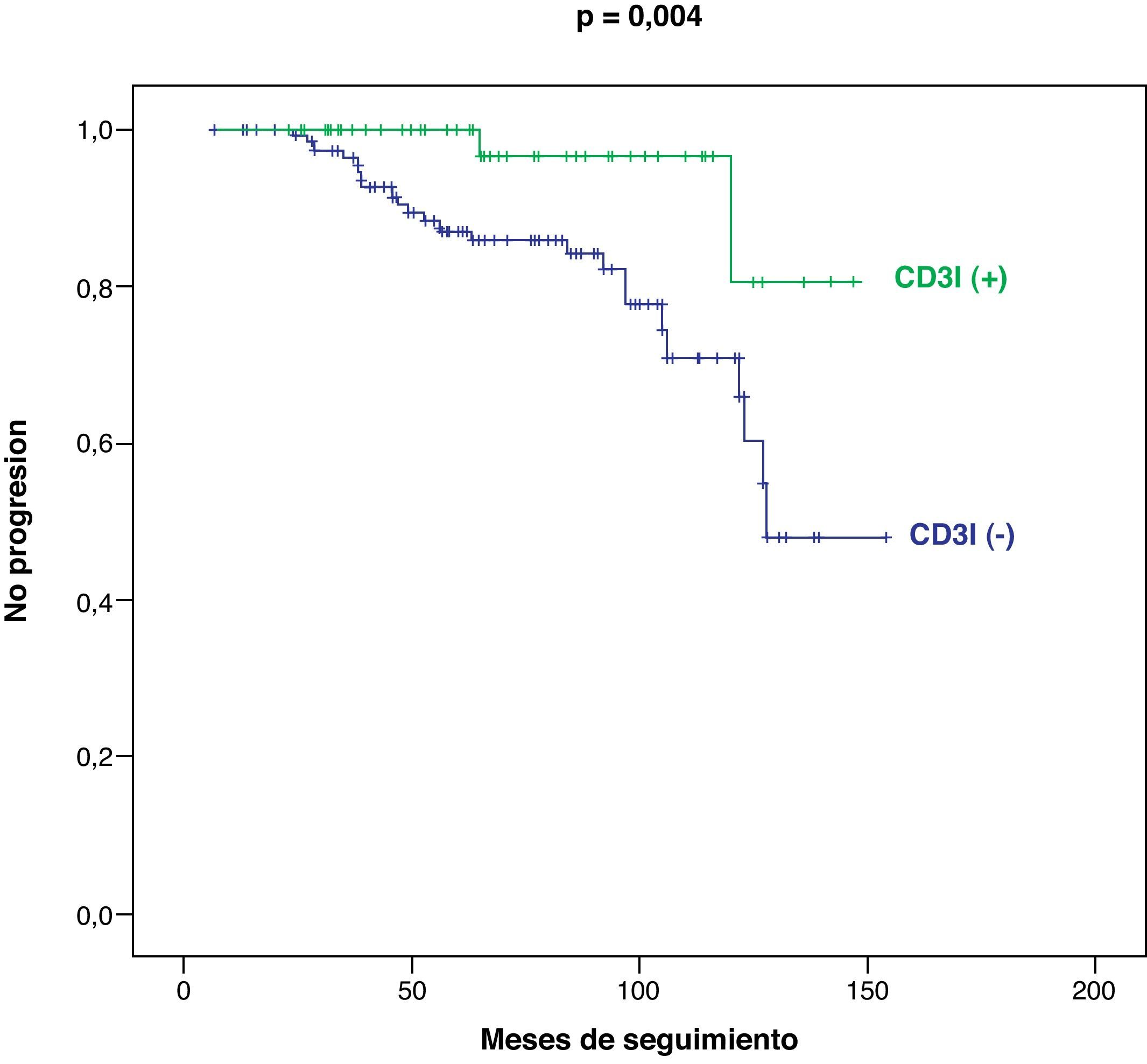
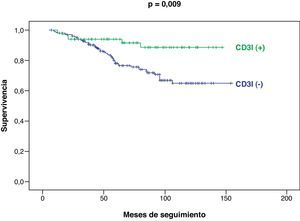
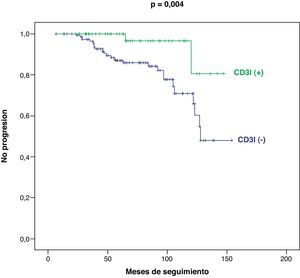
Considerando la totalidad de nuestra serie, las curvas de supervivencia y de no progresión tumoral han sido significativamente más favorables en los pacientes CD3I (+), con respecto a los CD3I (−), p=0,009 (fig. 2) y p=0,004, respectivamente (fig. 3).
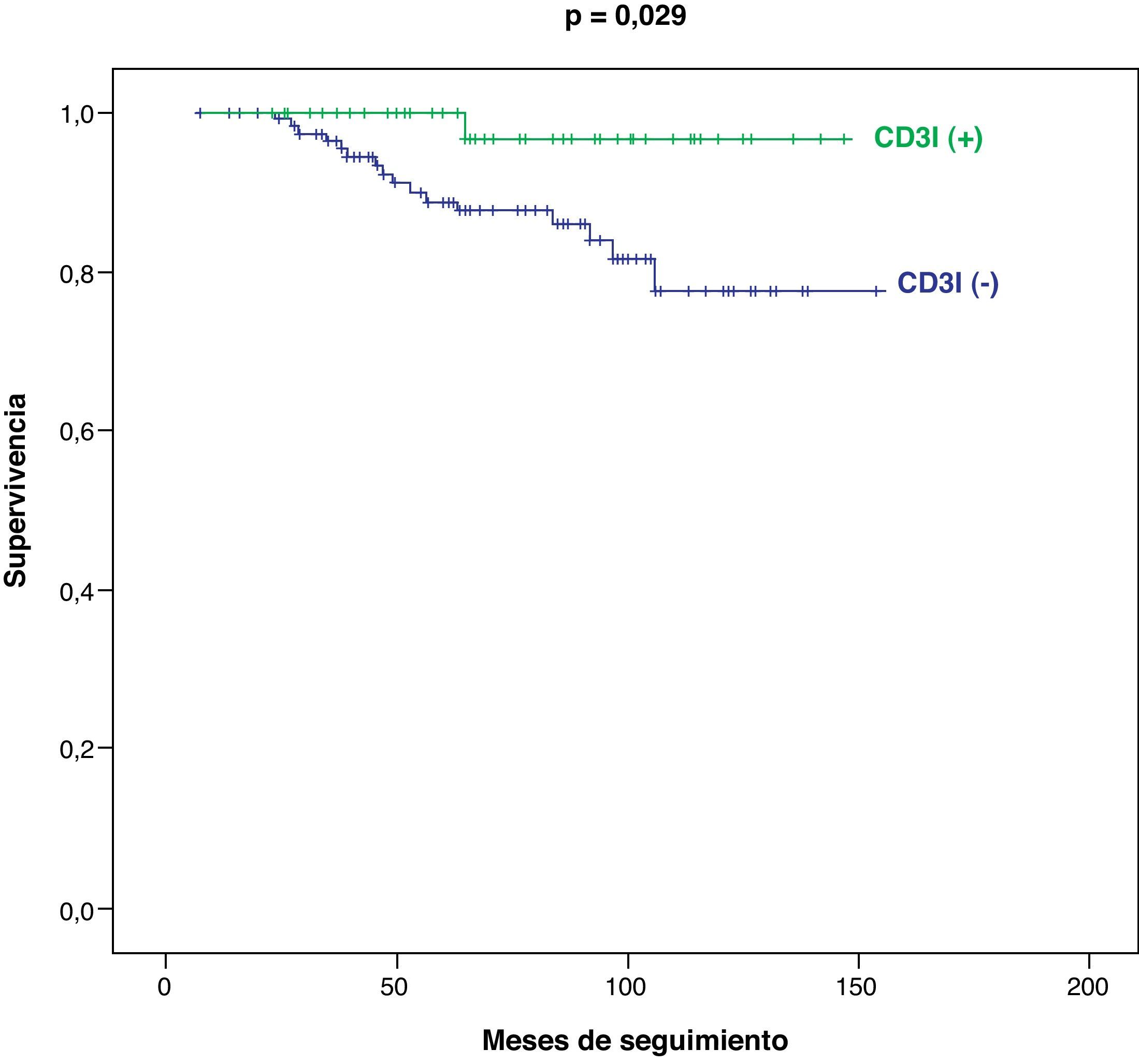
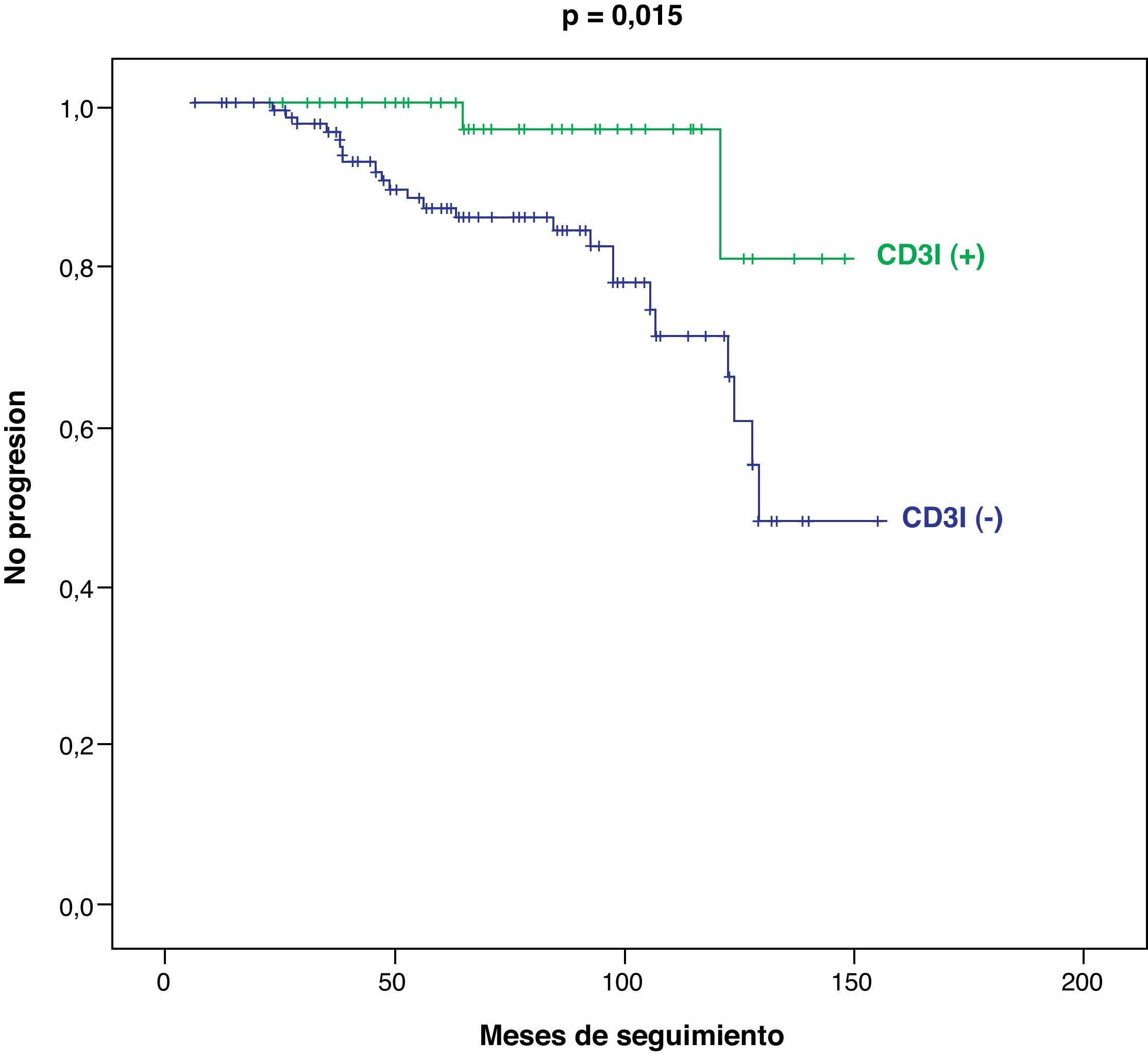
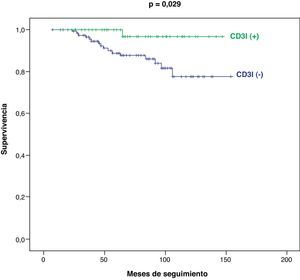
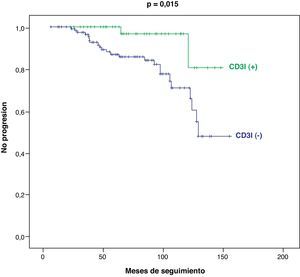
En el subgrupo de pacientes en estadio tumoral I-II (n=168), también se registran diferencias significativas entre los pacientes CD3I (+) y CD3I (−) en cuanto a mejor supervivencia (p=0,029) (fig. 4) y menor progresión tumoral (p=0,015) (fig. 5).
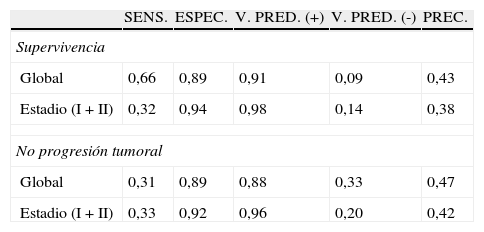
Para valorar la capacidad predictiva de la expresión positiva de CD3I, sobre el pronóstico del CCR, hemos comparado la frecuencia de supervivencia y de no progresión del tumor entre los casos CD3I (+) y (−). En el global de la serie, los tumores CD3I (+) mostraron un mayor porcentaje de supervivencia: 90,8% que los CD3I (−): 74,2% [p=0,005; OR=3,42; IC 95%=(1,31-9,42)]. También la falta de progresión tumoral fue superior en los casos CD3I (+): 87,7% a la de los CD3I (−): 66,7% [p=0,019; OR=3,56; IC 95%=(1,56-8,64)]. En el subgrupo de pacientes en estadio I-II se confirma la mayor supervivencia de los pacientes CD3I (+): 97,9% versus 86,4% [p=0,049; OR=7,53; IC 95%=(1,01-1,56)] y la mayor falta de progresión del tumor: 95,9% versus 79,7% [p=0,016; OR=6; IC 95%=(1,29-38,40)]. La sensibilidad, especificidad, valor predictivo positivo y negativo y precisión diagnóstica de dicha capacidad predictiva de la expresión CD3I (+) para la supervivencia y la no progresión tumoral se resumen en la tabla 3.
Sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y precisión diagnóstica para la supervivencia y la no progresión tumoral de la expresión tisular de CD3I (+)
| SENS. | ESPEC. | V. PRED. (+) | V. PRED. (-) | PREC. | |
| Supervivencia | |||||
| Global | 0,66 | 0,89 | 0,91 | 0,09 | 0,43 |
| Estadio (I + II) | 0,32 | 0,94 | 0,98 | 0,14 | 0,38 |
| No progresión tumoral | |||||
| Global | 0,31 | 0,89 | 0,88 | 0,33 | 0,47 |
| Estadio (I + II) | 0,33 | 0,92 | 0,96 | 0,20 | 0,42 |
ESPEC.: especificidad; SENS.: sensibilidad; PREC.: precisión diagnóstica; V. PRED. (+): valor predictivo positivo; V. PRED. (−): valor predictivo negativo.
Dada la variabilidad individual que conlleva el pronóstico del CCR, es muy conveniente poder establecer parámetros con valor predictivo sobre la progresión tumoral y la supervivencia del paciente. Esto es todavía más importante en los casos en los que se ha efectuado la extirpación quirúrgica de la neoplasia, ya que su irresecabilidad nos habría indicado de entrada un mal pronóstico. Junto a las variables clásicas, fundamentalmente la estadificación tumoral pTNM6,11,12, en estos últimos años se ha barajado el estudio de la respuesta inmunitaria local del huésped frente al cáncer, expresada en forma de infiltración linfocítica tumoral. Esta respuesta inmunitaria se ha valorado a través de distintos parámetros que reflejan la globalidad de los linfocitos T: CD311,17,22,25 o sus diferentes subtipos linfocitarios CD426, CD8 citotóxicos13,16,17,26–30, CD1631, CD2511, CD45RO11,16,17,28,29, CD6830 o los linfocitos reguladores FOXP311,17,25,28,30, todos ellos estudiados de modo individual o en diversas combinaciones.
Aunque, en su conjunto, las diversas publicaciones apoyan un mejor pronóstico para los CCR que expresan infiltración linfocitaria tumoral, las conclusiones de los autores no son concordantes, habiendo quien limita su presencia al efecto de una respuesta inflamatoria local al tumor32. Así vemos cómo algunos trabajos llegan a afirmar que el valor pronóstico del infiltrado linfocítico tumoral es superior incluso a la estadificación pTNM16,33, mientras otros autores opinan que aún no está bien establecido el perfil de estudio inmunohistoquímico más adecuado para el pronóstico y que todavía no se puede aplicar en la práctica clínica6,23. También está en discusión la posible relación entre el infiltrado linfocítico tumoral y la inestabilidad de microsatélites, habiendo publicaciones que sugieren una interrelación común17,34,35 y otras que indican un valor independiente13,22. Esta posible relación será objeto de estudio por parte de nuestro grupo, en un trabajo posterior.
El valor pronóstico de la expresión tisular de CD3, que es el parámetro que hemos estudiado, también ha mostrado discordancias en las publicaciones previas. En un reciente estudio sueco, el análisis multivariante mostró un significativo mejor pronóstico para la supervivencia de los casos con elevada expresión de CD322. Sin embargo, en otros trabajos el valor predictivo del CD3 para la supervivencia17,22 o la progresión tumoral11 se pierde al efectuar el análisis multivariable.
Una posible explicación para estas discrepancias puede estar en la diferente metodología empleada para el estudio inmunohistoquímico del CD3. Al revisar la bibliografía vemos cómo el recuento de los linfocitos se ha efectuado de diversas formas: desde sistemas cuantitativos por autoanalizador de imagen16,17,23 a métodos semicuantitativos, con elaboración de scores de puntuación13,22, o cualitativos25. También difiere el área analizada, que varía entre el epitelio de la neoplasia17,25, diversas localizaciones en su estroma13,22, e incluso las adenopatías tumorales23. Finalmente, unos trabajos incluyen todos los estadios tumorales17,22, frente a otros que se limitan a determinados estadios23,25,27.
Aunque la valoración del CD3 por sistemas de imagen automatizados puede permitir un recuento más objetivo y reproducible, nosotros hemos empleado un método cualitativo de valoración, efectuando el recuento por un único patólogo para evitar diferencias interobservador. Se ha postulado que la localización intraepitelial de los linfocitos T es la que mayor impacto tiene sobre el pronóstico del CCR36. Por este motivo, y como otros autores17,25, hemos preferido estudiar el CD3 únicamente en el epitelio tumoral, lo que simplifica el estudio por el patólogo.
Nuestra proporción de casos CD3I (+), 25,9%, ha sido similar a la previamente publicada del 21,1%22, sin que hayamos encontrado diferencias en cuanto a su frecuencia entre el sexo de los pacientes, su edad ni la localización colónica o rectal del tumor.
Al igual que la mayoría de los publicados11,13,22, nuestro trabajo cuenta con la limitación de ser un estudio retrospectivo, con diferente tiempo de seguimiento entre pacientes, lo que ha precisado emplear métodos de supervivencia para su análisis estadístico. Los resultados de la serie muestran cómo la expresión tisular positiva de CD3 en el epitelio de la neoplasia presenta un significativo valor pronóstico en el análisis multivariable, independientemente del estadio tumoral y por consiguiente del hecho de haber recibido o no tratamiento adyuvante, ya que la aplicación de dicho tratamiento dependió de la estadificación. Este buen pronóstico ha sido obtenido mediante la aplicación de una única tinción inmunohistoquímica, sencilla y de reducido coste y no solo afecta a la supervivencia, sino también a la no progresión tumoral tras la resección inicial de la neoplasia, sin haberse registrado diferencias significativas en cuanto a la frecuencia de expresión positiva del CD3I entre los casos con progresión locorregional del tumor y los que presentaron metástasis a distancia.
Como mencionamos anteriormente, la estadificación pTNM se ha considerado como el mejor patrón para el pronóstico del CCR6,11,12. No obstante, dentro de un mismo estadio tumoral los pacientes pueden presentar una evolución diferente11. La expresión tisular de CD3I podría ser de gran utilidad si permitiese estratificar variaciones en el pronóstico de los pacientes clasificados dentro de un mismo estadio tumoral. El número de casos incluidos en nuestra serie nos ha impedido hacer un estudio estadístico, con la potencia suficiente, del valor pronóstico del CD3I (+) en cada uno de los estadios pTNM. Por ello, nos hemos limitado a analizarlo en un subgrupo de pacientes con cánceres menos avanzados, en los que el crecimiento del tumor se limitaba a la pared colorrectal (estadios I-II). Observamos cómo también en este subgrupo de pacientes con teórico mejor pronóstico global, la expresión de CD3I (+) es capaz de discriminar una significativa menor progresión tumoral post-operatoria y una mayor supervivencia, si se les compara con los casos CD3I (−).
Con respecto al resto de los estudios consultados, presentamos la originalidad de determinar el valor de la expresión de CD3I, considerándola como una prueba predictiva acerca de la supervivencia y la falta de progresión tumoral tras la resección quirúrgica.
Los resultados obtenidos muestran unos valores bajos de sensibilidad y precisión, con un mínimo valor predictivo negativo, tanto para la supervivencia como para la progresión tumoral. Por el contrario, la expresión (+) de CD3I se acompaña de una muy alta especificad y valor predictivo positivo para el pronóstico de supervivencia y de falta de progresión de la neoplasia. Esta capacidad predictiva se cumple en la globalidad de la serie y también en el subgrupo de pacientes en estadio tumoral I-II. Vemos por tanto que la utilidad del estudio del CD3 intraepitelial como factor predictivo de un mejor pronóstico se centra en el subgrupo de pacientes con expresión positiva, careciendo de utilidad en los casos CD3I (−).
En el CCR en estadio II y especialmente en los tumores de localización colónica, todavía están en discusión cuales son los mejores criterios para la selección de aquellos pacientes que más se beneficiarían de un tratamiento oncológico adyuvante. Dicho tratamiento obtiene un limitado margen de mejora en cuanto a supervivencia, presentando efectos secundarios y un elevado coste, por lo que en general se limita a los casos con criterios de mayor riesgo37,38. Si en este estadio II futuros estudios confirmasen un valor pronóstico favorable de la expresión de CD3I (+), su valoración podría ser de gran utilidad como parámetro predictivo que orientase a que estos pacientes CD3I (+) posiblemente no precisarían la aplicación de tratamiento oncológico adyuvante, dada su probable mejor evolución.
Podemos concluir que, en nuestra serie, la determinación cualitativa de la expresión tisular del CD3 (+) en el epitelio tumoral de los CCR resecados ha mostrado un valor pronóstico favorable independiente, con índices significativamente superiores de supervivencia y no progresión tumoral a los 6 años de la cirugía. Este mejor pronóstico se mantiene en el subgrupo de pacientes con estadios menos avanzados (I-II) y presenta unas tasas muy elevadas de especificidad y valor predictivo positivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A B. Ibáñez, de la Unidad de Metodología del Centro de Investigación Biomédica de Navarra, por su gran ayuda en el estudio estadístico.