PAPEL DEL USO DE PROBIÓTICOS EN LA EFECTIVIDAD DE LOS TRATAMIENTOS FRENTE A HELICOBACTER PYLORI: RESULTADOS DEL REGISTRO EUROPEO SOBRE EL MANEJO DE LA INFECCIÓN POR HELICOBACTER PYLORI (HP-EUREG)
1Department of Gastroenterology, Hospital Universitario Miguel Servet, Instituto de Investigación Sanitaria de Aragón (IIS Aragón), Zaragoza. 2Department of Statistical Methods, Faculty of Sciences, University of Zaragoza, Institute for Biocomputation and Physics of Complex Systems (BIFI), University of Zaragoza. 3Digestive Unit, Agencia Sanitaria Costa del Sol, Marbella. 4Department of Medical and Surgical Sciences, IRCCS St, Orsola Polyclinic, University of Bologna, Italia. 5Department of Gastroenterology, DC Rogaska, Slatina, Eslovenia. 6Institute for Digestive Research and Department of Gastroenterology, Lithuanian University of Health Sciences, Kaunas, Lituania. 7Aparato Digestivo, Hospital Universitario de Valme, Sevilla. 8A.S. Loginov Moscow Clinical Scientific Center, Moscow, Rusia. 9Department of Gastroenterology, Biodonostia Health Research Institute, CIBERehd, Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBERehd); Department of Medicine, Universidad del País Vasco (UPV/EHU), San Sebastián. 10Department of Gastroenterology, Hospital General de Tomelloso, Centro de Investigación en Red de Enfermedades Hepáticas y Digestivas (CIBERehd), Gastroenterology, Instituto de Investigación Sanitaria Princesa, Madrid. 11Interni Oddelek, Diagnostic Centre, Bled, Eslovenia. 12Department of Digestive Disorders, Aberdeen Royal Infirmary, Aberdeen, Reino Unido. 13Gastroenterology, University of Oviedo. 14Servicio de Aparato Digestivo, Hospital Clínico Universitario Lozano Blesa, Instituto de Investigación Sanitaria de Aragón (IIS Aragón), CIBERehd, Zaragoza. 15T, Malaya Therapy National Institute of the National Academy of Medical Sciences of Ukraine, Kharkiv, Ucrania. 16Patología Digestiva, Hospital General Universitario de Valencia. 17Department of Pancreatic, Biliary and upper digestive tract disorders, A.S. Loginov Moscow clinical scientific center, Moscow, Department of propaedeutic of internal diseases and gastroenterology, A,I, Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Department of outpatient therapy and family medicine, Tver State Medical University, Tver, Rusia. 18Medicina interna e Gastroenterologia, Fondazione Policlinico Universitario Agostino Gemelli IRCCS, Roma, Italia. 19Azerbaijan State Advanced Training Institute for Doctors named by A. Aliyev, Azerbaijan, Bakú. 20Gastro, Digestive Diseases Centre, Riga, Institute of Clinical and Preventive Medicine, University of Latvia, Riga, Letonia. 21Gastroenterology Clinic, Henry Dunant Hospital, Athens, Grecia. 22Gastroenterology Department, Centro Hospitalar do Porto, Porto, Universidade do Porto, Instituto de Ciências Biomédicas de Abel Salazar, Universidade do Porto; Center for Research in Health Technologies and Information Systems (CINTESIS), Porto, Portugal. 23Department of Gastroenterology, Østfold Hospital Trust, Grålum, Noruega. 24Division of Gastroenterology, Rabin Medical Center, PetahTikva, Sackler School of Medicine, Tel Aviv University, Tel Aviv, Israel. 25Department of Surgery, Transplantation and Gastroenterology, Semmelweis University, Budapest, Hungría. 26Department of Gastroenterology, University Hospital of Split, Split, Croacia. 27School of Medicine, Trinity College Dublin, Dublin, Irlanda. 28Department of Gastroenterology, Hacettepe University, Ankara, Department of Gastroenterology, HC International Clinic, Ankara, Turquía. 29Department of Gastroenterology, Hepatology and Infectious Diseases, University Hospital of Magdeburg, Magdeburg, Alemania. 30Department of Medical Microbiology, Medical University of Sofia, Sofia, Bulgaria. 31Clinic of Gastroenterology and Hepatology, Clinical Center of Serbia, Belgrade, Faculty of Medicine, University of Belgrade, Serbia. 322nd Department of Internal Medicine-Gastroenterology and Geriatrics, University Hospital Olomouc, Faculty of Medicine and Dentistry, Palacky University Olomouc, Department of Surgery, University Hospital Brno, Faculty of Medicine, Masaryk University, Brno, Department of Gastroenterology and Digestive Endoscopy, Masaryk Memorial Cancer Institute, Brno, República Checa. 33Hepato-Gastroenterology & Digestive Oncology Unit, University Hospital of Nantes, Francia. 34Department of Gastroenterology, Pomeranian Medical University in Szczecin, The Centre for Digestive Diseases, Endoklinika, Szczecin, Polonia. 35Gastroenterology Department, Kantonsspital Aarau, Suiza. 36GOES research group, Althaia Xarxa Assistencial Universitària de Manresa. 37Unidad de Gastroenterología, Hospital Santos Reyes, Aranda de Duero. 38Hospital Clínic de Barcelona, Centro de Investigación Biomédica en Red en Enfermedades Hepáticas y Digestivas (CIBERehd), IDIBAPS (Institut d’Investigacions Biomèdiques August Pi i Sunyer), University of Barcelona. 39Servicio de Aparato Digestivo, Hospital Universitario de La Princesa, Instituto de Investigación Sanitaria Princesa (IIS-Princesa), Universidad Autónoma de Madrid (UAM), Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBERehd), Madrid. 40INSERM U1312, Université de Bordeaux, Francia.
Introducción: Existen dudas acerca de la efectividad del uso concomitante de probióticos (PB) en el tratamiento de la infección por Helicobacter pylori.
Objetivos: Determinar si el uso de PB mejora la efectividad de los tratamientos erradicadores utilizados en Europa.
Métodos: Registro prospectivo, multicéntrico, no intervencionista (Hp-EuReg) de la práctica clínica de los gastroenterólogos europeos. Se recogieron los datos en un e-CRD en AEG-REDCap desde 2013 hasta 2021. Se incluyeron todos los datos de los países con al menos 30 casos sometidos a terapia erradicadora y al menos 1 con PB asociados, utilizando los pacientes sin PB como controles y agrupando por regiones geográficas. Se realizaron análisis por intención de tratar modificada (mITT), así como un análisis multivariante, evaluando los factores asociados con la efectividad del tratamiento.
Resultados: Se incluyeron 36.699 pacientes, 8.233 (22%) con PB. Globalmente, el uso de PB se asoció a una mayor efectividad (91 vs. 86%; p < 0,0001). Al ajustar por régimen de tratamiento, esta significación se mantuvo para las terapias triples (89 vs. 83%; p < 0,0001), cuádruple concomitante (93 vs. 89%; p = 0,0009), cuádruple con bismuto (92 vs. 86%; p < 0,0001) y secuencial (91 vs. 78%; p < 0,0001). En el modelo de regresión logística en primera línea erradicadora (ajustado por edad, sexo, duración de tratamiento erradicador, dosis de IBP y adherencia), el uso de PB mantuvo el beneficio en los tratamientos triples, cuádruple con bismuto y secuencial. Tras ajustar dicho modelo por regiones (tabla), se mantuvo la significación en la región Este (baja tasa de resistencias a claritromicina y metronidazol) para las terapias triples, y en la región Centro (alta tasa de resistencias) para las terapias cuádruple concomitante y secuencial.
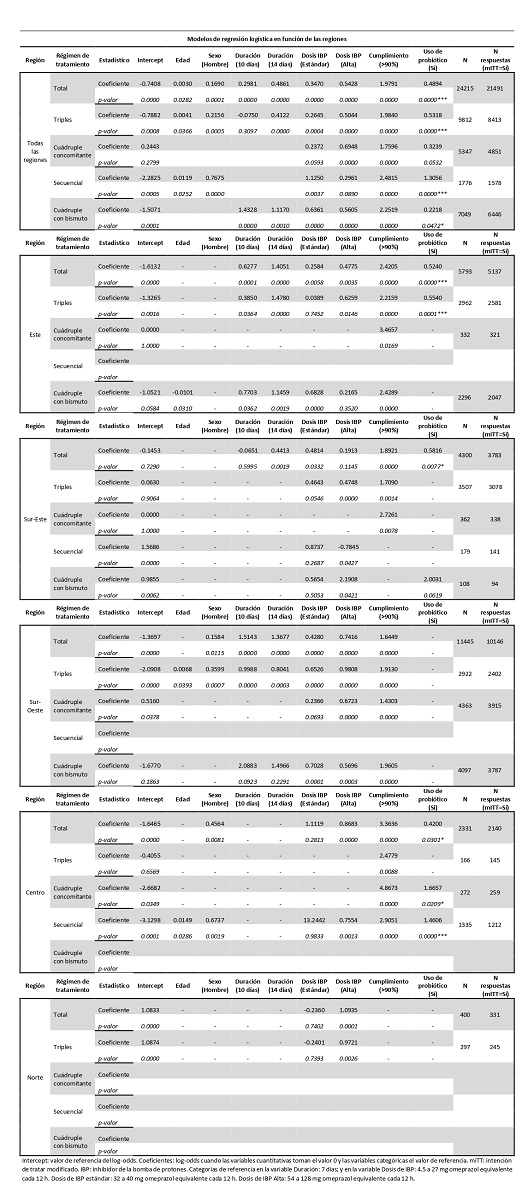
Conclusiones: En Europa el uso de fórmulas con PB adyuvante al tratamiento erradicador se asocia con una mayor efectividad de este, siendo el beneficio superior en las terapias triples y secuencial.









