Describir las características epidemiológicas, analíticas, histológicas y evolutivas de pacientes con infección crónica por VHB AgHBe-negativo.
Material y métodosEstudio observacional de cohorte retrospectivo de pacientes diagnosticados de infección crónica VHB AgHBe-negativo (2005-2012) sin otras hepatopatías.
ResultadosSe incluyeron 138 pacientes con edad media de 40,5±12,2 años, de los cuales el 54% eran mujeres. El 38% eran extranjeros, con incremento de estos en los últimos años (p<0,001). Las transaminasas en el momento del diagnóstico eran normales en casi el 75% y el ADN-VHB <2.000UI/ml en el 56%. En los portadores inactivos existe una disminución progresiva de los niveles de ADN-VHB en el periodo de estudio. En el 47% se evaluó la fibrosis hepática por Fibroscan® o biopsia hepática: el 55,4% resultó normal y el 6,1% reportó cirrosis. El 77,77% eran portadores inactivos. Precisaron tratamiento el 15,5% (20% por cirrosis y 80% por HBC AgHBe-negativo). Aclararon el AgHBs 5 pacientes (tasa anual 0,94%), presentando todos al diagnóstico ADN-VHB <2.000UI/ml. Cinco pacientes desarrollaron alguna complicación (3,6%), 4 de ellos carcinoma hepatocelular (CHC) (solo 2 presentaban cirrosis). Hubo un fallecimiento relacionado con el VHB (0,72%).
ConclusiónEntre los enfermos con infección crónica por VHB AgHBe-negativo predominan los portadores inactivos. Se produce un progresivo descenso de ADN-VHB en los primeros años tras el diagnóstico. Desarrollan poca morbimortalidad, especialmente si existe GPT normal y ADN-VHB bajo al diagnóstico. Un número no despreciable de pacientes precisa tratamiento. El CHC es la complicación más frecuente, incluso en pacientes sin cirrosis.
To describe the epidemiological, analytical and histological characteristics and clinical course of hepatitis B virus (HBV) carriers with negative HBe antigen.
Material and methodsObservational, retrospective cohort study of HBV carriers with negative HBe antigen (2005-2012), with no other causes of liver disease.
ResultsOne hundred and thirty-eight patients were included, with mean age 40.5±12.2 years; 54% were women, and 38% were of foreign origin; the number of foreign patients significantly increased (P<.001) over the years. Transaminases were normal in nearly 75% and HBV-DNA was <2,000IU/ml in 56% of patients at diagnosis. There was a gradual decrease in HBV-DNA levels in inactive carriers over the study period. Fibrosis study was performed in 47% of patients by Fibroscan® or liver biopsy: 55.4% normal histology and 6.1% cirrhosis. Just over three quarters of patients (77.77%) were inactive carriers. Treatment was required in 15.5% of patients (20% because of cirrhosis and 80% HBeAg-negative chronic hepatitis B). Five patients cleared HBsAg (annual rate .94%), all of whom presented HBV-DNA <2,000IU/ml at diagnosis. Five patients developed complications (3.6%), 4 of them hepatocellular carcinoma (HCC), of which only 2 had cirrhosis. There was 1 HBV-related death (.72%).
ConclusionAmong HBV carriers with negative HBe antigen, inactive HBs-Ag carriers are predominant. HBV-DNA gradually decreases in the first few years after diagnosis. Morbidity and mortality are low, especially if glutamic pyruvic transaminase (GPT) is normal and HBV-DNA levels are low at diagnosis. Treatment is needed in a considerable number of patients. HCC is the most frequent complication, even in the absence of cirrhosis.
La infección crónica por el virus de la hepatitis B (VHB) es un problema de salud pública a nivel mundial. Se estima que unos 350-400 millones de personas en el mundo presentan infección crónica por este virus1, y que unas 620.000 personas mueren anualmente en relación con esta infección2.
La infección crónica por el VHB se puede presentar como hepatitis B AgHBe (antígeno e de la hepatitis B) positivo(+) o negativo(–). La infección crónica AgHBe(–) se produce tras la seroconversión del AgHBe. En el 75% de los casos, del estado de hepatitis crónica AgHBe(+) se pasa al estado de portador inactivo del VHB (PI), caracterizado por unas transaminasas persistentemente normales, ácido desoxirribonucleico (ADN) del VHB bajo (generalmente <2.000UI/ml), y con poca afectación histológica. En el 25% restante la seroconversión del AgHBe da paso a la hepatitis crónica AgHBe(–), bien directamente, en gran parte por mutaciones que se producen en los nucleótidos de la región precore y/o del promotor del core, o bien secundariamente a una reactivación desde el estado de PI, en que se producen periodos de reactivación con un patrón de niveles fluctuantes de ADN del VHB (ADN-VHB), aminotransferasas, y de hepatitis activa3.
La fase de infección crónica AgHBe(–) fue descrita por primera vez en países mediterráneos4, estando en la actualidad descrita en todo el mundo5. Estudios de Europa, Asia y Estados Unidos describen un incremento en la prevalencia de este tipo de pacientes6, principalmente debido al envejecimiento de la población infectada, y representa la forma más frecuente de hepatitis crónica por VHB en el mundo, como ocurre en Europa7, alcanzando en la actualidad el 85-90% de los pacientes. En nuestra serie publicada de pacientes con infección crónica por el VHB8 el grupo más numeroso lo representan los pacientes con infección crónica AgHBe(–) (87,61%), siendo similar a otros trabajos recientes publicados en nuestro país9,10,en otros países mediterráneos11, y en zonas alejadas a la nuestra, como en Asia12 o Sudamérica13. Debido a que los pacientes AgHBe(–) son el grupo más numeroso dentro de la infección por el VHB, nos propusimos realizar un estudio para describir las características y evolución de este grupo de pacientes en nuestra área sanitaria.
Material y métodosEstudio observacional de cohortes retrospectivo de pacientes diagnosticados de infección crónica por VHB AgHBe(–) en el momento del diagnóstico en nuestra área sanitaria desde junio de 2005 a julio de 2011, y con seguimiento hasta diciembre de 2012.
Se incluyeron todos los pacientes mayores de 13 años, con AgHBs(+) durante más de 6 meses, con AgHBe(–) y Anti-AgHBe(+). Se excluyeron enfermos coinfectados por VIH, VHC y/o VHD; presencia de insuficiencia renal avanzada (aclaramiento de creatinina <30ml/min y/o diálisis) (al ser seguidos por el servicio de nefrología), otras hepatopatías asociadas (estudio de hormonas tiroideas, de autoinmunidad, perfil férrico [gen de la hemocromatosis si en dos determinaciones el IST fue mayor del 45%], porfirinas en orina, alfa1-antitripsina, cupremia, cobre en orina y ceruloplasmina); también se excluyó a los pacientes con obesidad (índice de masa corporal [IMC] ≥35kg/m2), datos de esteatohepatitis en biopsia hepática, cirrosis de causa no claramente relacionada con la infección crónica por VHB y consumo de alcohol ≥40g/día, así como aquellos que habían recibido tratamiento previo para la infección por VHB.
Se recogieron las características sociodemográficas, datos epidemiológicos y clínicos al diagnóstico, y el motivo por el que se llegó al diagnóstico de la infección crónica por el VHB. En la evolución se recogieron cada 6±2 meses variables analíticas, serológicas, ADN-VHB por reacción en cadena de la polimerasa (PCR), e ingresos hospitalarios realizados, así como la causa de estos. Se realizó control ecográfico cada 6 meses en los enfermos cirróticos y cada uno o 2 años en los no cirróticos.
El estudio de la fibrosis hepática se realizó por biopsia hepática (según la clasificación de METAVIR14), según las indicaciones de la guía clínica vigente en cada momento. Para este trabajo se establecieron las siguientes categorías: normal o cambios mínimos (A0-F0), diferentes grados de fibrosis, y cirrosis (F4). Si no existía biopsia hepática y sí Fibroscan® se tomó como valor de fibrosis hepática este, tomando como referencia los valores del trabajo de Viganò et al.15, siendo: F0-1 (de 2,5 a 6,2kPa), normal; F2-3 (de 6,2 a 13,1kPa), diferentes grados de inflamación-fibrosis; y F4 (>13,1kPa), cirrosis; que se corresponderían con los valores de fibrosis en el sistema METAVIR utilizado para las biopsias hepáticas. A su vez se incluyó para el análisis como F4 a los pacientes diagnosticados de cirrosis hepática por datos clínico-analíticos o de pruebas de imagen, en los que no hacía falta realizar biopsia hepática o Fibroscan® para llegar al diagnóstico.
Se consideró el seguimiento clínico de los pacientes hasta la última revisión en consulta de hepatología. En el estudio analítico se consideró hasta la última analítica de seguimiento solicitada por la unidad de hepatología con serología para el VHB, teniendo en cuenta para dicho análisis únicamente a los pacientes con 3 o más analíticas en el seguimiento. En los pacientes que requirieron tratamiento médico para la infección crónica por el VHB se evaluó el seguimiento clínico hasta la fecha de la consulta en que se inició este, y el seguimiento analítico hasta la última analítica previa a este.
Se consideró PI a todo paciente con glutámico pirúvico transaminasa (GPT) persistentemente normal (<40mU/ml), y ADN-VHB bajo, discriminándose entre los que tuvieron ADN-VHB persistentemente <2.000UI/ml (PI puros), y los que tuvieron ADN-VHB entre 2.000 y 20.000UI/ml en alguna ocasión. Se consideró paciente en situación indeterminada al que presentó GPT persistentemente normal o fluctuante con elevaciones leves (generalmente <2 límite superior de la normalidad [LSN]) y ADN-VHB pico >20.000UI/ml en alguna ocasión. Se consideró reactivación de un PI a HBC AgHBe(–) a todo paciente que teniendo las 3 primeras GPT normales (<40mU/ml) y ADN-VHB bajo (<20.000UI/ml) presentó posteriormente elevaciones de GPT por encima de 40mU/ml junto con ADN-VHB >20.000UI/ml. Se consideró estar en fase de HBC AgHBe(–) al diagnóstico a todo paciente que desde las primeras analíticas presentaba persistentemente GPT >40mU/ml y ADN-VHB >20.000UI/ml.
Se recogieron los pacientes que presentaron cirrosis en la evolución, así como sus complicaciones (encefalopatía hepática [EH]), hemorragia digestiva por varices (HDA), descompensación edemoascítica (DEA), o hepatocarcinoma (CHC). Se diagnosticó de CHC las lesiones ocupantes de espacio >1cm, en pacientes con cirrosis hepática, con al menos una prueba de imagen (tomografía y/o resonancia magnética con contraste) con comportamiento típico de CHC (captación en fase arterial y lavado en fase portal o tardía), realizando estudio histológico en los pacientes con comportamiento radiológico atípico o dudoso, y en aquellos sin cirrosis hepática. Se consideraron acontecimientos desfavorables en la evolución el presentar cirrosis, alguna de sus complicaciones, CHC en hígado no cirrótico, y/o necesidad de tratamiento en la evolución.
La realización del estudio fue aprobada por el comité ético de nuestro centro.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS 20.0 (IBM Corporation, 2011). Describiremos las variables categóricas mediante recuento (porcentaje). Las variables cuantitativas se describen mediante la media±desviación típica si la distribución asume normalidad, y mediante la mediana (intervalo intercuartílico [IIC]) si no cumple dicha hipótesis.
El contraste de la distribución entre variables dicotómicas y categóricas se realizó mediante tablas de contingencia con el estadístico Chi-cuadrado o Fisher, según correspondía. La comparación de medias entre variables cualitativas se realizó mediante el test t-Student cuando comparamos 2 medias o análisis de la varianza de un factor cuando comparamos más de 2 medias, si cumplían criterios de normalidad. Si no podía trabajar bajo el supuesto de normalidad de la variable de interés, utilizamos los test no paramétricos U de Mann-Whitney o H de Kruskal-Wallis para comparar la igualdad en la distribución de la variable cuantitativa en 2 grupos o en más de 2 grupos, respectivamente.
En el estudio de la evolución del paciente, se utilizaron pruebas para muestras dependientes, como la t-Student para variables relacionadas o ANOVA para medidas repetidas, si la variable tenía distribución normal o los test de Wilcoxon o Friedman en otro caso. Se consideró significativa una p<0,05.
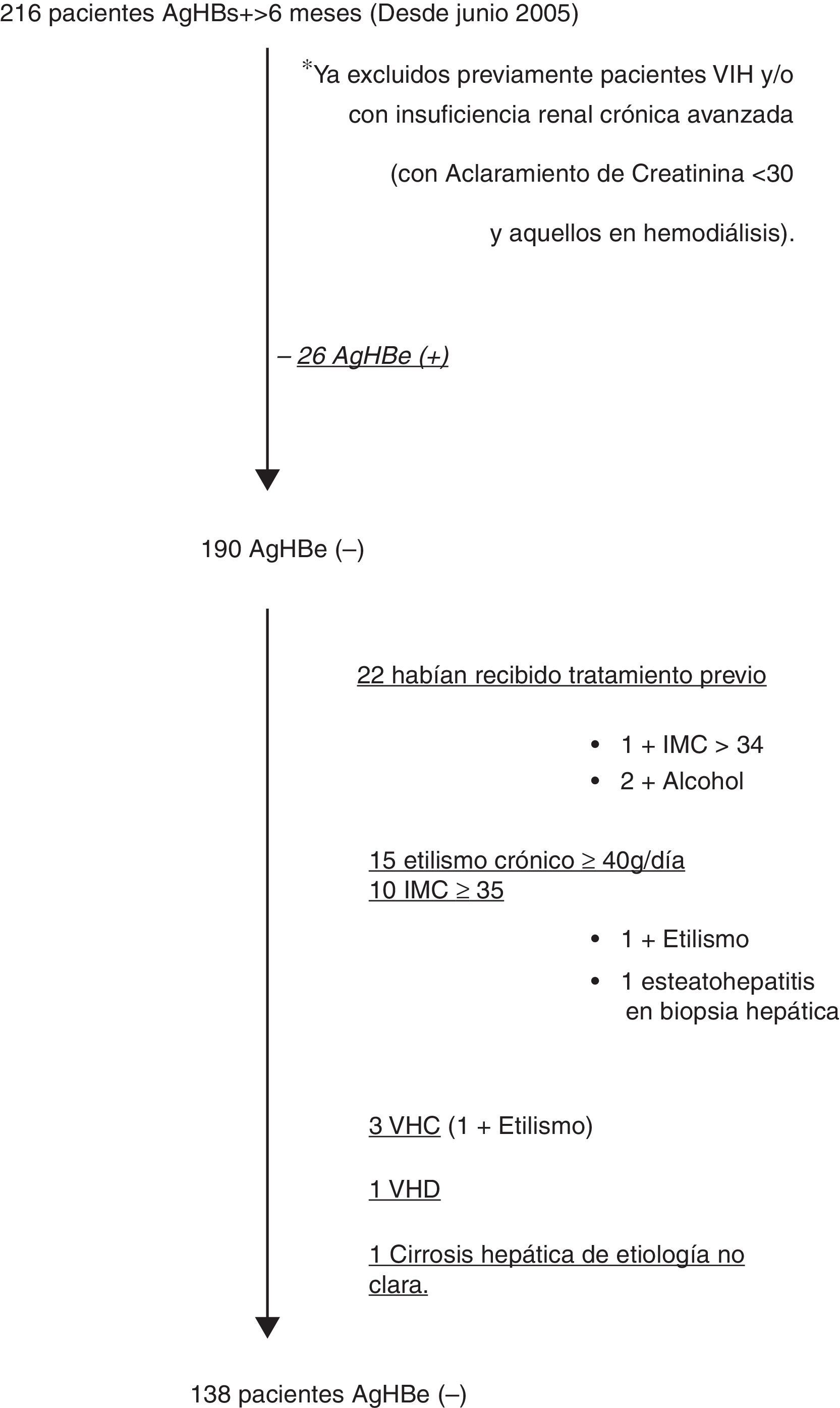
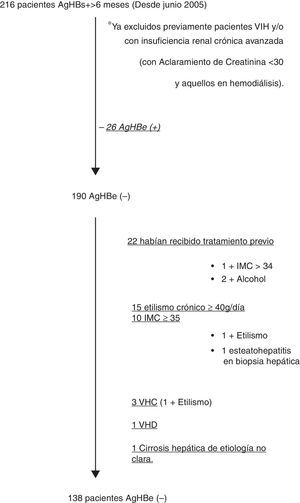
ResultadosEn la figura 1 describimos el diagrama de flujo de la selección de los pacientes con AgHBs(+) durante el periodo de estudio, que cumplieron los criterios de inclusión y ninguno de exclusión, incluyéndose 138 pacientes, de los cuales a 126 se pudo realizar seguimiento analítico.
La edad media al diagnóstico fue de 40,5±12,2 años (56,5% de pacientes diagnosticados antes de los 40 años). El porcentaje de mujeres fue del 54%, y el de extranjeros del 38%. El diagnóstico realizado a nativos españoles e inmigrantes ha variado a lo largo del tiempo, incrementándose significativamente los pacientes inmigrantes en los últimos años (p<0,001). El origen predominante de estos fue Europa del Este (46%), principalmente rumanos (87,5% de los de esta área), seguido de africanos (31%), entre los que predominaron los marroquíes (43% de los africanos), asiáticos (10%), centroamericanos (9%), y pacientes de Oriente Medio (4%).
En relación con las principales características epidemiológicas, presentaban antecedentes familiares de infección por VHB 34 pacientes (24,6%), no habiendo pacientes con adicción o ex-adicción a drogas por vía parenteral (ADVP), presentando transfusiones previas el 5,8%, tatuajes el 5,1%, y piercing el 1,45%.
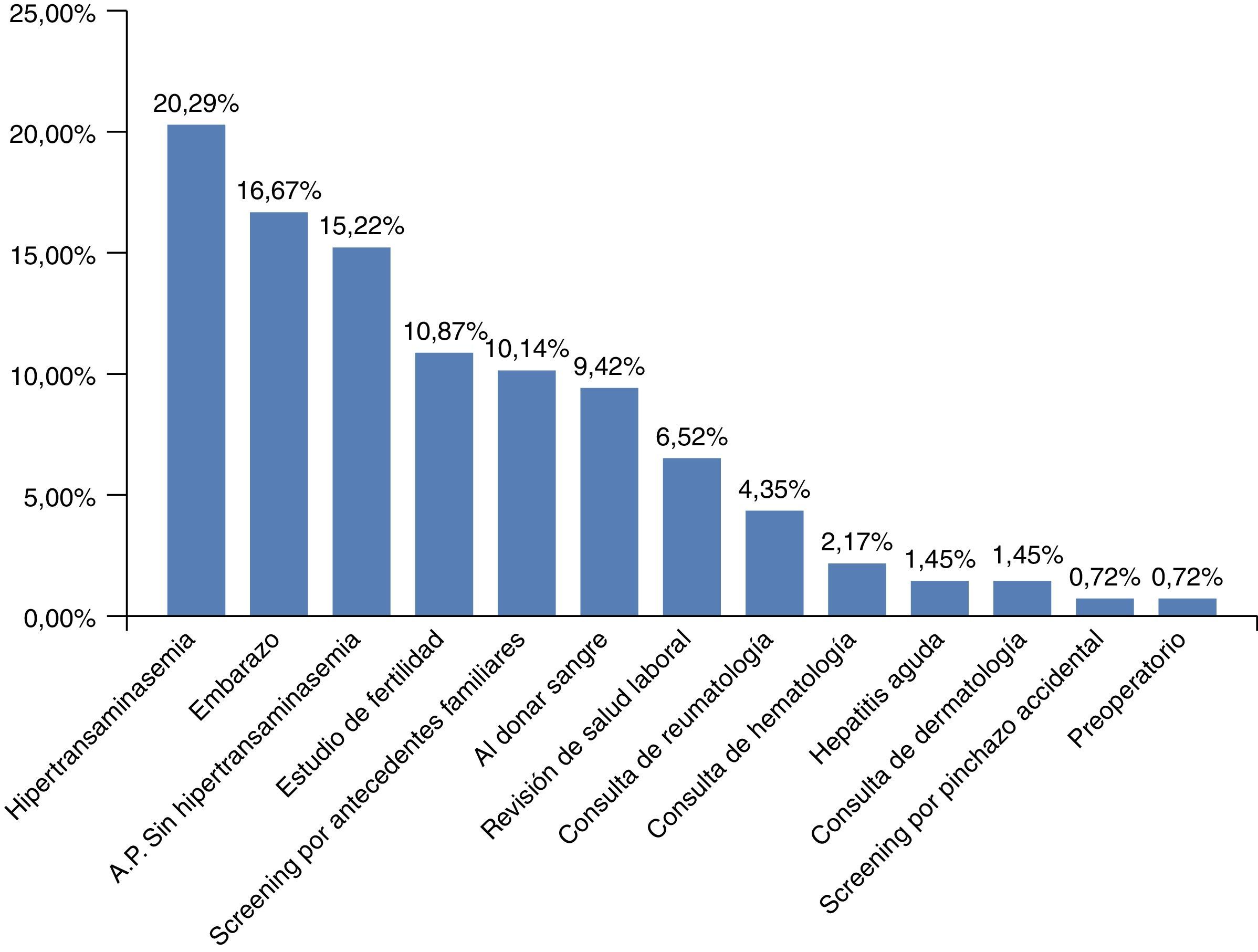
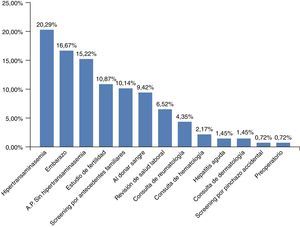
El motivo del diagnóstico de infección crónica por VHB fue muy variado (fig. 2). Lo más frecuente fue por hipertransaminasemia (20,29%), sin embargo, agrupando todos los motivos de cribado de infección por VHB (embarazo, fertilidad, por antecedentes familiares, al donar sangre, o en las diversas consultas previo a tratamientos inmunosupresores), este fue el motivo del diagnóstico en el 55,07%.
Presentaban síntomas o signos al diagnóstico 12 de los 138 pacientes (8,69%). Solo en un paciente estaba claramente relacionado con la infección crónica por el VHB (0,72%), pues presentó al diagnóstico DEA; existiendo pacientes que presentaban síntomas que podrían tener relación con la enfermedad (3 pacientes con astenia, 2 con artralgias-artritis, y uno con hematuria); y otros que presentaban síntomas más inespecíficos o no relacionados (2 con dispepsia, uno con eritema nudoso, uno con uveítis, y otro con dolor abdominal inespecífico). A la exploración presentó estigmas de hepatopatía crónica al diagnóstico solo un paciente (el mismo que se diagnosticó por DEA).
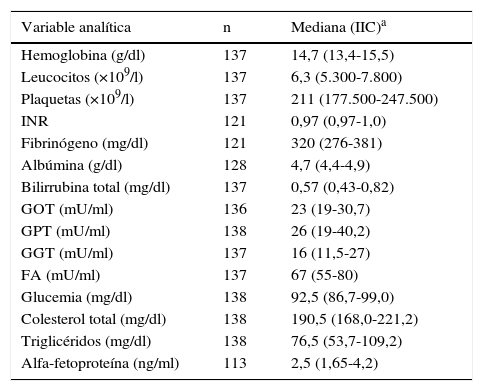
En la tabla 1 se muestran los datos bioquímicos en el momento del diagnóstico. La GPT al diagnóstico fue normal en 103 pacientes (74,6%). De estos, 95 (91,26%) presentaban ADN-VHB <20.000UI/ml y 67 (64,08%) <2.000UI/ml al diagnóstico. Los pacientes con GPT normal al diagnóstico en relación con los valores de GPT alterada presentaron una menor carga viral de forma estadísticamente significativa (916 [IIC: 110-3.830] UI/ml vs. 6.840 [IIC: 479-38.000] UI/ml; p=0,003). La carga viral cuantitativa media al diagnóstico fue de 43.726±238.701UI/ml, con una mediana de 6.230UI/ml. Definimos 4 grupos según el ADN-VHB al diagnóstico: indetectable (14%); 0-2.000UI/ml (42%); 2.000-20.000UI/ml (27%), y >20.000UI/ml (17%); suponiendo los pacientes con ADN-VHB <2.000UI/ml el 56%.
Datos analíticos generales al diagnóstico
| Variable analítica | n | Mediana (IIC)a |
|---|---|---|
| Hemoglobina (g/dl) | 137 | 14,7 (13,4-15,5) |
| Leucocitos (×109/l) | 137 | 6,3 (5.300-7.800) |
| Plaquetas (×109/l) | 137 | 211 (177.500-247.500) |
| INR | 121 | 0,97 (0,97-1,0) |
| Fibrinógeno (mg/dl) | 121 | 320 (276-381) |
| Albúmina (g/dl) | 128 | 4,7 (4,4-4,9) |
| Bilirrubina total (mg/dl) | 137 | 0,57 (0,43-0,82) |
| GOT (mU/ml) | 136 | 23 (19-30,7) |
| GPT (mU/ml) | 138 | 26 (19-40,2) |
| GGT (mU/ml) | 137 | 16 (11,5-27) |
| FA (mU/ml) | 137 | 67 (55-80) |
| Glucemia (mg/dl) | 138 | 92,5 (86,7-99,0) |
| Colesterol total (mg/dl) | 138 | 190,5 (168,0-221,2) |
| Triglicéridos (mg/dl) | 138 | 76,5 (53,7-109,2) |
| Alfa-fetoproteína (ng/ml) | 113 | 2,5 (1,65-4,2) |
Disponemos de información de fibrosis hepática, durante el seguimiento, por histología en 36 casos y por FibroScan® en 28. En 36 pacientes no se objetivó fibrosis (55,4%), 25 presentaron diferentes grados de inflamación-fibrosis (38,5%), y 4 presentaron cirrosis (6,1%), uno de ellos diagnosticado por datos clínico-analíticos y ecográficos al diagnóstico, al iniciar con una DEA. Los 4 pacientes con cirrosis (3,1%) eran varones (p=0,024), con una edad media superior a la de los pacientes sin cirrosis (61,7±8,6 años vs. 39,8±11,7 años; p=0,003), estando al diagnóstico en estadio A de Child-Turcotte-Pugh.
Se realizó seguimiento analítico a 126 pacientes, con tiempo medio de 33,6±22,1 meses, y 6,5 determinaciones analíticas de media por paciente. El tiempo medio de seguimiento clínico fue de 42,14±21,50 meses. El pico de GPT mediano fue de 32 (IIC: 23,5-65) mU/ml, y el tiempo hasta alcanzar dicho pico tuvo una mediana de 10,4 (IIC: 4,4-25) meses. El valor mediano máximo de carga viral fue 3.620 (IIC: 531-13.900) UI/ml, y el mínimo 216 (IIC: 30-1.095) UI/ml. El tiempo hasta alcanzar el pico de ADN-VHB tuvo una mediana de 11,2 (IIC: 3,5-23,6) meses. De los 108 que presentaban carga viral detectable al diagnóstico se mantuvieron así 81 (75%), 18 (16,67%) se hicieron indetectables, y 9 (8,33%) presentaron fluctuaciones entre detectable e indetectable. De los 18 con carga viral indetectable, 11 (61,11%) se mantuvieron así, 6 (33,33%) se hicieron detectables, y uno (5,56%) presentó fluctuaciones.
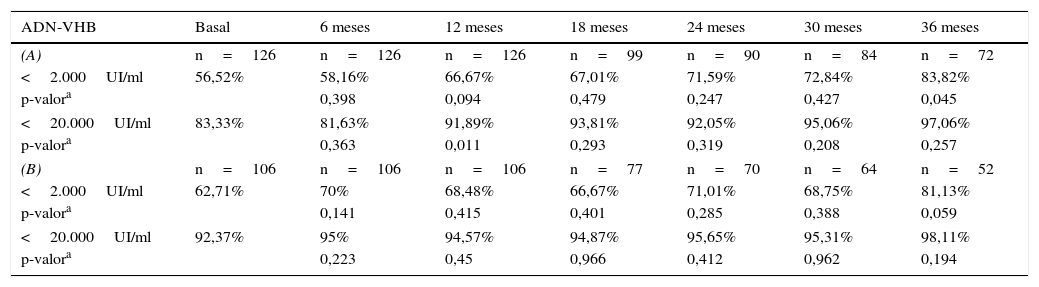
Realizando un análisis evolutivo del porcentaje de pacientes con ADN-VHB <2.000UI/ml y <20.000UI/ml en cada momento del estudio, vemos en la tabla 2A cómo hay una tendencia a incrementarse el porcentaje de pacientes con ADN-VHB inferior en la evolución, si bien solo se observaron diferencias significativas en 2 de los periodos de estudio. Podría existir un sesgo al irse excluyendo del estudio a los pacientes que comenzaron tratamiento, al tener estos carga viral generalmente más elevada, sin embargo, como se observa en la tabla 2B, esta tendencia se mantiene, pero sin existir diferencias significativas en ningún periodo.
Porcentaje de pacientes con ADN-VHB <2.000UI/ml y <20.000UI/ml en cada momento de la evolución. (A) De la serie general, y (B) excluyendo los pacientes que fueron tratados
| ADN-VHB | Basal | 6 meses | 12 meses | 18 meses | 24 meses | 30 meses | 36 meses |
|---|---|---|---|---|---|---|---|
| (A) | n=126 | n=126 | n=126 | n=99 | n=90 | n=84 | n=72 |
| <2.000UI/ml | 56,52% | 58,16% | 66,67% | 67,01% | 71,59% | 72,84% | 83,82% |
| p-valora | 0,398 | 0,094 | 0,479 | 0,247 | 0,427 | 0,045 | |
| <20.000UI/ml | 83,33% | 81,63% | 91,89% | 93,81% | 92,05% | 95,06% | 97,06% |
| p-valora | 0,363 | 0,011 | 0,293 | 0,319 | 0,208 | 0,257 | |
| (B) | n=106 | n=106 | n=106 | n=77 | n=70 | n=64 | n=52 |
| <2.000UI/ml | 62,71% | 70% | 68,48% | 66,67% | 71,01% | 68,75% | 81,13% |
| p-valora | 0,141 | 0,415 | 0,401 | 0,285 | 0,388 | 0,059 | |
| <20.000UI/ml | 92,37% | 95% | 94,57% | 94,87% | 95,65% | 95,31% | 98,11% |
| p-valora | 0,223 | 0,45 | 0,966 | 0,412 | 0,962 | 0,194 | |
El 77,77% de los pacientes estaban en estado de PI (el 56,1% con ADN-VHB <2.000UI/ml persistentemente y el 44,9% con ADN-VHB entre 2.000-20.000UI/ml en alguna ocasión). En este grupo existieron un 27,5% de pacientes que, al diagnóstico o de forma puntual en el seguimiento, presentaron alguna elevación de GPT <2LSN en relación con esteatohepatitis y/o ingesta esporádica de alcohol, no relacionándose con la actividad de la enfermedad.
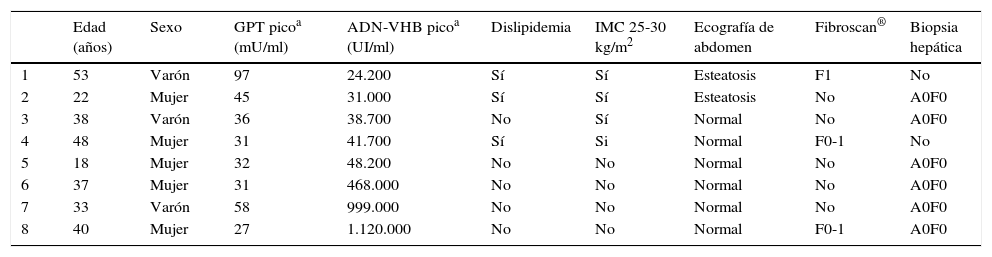
Hubo 8 pacientes (6,34%) en situación indeterminada (GPT normal o fluctuante leve, con pico de ADN-VHB >20.000UI/ml en alguna ocasión). De estos, 5 presentaron GPT persistentemente normal, y 3 presentaron fluctuaciones de GPT leves con pico de GPT en la evolución no superior a 97mU/ml (GPT media de 64,25mU/ml), sin datos de hepatopatía en las ecografías realizadas, teniendo el que hizo el pico más alto de GPT (97mU/ml) esteatosis en la ecografía y dislipidemia; a estos 8 pacientes se les realizó estudio de fibrosis hepática, bien por Fibroscan® y/o biopsia hepática, todos con resultado normal.
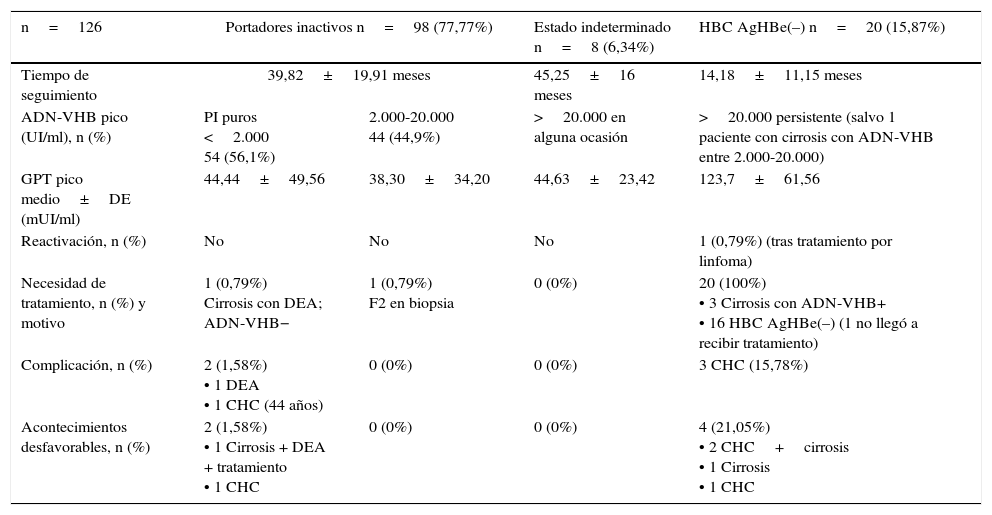
El 15,87% de los pacientes estaban en HBC AgHBe(–) desde el diagnóstico. No se observaron reactivaciones desde PI a HBC AgHBe(–), si bien, sí se recibió a un paciente derivado para tratamiento por reactivación secundaria a tratamiento de un linfoma. En la tabla 3 se muestra la situación de los pacientes en la evolución, así como las complicaciones; en la tabla 4 se presentan las características de los pacientes en situación indeterminada, y en la tabla 5 la comparativa entre los PI y los pacientes en situación indeterminada.
Evolución de los pacientes seguidos con 3 o más determinaciones de GPT en la evolución
| n=126 | Portadores inactivos n=98 (77,77%) | Estado indeterminado n=8 (6,34%) | HBC AgHBe(–) n=20 (15,87%) | |
|---|---|---|---|---|
| Tiempo de seguimiento | 39,82±19,91 meses | 45,25±16 meses | 14,18±11,15 meses | |
| ADN-VHB pico (UI/ml), n (%) | PI puros <2.000 54 (56,1%) | 2.000-20.000 44 (44,9%) | >20.000 en alguna ocasión | >20.000 persistente (salvo 1 paciente con cirrosis con ADN-VHB entre 2.000-20.000) |
| GPT pico medio±DE (mUI/ml) | 44,44±49,56 | 38,30±34,20 | 44,63±23,42 | 123,7±61,56 |
| Reactivación, n (%) | No | No | No | 1 (0,79%) (tras tratamiento por linfoma) |
| Necesidad de tratamiento, n (%) y motivo | 1 (0,79%) Cirrosis con DEA; ADN-VHB− | 1 (0,79%) F2 en biopsia | 0 (0%) | 20 (100%) • 3 Cirrosis con ADN-VHB+ • 16 HBC AgHBe(–) (1 no llegó a recibir tratamiento) |
| Complicación, n (%) | 2 (1,58%) • 1 DEA • 1 CHC (44 años) | 0 (0%) | 0 (0%) | 3 CHC (15,78%) |
| Acontecimientos desfavorables, n (%) | 2 (1,58%) • 1 Cirrosis + DEA + tratamiento • 1 CHC | 0 (0%) | 0 (0%) | 4 (21,05%) • 2 CHC+cirrosis • 1 Cirrosis • 1 CHC |
CHC: hepatocarcinoma; DEA: descompensación edemoascítica; PI: portador inactivo.
Pacientes en situación indeterminada en la evolución
| Edad (años) | Sexo | GPT picoa (mU/ml) | ADN-VHB picoa (UI/ml) | Dislipidemia | IMC 25-30 kg/m2 | Ecografía de abdomen | Fibroscan® | Biopsia hepática | |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 53 | Varón | 97 | 24.200 | Sí | Sí | Esteatosis | F1 | No |
| 2 | 22 | Mujer | 45 | 31.000 | Sí | Sí | Esteatosis | No | A0F0 |
| 3 | 38 | Varón | 36 | 38.700 | No | Sí | Normal | No | A0F0 |
| 4 | 48 | Mujer | 31 | 41.700 | Sí | Si | Normal | F0-1 | No |
| 5 | 18 | Mujer | 32 | 48.200 | No | No | Normal | No | A0F0 |
| 6 | 37 | Mujer | 31 | 468.000 | No | No | Normal | No | A0F0 |
| 7 | 33 | Varón | 58 | 999.000 | No | No | Normal | No | A0F0 |
| 8 | 40 | Mujer | 27 | 1.120.000 | No | No | Normal | F0-1 | A0F0 |
GPT: glutámico pirúvico transaminasa; IMC: índice de masa corporal.
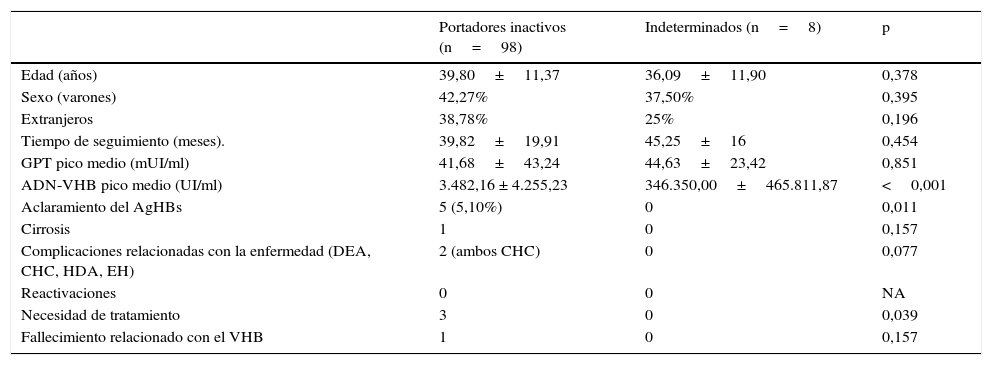
Comparativa de pacientes portadores inactivos vs. en situación indeterminada
| Portadores inactivos (n=98) | Indeterminados (n=8) | p | |
|---|---|---|---|
| Edad (años) | 39,80±11,37 | 36,09±11,90 | 0,378 |
| Sexo (varones) | 42,27% | 37,50% | 0,395 |
| Extranjeros | 38,78% | 25% | 0,196 |
| Tiempo de seguimiento (meses). | 39,82±19,91 | 45,25±16 | 0,454 |
| GPT pico medio (mUI/ml) | 41,68±43,24 | 44,63±23,42 | 0,851 |
| ADN-VHB pico medio (UI/ml) | 3.482,16 ± 4.255,23 | 346.350,00±465.811,87 | <0,001 |
| Aclaramiento del AgHBs | 5 (5,10%) | 0 | 0,011 |
| Cirrosis | 1 | 0 | 0,157 |
| Complicaciones relacionadas con la enfermedad (DEA, CHC, HDA, EH) | 2 (ambos CHC) | 0 | 0,077 |
| Reactivaciones | 0 | 0 | NA |
| Necesidad de tratamiento | 3 | 0 | 0,039 |
| Fallecimiento relacionado con el VHB | 1 | 0 | 0,157 |
AgHBs: antígeno de superficie de la hepatitis B; CHC: hepatocarcinoma; DEA: descompensación edemoascítica; EH: encefalopatía hepática; GPT: glutámico pirúvico transaminasa; HDA: hemorragia digestiva por varices; NA: no analizable.
Recibieron tratamiento farmacológico 20 pacientes, según las indicaciones de las guías clínicas en cada momento16,17, correspondiendo a un 15,5% de la serie. Las indicaciones de tratamiento fueron: 4 por cirrosis hepática (20% de los tratados) —3 al detectarse carga viral y uno al iniciar con DEA—; uno al presentar pico de ADN-VHB >2.000UI/ml y F2 en biopsia hepática; y 16 pacientes por estar en fase de HBC AgHBe(–) (80% de los tratados), uno no llegando a iniciar tratamiento al abandonar el seguimiento. De los 16 pacientes en fase de HBC AgHBe(–), 13 presentaban GPT alterada desde el diagnóstico, y 3 la alteraron en la evolución.
Hubo 5 pacientes que perdieron el AgHBs (4%). El tiempo mediano hasta el aclaramiento del AgHBs fue de 26,47 (IIC: 8,64-43,94) meses. La tasa media anual de pérdida del AgHBs fue del 0,94% y la tasa acumulada a los 3 años, del 2,83%. La edad media de los pacientes con pérdida de AgHBs fue de 54,7±7,1años, y la de los que no tuvieron pérdida del AgHBs fue de 38,7±10,9años (p=0,004). Ninguno de los pacientes con pérdida del AgHBs presentó complicaciones en su evolución; 3 de los 5 pacientes con pérdida de AgHBs realizaron la seroconversión a Anti-HBs (60% de los que aclararon el AgHBs). El tiempo mediano desde la pérdida del AgHBs hasta la seroconversión fue de 10,5 (IIC: 0-22,7) meses. El 80% de los pacientes que realizaron el aclaramiento del AgHBs presentaban al diagnóstico GPT <40mU/ml y ADN-VHB <2.000UI/ml (80% ADN-VHB indetectable). En la tabla 6 se muestra el estudio comparativo de GPT y ADN-VHB, basal y pico, entre los pacientes con y sin pérdida del AgHBs.
Comparativa de GPT y ADN-VHB entre pacientes con y sin pérdida del AgHBs
| n=126 | Aclaramiento del AgHBs n=5 (3,97%) | No aclaramiento del AgHBs n=121 (96,03%) | p |
|---|---|---|---|
| GPT al diagnóstico (mU/ml) | 25,80±17,81 | 31,97±28.72 | 0,421 |
| GPT pico (mU/ml) | 34,00±22,53 | 43,74±44,94 | 0,566 |
| ADN-VHB al diagnóstico (UI/ml) | 21,60±48,30 | 5.214,70±1.6074 | 0,002 |
| ADN-VHB pico (UI/ml) | 1.089,60±1.869,56 | 31.100,22±154.440,70 | 0,053 |
AgHBs: antígeno de superficie de la hepatitis B; GPT: glutámico pirúvico. transaminasa.
Fueron 5 los pacientes que desarrollaron alguna complicación (3,6%). Uno tuvo DEA y 4 CHC. El tiempo medio hasta la complicación fue de 3 años y medio; 4 pacientes desarrollaron CHC (2,9%), 2 pacientes presentaban cirrosis y 2 no (50% de los que desarrollaron un CHC). Los 4 pacientes tenían nacionalidad española y eran mayores de 40 años (edad media 61,75±11,9), siendo 3 de los 4 varones, sin encontrarse datos de cirrosis en 2 por clínica, analítica, ecografía, ni por biopsia hepática (ambos A1F0). La tasa anual de desarrollo de CHC en los pacientes con cirrosis fue del 17,85%. Los pacientes que tuvieron alguna complicación fueron significativamente mayores que los pacientes sin complicaciones: 62,5±10,3 años vs. 39,63±11,5 años (p=0,001).
Durante el seguimiento hubo 5 pacientes que ingresaron por causas relacionadas con la infección por el VHB (3,87%), el 80% en relación con el diagnóstico, tratamiento o cirugía de CHC, y el 20% por DEA.
Fallecieron 2 pacientes (1,4%). Uno debido a un carcinoma epidermoide de pulmón y otro a un colangiocarcinoma, siendo este el único fallecimiento que pudo tener relación con la infección por VHB (0,72%). Era un varón, natural de Rumanía, diagnosticado a los 42 años a raíz de un estudio por colestasis disociada, quien al diagnóstico presentaba GPT <40mU/ml y ADN-VHB indetectable, permaneciendo el ADN-VHB indetectable en el seguimiento, sin realizar la pérdida del AgHBs. Se realizó gastroscopia sin objetivar datos de HTP, y una ecografía de abdomen sin signos de hepatopatía crónica, no presentando ningún dato clínico, analítico, ni pruebas complementarias sugestivas de cirrosis.
DiscusiónExisten pocas series recientes publicadas en relación con la infección crónica por el VHB en nuestro país, siendo escasas las que se focalizan únicamente en los pacientes AgHBe(–), a pesar de ser estos el grupo más importante en nuestras consultas. La edad de los pacientes con HBC AgHBe(–) en los trabajos más antiguos se situaba entre 40-55 años18,19, mayor que la de los pacientes con HBC AgHBe(+)20. En una serie francesa más reciente, la edad media de los pacientes AgHBe(–) fue de 46,4±14,4 años, sin embargo, en este mismo trabajo se hizo un subanálisis de los pacientes naif viéndose que la edad media estaba en 40,9±14,8 años7, lo que coincide con nuestros datos y con otros trabajos actuales similares al nuestro9.
En series antiguas se observaba un predominio del sexo masculino (ratio masculino/femenino de 4,6/1,7)20, y series recientes continúan indicando un predominio del sexo masculino (75-88%)21,22. Si bien, en publicaciones actuales con pacientes bien seleccionados y que nunca habían sido tratados, la proporción hombre/mujer continúa con un predominio masculino (2,3/1,5)7,13,23, pero ya con una menor diferencia, incluso hay trabajos que presentan un leve predominio del sexo femenino24. Nuestros resultados van en este sentido (54% mujeres), pudiendo estar relacionado con los estrictos criterios de selección que tenemos para evitar sesgos en la evolución natural, como el consumo de alcohol —que suele ser más frecuente en varones, y fueron excluidos—, o por el alto porcentaje de pacientes diagnosticados en el cribado durante el embarazo (16,6%).
La inmigración ha afectado de forma importante a la epidemiología de esta infección. En las últimas 2-3 décadas ha habido un incremento en la inmigración de personas de regiones con prevalencia alta o intermedia de la infección crónica por VHB a países desarrollados7,25, incluido España8,9. En nuestra serie la población inmigrante representa de media el 38%, con un incremento de estos respecto a los españoles en el periodo de estudio en los últimos años, dato semejante al descrito en un reciente estudio realizado en Grecia en un periodo similar26. De ahí la importancia de hacer el cribado en este grupo de población, sobre todo en mujeres embarazadas. Así, en nuestro trabajo el porcentaje de diagnóstico en el embarazo fue del 16%, pero existiendo una diferencia significativa entre españolas e inmigrantes (22,2% vs. 44,8%; p=0,04).
El 24% de nuestra serie presentaba antecedentes familiares de infección por VHB, habiéndose descrito porcentajes en torno al 13-63%23,27. En un reciente trabajo realizado en Brasil13 se describe la posible transmisión vertical o intrafamiliar en un 43%. En nuestro trabajo no se han recogido pacientes infectados por transmisión vertical, lo cual es posible, pues esta es una forma de transmisión infrecuente en países con sistemas sanitarios desarrollados, donde los programas de cribado durante el embarazo (en nuestra serie se detectaron por este motivo un 16% de los pacientes, suponiendo hasta el 38% de las mujeres), la vacunación, y profilaxis primaria en el parto y posparto desde hace años hacen muy difícil ver este tipo de transmisión. En nuestra serie, el 10% de los pacientes se diagnosticaron gracias al cribado por antecedentes familiares, debido posiblemente a que este despistaje no se hace en la numerosa población extranjera. Se ha sugerido la saliva como posible mecanismo de transmisión del VHB28. Esta posible forma de transmisión podría explicar ese porcentaje de pacientes sin un evidente factor de riesgo de transmisión del VHB.
En el momento actual, con base en la evidencia acumulada29, se ha consolidado el hecho de realizar el cribado serológico de hepatitis B en pacientes que van a ser sometidos a tratamientos inmunosupresores o quimioterápicos. Así, en nuestra serie estos protocolos fueron la causa por la que se realizó el diagnóstico de la infección crónica por el VHB en hasta el 8% de los pacientes de la serie (fig. 2), realizado en las consultas de reumatología, hematología y dermatología. Sin embargo, hay que seguir divulgando la necesidad de dicho cribado, ya que se siguen produciendo reactivaciones en este grupo de pacientes, como ocurrió en nuestra serie al haber una reactivación a HBC AgHBe(–) en un paciente que fue tratado por un linfoma.
Los pacientes con infección crónica por VHB AgHBe(–) de nuestra serie en su mayoría estaban asintomáticos cuando acudieron a la consulta, y de los pacientes con síntomas, que no llegaron al 9%, solo en un paciente estaba claramente relacionado con la hepatopatía de base, ya que había tenido una DEA. El resto de síntomas fueron inespecíficos. Durante el seguimiento solo falleció un enfermo en relación con el VHB y 5 pacientes requirieron ingreso por causas relacionadas con la infección (3,87%), el 80% en relación con el diagnóstico, tratamiento o cirugía de CHC. De esta forma se puede estimar que la calidad de vida de los pacientes con infección crónica por VHB AgHBe(–) es buena o aceptable en la mayoría de los casos.
Debido a que la infección crónica por el VHB es una enfermedad silente en la mayoría de las ocasiones, la ausencia de síntomas no es suficiente para separar pacientes con enfermedad hepática progresiva significativa de los PI30. Por ello, un paciente con AgHBs(+), AgHBe(–), Anti-HBe(+), GPT normal y ADN-VHB no detectable en una sola ocasión no debe ser clasificado como PI sin un apropiado seguimiento. En nuestro trabajo observamos cómo el valor mediano de GPT pico no se obtuvo hasta los 10,4 meses, y el ADN-VHB pico hasta los 11,2 meses. Se ha observado que en pacientes con GPT normal al diagnóstico el riesgo de alterar esta durante el seguimiento es mayor durante el primer año (15-20%)31,32, y disminuye una vez pasados los 3 años de seguimiento32-34, lo que coincidiría con nuestros resultados. Por ello, se indica una monitorización de la GPT en los primeros años de seguimiento en este tipo de pacientes para poder establecer el estadio de la enfermedad en la que se encuentran30.
En consonancia con otros trabajos publicados35,36, los niveles de ADN-VHB en pacientes AgHBe(–) disminuyen en el primer año de seguimiento debido a la trasformación de este tipo de pacientes en su mayor parte en PI, donde la carga viral pasa a ser baja o indetectable. Así, en la tabla 2, vemos cómo el porcentaje de pacientes con carga viral baja va aumentando de forma progresiva en el tiempo, indicando un descenso en la carga viral en los PI.
El aclaramiento del AgHBs es un evento que se ha tenido como poco frecuente en la evolución de los pacientes con infección crónica por el VHB, así su incidencia se estima aproximadamente en 0,1-0,8% en pacientes que adquieren la infección en la infancia, y en 0,4-2% en los que la adquieren en la adolescencia o edad adulta37-40, como podría ser nuestra población. Trabajos más recientes, y con un seguimiento de entre 25 y 30 años, estiman una tasa de aclaramiento anual del AgHBs de entre el 141 y el 1,8%42, similar al de nuestro estudio (0,94%). De estos enfermos, aproximadamente la mitad desarrollan Anti-HBs, a veces varios meses después43. El 80% de los pacientes que realizaron el aclaramiento del AgHBs presentaban GPT <40mU/ml y una carga viral <2.000UI/ml al diagnóstico en todos los casos, siendo indetectable en el 80% de ellos. Esto coincide con lo descrito en la literatura44, que indica que los pacientes que realizan el aclaramiento presentan de forma continuada un ADN-VHB bajo o persistentemente indetectable años antes de la seroconversión. Aunque estos pacientes en nuestra serie no presentaron complicaciones en el tiempo de evolución de este trabajo, se debe tener en cuenta que los pacientes que aclaran el AgHBs por encima de los 50 años, como es nuestro caso, tienen un riesgo aumentado de desarrollar CHC43, por lo que a pesar de que en el momento actual, con la evidencia acumulada, no se pueda dar una recomendación de incluirles en un programa de cribado de CHC, sí sería prudente mantenerles en nuestras consultas con un seguimiento anual o bianual. De hecho, hay trabajos que indican que no hay una reducción del riesgo de CHC en los pacientes que aclaran el AgHBs en relación con los que no lo aclaran45,46, y que el hecho de realizar el aclaramiento del AgHBs no necesariamente implica buen pronóstico.
La tasa anual de progresión a cirrosis en pacientes con infección crónica por el VHB está entre el 1 y el 7%41,47, siendo mayor en los pacientes AgHBe(–), con tendencia al 7%. El porcentaje de cirróticos en nuestra serie es de un 6%, con una tasa anual del 1,03% (datos no mostrados, ya que no es un trabajo realizado específicamente con este objetivo), habiéndose descrito estas bajas tasas en otros trabajos47. Este bajo porcentaje se podría explicar por el gran porcentaje de pacientes en fase de PI. La edad es un factor claramente relacionado con el desarrollo de cirrosis48,49, así en nuestro trabajo los pacientes con cirrosis presentaron una edad media claramente superior a los pacientes sin cirrosis. La edad a partir de la cual hay que pensar en que puede existir daño histológico significativo está en la mayoría de los trabajos en los 40 años50. Hay trabajos, en países en vías de desarrollo, en los que se indican edades más tempranas (en torno a los 30 años51), teniendo en cuenta que son países donde la infección se transmite principalmente en el embarazo, el parto y en los primeros años de la vida, existiendo mayor tiempo de evolución de la enfermedad, lo que explicaría la mayor afectación histológica de forma precoz. Otro de los factores claramente relacionado con el desarrollo de cirrosis es el sexo masculino49, hecho que se corrobora en nuestro estudio, donde el 100% de los pacientes con cirrosis fueron varones.
Es clara la asociación entre el CHC y la hepatopatía por virus B52, pero hasta el 30-50% de los CHC asociados a virus B ocurren en ausencia de cirrosis; de hecho solo el 50% de nuestros pacientes que desarrollaron CHC lo hicieron sobre un hígado cirrótico. En nuestro trabajo el 75% de los pacientes que presentaron CHC fueron varones, coincidiendo con lo descrito53.
La mortalidad descrita en este tipo de pacientes varía desde una baja tasa de mortalidad (1%)41, a otros trabajos donde se objetivan tasas mayores de mortalidad (15%)54. Solo detectamos 2 fallecimientos; ambos pacientes fueron varones y con más de 40 años al diagnóstico. Uno de los 2 fallecimientos estuvo en probable relación con la infección por el VHB (0,72% de la serie), ya que desarrolló un colangiocarcinoma55.
En nuestro estudio, al igual que en otros trabajos publicados, el grupo más numeroso de pacientes con HBC AgHBe(–) son los PI. Las últimas guías europeas hablan de PI en los pacientes con GPT persistentemente normal y ADN-VHB <2.000UI/ml (PI puros)17, sin embargo, y como se ha explicado, esta infección es dinámica, y algunos pacientes con GPT normal presentan picos de ADN-VHB entre 2.000-20.000UI/ml en la evolución (en nuestra serie casi el 45% de los PI), no presentando este grupo de pacientes mayor afectación histológica ni mayores complicaciones en la evolución que los PI puros (tabla 3). Además, el 6% de pacientes presentan una situación indeterminada, con picos de ADN-VHB a veces superiores a 20.000UI/ml, pero sin encontrarse en estos daño histológico significativo ni mayores complicaciones que en los PI (tablas 3-5). Así proponemos el término de portador semiinactivo para este grupo de pacientes en situación indeterminada, en quienes habrá que hacer un seguimiento más estrecho hasta que se pueda aclarar su pronóstico, pero en los que no queda claro que tengan peor evolución que los PI.
Se trató en el seguimiento a 20 pacientes (15,5%), el 80% al encontrarse en fase de HBC AgHBe(–). De estos, el 81,25% presentaban GPT alterada al diagnóstico, por lo que en la gran mayoría de los casos los pacientes que requieren tratamiento tienen GPT alterada desde el inicio del seguimiento. Un reciente estudio español obtiene datos muy similares a los nuestros en este sentido9.
En resumen, los pacientes con infección crónica por el VHB AgHBe(–) en general se encuentran asintomáticos al diagnóstico y en la evolución. La aparición de cirrosis es poco frecuente. No se deber obviar que hasta en la mitad de los casos el CHC, que es la principal complicación, se desarrolla en pacientes sin cirrosis. Además debe tenerse en cuenta el porcentaje de pacientes con necesidad de tratamiento.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de interés.
Al Dr. Marcelino Sánchez Casado, adjunto de la UCI del Hospital Virgen de la Salud de Toledo, por su ayuda tanto en la metodología como en la estadística para la realización de este trabajo.