La enfermedad relacionada con IgG4 es un trastorno sistémico caracterizado por lesiones inflamatorias difusas o tumorales. Puede simular cáncer de páncreas, llevando a errores diagnósticos y terapéuticos que condicionan un aumento en la morbimortalidad de los pacientes. El objetivo de esta revisión es realizar una aproximación diagnóstica diferencial de estas dos entidades desde el punto de vista epidemiológico, clínico, analítico, imagenológico e histopatológico.
IgG4-related disease is a systemic disorder characterised by diffuse or tumoural inflammatory lesions. It can mimic pancreatic cancer, leading to errors in diagnosis and treatment increasing rates of morbidity and mortality in patients. The aim of this review is to take a differential diagnostic approach to these two entities using epidemiology, clinical and laboratory findings, imaging and histopathology.
La enfermedad relacionada con IgG4 (ER-IgG4) es un trastorno sistémico caracterizado por lesiones inflamatorias difusas o tumorales que exhiben un denso infiltrado linfoplasmocitario con abundantes células plasmáticas productoras de IgG4, flebitis obliterativa y evolución a fibrosis estoriforme1. Puede presentarse de manera heterogénea, con compromiso sistémico o de órgano único, de manera sincrónica o metacrónica1-3. Es considerada una gran «simuladora» de enfermedades tumorales malignas1-5. La nomenclatura de ER-IgG4 fue designada en el año 2010 y aceptada en el primer congreso internacional de esta entidad en Boston1-5. Este evento derivó en el primer consenso que definió los hallazgos patológicos distintivos en 20124 y en las primeras guías de manejo y tratamiento publicadas en 20155. Su conocimiento reciente condiciona un aumento en la morbimortalidad, y errores diagnósticos y terapéuticos cuando no es tenida en cuenta entre los diagnósticos diferenciales de lesiones tumorales1-5. Debido al frecuente compromiso pancreático, la pancreatitis autoinmune (PAI) por ER-IgG4 puede simular carcinoma pancreático (CP)1-4.
El objetivo principal de esta revisión es realizar una aproximación diagnóstica diferencial de estas dos entidades desde el punto de vista demográfico, clínico, analítico, imagenológico e histopatológico.
Material y métodosSe realizó una revisión no sistemática de la literatura en idiomas inglés y español en Pubmed. Se seleccionaron artículos publicados en los últimos 10años. Empleando la estrategia de búsqueda «Immunoglobulin G4 [MeSH] related disease» y «Pancreatic [MeSH] cancer» se obtuvieron 5.073 y 20.746 resultados, respectivamente. Por este motivo, el enfoque incluyó información relevante y actual de revistas de alto impacto y/o de autores expertos en los distintos apartados de estas enfermedades.
Resultados: diferenciación entre PAI en ER-IgG4 y CPEpidemiologíaDebido al reconocimiento reciente de ER-IgG4, su verdadera prevalencia e incidencia son desconocidas y probablemente subestimadas1-3. Hasta un 80% de los datos provienen de países asiáticos, principalmente Japón, donde se ha informado una prevalencia de 2,6-10,2 casos por millón de habitantes y una incidencia de 336-1.300 casos nuevos por año3. En los últimos años se incrementaron los reportes a nivel mundial, especialmente en Europa y Norteamérica3.
La ER-IgG4 es más frecuente en hombres (relación hombre-mujer, 3:2)1-3. La edad media es de 60años3.
El compromiso pancreático y el de glándulas submaxilares son los más frecuentemente reportados en la literatura1-4. La PAI tipo1 es el patrón de compromiso de la ER-IgG41-3. En la tabla 1 se muestran las diferencias entre PAI tipo1 y2. La prevalencia del tipo1 no supera el 11% de las pancreatitis crónicas3. Se ha reportado en un 98% de las series internacionales de ER-IgG4 con compromiso pancreatobiliar y hasta en un 41% de los casos sistémicos de la enfermedad3.
Diferencias entre PAI tipo 1 y 261
| Pancreatitis autoinmune | Tipo 1 | Tipo 2 |
|---|---|---|
| Sexo | Hombres > mujeres | Hombres ≥ mujeres |
| Edad de inicio | Adultos | Jóvenes y adultos |
| Histología | Pancreatitis esclerosante linfoplasmocitaria | Pancreatitis ductal céntrica idiopática |
| Infiltrado neutrofílico | Ausente | Frecuente |
| IHQ IgG4 positiva | Presente | Ausente |
| IgG4 sérica | Suele estar elevada | Normal |
| Respuesta a esteroides | Buena | Buena |
| Lesiones extrapancreáticas | Frecuentes (ER-IgG4) | Raras (asociación a EII) |
EII: enfermedad inflamatoria intestinal; IHQ: inmunohistoquímica.
El CP se presenta con mayor frecuencia entre la séptima y octava década, con una edad media de aparición a los 71años6. En España se informó una incidencia de 6,9 por 100.000 habitantes en el año 2015, teniendo en cuenta ambos sexos7. La enfermedad presenta un cociente hombre/mujer de 1:1 a nivel mundial6-10.
Manifestaciones clínicasLa presentación inicial de ER-IgG4 es heterogénea e inespecífica1-5. Frecuentemente tiene un curso subagudo o crónico, a menudo silente, o se exterioriza de manera aguda por una complicación secundaria2. También puede ser un hallazgo incidental en un método por imagen1-5. Los principales síntomas y signos reportados se describen en la tabla 2. La astenia suele ser leve, la pérdida de peso no evoluciona rápidamente a síndrome consuntivo, y la hiporexia es infrecuente en ausencia de enfermedad evolucionada1-3. La pancreatitis aguda es infrecuente1,3. La afectación biliar como colangitis esclerosante (CE-IgG4) está presente en el 50-90% de los pacientes con compromiso pancreático3, y puede complicarse con colangitis infecciosa y sepsis por estasis biliar1-3. Se ha reportado diabetes de reciente comienzo en el 40 al 70%, con gran variabilidad entre las distintas series, apareciendo en general cuando la enfermedad ha progresado a fibroesclerosis y reemplazo significativo de la glándula1-5.
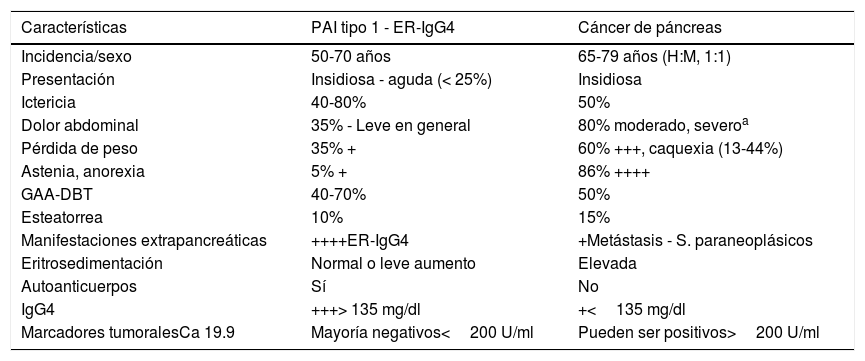
Características clínicas de pancreatitis autoinmune tipo 1 asociada a enfermedad relacionada con IgG4 y cáncer pancreático
| Características | PAI tipo 1 - ER-IgG4 | Cáncer de páncreas |
|---|---|---|
| Incidencia/sexo | 50-70 años | 65-79 años (H:M, 1:1) |
| Presentación | Insidiosa - aguda (< 25%) | Insidiosa |
| Ictericia | 40-80% | 50% |
| Dolor abdominal | 35% - Leve en general | 80% moderado, severoa |
| Pérdida de peso | 35% + | 60% +++, caquexia (13-44%) |
| Astenia, anorexia | 5% + | 86% ++++ |
| GAA-DBT | 40-70% | 50% |
| Esteatorrea | 10% | 15% |
| Manifestaciones extrapancreáticas | ++++ER-IgG4 | +Metástasis - S. paraneoplásicos |
| Eritrosedimentación | Normal o leve aumento | Elevada |
| Autoanticuerpos | Sí | No |
| IgG4 | +++> 135 mg/dl | +<135 mg/dl |
| Marcadores tumoralesCa 19.9 | Mayoría negativos<200 U/ml | Pueden ser positivos>200 U/ml |
DBT: diabetes mellitus; GAA: glucemia alterada en ayunas.
El compromiso aislado de un solo órgano es excepcional1-4. Este hecho facilita el diagnóstico diferencial con CP. Es importante interrogar sobre síntomas atópicos como asma bronquial, rinitis y sinusitis crónica, que pueden aparecer hasta en un 40%1-3,11.
El adenocarcinoma de páncreas es la neoplasia más común en este órgano6. Suele tener una presentación insidiosa que conlleva un diagnóstico tardío cuando la enfermedad presenta síntomas significativos por invasión local o metástasis a distancia6,9. El retraso diagnóstico es mayor cuando el tumor se localiza en el cuerpo y en la cola de la glándula (20% de los casos)9,10. La afectación pancreática evoluciona rápidamente generando significativa astenia y pérdida de peso6,10. El dolor abdominal es frecuente y se intensifica en pocos meses6. La ictericia obstructiva suele ser más precoz, y es más frecuente en los tumores cefálicos6,9. Puede asociarse a coluria, acolia y prurito por colestasis6,9,10.
El signo de Courvoisier-Terrier (vesícula palpable indolora) en un paciente ictérico sin cólico biliar, vinculado clásicamente a obstrucción maligna del árbol biliar extrahepático (presente en 13% en CP), puede observarse en algunas formas de presentación de ER-IgG43,6,9. Otras manifestaciones incluyen diarrea (44%), esteatorrea (10-25%) y vómitos (33%)6,9,10.
El compromiso extrapancreático por invasión local es frecuente al diagnóstico de CP6. La infiltración de la pared vascular por el tumor puede ser similar a la periarteritis característica de ER-IgG4, las metástasis linfáticas confundirse con linfadenitis-IgG4, y la infiltración carcinomatosa de órganos vecinos puede simular fibrosis retroperitoneal1,12.
El infrecuente síndrome paraneoplásico «paniculitis-artritis-eosinofilia» podría simular ER-IgG4 por la asociación de lesión pancreática con eosinofilia11.
La similitud de signos y síntomas mencionados obliga a realizar una exhaustiva diferenciación a través de métodos complementarios y jerarquizan el rol de la histopatología5.
Hallazgos de laboratorioAnalíticaLos pacientes con PAI-IgG4 presentan elevación de transaminasas y patrón colestásico en el 70 al 80% de los casos3. A diferencia de otras enfermedades inflamatorias y autoinmunes, la eritrosedimentación y la proteínaC reactiva suelen ser normales1-5. Otros hallazgos inespecíficos son: aumento variable de amilasa y lipasa (generalmente leve a moderado), anemia de enfermedades crónicas, eosinofilia variable y aumento de inmunoglobulinaE en el 20 al 40%1-5,11. Los niveles de complemento generalmente están normales cuando existe compromiso pancreático, pero puede observarse hipocomplementemia hasta en un 25% de pacientes con compromiso submaxilar, pulmonar, aórtico, y es considerado un marcador de actividad en la afectación renal1-3. Existe hipergammaglobulinemia policlonal en más del 60% de los casos1-5.
En el CP puede haber anemia leve o trombocitosis reactiva, aumento de transaminasas y enzimas de colestasis, y elevación leve de amilasa y lipasa (35%)9. Solo el 5% de los pacientes presentan pancreatitis aguda6,7.
IgG4 séricaEs el isotipo de inmunoglobulinaG menos abundante (menos del 5% en pacientes sanos)1-3. Su estructura consiste en 2 cadenas pesadas y 2 ligeras. A diferencia de otros subtipos, los puentes disulfuro que unen las 2 cadenas pesadas son inestables1. Esto permite la separación y recombinación aleatoria con fragmentos de otras moléculas de IgG41-3. La formación de nuevas moléculas bivalentes le permite actuar como anticuerpos con dos especificidades de unión a antígenos diferentes, pero sin capacidad de intercambio de antígenos o formación de complejos inmunes como lo hacen los otros subtipos de IgG (IgG1, IgG2 e IgG3)1-5. Se consideran normales los valores menores a 140mg/dl13,14.
En 2007, un estudio comparó los niveles de IgG total e IgG4 entre 45 pacientes con PAI y 135 pacientes con CP13. Los autores encontraron niveles elevados de IgG total en el 42% de casos de PAI frente al 5% en CP, y de IgG4 ≥140mg/dl en el 76% de los pacientes con PAI (media 550±98mg/dl) versus el 10% en CP (media 70±9mg/dl, OR:37)13. Al elevar el punto de corte a 280mg/dl solo el 1% de los pacientes con CP tenían niveles elevados, frente al 53% en PAI27. Un estudio prospectivo también concluyó que niveles ≥280mg/dl mostraron mayor especificidad (E) para distinguir ER-IgG4 de otras patologías inflamatorias y neoplásicas (E 96,2%, valor predictivo negativo [VPN] 97,7%, y sensibilidad [S] del 56,9%)14. Un metaanálisis reciente concluyó que un valor de corte de IgG4 sérica de 135 a 144mg/dl tiene una S del 87% y una E del 83% para el diagnóstico de ER-IgG415. Cuando se utilizó un valor de corte de 280mg/dl, la S combinada disminuyó al 63%, pero la E fue del 95%15. Este trabajo incluyó un número modesto de estudios, pero reflejó una heterogeneidad significativa respecto a los valores que deben considerarse positivos. Por lo tanto, aunque este marcador tiene valor en un contexto clínico adecuado, su performance diagnóstica es modesta13-15. También se han encontrado concentraciones elevadas de IgG4 sérica en otras enfermedades mediadas por esta molécula —glomerulonefritis membranosa, púrpura trombótica trombocitopénica, pénfigo foliáceo— y en procesos linfoproliferativos, enfermedades respiratorias crónicas, colangitis esclerosante primaria, colangiocarcinoma, dermatitis atópica, enfermedades parasitarias, entre otras1-3,13-15. Sin embargo, en estos procesos los valores suelen ser inferiores a 280mg/dl13-15.
Es necesario enfatizar que del 20 al 30% de los pacientes con ER-IgG4 tienen niveles séricos normales de esta IgG1,14,15. Algunos autores creen que puede deberse al compromiso de pocos órganos o a enfermedad avanzada y fibrótica, a la variabilidad de criterios aplicados en las distintas series, a diferencias étnicas y geográficas, o al método inmunológico empleado en su detección1-3,14-16. Otra posibilidad de falsos negativos es el fenómeno de prozona17-19. Los ensayos de nefelometría para IgG4 son propensos a error en presencia de exceso de antígeno, pudiendo subestimar la concentración debido a que no se produce floculación17,18. La dilución adecuada de la muestra de suero durante el proceso de ensayo evitaría este efecto17.
Por todo lo mencionado, este método carece de peso específico para diferenciar de manera aislada ER-IgG4 y CP.
Identificación de plasmoblastos circulantesLa fisiopatogenia de ER-IgG4 no ha sido dilucidada completamente1-3. Se ha postulado que en individuos genéticamente susceptibles un disparador ambiental o un microorganismo podrían provocar alteraciones en la presentación de autoantígenos, defectos en la inmunidad innata y pérdida de la tolerancia inmunológica1. Esto produciría un disbalance entre linfocitosT hellper (Th)1 y2 con un aumento de la respuesta de estos últimos1,2. Los Th2 activados secretan interleucina (IL) 5, responsable de la eosinofilia periférica y tisular, e IL-13, que estimula la proliferación de célulasB y plasmocitos productores de IgG e IgE1,2. Este proceso induce la respuesta de célulasT reguladoras (Treg, CD25+ FoxP3+) convencionales y de memoria productoras de IL-103,20,21. Esta IL es responsable del cambio a la subclase IgG4 en las célulasB y de la producción de factor de crecimiento transformanteβ, que estimula la participación de fibroblastos1,3. Todo esto genera infiltración de células plasmáticas, eosinófilos y fibroblastos, provocando el daño tisular1-3. Por otro lado, los linfocitos Th foliculares inducen el desarrollo de centros germinales en los ganglios linfáticos, la generación de plasmoblastos (PB) secretores de IgG4 y células plasmáticas de larga vida21,22. A partir de estos conocimientos se ha avanzado en la investigación del rol de los PB en la enfermedad21.
La concentración de PB circulantes puede analizarse por citometría de flujo detectando diferentes marcadores presentes en su superficie21,22. Su determinación ha demostrado utilidad como biomarcador, ya que aumentan cuando la enfermedad está activa (incluso en presencia de IgG4 sérica normal), disminuyen drásticamente cuando los pacientes responden a rituximab y se elevan en las recaídas21,22. Sin embargo, la disponibilidad de esta técnica limita su uso en la práctica diaria.
No suelen encontrarse PB en sujetos sanos, a excepción de niveles bajos y transitorios luego de vacunación o algunos procesos infecciosos21. Sin embargo, pueden hallarse en otras enfermedades inflamatorias, autoinmunes y en procesos hematológicos22.
Hasta el momento no se ha analizado la concentración en poblaciones seleccionadas con CP21.
Marcadores tumoralesMúltiples investigaciones han evaluado la utilidad de estos marcadores para cribado y diagnóstico del CP9,10. El más estudiado es el antígeno sérico del cáncer19-9 (CA19-9)9,23. En el 10% de las personas (con genotipo negativo de Lewis) no es un marcador útil9. En pacientes asintomáticos la S y la E presentan gran variabilidad (70 a 92% y 68 a 92%, respectivamente)23. Debido a su baja S, las guías de expertos no lo recomiendan como método de cribado de CP, aunque sí es de utilidad para el seguimiento de los pacientes intervenidos quirúrgicamente9.
La S es muy baja en tumores pequeños9,23,24. Asimismo, puede encontrarse elevada en pancreatitis aguda y crónica, cirrosis hepática, colangitis, colelitiasis, tumores neuroendocrinos del páncreas, cáncer biliar o hepatocelular, entre otras patologías23,25. Incluso en pacientes sintomáticos, el valor de corte de 37UI/ml solo permitiría discriminar CP de enfermedad benigna con una S y E del 77 y del 87%, respectivamente, y valor predictivo positivo [VPP] del 72%13. El CA19-9 se encuentra elevado en el 27% de pacientes con PAI13. Un valor de corte más elevado (100UI/ml) aumenta la E para CP (71% CP versus 9% en PAI)13. Sin embargo, no hay nivel de CA19-9 (incluso >10.000UI/ml) que pueda verse exclusivamente en pacientes con CP13,23. Por tanto, deben considerarse estas limitaciones a la hora de solicitar este marcador para diferenciar ambas patologías.
AutoanticuerposNo existen Ac específicos ni suficientemente sensibles asociados a ER-IgG41-3. Se ha reportado la asociación de Ac anti-lactoferrina, anti-anhidrasa carbónicaII, Ac anti-proteína fijadora de plasminógeno e inhibidor de la secreción pancreática de tripsina con PAI, pero su valor en la práctica clínica es incierto26,27.
Los Ac IgG4 pueden unirse a la región Fc de IgG produciendo un factor reumatoide (con papel patogénico incierto) presente hasta en el 20% de los pacientes1-3. También pueden observarse Ac antinucleares (generalmente títulos bajos) y se ha descripto anti-Ro/SSA y anti-La/SSB en pacientes con ER-IgG41,2. Sin embargo, su presencia obliga a descartar síndrome de Sjögren1,3. La presencia de Ac antimicrosomales y anti-músculo liso puede evidenciarse en esta enfermedad, pero no se ha podido esclarecer si se trata de una asociación con hepatopatías autoinmunes27.
La presencia de Ac anticitoplasma de neutrófilos (ANCA) obliga a descartar vasculitis necrosante28. El hallazgo de anti-DNA, anti-Sm, anti-RNP y crioglobulinas debe alertar de la posibilidad de otra enfermedad sistémica en el contexto clínico adecuado28.
La presencia de Ac en ER-IgG4, hasta el momento, carece de utilidad diagnóstica y no permite diferenciar esta enfermedad del CP20,23.
Diagnóstico por imágenesLa PAI-IgG4 puede presentar 3 patrones: difuso, focal o multifocal1-3,28. El difuso, conocido como «páncreas en salchicha», es el más frecuente1-3. Se caracteriza por aumento homogéneo del tamaño glandular y pérdida del contorno lobulado1-5. Se asocia frecuentemente a CE-IgG41,27-29. Una de las claves para diferenciar esta enfermedad de CP es encontrar alteraciones en otros órganos1-5,12,29. A nivel renal, por ejemplo, en ER-IgG4 se pueden observar lesiones nodulares corticales uni o bilaterales, agrandamiento difuso cortical bilateral y/o afectación de la pelvis renal1-3,29,30. En el retroperitoneo suele presentar tumefacción rodeando la aorta abdominal (periaortitis) y sus ramas, y envolver los uréteres y la pelvis renal ocasionando hidronefrosis1-3,31. La mesenteritis esclerosante puede también confundirse con linfoma, fibromatosis y tumores neuroendocrinos desde el punto de vista radiológico1,2,30.
Mientras que el CP infiltra vasos y órganos, la ER-IgG4 los rodea y engloba31,32. Sin embargo, esta diferencia puede generar dudas cuando ambas enfermedades se encuentran en estadios avanzados31.
Ultrasonografía (US) abdominal convencional y contrastadoLa US convencional continúa siendo de elección en el estudio inicial de la patología pancreática30,31. La presencia de una masa hipoecogénica a nivel cefálico y la dilatación de los conductos pancreático y biliar sugieren CP32,33. En la afectación de cuerpo y cola se dificulta la visualización por la falta de dilatación biliar y la presencia de gas en estómago y colon transverso33. La S y la E de este estudio también dependen de la experiencia del operador, del estadio de la enfermedad y del hábito constitucional del paciente31,33. Por estos motivos su precisión diagnóstica en CP es controvertida y la S oscila entre el 50 y el 90%30-33. El contraste mejora la visualización, permitiendo en algunos casos diferenciar tumores focales sugestivos de malignidad de lesiones fibroinflamatorias31-33.
La PAI-IgG4 exhibe un aumento difuso del tamaño glandular, reducción de la ecogenicidad y disminución del conducto pancreático por compresión del parénquima afectado31. La administración de contraste revela realce homogéneo o inhomogéneo (según el grado de fibrosis y adelgazamiento de los vasos pancreáticos por la infiltración linfocítica) moderado a intenso en la fase precoz, con un lavado lento y progresivo1,31. El contraste adquiere gran utilidad para diferenciar el patrón focal y multifocal de PAI del CP31.
Las principales diferencias ecográficas entre estas dos entidades se resumen en la tabla 3.
Características ultrasonográficas diferenciales entre pancreatitis autoinmune tipo 1 y cáncer de páncreas
| Pancreatitis autoinmune difusa | Cáncer de páncreas | |
|---|---|---|
| US convencional | • Hipoecoico con aumento de volumen• Agrandamiento difuso, en «salchicha»• Conducto pancreático disminuido• Rodea los vasos y órganos, no infiltra | • Hipoecoico• Márgenes mal definidos• Dilatación del Wirsung• Infiltración vascular• Metástasis |
| Doppler | • No se detectan vasos tumorales | • No se detectan vasos tumorales |
| US con contraste | • Realce moderado o marcado• Inhomogéneo en fase precoz• Lavado del contraste lento y progresivo | • Tumor poco vascularizado• Vasos marginales al tumor |
| US endoscópica | • Agrandamiento hipoecoico difuso o masa hipoecoica irregular focal con o sin linfadenopatía peripancreática | • Manchas hiperecoicas dentro de la masa por la compresión de los ductos pancreáticos |
US: ultrasonografía.
La US abdominal es un método de primera imagen aceptable pero no aporta seguridad diagnóstica31-33.
Elastografía convencional y ecoendoscópicaLos nuevos equipos, las técnicas de segunda generación, el método endoscópico y los programas informáticos han mejorado los resultados de este estudio disminuyendo los sesgos de interpretación34,35. Sin embargo existen pocos trabajos en este campo y con número limitado de casos35-40. Los estudios elastográficos han mostrado resultados inconsistentes con respecto a la dureza de las lesiones pancreáticas asociadas específicamente con PAI41. Por otra parte, un estudio informó una S del 100% y una E del 67% para la detección de tumores pancreáticos36.
Otro estudio con elastografía ecoendoscópica incluyó 130 pacientes consecutivos con lesiones pancreáticas sólidas y 20 controles sanos y definió 4 patrones elastográficos diferentes: homogéneo verde (controles sanos), heterogéneo predominantemente verde (principalmente lesiones inflamatorias y ausente en CP), heterogéneo predominantemente azul (adenocarcinomas y otras neoplasias) y un patrón homogéneo azul (solo en tumores neuroendocrinos)39. Los autores concluyeron que un patrón predominantemente verde, homogéneo o heterogéneo, excluye malignidad con alta precisión37. La S, la E, el VPP, el VPN y la precisión global de la elastografía endoscópica para el diagnóstico de malignidad fueron del 100, del 85,5, del 90,7, del 100 y del 94%, respectivamente37. Sin embargo, otros estudios previos con menor número de pacientes obtuvieron una S similar pero una E claramente menor (60-70%)38,39.
Un metaanálisis que incluyó siete estudios y 752 pacientes reveló S global del 97% y E del 76%40.
Por lo tanto, esta técnica puede complementar a la clínica y a otros estudios por imagen en centros que cuenten con personal y equipos idóneos, permitiendo fundamentalmente excluir malignidad y facilitando la obtención de biopsias35,42.
Ultrasonografía endoscópica (USE)Esta herramienta ofrece mayor resolución del parénquima pancreático respecto a la US convencional43. Ha demostrado mayor rendimiento diagnóstico que la tomografía por emisión de positrones (PET-TC), la tomografía computarizada (TC) y la US abdominal para reconocer los tumores pancreáticos en estadios iniciales (S 99% frente al 55% para la TC)43,44. Tiene la desventaja de ser una técnica invasiva, aunque con baja tasa de complicaciones (1 a 3%)44. En PAI1 permite visualizar el aumento hipoecoico difuso o focal de la glándula y las linfadenopatías peripancreáticas41. En el patrón focal, a diferencia del CP, suelen observarse manchas hiperecoicas dentro de la masa por infiltración linfocítica y compresión de los conductos1-3,40,41. A pesar de estos sutiles cambios que no siempre están presentes, no existen características específicas para diferenciar PAI del CP.
Si se agrega contraste, las lesiones de PAI pueden ser homogéneamente hipervascularizadas, mientras que el CP es principalmente hipovascular (tabla 3)41.
La mayor ventaja del USE es la posibilidad de guiar la punción-biopsia43-45.
Tomografía computada con contraste intravenosoPermite visualizar el páncreas y la extensión del proceso inflamatorio o neoplásico32,42.
En PAI difusa se visualiza el «páncreas en salchicha» con «signo del halo» o «falsa cápsula», hipodensidad que aparece en fase tardía rodeando la glándula y que permite diferenciarla del linfoma1-3. El conducto suele verse irregular y estenótico por inflamación circundante1-3,33. El patrón focal suele ser hipodenso en fase temprana e isodenso en la tardía, comportamiento similar al CP1,32,33. En este caso cobran mayor valor los hallazgos extrapancreáticos1-3.
La TC es de gran utilidad ante la sospecha de CP por su amplia disponibilidad y experiencia en la interpretación de resultados. Tiene una S >90% y una E del 99%32,33,45,46. La mayor limitación es la menor S para lesiones tempranas y tumores menores de 2cm30. Estos valores mejoran con la tomografía helicoidal trifásica47. El protocolo para páncreas incluye una fase arterial con máximo realce de la aorta a los 30s, una fase «pancreática» con mayor contraste entre el tumor y el parénquima a los 40s, y una fase venosa portal con realce máximo del hígado entre los 60 y 70s47. Las fases arterial y venosa contribuyen a la estadificación valorando el compromiso vascular, y la fase venosa portal permite identificar metástasis hepáticas47. El CP se visualiza como masa mal definida e hipodensa respecto al resto de la glándula, con patrón heterogéneo y bordes espiculados30,32,46-48. Sin embargo, tumores pequeños y de bajo grado pueden verse isodensos respecto al parénquima normal y requieren signos secundarios para su reconocimiento (desaparición ductal focal, dilatación ductal distal, atrofia parenquimatosa distal, deformidad del contorno pancreático)46-48. En fase tardía presenta aumento heterogéneo de intensidad y realce periférico, y pueden verse hebras peripancreáticas que se extienden al tejido adiposo circundante32,33,46-48. A diferencia de la PAI, el conducto suele tener contornos lisos, con estenosis o amputación focal en el sitio del tumor y dilatación pre-obstructiva30,31,46-48. La doble dilatación de los conductos pancreático y biliar está presente en el 70% de los casos de CP de localización cefálica, pero no es patognomónica y puede verse en pancreatitis crónica31. Además, suele evidenciarse infiltración desorganizada de las paredes vasculares y de los órganos vecinos que puede ser indistinguible de los casos de PAI con extensa inflamación de tejidos peripancreáticos45,46.
Colangiopancreatorresonancia (CPR)Es una técnica útil para demostrar alteraciones anatómicas de vía biliar y conductos pancreáticos.
Los hallazgos son similares a la TC pero puede aportar información diferencial del compromiso biliar en pacientes con colecistitis y/o CE-IgG41-3,28. Un estudio retrospectivo que incluyó 162 pacientes (47 con CE-IgG4, 73 con colangitis esclerosante primaria [CEP] y 42 con hepatopatías autoinmunes) analizó los hallazgos de CPR en conductos biliares, hígado, páncreas y otros órganos49. Los autores mostraron que la CE-IgG4 se asoció significativamente con engrosamiento contiguo de los conductos biliares intra y extrahepáticos, anomalías del parénquima pancreático, alteraciones renales y engrosamiento de la pared de la vesícula biliar49. El grosor de la pared del conducto biliar común fue significativamente mayor en CE-IgG4 (media de 3mm) respecto a CEP (1,89mm) y al grupo de enfermedad hepática autoinmune (1,80mm)49. Sin embargo, no encontraron significación estadística entre los tres grupos respecto a la ubicación o longitud de las estenosis del conducto biliar extrahepático, las linfadenopatías abdominales o la fibrosis retroperitoneal49.
En un estudio que comparó CPR con la colangiopancreatografía retrógrada endoscópica (CPRE) para detectar CP, la S de la CPRE fue del 84% y la E del 97%, equiparables a las de la CPRE, que fueron del 70 y del 94%, respectivamente50. Los tumores cefálicos del páncreas pueden ocasionar también obstrucción del conducto biliar común9,10. Si se sospecha CP, la valoración requiere que se agreguen imágenes en T1 eco de gradiente y T2 con administración de contraste9,27,30,50. El CP se presenta característicamente hipointenso en T1 respecto al parénquima normal30,50. Puede observarse ensanchamiento difuso, segmentario o focal del páncreas, con retraso en el realce o hipoatenuación50.
Colangiopancreatografía retrógrada endoscópicaAlgunos estudios han mostrado que la CPRE, la CPR y la USE permiten una adecuada visualización de las estenosis biliares 34,40,45. La CPRE asociada al USE arrojó mejores resultados en el diagnóstico diferencial entre enfermedad benigna y maligna, pero este último es un método de menor disponibilidad34,40,45.
Los hallazgos de PAI en la CPRE son: estenosis mayor a 1/3 de la longitud del conducto pancreático, ausencia de dilatación proximal al sitio de estenosis, múltiples zonas estenóticas, y ramas secundarias que emergen desde el segmento estenosado28. El conducto biliar se afecta concomitantemente en el 20 al 80% de los pacientes28,30. Se han descripto 4 patrones de afectación biliar en CE-IgG428. El tipo1 involucra la zona distal del conducto biliar común, y entre los diagnósticos diferenciales debe incluirse el CP, el colangiocarcinoma distal y la afectación secundaria a pancreatitis crónica28. Algunos expertos han planteado que, a diferencia del colangiocarcinoma o CP, la CE-IgG4 no suele presentar dilatación preestenótica28,31.
Tomografía por emisión de positrones (PET/TC) con 18F-fluorodesoxiglucosa (18F-FDG)Esta técnica permite la valorar el compromiso extrapancreático51. Un estudio prospectivo que evaluó con PET/TC a 35 pacientes con ER-IgG4 demostró afectación multiorgánica en el 97%, y en el 71% se evidenció participación de al menos un órgano que no se había objetivado por examen físico, US y TC52. Los autores detallaron que en ER-IgG4 existe una imagen y patrón específicos que incluyen una captación elevada de 18F-FDG en páncreas y glándulas salivales, lesiones parcheadas en la región retroperitoneal y paredes vasculares, y afectación multiorgánica que no puede interpretarse como metástasis52. En siete casos, los nuevos hallazgos en la PET/TC permitieron reelegir el sitio de la biopsia por lesiones más accesibles, como ganglios linfáticos periféricos y glándulas submandibulares52. Además, demostraron que luego de 2 a 4semanas de tratamiento con 40mg de prednisona por día el 72% mostraron una remisión completa y los restantes una disminución en la captación de 18F-FDG >80%52. Otro estudio que evaluó la utilidad de la PET/TC en 26 pacientes con ER-IgG4 mostró que todos los pacientes tenían dos o más órganos afectados, con valores medios del valor de captación estandarizado (SUV) de 4,14 (rango 0,30 a 8,78)53. Describieron también que 11 pacientes habían sido erróneamente diagnosticados de tumores submandibulares, CP, pancreatitis, fibrosis intersticial pulmonar, fibrosis retroperitoneal o vasculitis sistémica antes de la PET-TC53. En un estudio reciente de casos y controles, con el objetivo de evaluar la utilidad de PET/TC para el diagnóstico de PAI y la exclusión de CP, se incluyeron 53 pacientes con sospecha de PAI que tuvieron una PET/TC antes del tratamiento, y se compararon con la PET/TC de 61 pacientes con CP54. Los investigadores encontraron diferencias significativas en la morfología de captación tumoral pancreática, SUV, características de textura del tumor primario y en el número y ubicación de focos extrapancreáticos entre ambos grupos54. Utilizando un modelo de predicción, el área bajo la curva de receptor-operador fue de 0,95 (p<0,0001), con S, E, VPP y VPN del 90,6, del 84,0, del 87,9 y del 87,5%, respectivamente, en la diferenciación entre PAI y CP54. Por lo tanto, los autores concluyeron que la PET/TC ofrece una alta sensibilidad para diferenciar PAI de CP y que los focos inflamatorios sistémicos ayudan a confirmar el diagnóstico de PAI en pacientes que no han iniciado terapia con glucocorticoides54.
Los estudios mencionados concluyen que es una herramienta útil para el diagnóstico diferencial de ER-IgG4, para evaluar compromiso sistémico, guiar la biopsia y monitorizar la respuesta al tratamiento52-54.
El rol de la PET/TC en CP es controvertido. Su S y su E se han reportado entre 73-94% y 60-89%, respectivamente6,9,55. A pesar del mayor uso en patologías malignas, se desconoce si aporta más información que la que se obtiene con una TC helicoidal trifásica en un paciente con sospecha de CP6,9. Existen estudios a favor y en contra de una mayor S de la PET/TC para diagnosticar pequeñas lesiones metastásicas, con un límite de resolución cercano a 8mm, similar al de la TC55. Otro falso negativo incluye la hiperglucemia51-56.
Recientemente se ha publicado un estudio británico multicéntrico que evaluó la utilidad de sumar la PET/TC a la TC en 550 pacientes con sospecha de CP, y en función de sus resultados los autores concluyen en favor del uso más extensivo de esta técnica55. La S, la E, el VPP y el VPN de realizar ambos métodos superaron ligeramente a los de la TC como único método diagnóstico55. Las razones de probabilidad incrementales demostraron que la PET/TC mejoró significativamente la precisión diagnóstica en todos los escenarios (p<0,0002), cambió correctamente la estadificación del CP en 56 casos (p=0,001) e influyó en el tratamiento en el 45% de los pacientes55. Asimismo, permitió detener la resección en el 20% de los pacientes que debían someterse a cirugía55. Sin embargo, los autores asumen que el beneficio de la PET/TC fue limitado en pacientes con pancreatitis crónica u otros tumores pancreáticos55. A la luz de los resultados expresados, se consideró que la PET/TC era solo más coste-efectiva para el subgrupo de pacientes con sospecha de CP que se consideraban erróneamente resecables55,56.
En conclusión, a pesar de algunos resultados prometedores, esta herramienta es costosa y de disponibilidad limitada. Por otro lado, su verdadera aplicabilidad en la práctica clínica diaria y su capacidad para medir actividad y decisiones terapéuticas requieren aún mayor estudio5,51. Por este motivo, las guías de consenso vigentes de ER-IgG4 advierten que su uso no puede ser estandarizado ni generalizado, y, por lo tanto, su utilidad debe ser evaluada en cada caso particular por los médicos tratantes5,51.
Respuesta terapéuticaNumerosos estudios han demostrado que la PAI responde al tratamiento con prednisona con recuperación casi completa, a excepción de casos muy avanzados donde la respuesta es parcial1-3,5. En pacientes con alta sospecha de PAI la respuesta terapéutica a glucocorticoides se considera un criterio diagnóstico HISORt (histología, imágenes, serología, otros órganos involucrados, respuesta al tratamiento)56. Generalmente existe remisión radiológica a las 2semanas de tratamiento óptimo (prednisona 40mg/día)56. En casos de alta sospecha de enfermedad inflamatoria se ha recomendado controlar la imagen en 8-12semanas para valorar la respuesta completa11,56. Sin embargo, cuando exista sospecha de malignidad, la ausencia de mejoría terapéutica a las 2semanas obliga a descartar formalmente esta etiología5. Los pacientes con CP pueden presentar un alivio transitorio de los síntomas durante el ensayo de esteroides debido a la reducción de la inflamación peritumoral56. Por este motivo la respuesta se evalúa con métodos de diagnóstico por imágenes buscando la resolución de la masa pancreática1-3,56.
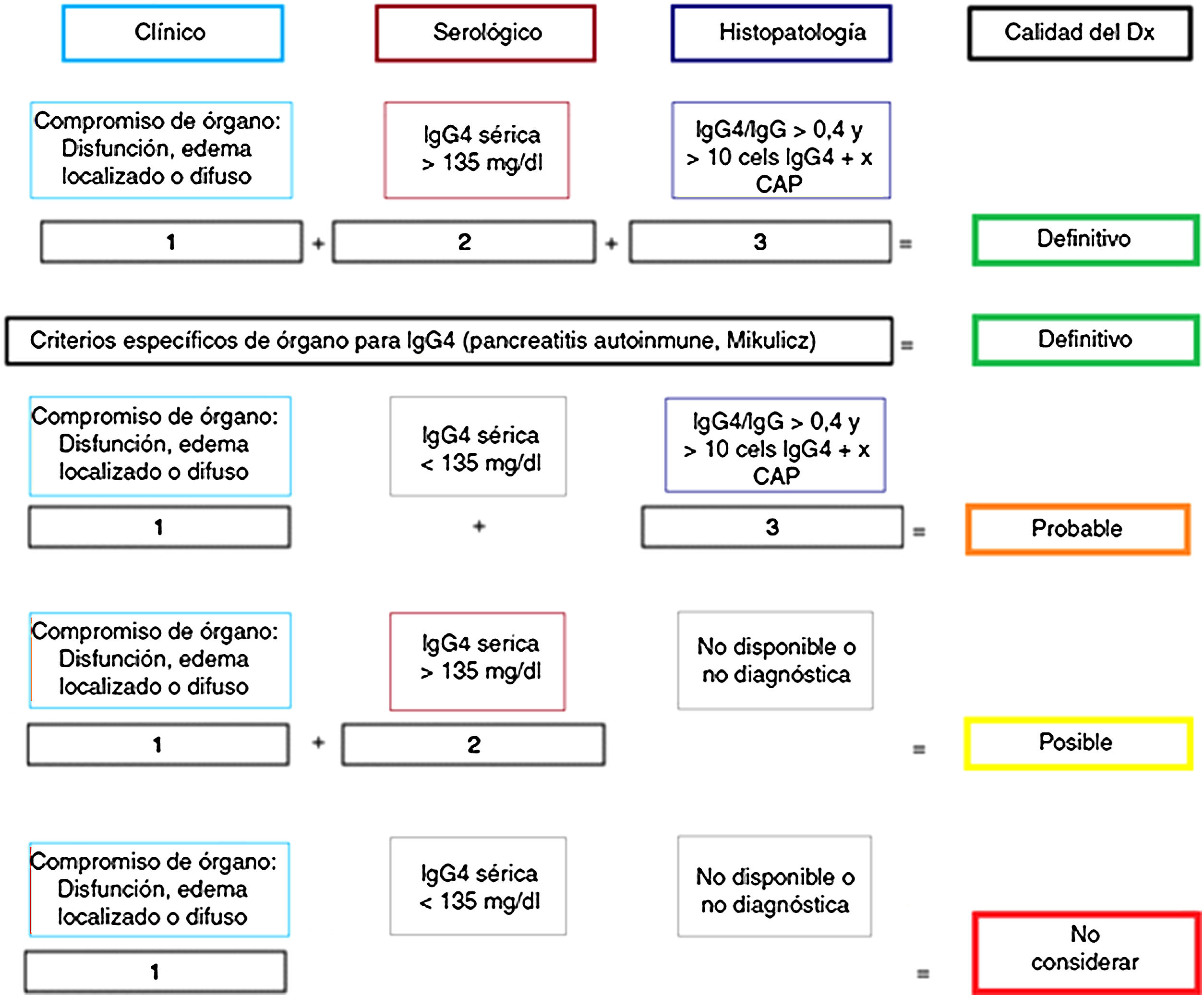
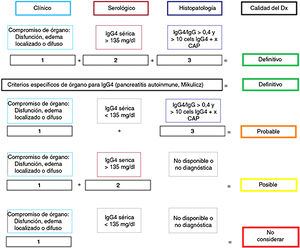
Anatomía patológicaImportancia del estudio histológicoAunque se han propuesto criterios «diagnósticos» para ER-IgG457,58 (fig. 1), tal como ocurre en otras enfermedades autoinmunes e inflamatorias, su mayor utilidad radica en clasificar pacientes para ensayos científicos y no reemplazan el juicio clínico5. La evaluación clínica, analítica y radiológica a menudo son insuficientes para distinguir entre ER-IgG4 y CP1,2,5,58. Por este motivo, las pautas del consenso internacional ER-IgG4 recomiendan fuertemente (acuerdo del 94% de expertos) realizar la confirmación histológica siempre que sea posible5,58.
Certeza del diagnóstico de ER-IgG4 según criterios diagnósticos de Umehara.
Adaptado de Ardila-Suarez et al.58.
También es preciso aclarar que la biopsia ofrece algunas dificultades, y que carece de valor intrínseco de certeza si no se correlaciona con los demás estudios5,29. El rendimiento del procedimiento depende de la calidad de la muestra, del sitio seleccionado, de la vía de obtención, del procesamiento y de la interpretación de los resultados4,29,58,59. El VPN de la biopsia en ER-IgG4 es más bajo que en CP6,58.
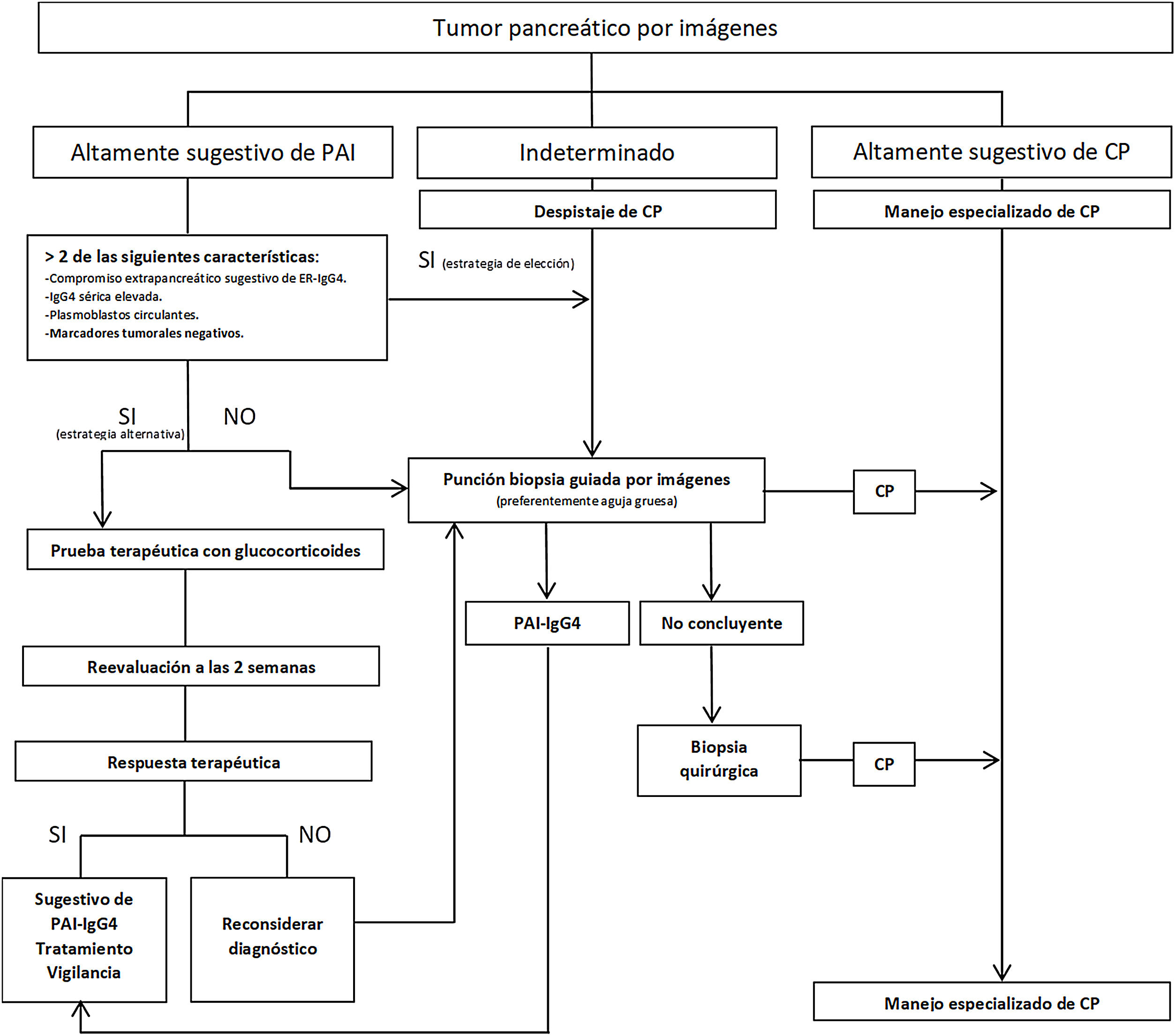
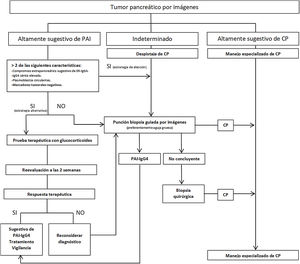
Se han propuesto estrategias para distinguir PAI-IgG4 del CP (fig. 2), estratificando a los pacientes en función de los hallazgos radiológicos en 3grupos: 1)imagen altamente sugestiva de PAI; 2)indeterminado (lesiones focales, multifocales, o difusas avanzadas con invasión peripancreática), y 3)imagen altamente sugestiva de CP59. Aunque la confirmación histológica es deseable en todos los escenarios, en pacientes del grupo1 que presenten riesgos y contraindicaciones absolutas, inaccesibilidad, o negativa del paciente a la biopsia, y que además tengan otros órganos afectados sugestivos de ER-IgG4 y/o niveles de IgG4 sérica elevados, y/o PB elevados y marcadores tumorales negativos (teniendo en cuenta las limitaciones de estos métodos), podría iniciarse terapia esteroidea (prednisona 40mg/día) y evaluar respuesta terapéutica con TC o CPR a las 2semanas. Si existiera respuesta, se puede considerar el diagnóstico de PAI con un seguimiento estrecho del paciente. Sin embargo, a pesar de poder diagnosticar PAI, no se podrá establecer un diagnóstico definitivo de ER-IgG4 si no se confirma histológicamente en páncreas u otro tejido. En los otros 2grupos se debe descartar malignidad con el estudio histológico e inmunohistoquímico1-6,29,57-59.
Obtención de la muestraLas características morfológicas más sugestivas de ER-IgG4 en el tejido pancreático requieren que la muestra preserve la arquitectura glandular4,29,58. Por este motivo no se sugiere realizar biopsias con aguja fina (PAAF) para diagnosticar ER-IgG45,58.
La estrategia de obtención de una biopsia pretratamiento (cirugía u oncológico) es cada vez más frecuente ante la sospecha de CP, principalmente si se trata de un paciente con una lesión avanzada o que requerirá neoadyuvancia6,9. En este caso la PAAF guiada por US o TC tiene una S del 80-90% y una E cercana al 100%59. Tiene las ventajas de ser una técnica de amplio uso (operadores más experimentados), más económica y no requiere sedación59,60.
La necesidad de una biopsia en un paciente con una lesión resecable de inicio permanece bajo discusión, ya que si la misma es negativa, no elimina la necesidad de una cirugía en un paciente con alta sospecha de CP y existiría un potencial riesgo de diseminación al peritoneo6,9. Se plantea que la PAAF guiada por USE transduodenal tiene una S del 90% y una E del 96%, y al no atravesar el peritoneo disminuiría el riesgo de diseminación60. Sin embargo, esta técnica obtiene predominantemente células aisladas, lo que dificulta el diagnóstico de tumores bien diferenciados o con marcada desmoplasia60. Por este motivo, siempre que anatómicamente sea posible, en centros con disponibilidad y experiencia se prefiere la biopsia de aguja gruesa (tru-cut) ecoendoscópica o percutánea, cuya tasa de complicaciones es muy similar a la de la biopsia por aguja fina (alrededor del 2%) y tiene la ventaja de requerir menor número de punciones durante el procedimiento6,9,59,60.
Por otra parte, en PAI, la PAAF ha mostrado una S de 36% y una E del 33%, frente a la biopsia con aguja gruesa, que alcanzó en algunos estudios una S y una E del 100% cuando se tomó por USE de una lesión altamente sugestiva5,44,45,57,59. La biopsia tru-cut con aguja 19G puede realizarse también guiada por TC o US convencional5,44,45.
Surgen también dificultades cuando las muestras evidencian pancreatitis crónica inespecífica, debido a que estos cambios pueden corresponder a un área de la vecindad de un CP o PAI1-3,5,59. En estos casos, o en escenarios dudosos (evolución clínica atípica, ausencia de afectación de otros órganos, ausencia de halo periférico en la masa, morfología ductal inespecífica, niveles normales de IgG4, etc.) puede ser necesario repetir la punción u obtener biopsias quirúrgicas a través de videolaparoscopia exploradora, evitando una duodenopancreatectomía innecesaria si no existe clara sospecha de CP1,5,12,29,56,59. Las biopsias intraoperatorias por congelación pueden ser difíciles de interpretar debido a la intensa reacción desmoplásica que puede observarse a menudo en ER-IgG4, confundiendo el diagnóstico con CP1,4,12,29,57,59.
Hallazgos histológicos e inmunohistoquímicosLos hallazgos histológicos de PAI-IgG4 son: infiltrado linfoplasmocitario denso (S 100%, E 17%) con células plasmáticas positivas para IgG4, en un contexto de fibrosis con patrón estoriforme (S 31%, E 100%) y flebitis obliterante (S 54%, E 100%)1-5,57,58. Otros hallazgos posibles son: fibrosis no estoriforme (S 91%, E 82%), flebitis no obliterante e infiltrado leve a moderado de eosinófilos (S 43%, E 100%)4,57,58. Se requieren más de 10células plasmáticas IgG4+ por campo de alto poder (CAP) para muestras obtenidas por punción, y más de 50células IgG4+ CAP para muestras quirúrgicas4,57,58. Sin embargo, es importante tener en cuenta que la fase evolutiva de la enfermedad puede condicionar los resultados57. La enfermedad pancreática con fibrosis retroperitoneal significativa a menudo se diagnostica tardíamente y puede mostrar una fibrosis paucicelular57. Por este motivo algunos investigadores postulan que una relación de IgG4:IgG en células plasmáticas de más del 40% es altamente sugestiva cuando está respaldada por características clínicas e imagenológicas4,29,57,58.
La mera presencia de células IgG4+ en otros tejidos sin los hallazgos histológicos compatibles tampoco es suficiente para el diagnóstico, ya que puede observarse en otras patologías: diverticulitis, vasculitis ANCA, enfermedad de Castleman multicéntrica4,58. El CP también puede ser infiltrado por células plasmáticas IgG4+ en diversos grados, y este fenómeno también se puede observar en otras neoplasias y en los ganglios linfáticos regionales4,29,57. En estos casos la infiltración suele ser parcheada y no está asociada con otras características histológicas de ER-IgG41-4. La discusión sobre si los casos informados como CP sincrónico y ER-IgG4 representan una asociación verdadera, si los hallazgos de células IgG4+ en las zonas vecinas al CP son un epifenómeno, o si la asociación es mera coincidencia, permanece incierta1-5,29,58. Por lo tanto, en los casos dudosos es apropiado obtener más tejido. Si al menos dos de las tres características básicas de ER-IgG4 están presentes junto al aumento significativo en células IgG4+ o IgG4/IgG >40%, el diagnóstico de ER-IgG4 puede ser realizado1-4,29. Si no se cumplen esas condiciones, el diagnóstico es probable y necesita evidencia adicional, como IgG4 sérica elevada, PB, hallazgos radiológicos y/o afectación sistémica29.
En CP las células neoplásicas suelen formar glándulas e infiltran la fibrosis estromal densa (adenocarcinomas ductales), y por ese motivo se denominan tumores escirros o desmoplásicos6,9. Cuando la fibrosis es extensa y se realiza PAAF, se suelen requerir numerosas muestras para hallar células atípicas9.
Algunos subtipos de CP ductal son el carcinoma de células claras, el adenoescamoso, el indiferenciado o anaplásico y el mucinoso no-cístico6,9. Otras variantes que se presentan como masas sólidas son el acinar y el pseudopapilar-sólido (infrecuentes y de mejor pronóstico)6,9. Tienen tendencia a invadir tejidos vecinos, vasos sanguíneos y estructuras nerviosas9.
ConclusionesEl diagnóstico entre PAI en ER-IgG4 y CP requiere necesariamente un abordaje multidisciplinario que incluya la discusión de los hallazgos clínicos, serológicos, radiológicos e histológicos. Siempre que sea posible debe realizarse la confirmación histológica de estos procesos. Todos los esfuerzos deben destinarse a excluir malignidad, pero se sugiere adoptar estrategias de manejo que eviten resecciones quirúrgicas amplias en aquellos pacientes donde la sospecha de PAI y ER-IgG4 sea elevada.
FinanciaciónLos autores declaramos que no tenemos fuente de financiación.
Conflicto de interesesLos autores declaramos que no tenemos conflicto de intereses.