La presencia de síntomas digestivos asociados al síndrome de intestino irritable (SII) en pacientes con enfermedad inflamatoria intestinal (EII) en remisión es un tema de interés creciente. Si bien existe una heterogeneidad de los estudios clínicos en relación con el uso de criterios de remisión de la EII y del diagnóstico de SII, los datos disponibles indican que la superposición EII-SII afectaría hasta un tercio de los pacientes en remisión, y coinciden en el hallazgo de un impacto negativo en la salud mental y calidad de vida de los individuos que la padecen. Las bases fisiopatológicas que explicarían esta potencial superposición no están completamente dilucidadas, sin embargo, la alteración en el eje cerebro-intestino asociada al aumento en la permeabilidad intestinal, la activación neuroinmune y la disbiosis serían fenómenos comunes a ambas condiciones. La hipótesis de una nueva entidad clínica o síndrome de «enfermedad inflamatoria intestinal irritable» o «SII postinflamatorio» con un perfil de microinflamación distintivo del SII, es motivo de intensa investigación. El reto clínico supone certificar la remisión de la actividad de la EII y descartar otras causas no inflamatorias de síntomas digestivos funcionales persistentes potencialmente tratables. En el caso de síntomas asociados a SII, a falta de evidencia suficiente, se debe realizar un control integral y personalizado del cuadro clínico (medidas dietéticas, farmacológicas y psicoterapéuticas), similar a un SII genuino.
The presence of digestive symptoms associated with irritable bowel syndrome (IBS) in patients with inflammatory bowel disease (IBD) in remission is a topic of growing interest. Although there is heterogeneity in clinical studies regarding the use of IBD remission criteria and the diagnosis of IBS, the available data indicate that the IBD-IBS overlap would affect up to one third of patients in remission, and they agree on the finding of a negative impact on the mental health and quality of life of the individuals who suffer from it. The pathophysiological bases that would explain this potential overlap are not completely elucidated; however, an alteration in the gut-brain axis associated with an increase in intestinal permeability, neuroimmune activation and dysbiosis would be common to both conditions. The hypothesis of a new clinical entity or syndrome of “Irritable Inflammatory Bowel Disease” or “Post-inflammatory IBS” is the subject of intense investigation. The clinical approach is based on certifying the remission of IBD activity and ruling out other non-inflammatory causes of potentially treatable persistent functional digestive symptoms. In the case of symptoms associated with IBS and in the absence of sufficient evidence, comprehensive and personalized management of the clinical picture (dietary, pharmacological and psychotherapeutic measures) should be carried out, similar to a genuine IBS.
La enfermedad inflamatoria intestinal (EII) y el síndrome de intestino irritable (SII) son enfermedades de carácter crónico que afectan el tubo digestivo, y que se presentan con actividad clínica fluctuante, compartiendo en parte su sintomatología clínica (dolor abdominal, hinchazón y diarrea). A pesar de estas sutiles similitudes, se diferencian profundamente en el grado de afectación y nivel de inflamación presente en la mucosa intestinal, evolución clínica y estrategias terapéuticas utilizadas en su manejo, entre otras1. Sin embargo, algunos estudios recientes han sugerido alteraciones fisiopatológicas que podrían ser similares en ambas condiciones. Entre ellas se encuentran las alteraciones del eje cerebro-intestino asociadas al aumento de la permeabilidad intestinal, activación neuroinmune y disbiosis2. El planteamiento de que el SII podría considerarse una manifestación incipiente o leve de la EII ha sido controvertido debido a la falta de evidencia que demuestre esta secuencia, sin embargo, la coexistencia de EII-SII en pacientes en remisión ha sido motivo de interés clínico y científico por las dificultades que representa establecer su diagnóstico1,2. El objetivo de este artículo es entregar una revisión de la evidencia disponible sobre la relación entre EII y SII que permita explicar la existencia de síntomas digestivos persistentes en un subgrupo de pacientes con EII en remisión.
Generalidades de la enfermedad inflamatoria intestinal y el síndrome de intestino irritable. Haciendo un contrapuntoLa EII con sus principales exponentes, la colitis ulcerosa (CU) y la enfermedad de Crohn (EC), se caracteriza por períodos de actividad clínica (brotes) y remisión de la enfermedad, pudiendo acompañarse además de manifestaciones extraintestinales3. Su prevalencia e incidencia aumentan con la industrialización de los países y la vida urbana, siendo mayor en países occidentales. Su máxima incidencia se encuentra entre los 20 y 30 años, sin diferencias significativas por sexo4. El diagnóstico se establece con el conjunto de elementos clínicos (dolor abdominal, diarrea, rectorragia), estudios endoscópicos, histológicos y/o radiológicos que evidencian inflamación a nivel intestinal3. En su fisiopatología, desarrollo y evolución destacan la interacción de factores genéticos, microbiota intestinal, respuesta inmune y factores ambientales3.
El SII, por su parte, es un trastorno digestivo frecuente a nivel global, tanto en el mundo urbano como rural, alcanzado una prevalencia del 12,8% al 15% en la población general, siendo más frecuente en mujeres, con mayor presentación entre los 30 y 50 años5. Sus criterios diagnósticos, basados en el consenso Roma IV, se establecen con la presencia de dolor abdominal y alteraciones en el hábito defecatorio6. Similar a la EII, la fisiopatología del SII es compleja y multifactorial involucrando factores ambientales y psicosociales que conducen a alteraciones de la motilidad gastrointestinal, hiperalgesia visceral, aumento de la permeabilidad intestinal, activación inmune y alteración de la microbiota, lo que refleja una comunicación alterada del eje cerebro-intestino7. Es necesario destacar que, a diferencia de la EII, el factor genético no ha sido completamente establecido3. En contrapunto con la EII, los resultados de las pruebas de rutina clínica, de laboratorio, endoscópicas y radiológicas evidencian ausencia de inflamación intestinal6. Sin embargo, a través de técnicas analíticas de investigación en laboratorio se han descrito en subgrupos de pacientes con SII hallazgos asociados a una microinflamación en la mucosa intestinal y plasma, con evidencia de hiperplasia y activación de células inmunes (aumento de mastocitos, eosinófilos, células T y células plasmáticas) tanto en biopsias de intestino delgado como colónicas, así como la elevación de citoquinas proinflamatorias a nivel sistémico8. Este estado de microinflamación, también llamado por algunos autores «activación inmune de bajo grado», sugiere la posibilidad de que esta entidad corresponda a una forma leve o inicial de EII, hipótesis controvertida si consideramos la evidencia actual que indica que la evolución natural del SII no conduce al desarrollo de una EII6. Sin embargo, la existencia de síntomas digestivos persistentes, ya sea aislados o asociados, es frecuente en el curso de la EII inactiva. Se ha descrito que hasta un tercio de los pacientes con EII en remisión presentan síntomas tipo SII9, siendo incluso su prevalencia mayor a la descrita en la población general9–17, y mayor para EC que para CU11,18,19. Esta discutible relación entre los síntomas de SII en pacientes con EII en remisión nos induce a preguntarnos si el SII es una condición preexistente o de novo desencadenada por altos niveles de estrés psicosocial en pacientes con EII, o simplemente son cuadros independientes que coexisten por coincidencia, considerando la alta prevalencia de SII en la población general, o si su aparición es consecuencia de una secuela postinflamatoria de la mucosa que condujo a cambios microestructurales y funcionales crónicos, o si estos síntomas corresponden a una mínima actividad de la EII no detectada por métodos convencionales. Las respuestas a estos interrogantes aún no están clarificadas.
Evidencia en desarrollo. Estudios de superposición enfermedad inflamatoria intestinal-síndrome de intestino irritableEl primer dato sobre SII post-EII fue descrito por Isgar et al. en 1983, quienes estudiaron a 98 pacientes con CU en remisión clínica y endoscópica, reportando que el 33% de tenía síntomas tipo SII según criterios de Manning9. Estudios posteriores han mostrado resultados de superposición similares12,13,16,17, y otros documentaron menores prevalencias de síntomas de SII en EII, en el rango de 16,3% a 27%14,18–20. En esta línea, un metaanálisis que incluyó 13 estudios con 1.703 pacientes con EII, demostró que síntomas del tipo SII estuvieron presentes en el 35% de los pacientes con EII en remisión (OR 4,39 para SII), siendo más frecuente en EC (46%) vs. CU (36%) (OR 1,62)11. Por su parte, Simren et al. no observaron una relación entre la presencia o ausencia de síntomas tipo SII en EII que se asociara con la edad, el uso de tratamiento crónico para la EII y la extensión de la enfermedad, tanto en CU como en la EC; sin embargo, constataron que la duración de la EII fue más prolongada en el grupo con síntomas de SII que en aquellos sin síntomas asociados (22 vs. 18 años, p=0,06)10. En concordancia con este hallazgo, un estudio de una cohorte de pacientes con CU reportó que los síntomas tipo SII fueron más frecuentes después de 20 años de evolución de la enfermedad15. Estos últimos datos si bien son limitados, sugerirían que la inflamación sostenida en el tiempo y el daño estructural producto de la fibrosis pueden llevar a cambios en el funcionamiento del intestino en un subgrupo de pacientes con EII21,22.
Dificultades en los criterios diagnósticos de superposición enfermedad inflamatoria intestinal-síndome de intestino irritableUno de los principales problemas en establecer la coexistencia de SII con EII es la heterogeneidad entre los diseños de los estudios respecto a los criterios seleccionados por los autores para definir remisión de la EII y el diagnóstico de SII (criterios de Manning, Roma I, II, III o recientemente IV)6. En relación con la remisión de la EII, mientras algunos investigadores se basan en criterios clínicos17, otros utilizan criterios de remisión endoscópica y/o histológica13,16. Otros autores utilizan biomarcadores no invasivos, como la calprotectina fecal (CF) para definir remisión, aunque con diferentes puntos de corte12,19. A continuación se discuten algunas de estas variables:
Uso de índices clínicos o encuestas de síntomas: se ha demostrado la falta de correlación entre los síntomas y la actividad de la EII23. Es así como un estudio reportó que el 27% de pacientes con CU en remisión endoscópica e histológica mantenían una alteración en la frecuencia de deposiciones24. Desde el punto de vista clínico, la reducida variedad sintomática que ofrece el tubo digestivo puede hacer difícil la diferenciación de un brote de EII de un cuadro de SII, lo que puede traer como consecuencia errores en su control o tratamiento, aumento de la morbilidad por reacciones adversas por sobretratamiento, deterioro de la calidad de vida y aumento de los costes en salud.
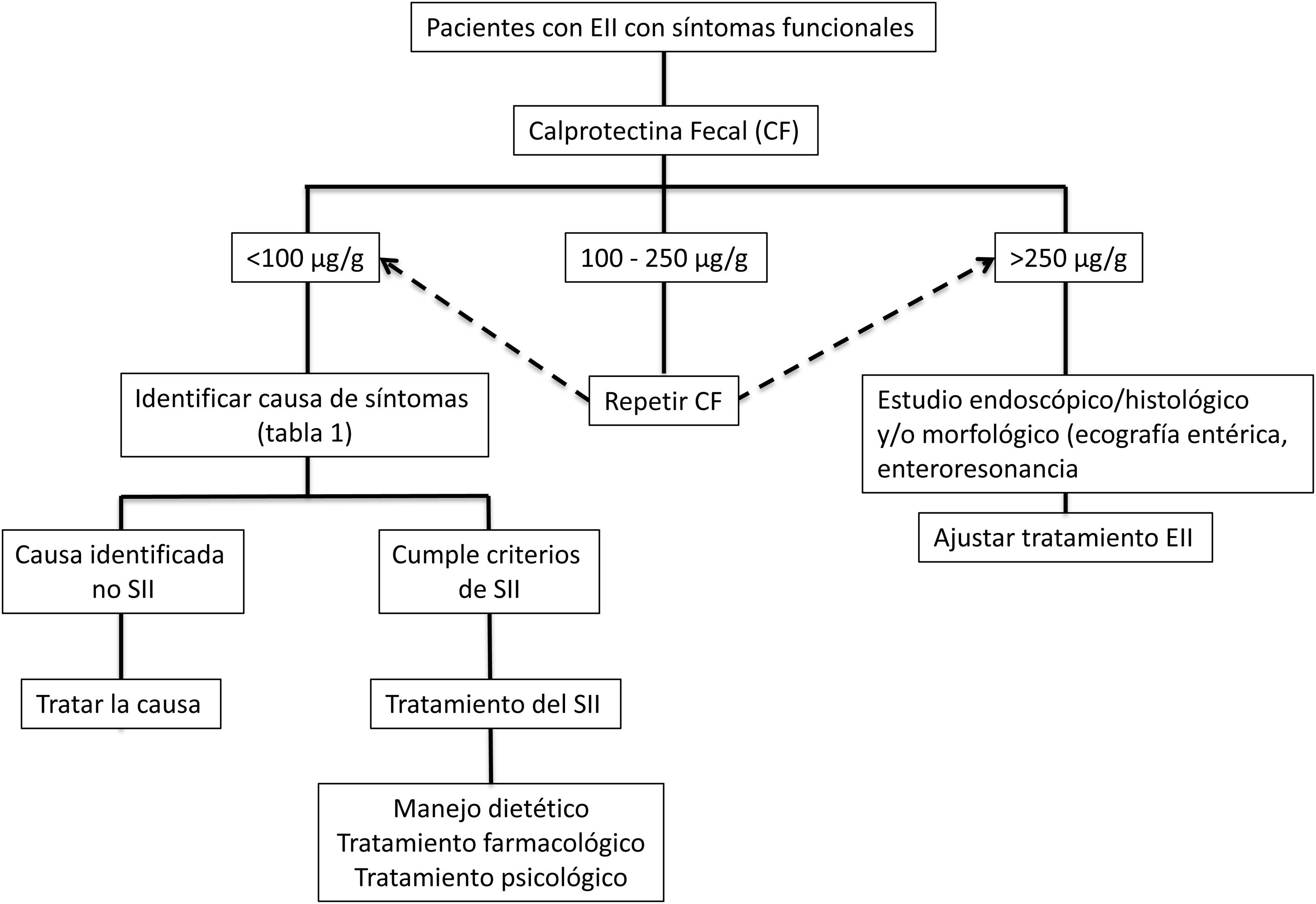
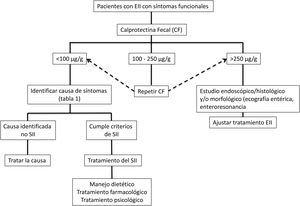
Uso de biomarcadores: La CF, un biomarcador de actividad inflamatoria intestinal, ha sido ampliamente utilizado para el diagnóstico diferencial de EII con enfermedades funcionales como el SII, y para evaluar la respuesta al tratamiento y el seguimiento de la EII25. La CF tiene una buena correlación con la actividad endoscópica, con una sensibilidad de 88% y especificidad del 73%, con mejor rendimiento para CU que EC26,27. Si bien el valor de referencia normal para diferenciar enfermedad inflamatoria de funcional en población general es<50μg/g28,29, en pacientes con EII...un metaanálisis que incluyó 13 estudios encontró que un valor de CF 250μg/g pudo discriminar entre pacientes endoscópicamente activos de inactivos con una sensibilidad combinada del 80% y una especificidad del 82%30. Este límite de corte ha sido replanteado en virtud de una nueva evidencia y mayores exigencias en la definición de remisión; es así como en relación con la búsqueda de remisión histológica un estudio prospectivo en pacientes con CU mostró que un valor de CF<40,5μg/g predijo remisión histológica (área bajo la curva de 0,755; sensibilidad de 41% y especificidad del 100%)31. Actualmente, un valor de CF <100μg/g es considerado parte de los objetivos de tratamiento de la EII por su capacidad de predecir una baja actividad inflamatoria en CU, permitiendo sustituir incluso la evaluación endoscópica32,33.
Los estudios que utilizan CF para evaluar sobreposición son heterogéneos y usan diferentes gold standard en las definiciones de remisión. Algunos de estos estudios han utilizado valores de CF<250μg/g para considerar pacientes en remisión23,34, lo que podría erróneamente incluir a un grupo de pacientes con inflamación subclínica e histológica y sobreestimar la prevalencia de SII. Es entonces razonable considerar que valores de CF<50μg/g, e incluso CF<100μg/g33, podrían descartar inflamación subclínica como causa de síntomas funcionales persistentes en pacientes con EII en remisión, y valores de CF entre 100 y 250μg/g deberían requerir mayor atención, ya que podrían reflejar una necesidad de optimizar el tratamiento de la EII, y con ello provocar alivio sintomático. Por otra parte, tampoco se ha demostrado una elevación de CF en pacientes con EII en remisión con síntomas de SII12,18. De hecho, Jonefjall et al. no encontraron diferencias en los niveles de CF entre aquellos pacientes con EII en remisión profunda con y sin síntomas tipo SII (18μg/g vs. 31μg/g, p=0,11), pero sí detectaron mayores niveles de citoquinas inflamatorias18. Esto sugiere que niveles de CF<50μg/g no serían útiles para discriminar inflamación oculta («microinflamación») que permitan sugerir la presencia de un SII.
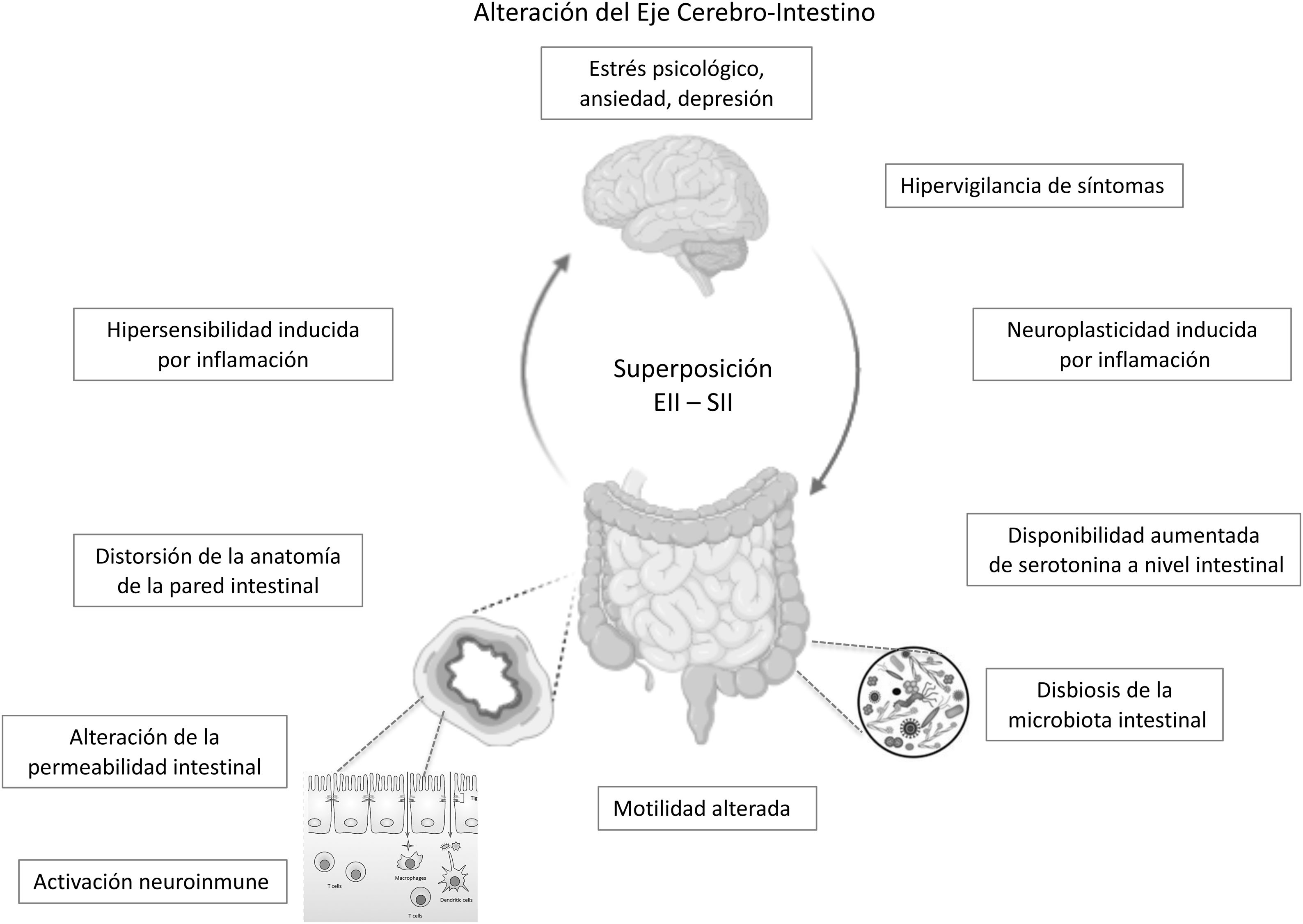
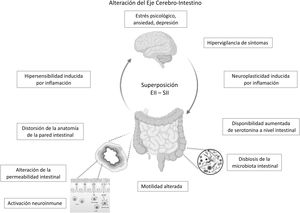
En el caso de pacientes en remisión endoscópica, un estudio en 103 pacientes con CU mostró que la presencia de actividad histológica no explicaría necesariamente la persistencia de síntomas funcionales en estos, y los valores de biomarcadores como CF y citoquinas inflamatorias no difirieron entre aquellos con o sin actividad histológica24. Al parecer, cambios mucho más profundos a nivel de la estructura y función de la barrera intestinal secundarios a la inflamación crónica no detectables por estudios convencionales podrían explicar estos síntomas tipo SII. Una alteración a nivel del eje cerebro-intestino sería un modelo propuesto por algunos autores para explicar la superposición EII-SII: trastornos orgánicos presentes en la EII tales como alteraciones en la microbiota intestinal y en la permeabilidad de la mucosa con subsecuente translocación de macromoléculas, bacterias y células inflamatorias promoverían el desarrollo de hipersensibilidad visceral que, combinado con factores centrales, tales como ansiedad e hipervigilancia, producirían síntomas tipo SII en un subgrupo de pacientes con EII en remisión35.
A continuación revisaremos algunos aspectos fisiopatológicos que buscan dilucidar la posible interacción entre estas dos enfermedades.
Aspectos fisiopatológicos de la interacción enfermedad inflamatoria intestinal-síndrome de intestino irritableDesde el punto de vista fisiopatológico, el cuadro que más se acerca a la superposición de SII con EII es el SII post-infeccioso (SII-PI). Este se caracteriza por la aparición de síntomas de SII posterior a un cuadro de gastroenteritis aguda infecciosa en individuos previamente asintomáticos36. Se postula que la adquisición de una infección aguda del tracto intestinal generaría un estado inflamatorio crónico en un sujeto con factores de riesgo conocidos (sexo femenino, edad avanzada, comorbilidad psicológica —hipocondriasis, depresión, neuroticismo, estrés, eventos de vida adversos— y tabaquismo) y que puede permanecer incluso tras la erradicación del agente infeccioso36. Se ha observado que la mucosa colorrectal de pacientes con SII-PI presenta una mayor infiltración de macrófagos, mastocitos y linfocitos intraepiteliales por aumento de la permeabilidad intestinal en un sujeto genéticamente predispuesto, incapaz de resolver completamente la inflamación aguda37. Este cuadro clínico nos vislumbra algunas luces del efecto que podría ejercer en el tiempo un daño inflamatorio en la mucosa intestinal de pacientes con EII en remisión con cierto perfil de riesgo para el desarrollo de síntomas funcionales.
Rol de la inflamación y perfil de citoquinas en enfermedad inflamatoria intestinal-síndrome de intestino irritableEn la patogenia de la EII se ha descrito un aumento en la expresión de citoquinas proinflamatorias, que son claves en el inicio y evolución de la enfermedad. Algunas de estas son las interleucinas (IL)-1, IL-6, IL-8 y TNF-α4. En relación con el SII, los resultados son contradictorios38, sin embargo, en subgrupos de pacientes se ha descrito una tendencia a la elevación de citoquinas proinflamatorias en plasma, principalmente de IL-6, IL-8 y TNF-α39,40.
En relación con la interacción SII-EII, se ha postulado que la presencia de una microinflamación persistente en la EII en remisión contribuiría a las alteraciones en la permeabilidad de la barrera epitelial intestinal de manera similar a lo observado en pacientes con SII41. Un estudio que incluyó 298 pacientes con CU, encontró que 24 pacientes en remisión profunda con síntomas asociados a SII, tenían niveles significativamente mayores de algunas citoquinas séricas (IL-1b, IL-6, IL-13, IL-10 e IL-8) en comparación con pacientes con CU asintomáticos en remisión, además de mayores niveles de ansiedad, depresión y percepción del estrés18. Sin embargo, en un reciente estudio que caracterizó el perfil de proteínas inflamatorias sistémicas, se observó perfiles distintivos en pacientes con CU y SII, independiente de la inflamación de la CU o la presencia de síntomas tipo SII de aquellos con CU en remisión, lo que sugiere que los mecanismos inflamatorios de estas enfermedades serían diferentes42.
Rol de la inflamación y disrupción de la barrera epitelial, mastocitos y eosinófilosLa disrupción de la barrera epitelial intestinal ha sido descrita tanto en pacientes con EII43 como con SII44,45. Vivinus-Nebot et al. demostraron un aumento en la permeabilidad paracelular usando cámara Ussing, y disminución en la expresión del mRNA de proteínas de unión estrecha (zónula occludens-1, α-catenina y ocludina) en biopsias cecales de pacientes con EII en remisión con síntomas tipo SII, y en pacientes con SII en comparación con aquellos EII en remisión sin síntomas (p<0,01), y controles (p<0,01). Además, un aumento significativo de los linfocitos intraepiteliales y expresión de TNF-α fue documentado en biopsias...de pacientes... con EII y síntomas tipo SII, hallazgos no observados en biopsias de pacientes con SII13. Según esto, ¿es acaso entonces la superposición de síntomas de SII en EII un cuadro distinto a la SII clásica?. Sin duda se necesitan mayores estudios para confirmar estos resultados. Posteriormente, un estudio prospectivo en el que se evaluó la permeabilidad de la mucosa intestinal mediante endomicroscopía confocal láser (cuantificado por Confocal Leak Score [CLS]) en pacientes con EII en remisión endoscópica, se observó un score más alto de CLS (indicativo de mayor permeabilidad) en sintomáticos (diarrea, dolor abdominal) que en asintomáticos (p<0,001) y controles (p<0,001), correlacionado con una mayor gravedad de la diarrea. De modo interesante, en este estudio la permeabilidad intestinal fue similar para controles y EII inactiva asintomática, sin embargo, la ausencia de un grupo control con SII podría limitar la validez de estas observaciones20. En esta línea, Katinios et al. observaron una mayor permeabilidad paracelular del epitelio intestinal en biopsias colónicas de pacientes con CU inactiva (remisión clínica-endoscópica) y en pacientes con SII subtipo mixto, en comparación con sujetos controles (p<0,05), siendo esta mayor para CU. Estos resultados se correlacionaron significativamente con el número de eosinófilos en el tejido, siendo esta correlación mayor para CU que para SII (p<0,05)41. Cabe destacar que, en este estudio, los pacientes con CU habían sido recientemente tratados por recaída dentro del año, lo que podría explicar la existencia de una mayor permeabilidad del epitelio intestinal a pesar de la remisión, diferente a lo reportado previamente en CU en remisión prolongada20,46. Sin embargo, los autores sugieren que el aumento de la permeabilidad paracelular sería una característica fisiopatológica típica para ambas enfermedades41.
El mastocito es una célula inmune que ha sido involucrada en la regulación de la permeabilidad intestinal tanto en EII47 como en SII48. Se ha descrito una interacción cercana entre los eosinófilos y mastocitos en EII que podría estar asociado a una disrupción de la barrera intestinal y al aumento de la permeabilidad41. Recientemente, un estudio que incluyó 35 pacientes con EII (15CU y 20EC) en remisión profunda con síntomas de SII, reportó un aumento en el número de eosinófilos en la mucosa colónica en comparación con pacientes en remisión sin síntomas de SII (promedio 421eo/mm2 en CU, 397eo/mm2 en EC vs. 36eo/mm2 en controles) y, que al ser tratados con dieta hipoalergénica (eliminación de 5 alimentos) y budesonida oral, se observó disminución del número de eosinófilos asociado a respuesta clínica favorable en el 67% de los pacientes a los 7-10días49. Los autores plantean qué alimentos alergénicos podrían desencadenar una respuesta inmune en una mucosa previamente alterada, y esto explicar los síntomas presentes en pacientes con EII en remisión. A pesar de lo sugerente de estos resultados deben ser tomados con cautela, ya que no coinciden con lo reportado en estudios previos en pacientes con EII activos, en los que se describió un aumento mucho menor en el número de eosinófilos50,51, pudiendo solo reflejar una respuesta aumentada de eosinófilos en un subgrupo de pacientes con EII.
Hipersensibilidad visceral inducida por inflamaciónEl receptor de potencial transitorio vaniloide tipo 1 (TRPV1) es expresado en neuronas aferentes primarias que sensan el estímulo doloroso, y sus niveles de expresión se han relacionado con la hipersensibilidad visceral descrita en algunos trastornos gastrointestinales52,53. Similar a lo visto en un pequeño grupo de pacientes con SII54, el mismo autor, en un estudio en biopsias colónicas de 20 pacientes con EII quiescente (remisión profunda) con síntomas tipo SII, encontró un incremento de 3,9 veces de fibras nerviosas inmunorreactivas de TRPV1 en comparación con controles, y 5 veces más que en pacientes con EII quiescente asintomáticos, lo que se correlacionó con la severidad del dolor abdominal55. Dado el escaso número de pacientes en estos estudios, es aún prematuro asegurar un rol a la hipersensibilidad visceral mediada por TRPV1 en la fisiopatología del dolor en la EII en remisión. Su confirmación podría dirigir a un potencial blanco terapéutico.
Alteraciones de la motilidad intestinalLos estudios de motilidad colónica en pacientes con EII son limitados y con resultados dispares debido a que se han realizado en un pequeño número de pacientes, estudios in vivo vs. in vitro, CU vs. EC, con diferentes estados de la enfermedad (EII activa vs. inactiva, extensión de la enfermedad y tiempo de evolución) y diferentes técnicas diagnósticas. En vista de estas consideraciones algunos estudios han evidenciado alteraciones en la motilidad colónica en subgrupos de pacientes con CU y EC56. Un mecanismo postulado es que la inflamación crónica produciría cambios en la interacción neuronal del sistema nervioso entérico, que podría persistir en el tiempo después de resolverse el daño inflamatorio. Esto es lo que se conoce como «neuroplasticidad inducida por inflamación», y considera la hiperexcitabilidad de las neuronas aferentes, la facilitación sináptica y la atenuación de la transmisión inhibitoria neuromuscular57. Otras alteraciones descritas en pequeños grupos de pacientes con EII, y que serían inducidas por inflamación crónica son los cambios de la conductabilidad iónica en el músculo liso58, la respuesta a neurotransmisores y la mayor disponibilidad de serotonina en las regiones inflamadas secundario a cambios en la señalización de la mucosa intestinal59. Se postula que la distorsión de la anatomía de la pared intestinal que incluye atrofia de la mucosa, cambios musculares (displasia fibromuscular de la muscular de la mucosa y muscular propia) y desarrollo de fibrosis, tanto en EC como en CU, conduciría a rigidez de la pared intestinal, dismotilidad colónica y disfunción anorrectal56. Sin embargo, otros autores no han logrado demostrar dismotilidad colónica en pacientes con EII60.
Sin duda, la teoría de que la neuroplasticidad inducida por inflamación, el desarrollo de fibrosis y dismotilidad secundaria podría explicar en parte la presencia de síntomas funcionales persistentes en pacientes con EII en remisión, es del todo provocadora pero, frente a la limitada evidencia y resultados controvertidos, esto no puede extrapolarse a toda la población de pacientes con EII.
Rol de la microbiota intestinal en enfermedad inflamatoria intestinal-síndrome de intestino irritableEl papel que desempeña la microbiota intestinal en la patogénesis del SII y de la EII es conocido. Pacientes con EII muestran una disbiosis que se caracteriza por una disminución de la diversidad de la microbiota (descenso de Firmicutes), una reducción de bacterias productoras de ácidos grasos de cadena corta (Clostridium cluster iv, XIVa, XVII y Faecalibacterium prausnitzii), y un aumento de bacterias mucolíticas (Ruminococcus gnavas y Ruminococcus torques), bacterias reductoras de sulfato (Desulfovibrio) y bacterias patogénicas (E. coli adhesiva/invasiva)61. En el SII, por su parte, existe una sólida evidencia de estas alteraciones en la composición y densidad microbiana, donde se ha descrito una abundancia relativa de especies de bacterias proinflamatorias (Enterobacteriaceae), con una reducción en Lactobacillus y Bifidobacterium, además de cambios en la relación Firmicutes/Bacteroidetes en comparación con controles sanos62.
Un estudio que analizó la composición de la microbiota fecal mediante la determinación de rRNA 16S, reveló que la presencia de síntomas tipo SII en pacientes con EII en remisión (definido por CF<250μg/g) no se asoció a alteraciones distintivas relacionadas con la abundancia de la taxa bacteriana individual o en la diversidad bacteriana global respecto a pacientes con EII en remisión asintomáticos, EII activa y EII con inflamación oculta (EII asintomáticos con CF>250μg/g). Sin embargo, este estudio no consideró controles sanos y sujetos con SII para comparación34. Recientemente, Boland et al., tras analizar biopsias de pacientes con EC y controles, reportaron que, a pesar de la evidencia de remisión, la diversidad fue más baja en la microbiota intestinal en EC que en controles, además de encontrar una reducida diversidad Chao1 (p=0,01) y mayor tendencia a una disbiosis en la microbiota intestinal de pacientes con síntomas residuales (p=0,059), infiriendo que la composición de esta podría estar asociada con la diarrea persistente63.
Aspectos psicológicos y calidad de vidaLos factores psicosociales están fuertemente implicados en de la fisiopatología del SII y constituye uno de los componentes de la interacción del eje cerebro-intestino. La comorbilidad psiquiátrica es común en el SII, con prevalencias de síntomas de ansiedad y trastorno de ansiedad de 39,1% y 23%, respectivamente, y de síntomas de depresión y trastorno depresivo de 28,8% y 23,3%64. De manera similar, la depresión afecta a más del 25% de los pacientes con EII, y la ansiedad a más del 30%, siendo mayor en activos que en inactivos65 y 2 a 3 veces mayor que en la población general66, contribuyendo al deterioro en la calidad de vida de los pacientes. La influencia del estrés psicosocial en la actividad inflamatoria de la EII es motivo de discusión67, sin embargo nueva evidencia ha descrito un posible rol de los eventos estresantes como desencadenantes de los brotes de la EII68.
Similar a lo reportado por otros autores12 en estudios de superposición EII-SII e impacto psicológico, Perera et al. describieron mayores niveles de ansiedad y depresión en pacientes con EII en remisión con síntomas de SII en comparación a aquellos sin síntomas16. Además, un reciente estudio de 137 pacientes con EII mostró una puntuación en el IBDQ (calidad de vida en EII) significativamente menor en aquellos pacientes en remisión con síntomas tipo SII17. Otro estudio evidenció similares hallazgos, además de mayores niveles de depresión, ansiedad y somatización en pacientes con EII en remisión (CF<250μg/g) con síntomas tipo SII, manteniendo esta tendencia al usar valores de CF<100μg/g para definir remisión19. Apoyando estos datos, en un estudio transversal que incluyó 6.309 sujetos con EII, un 20% reportó tener el diagnóstico de SII asociado al de EII, encontrando en este grupo peores índices de calidad de vida (IBDQ), mayor asociación con ansiedad, depresión, fatiga, trastornos del sueño, interferencia del dolor y disminución de la satisfacción social en comparación con aquellos con SII69.
No está claro si mayores niveles de ansiedad y depresión son un factor de riesgo o una consecuencia de la presencia de síntomas de SII en pacientes con EII en remisión, sin embargo, el deterioro en la calidad de vida es significativo en este subgrupo de pacientes70.
El eje cerebro-intestino es el sustrato neuroanatómico de interacción bidireccional de las vías neuroendocrinas, el sistema nervioso central, el sistema nervioso periférico y el sistema nervioso autónomo con el tubo digestivo. Trastornos psicológicos y factores psicosociales influencian el funcionamiento del tracto digestivo generando síntomas, los que a su vez generan mayor distrés psicológico7,70,71. Si bien, este es uno de los pilares para la comprensión del SII, podría en parte explicar la sobreposición SII-EII en individuos predispuestos. Como se mencionó previamente, se desconoce si los trastornos psicológicos, altamente prevalentes en pacientes con EII en remisión con síntomas tipo SII son provocados por los síntomas digestivos persistentes o son un factor predisponente para su desarrollo. Algunos autores plantean que la presencia de síntomas de SII en EII en remisión podría corresponder a un síndrome distinto del SII clásico, ya que se presentaría en pacientes con una base inflamatoria. Parte... de la evidencia actual ha mostrado alteraciones en la permeabilidad intestinal y una activación inflamatoria leve, diferentes o no vistas en el SII genuino o en pacientes con EII en remisión asintomáticos. Estas alteraciones,..., basado en la interacción eje cerebro-intestino, podrían ser desencadenadas por distrés psicológico. Gajula et al. han propuesto llamar a este síndrome «enfermedad inflamatoria intestinal irritable»72. Sin duda se necesitan más estudios para clarificar y confirmar esta relación SII-EII a través de estudios prospectivos que permitan evaluar qué perfil de pacientes con EII tendrán mayor probabilidad de desarrollar un «SII postinflamatorio» (fig. 1).
A pesar de este enfoque, en vista de la limitada evidencia actual, parece hasta ahora más razonable y conciliador hablar de la «coexistencia» de ambas enfermedades (SII-EII) que podrían darse de forma independiente en el mismo sujeto, ya sea de manera sucesiva o simultánea, y cuyo manejo clínico debería responder al modelo biopsicosocial.
Enfoque clínicoFrente a pacientes con EII en remisión con síntomas tipo SII (alteración del hábito intestinal ya sea diarrea o estreñimiento, dolor abdominal, distensión-hinchazón) es necesario indagar sobre la presencia de síntomas y signos... de alarma como la bajada de peso, sangrado, anemia, fiebre o síntomas nocturnos. Además se debe interrogar sobre el consumo de antiinflamatorios no esteroideos, fármacos que alteren la motilidad intestinal o una... reciente infección gastrointestinal. Al examen físico se debe ser exhaustivo con la búsqueda de alteración de los signos vitales, masas abdominales, sensibilidad abdominal aumentada con signos de rebote, palidez de piel o mucosas, entre otros. Signos o síntomas de alarma obligarán a recurrir directamente a un estudio endoscópico y/o algún método de imágenes. Si este no es el caso, una aproximación inicial no invasiva para confirmar la remisión de la EII, es el uso de biomarcadores como CF (fig. 2)73. Si bien los valores límite de CF pueden variar entre EC y CU, se recomienda que, ante valores intermedios (esto es entre 100 y 250μg/g) se realice seguimiento a 3meses para confirmar su elevación como reflejo de actividad de la enfermedad, la que podría beneficiarse de intensificación de la terapia de la EII. Frente a valores bajos de CF (CF<100μg/g) es necesario considerar diagnósticos diferenciales que puedan explicar la presencia de síntomas digestivos que requerirán un estudio dirigido (tabla 1) antes de catalogar al paciente como un verdadero SII. Además, se debe realizar una pesquisa activa de distrés psicológico o eventos estresantes (uso de escalas validadas) que pueden estar influenciando los síntomas. Sin duda, debemos considerar otras complicaciones no inflamatorias propias de la EII como generador de síntomas como son la presencia de estenosis en EC o CU y fístulas, además de secuelas postoperatorias como la presencia de adherencias o bridas. El estudio de imágenes debe ser dirigido según los hallazgos clínicos y de laboratorio.
Diagnóstico diferencial de síntomas asociados a síndrome de intestino irritable en pacientes con enferemdad inflamatoria intestinal en remisión
| Condición | Método diagnóstico | Tratamiento |
|---|---|---|
| Intolerancia a hidratos de carbono | Test de aire espirado con lactosa o fructosa | Restricción dietariaLactasa |
| Sobrecrecimiento bacteriano intestinal | Test de aire espirado con lactulosa o glucosa | Antibiótico intestinal |
| Diarrea por sales biliares | Prueba de SeHCAT, ácidos biliares fecales | Secuestradores de sales biliares: colestiramina |
| Enfermedad celíaca | Serología para enfermedad celíaca | Dieta libre de gluten |
| Insuficiencia pancreáticaPancreatitis crónica autoinmune | Elastasa fecalImágenesRecuento IgG4 | Reemplazo de enzimas pancreáticas |
| Alteraciones anatómicasEstenosis, fístulas | Estudios radiológicos | Resolución endoscópica o quirúrgica |
SeHCAT: ácido tauroselcólico marcado con selenio 75.
Tabla adaptada de Colombel et al.73
Ante la falta de estudios prospectivos, aleatorizados, en caso de confirmarse una probable coexistencia de SII-EII, el tratamiento debe ser individualizado y dirigido a un control de la dieta, terapia psicológica y farmacológica según el predominio de los síntomas (analgésicos, antiespasmódicos, antidepresivos, probióticos, antidiarreicos y laxantes), similar a un SII clásico. Actualmente se encuentra en curso MODULATE, un estudio prospectivo de seguimiento a largo plazo que tiene como finalidad evaluar la efectividad de amitriptilina, ondansetrón, loperamida y dieta baja en FODMAP en pacientes con CU en remisión con síntomas tipo SII74. Recientemente, Cox et al. reportaron que 14/27 (52%) pacientes con EII en remisión mejoraron sus síntomas tipo SII después de 4 semanas de una dieta baja en FODMAP al compararlos con aquellos con dieta control (p=0,007), mejorando además las puntuaciones en calidad de vida y encontrando menor abundancia de Bifidobacterium adolescentis, B. longum y Faecalibacterium prausnitzii, sin lograr demostrar cambios en los marcadores de inflamación75. Estudios en esta línea y con mayor número de pacientes son necesarios para corroborar estos resultados.
ConclusiónLos síntomas tipo SII son frecuentes en pacientes con EII en remisión, lo que constituye un desafío clínico debido a la similitud de su sintomatología. Si bien son dos enfermedades diferentes que podrían coexistir en un mismo paciente, ya sea por una preexistencia de una sobre otra o presentarse de manera simultánea, es interesante considerar que sus mecanismos fisiopatológicos tienen algunas similitudes: la activación neuroinmune, las alteraciones de la permeabilidad de la pared intestinal y de la microbiota intestinal comunes a ambas podrían confluir en una alteración del eje cerebro intestino (fig. 1), con un perfil de microinflamación distinto al de un SII genuino o de una EII en remisión. Este nuevo concepto sindromático de «SII postinflamatorio» o «enfermedad inflamatoria intestinal irritable» es tentador, sin embargo, la evidencia científica es aún insuficiente para apoyar esta hipótesis. La confirmación de la remisión de la EII es clave para evitar errores diagnósticos y de manejo con eventos adversos asociados a la intensificación innecesaria de la terapia de la EII. El tratamiento de esta condición es empírico, y está basado en el cuerpo de evidencia disponible sobre el manejo biopsicosocial del SII, que podría mejorar significativamente la calidad de vida de estos pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores del Hospital Clínico Universidad de Chile agradecen el apoyo y asesoría del Proyecto FONDECYT 1181699 en el artículo.