Evaluar los resultados del trasplante hepático aislado y del trasplante combinado hepatorrenal en una serie retrospectiva de 32 pacientes con enfermedad poliquística hepatorrenal.
Materiales y métodosEstudio observacional retrospectivo en el que se incluyeron los pacientes con enfermedad poliquística hepática (EPH) y enfermedad poliquística hepatorrenal (EPHR), que fueron evaluados para trasplante desde enero de 1999 a diciembre de 2019 en el Hospital Clínic de Barcelona.
ResultadosSe incluyeron un total de 53 pacientes; 32 (60,3%) tenían indicación de trasplante, de los cuales 12 recibieron trasplante hepático único y 20 doble trasplante hepático y renal. La edad media fue de 52 años y el 83,9% de los receptores fueron mujeres. La principal indicación de trasplante hepático fue la hepatomegalia sintomática incapacitante (93,5%). Dentro de las complicaciones postoperatorias, en el grupo de trasplante hepatorrenal, se detectaron una trombosis arterial hepática y una trombosis arterial renal. En ambos grupos se produjo una lesión de vena cava superior. Tres pacientes presentaron rechazo celular agudo que respondió a corticosteroides y un rechazo humoral que se trató con plasmaféresis. Durante el periodo de seguimiento 80 (27-121) meses, la supervicencia del injerto fue de 100% para el hígado y de 90% para el injerto renal. Fallecieron dos pacientes con trasplante hepatorrenal (uno por causas cardiovasculares y el otro por un adenocarcinoma intestinal).
ConclusionesEl trasplante hepático aislado o combinado hepático y renal en pacientes seleccionados con enfermedad poliquística tiene unos resultados excelentes, con pocas complicaciones, muy buena sobrevida del injerto y excelente supervivencia del paciente (93,8%).
To evaluate the results of isolated liver and combined liver and kidney transplantation in a retrospective series of 32 patients with hepatorenal liver and kidney disease.
Materials and methodsA retrospective observational study that enrolled patients with polycystic liver disease (PLD) and polycystic liver and kidney disease (PLKD) who were evaluated for transplantation between January 1999 and December 2019 at Hospital Clínic de Barcelona [Clinical Hospital of Barcelona].
ResultsWe included a total of 53 patients enrolled, 32 (60.3%) had indication for transplantation, of which 12 received a single liver transplant and 20 received a double liver and kidney transplant. The mean age was 52 years and 83.9% of the recipients were women. The main indication for liver transplantation was disabling symptomatic hepatomegaly (93.5%). Among the postoperative complications, in the combined liver and kidney transplant group, hepatic artery thrombosis in one case and renal artery thrombosis in other were detected. In both groups there was one case of inferior vena cava lesion. Three patients presented acute cellular rejection responding to corticosteroids and one presented humoral rejection which was treated with plasmapheresis. During the follow-up period of 80 (27-121) months, the liver transplant survival rate was 100% and the kidney transplant survival rate was 90%. Two patients in the combined liver and kidney transplant group died (one due to cardiovascular causes and the other due to intestinal adenocarcinoma).
ConclusionsIsolated liver transplantation or combined liver and kidney transplantation in selected patients with polycystic disease yields excellent results, with few complications, very good transplant survival and excellent patient survival (93.8%).
La enfermedad poliquística del hígado es el resultado de anomalías estructurales que se producen durante el desarrollo embrionario del árbol biliar. Estas alteraciones se manifiestan en el adulto en forma de tres entidades: complejo de Von Meyenburg, enfermedad poliquística hepática aislada (EPH) y la enfermedad poliquística hepatorrenal (EPHR)1. La prevalencia de la enfermedad EPH es de 1/100.000 a 1/1.000.000, mientras que la EPHR tiene una tasa de presentación de acuerdo con el patrón de herencia: de 1/400 a 1/1.000 en la variante autosómica dominante (EPHR-AD), considerada la más frecuente, y de 1/40.000 en la variante autosómica recesiva (EPHR-AR)2,3. La incidencia del complejo de Von Meyenburg se ha estimado en 7-60/1.0004.
Las opciones de tratamiento son la aspiración del quiste y la inyección de agentes esclerosantes, fenestración laparoscópica, tratamiento médico con análogos de somatostatina y el trasplante hepático, que es considerado el único tratamiento curativo1. Datos del Registro Europeo de Trasplante Hepático muestran una supervivencia del injerto del 88% y una tasa de supervivencia del paciente del 92% a los cinco años5. El trasplante se reserva para aquellos pacientes con morbilidad significativa y refractaria a otros tratamientos. En el caso de la EPHR se requiere una disminución del filtrado glomerular por debajo de 40 mL/min, para indicar el doble trasplante hepático y renal6.
Los pacientes que llegan al trasplante hepático o hepatorrenal podrían tener un curso postoperatorio complejo como consecuencia de la resección y extracción de un hígado de gran tamaño, con distorsión de las estructuras vasculares. El objetivo de este estudio es presentar la experiencia de nuestro centro en el trasplante hepático durante 20 años en los pacientes con enfermedad poliquística, destacando la supervivencia y las complicaciones asociadas el mismo.
Material y métodosPacientesSe analizaron retrospectivamente las características de todos los pacientes con EPH y EPHR, que fueron evaluados como candidatos para trasplante hepático o hepatorrenal de 1999 a 2019 en la Unidad de Trasplante Hepático del Hospital Clínic de Barcelona. Se consideraron indicaciones de trasplante, la presencia complicaciones de la EPH como hepatomegalia sintomática incapacitante, hipertensión portal (ascitis, hemorragia por várices esofágicas), complicaciones de los quistes hepáticos sin tratamiento alternativo (sepsis de repetición, a pesar de tratamiento médico profiláctico, compresión de estructuras) y malnutrición. Las indicaciones de trasplante hepatorrenal fueron la presencia de enfermedad renal crónica con tasa de filtrado glomerular (TFG) < 40 mL/min y de EPH con los criterios antes mencionados.
La técnica quirúrgica habitual se modificó para contemplar la utilización de un bypass venovenoso de vena cava inferior (VCI), por la compresión de la misma y por la dificultad de la movilización hepática. En ausencia de hipertensión portal y de vías hepatofugales, también se realizó derivación venovenosa del territorio esplácnico, mediante la canulación de la vena porta tras su sección. De este modo, se evitó la congestión venosa que provocaría un clampaje prolongado de la vena cava inferior y de la vena porta, para completar la hepatectomía y durante la fase anhepática.
De acuerdo con nuestro protocolo de inmunosupresión, el tratamiento utilizado inicialmente se basó en un agente inductor (basiliximab), un inhibidor de calcineurina (tacrolimus o ciclosporina) y un inhibidor de proliferación (micofenolato), buscando niveles de inmunosupresión más altos en los pacientes de trasplante doble por el mayor riesgo inmunológico.
Se recogieron los siguientes datos: edad, sexo, complicaciones de la enfermedad poliquística y tratamientos previos al trasplante, tiempo quirúrgico, necesidades transfusionales, tiempo de hospitalización durante el trasplante, peso del explante, tasa de filtrado glomerular pre y postransplante, complicaciones clínicas y quirúrgicas, incluyendo rechazo hepático y renal durante el seguimiento, supervivencia del injerto y del paciente. Se recogieron intencionadamente las manifestaciones extrahepáticas, incluyendo la presencia de hipertensión arterial, los antecedentes familiares de EPHR y la presencia de aneurismas cerebrales en aquellos que contaban con un estudio de imagen.
Análisis estadísticoSe realizó un análisis estadístico descriptivo. Las variables categóricas se representaron mediante porcentajes y las variables cuantitativas mediante mediana y rango intercuartil (RIQ). El análisis estadístico se realizó utilizando el paquete estadístico SPSS 23 (paquete estadístico para software de ciencias sociales; SPSS Chicago, IL).
ResultadosDurante el periodo comprendido entre el año 1999 a 2019, 53 pacientes fueron evaluados en nuestro centro por EPH y EPHR (fig. 1A-B). De ellos, 32 (60,3%) pacientes tenían indicación de trasplante; 12 recibieron un trasplante hepático único y 20 recibieron un doble trasplante hepatorrenal. Tenían antecedentes familiares de EPHR 29 pacientes (54,7%). La mediana de edad en el momento del trasplante fue de 52 años y el 83,9% de los receptores fueron mujeres. La principal indicación de trasplante fue la hepatomegalia sintomática incapacitante (93,5%), seguida de la malnutrición (32,4%) y la hipertensión portal (28,1%). El peso promedio de los explantes hepáticos fue de 5.700 g.
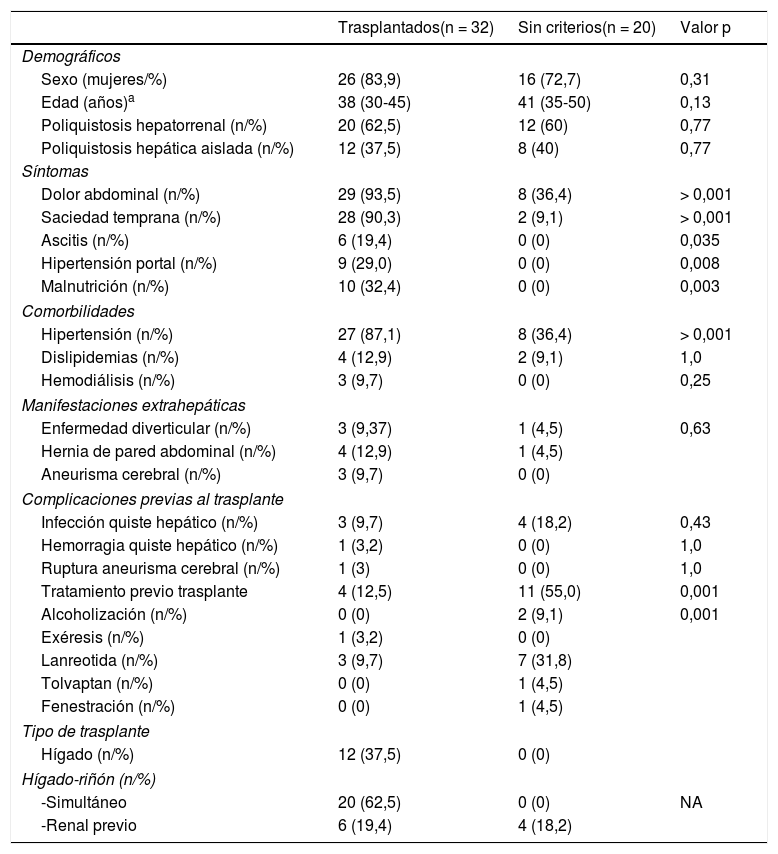
Las manifestaciones extrahepáticas en nuestra cohorte de pacientes evaluados fueron la hipertensión arterial (67,3%), la enfermedad diverticular (7,7%) y hernias de pared abdominal en 9,6% de los pacientes. La tabla 1 muestra la incidencia de estas manifestaciones, comparando pacientes con y sin indicación de trasplante. No existieron diferencias significativas entre ambos grupos de pacientes.
Características generales de los pacientes evaluados
| Trasplantados(n = 32) | Sin criterios(n = 20) | Valor p | |
|---|---|---|---|
| Demográficos | |||
| Sexo (mujeres/%) | 26 (83,9) | 16 (72,7) | 0,31 |
| Edad (años)a | 38 (30-45) | 41 (35-50) | 0,13 |
| Poliquistosis hepatorrenal (n/%) | 20 (62,5) | 12 (60) | 0,77 |
| Poliquistosis hepática aislada (n/%) | 12 (37,5) | 8 (40) | 0,77 |
| Síntomas | |||
| Dolor abdominal (n/%) | 29 (93,5) | 8 (36,4) | > 0,001 |
| Saciedad temprana (n/%) | 28 (90,3) | 2 (9,1) | > 0,001 |
| Ascitis (n/%) | 6 (19,4) | 0 (0) | 0,035 |
| Hipertensión portal (n/%) | 9 (29,0) | 0 (0) | 0,008 |
| Malnutrición (n/%) | 10 (32,4) | 0 (0) | 0,003 |
| Comorbilidades | |||
| Hipertensión (n/%) | 27 (87,1) | 8 (36,4) | > 0,001 |
| Dislipidemias (n/%) | 4 (12,9) | 2 (9,1) | 1,0 |
| Hemodiálisis (n/%) | 3 (9,7) | 0 (0) | 0,25 |
| Manifestaciones extrahepáticas | |||
| Enfermedad diverticular (n/%) | 3 (9,37) | 1 (4,5) | 0,63 |
| Hernia de pared abdominal (n/%) | 4 (12,9) | 1 (4,5) | |
| Aneurisma cerebral (n/%) | 3 (9,7) | 0 (0) | |
| Complicaciones previas al trasplante | |||
| Infección quiste hepático (n/%) | 3 (9,7) | 4 (18,2) | 0,43 |
| Hemorragia quiste hepático (n/%) | 1 (3,2) | 0 (0) | 1,0 |
| Ruptura aneurisma cerebral (n/%) | 1 (3) | 0 (0) | 1,0 |
| Tratamiento previo trasplante | 4 (12,5) | 11 (55,0) | 0,001 |
| Alcoholización (n/%) | 0 (0) | 2 (9,1) | 0,001 |
| Exéresis (n/%) | 1 (3,2) | 0 (0) | |
| Lanreotida (n/%) | 3 (9,7) | 7 (31,8) | |
| Tolvaptan (n/%) | 0 (0) | 1 (4,5) | |
| Fenestración (n/%) | 0 (0) | 1 (4,5) | |
| Tipo de trasplante | |||
| Hígado (n/%) | 12 (37,5) | 0 (0) | |
| Hígado-riñón (n/%) | |||
| -Simultáneo | 20 (62,5) | 0 (0) | NA |
| -Renal previo | 6 (19,4) | 4 (18,2) | |
Se realizó un estudio de imagen cerebral en 32 (60%) pacientes como prueba de despistaje de aneurismas cerebrales. En tres de ellos se objetivó un aneurisma cerebral y un paciente había presentado una hemorragia cerebral por ruptura aneurismática localizada en la arterial cerebral media. Esta hemorragia se había producido antes del trasplante y se había resuelto sin secuelas.
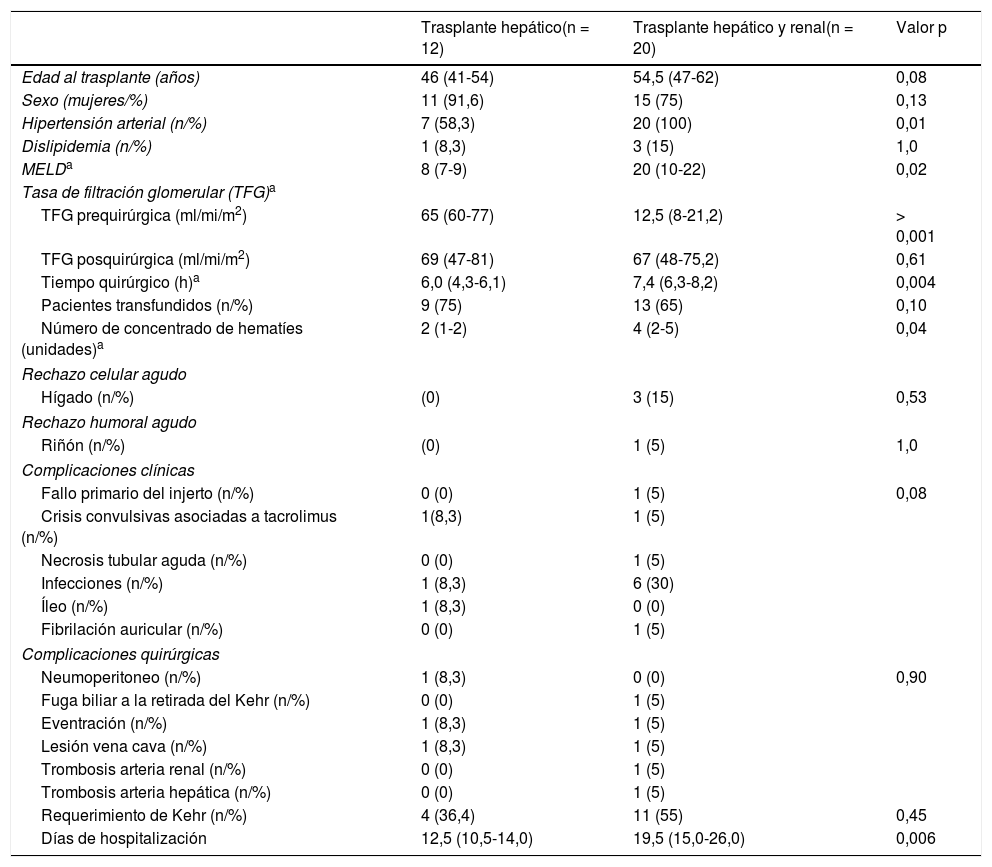
Complicaciones perioperatorias y supervivenciaEn la tabla 2 se describen las complicaciones postoperatorias en los pacientes trasplantados comparando trasplante hepático único con trasplante hepatorrenal. El tiempo quirúrgico del trasplante hepatorrenal fue de 7,4 h, superior al de trasplante hepático aislado que fue de 6,2 h. La necesidad transfusional (concentrados de hematíes) fue mayor en el grupo de trasplante hepatorrenal (4 vs. 2 concentrado de hematíes) (p < 0,04).
Características de pacientes trasplantados
| Trasplante hepático(n = 12) | Trasplante hepático y renal(n = 20) | Valor p | |
|---|---|---|---|
| Edad al trasplante (años) | 46 (41-54) | 54,5 (47-62) | 0,08 |
| Sexo (mujeres/%) | 11 (91,6) | 15 (75) | 0,13 |
| Hipertensión arterial (n/%) | 7 (58,3) | 20 (100) | 0,01 |
| Dislipidemia (n/%) | 1 (8,3) | 3 (15) | 1,0 |
| MELDa | 8 (7-9) | 20 (10-22) | 0,02 |
| Tasa de filtración glomerular (TFG)a | |||
| TFG prequirúrgica (ml/mi/m2) | 65 (60-77) | 12,5 (8-21,2) | > 0,001 |
| TFG posquirúrgica (ml/mi/m2) | 69 (47-81) | 67 (48-75,2) | 0,61 |
| Tiempo quirúrgico (h)a | 6,0 (4,3-6,1) | 7,4 (6,3-8,2) | 0,004 |
| Pacientes transfundidos (n/%) | 9 (75) | 13 (65) | 0,10 |
| Número de concentrado de hematíes (unidades)a | 2 (1-2) | 4 (2-5) | 0,04 |
| Rechazo celular agudo | |||
| Hígado (n/%) | (0) | 3 (15) | 0,53 |
| Rechazo humoral agudo | |||
| Riñón (n/%) | (0) | 1 (5) | 1,0 |
| Complicaciones clínicas | |||
| Fallo primario del injerto (n/%) | 0 (0) | 1 (5) | 0,08 |
| Crisis convulsivas asociadas a tacrolimus (n/%) | 1(8,3) | 1 (5) | |
| Necrosis tubular aguda (n/%) | 0 (0) | 1 (5) | |
| Infecciones (n/%) | 1 (8,3) | 6 (30) | |
| Íleo (n/%) | 1 (8,3) | 0 (0) | |
| Fibrilación auricular (n/%) | 0 (0) | 1 (5) | |
| Complicaciones quirúrgicas | |||
| Neumoperitoneo (n/%) | 1 (8,3) | 0 (0) | 0,90 |
| Fuga biliar a la retirada del Kehr (n/%) | 0 (0) | 1 (5) | |
| Eventración (n/%) | 1 (8,3) | 1 (5) | |
| Lesión vena cava (n/%) | 1 (8,3) | 1 (5) | |
| Trombosis arteria renal (n/%) | 0 (0) | 1 (5) | |
| Trombosis arteria hepática (n/%) | 0 (0) | 1 (5) | |
| Requerimiento de Kehr (n/%) | 4 (36,4) | 11 (55) | 0,45 |
| Días de hospitalización | 12,5 (10,5-14,0) | 19,5 (15,0-26,0) | 0,006 |
MELD: Model For End-Stage Liver Disease.
En el grupo de trasplante hepatorrenal se produjeron dos trombosis arteriales: un paciente presentó un infarto renal por trombosis de la arteria renal y otro paciente desarrolló un fallo primario del injerto hepático por trombosis de arteria hepática, requiriendo un retrasplante renal y hepático, respectivamente. Además, un paciente con trasplante hepatorrenal y otro con trasplante hepático único presentaron una lesión de vena cava superior que se reparó sin consecuencias. Un paciente de cada grupo presentó una eventración de la herida quirúrgica, uno a los tres meses y otro al año del trasplante. El tubo de Kehr se utilizó en 11/20 (55%) de los pacientes con trasplante hepatorrenal y en 4/12 (33,3%) de los pacientes con trasplante hepático aislado. En el grupo de trasplante hepatorrenal un paciente presentó fuga biliar al retirar el tubo de Kehr.
En el periodo posquirúrgico inmediato, siete pacientes presentaron un proceso infeccioso (21,8%). En el grupo de trasplante hepatorrenal, se diagnosticó una infección de vías urinarias en dos pacientes, una infección de herida quirúrgica, una bacteriemia por Pseudomonas aeruginosa, una infección por virus herpes zóster y cuatro presentaron neumonía intrahospitalaria. En el grupo de trasplante hepático aislado se presentó un caso de neumonía intrahospitalaria.
En el grupo de trasplante hepatorrenal tres pacientes presentaron un rechazo celular agudo hepático y un rechazo humoral renal diagnosticados todos por biopsia. Los tres casos de rechazo celular agudo hepático y el rechazo humoral renal respondieron a altas dosis de corticoides y plasmaféresis, respectivamente. El tiempo de estancia hospitalaria fue significativamente superior en el grupo de trasplante hepatorrenal 19,5 (15-26) días en relación con el grupo de trasplante hepático aislado con 12,5 (10,5-14) días (p < 0,006).
El seguimiento medio de los pacientes trasplantados fue de 80 (27-121) meses. Cuatro pacientes presentaron complicaciones: hepatitis autoinmune de novo a los 24 meses del trasplante, diverticulitis aguda leve resuelta con antibióticos, carcinoma basocelular de piel a los ocho meses postrasplante y adenocarcinoma de origen intestinal diseminado a los 16 meses del trasplante.
Dos pacientes presentaron insuficiencia renal crónica postrasplante a los 10 meses y a los ocho años, respectivamente, y fueron retrasplantados. Ningún injerto hepático necesitó un retransplante.
Dos de los 32 pacientes fallecieron (6,2%): un paciente falleció durante la intervención del trasplante por causas cardiovasculares y el otro falleció a los 16 meses postrasplante por un adenocarcinoma intestinal diseminado. Treinta pacientes están vivos, con adecuada función del injerto, mejoría de los síntomas que condicionaron el trasplante y con una mediana de sobrevida del trasplante de 94 meses para los casos de trasplante hepático, y de 70 meses para los casos de trasplante hepatorrenal.
DiscusiónLa EPH tiene una prevalencia en la población general de 1/1.000.000, mientras que la prevalencia de la EPHR oscila entre 1/400 a 1/1.000 y representa aproximadamente el 80-90% de todos los casos de la enfermedad poliquística1. Aunque se considera una enfermedad benigna, en una minoría de pacientes (3%), la expansión de los quistes hepáticos causa síntomas abdominales graves y en casos extremos puede ser causa de muerte7. El trasplante hepático está indicado en aquellos casos con morbilidad significativa y no controlable mediante otros tratamientos (dolor abdominal incapacitante, infección recurrente, hipertensión portal, afectación nutricional importante)8. Las opciones de tratamiento conservador y quirúrgico producen mejoría de los síntomas en pacientes con quistes de tamaño pequeño, pero en pacientes con múltiples quistes de gran tamaño, estos tratamientos solo producen una mejoría transitoria9. Dos cuestiones se han argumentado en contra del trasplante en la EPH y en la EPHR: por un lado, la baja mortalidad sin trasplante y el mantenimiento de una función hepática normal en muchos casos, y por otro, las dificultades quirúrgicas asociadas con la extracción de órganos de gran tamaño (el peso medio del hígado en esta serie fue de 5.000 g) y la consiguiente distorsión vascular. Sin embargo, los resultados de nuestra serie indican que el trasplante hepático o hepatorrenal se asocia con una elevada supervivencia en estos pacientes (100% EPH y 90% EPHR), que se producen pocas complicaciones quirúrgicas, similares a las que se pueden observar en trasplantes de otras patologías10, y que no se detecta un aumento de complicaciones infecciosas, episodios de rechazo y requerimientos transfusionales. Aunque no fue específicamente evaluado mediante cuestionarios, todos los pacientes presentaron una mejoría importante en su calidad de vida. Todo ello indica que el trasplante hepático o hepatorrenal en la EPHR es un buen tratamiento en aquellos casos seleccionados que cumplen los criterios establecidos.
La progresión a una enfermedad hepática en etapa terminal generalmente resulta excepcional y se observa en casos en los que el hígado alcanza volúmenes extremadamente elevados. La función hepática, por lo general, permanece intacta de forma que pacientes sintomáticos con hepatomegalia muy importante pueden tener una puntuación del Model For End-Stage Liver Disease (MELD) muy baja11,12. El factor con más peso en la puntuación del MELD en estos pacientes es la función renal en los casos de EPHR, la cual permanece conservada en pacientes con afección exclusivamente hepática. Por estas razones, la EPHR, y particularmente la EPH, se consideran una excepción y deben otorgarse puntos extra para su inclusión equitativa en lista de espera. Para su entrada en lista y priorización, se valoran: la presencia de signos clínicos de hipertensión portal, complicaciones intratables de los quistes o malnutrición y se dan puntos extra conforme aumenta el tiempo en lista de espera13,14. Del total de nuestros pacientes evaluados a lo largo de estos 20 años, las principales indicaciones de trasplante fueron la hepatomegalia sintomática, la malnutrición y la hipertensión portal.
Se ha demostrado que la función renal es uno de los factores más importantes para predecir el pronóstico del paciente con enfermedad poliquística. Elegir si se llevará a cabo el trasplante hepático o hepatorrenal depende de la función renal previa al trasplante15. En los pacientes de nuestro estudio con trasplante hepatorrenal, 10/20 pacientes (50%) estaban en diálisis previamente al trasplante. Tras el trasplante la función renal mejoró significativamente pasando la TFG de 12,5 (8-21,2) mL/min/1,73 m2 en el pretrasplante a 67 (48-75,2) mL/min/1,73 m2 (p > 0,001).
Se han descrito problemas quirúrgicos durante la hepatectomía debido a la importante hepatomegalia que presentan estos pacientes. Las complicaciones vasculares son las más frecuentes y se dan en mayor proporción en los pacientes con trasplante hepatorrenal16. En nuestro estudio, las complicaciones vasculares fueron muy pocas, con una incidencia algo mayor (3/20) en el grupo de trasplante hepatorrenal, con respecto al grupo de trasplante hepático aislado (1/12) (ns). Por otra parte, pensamos que la utilización del bypass veno-venoso contribuyó al mantenimiento de la estabilidad hemodinámica de los pacientes durante el procedimiento del trasplante, a la minimización de las pérdidas hemáticas y al mantenimiento de una mejor perfusión esplácnica y renal, al evitar la congestión venosa. Sin embargo, otros autores consideran que el bypass veno-venoso no es necesario en estos pacientes por lo que se hace difícil establecer una recomendación taxativa al respecto17. En ocasiones puede llegar a ser necesaria la sustitución de la VCI para evitar problemas de drenaje venoso del injerto.
Respecto a las complicaciones extrahepáticas de la EPHR, cabe destacar la presencia de aneurismas intracraneales. La EPHR es la enfermedad hereditaria más común asociada con aneurismas intracraneales, su prevalencia dentro de la EPHR varía de 4 a 40%18,19. En este padecimiento, la detección es más alta cuando existen otros miembros de la familia con aneurismas cerebrales. Para su búsqueda debido a su naturaleza no invasiva, la resonancia magnética y la tomografía computada son los métodos de elección19. De una cohorte de 113 pacientes estudiados en un hospital de Corea, se encontró una prevalencia de 20% (23 pacientes), de los cuales, el 8% (nueve pacientes) tenían el antecedente de ruptura aneurismática a una edad promedio de 34,9 años, siendo la localización más frecuente la arteria cerebral media (35%)18. En otra revisión sistemática de nueve estudios, la prevalencia de aneurismas asintomáticos intracraneales fue de 11,5 y del 1,9% de aneurismas con ruptura, con una edad promedio de ruptura de 42 años20. En nuestra cohorte de 53 pacientes evaluados, 33 (60%) tenían estudio de imagen de despistaje, encontrándose un aneurisma intracraneal asintomático en tres de ellos (5,6%), y otro caso tenía el antecedente de hemorragia intracraneal por rotura de aneurisma. En el momento actual no existe una definición clara de la actuación que debe llevarse a cabo frente a estos aneurismas asintomáticos en pacientes a los que se vaya a realizar un trasplante hepatorrenal. Algunos factores deberán ser considerados para la decisión del manejo como son: localización, tamaño, morfología, existencia de trombo en su interior, edad, antecedente de hemorragia subaracnoidea e historia familiar de hemorragia subaracnoidea, siendo el tamaño del aneurisma el predictor más importarte de ruptura. Las opciones de tratamiento son la colocación de clips, y actualmente, la colocación de espirales por vía endovascular19.
Posterior al trasplante, la calidad de vida de estos pacientes mejora dramáticamente, ya que desaparecen la plétora y el dolor abdominal, la desnutrición y la insuficiencia renal en el caso de que se realice trasplante doble. El cuestionario más utilizado para la evaluación de la calidad de vida en estos pacientes es el SF-36, que aborda el estado físico, emocional y social21. Kirchner et. al. evaluaron la calidad de vida después del trasplante con base en dos cuestionarios que abordaron temas de salud física, mental y cambios en el estilo de vida. En este estudio se pudo objetivar una mejoría en calidad de vida en el 100% de los pacientes trasplantados de hígado y en el 91% en los casos de trasplante combinado hepatorrenal22. Al tratarse de un estudio retrospectivo, la calidad de vida no se valoró adecuadamente. En general, los pacientes tuvieron mejoría de los síntomas y mejoría de la calidad de vida, sin que se pueda cuantificar ni especificar en qué áreas concretas se produzco esta mejoría.
El presente estudio muestra la experiencia en la selección, inclusión en lista de espera, trasplante y complicaciones asociadas en una cohorte de 53 pacientes con EPH y EPHR. El trasplante hepático o hepatorrenal es una opción excelente en el tratamiento de estos pacientes con una supervivencia superior al 90% a los ocho años del trasplante. Las posibles complicaciones quirúrgicas no suponen en la práctica un problema significativo.
ConclusiónEn los pacientes con enfermedad poliquística del hígado, cuando la afección es grave se debe considerar el trasplante de hígado o el trasplante combinado hepatorrenal como una opción de tratamiento. Aunque la técnica quirúrgica es más compleja en estos casos, y debe adaptarse a las condiciones específicas de estos pacientes cuando son seleccionados de forma adecuada, tiene resultados excelentes a largo plazo.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.