Las infecciones del tracto urinario (ITU) se encuentran entre las causas de consulta ambulatoria y de urgencias más frecuentes. La ausencia de pautas y consenso para el diagnóstico dadas por el laboratorio de microbiología puede dificultar la obtención de datos relevantes y confiables sobre los hallazgos microbiológicos y retrasar la toma de conductas clínicas apropiadas.
ObjetivoElaborar un algoritmo de decisión en ITU basado en la evidencia actual para el procesamiento de la muestra de orina, que incluye desde la recolección, el transporte y almacenamiento hasta su cultivo, con el fin de generar una directriz desde el laboratorio para la correcta toma de decisiones del médico.
MetodologíaSe lleva a cabo una búsqueda en la literatura y el concepto de expertos en Microbiología e Infectología basada en la revisión de las referencias bibliográficas disponibles en los términos de búsqueda relacionados, haciendo énfasis en estudios locales.
ResultadosSe generaron recomendaciones para el diagnóstico por el laboratorio de las ITU en Colombia, que incluyen recolección, almacenamiento y transporte, siembra y pruebas de susceptibilidad antimicrobiana.
Urinary tract infections (UTI) are one of the most frequent reasons for consultation in outpatient and emergency settings. The absence of guidelines and consensus from the microbiology laboratory for the diagnosis of UTI may affect the relevance and reliability of the results and delay the physician's treatment determination.
ObjectiveTo create an algorithm for the laboratory diagnosis of UTI in Colombia based on current evidence, in order to provide recommendations regarding sample collection, storage, transport and processing and to provide guidance for physicians’ decision making.
MethodsWe reviewed the current standards and guidelines for the diagnosis of UTI and considered comments from microbiology and infectious disease experts based on a literature search using relevant search terms and emphasizing local studies.
ResultsWe generated recommendations for collecting samples, storage, transport, culture and susceptibility testing for the reliable diagnosis of UTI in patients in Colombia.
La infección del tracto urinario (ITU) es una de las causas de consulta ambulatoria y de urgencias más frecuentes1,2. El cultivo de orina es el examen microbiológico de mayor importancia para diagnosticarla, aunque también representa una de las mayores cargas de trabajo en los laboratorios clínicos hospitalarios y ambulatorios. El profesional de laboratorio tiene la responsabilidad de reportar datos relevantes y confiables sobre los hallazgos microbiológicos del cultivo de orina, pero requiere retroalimentación por parte del clínico, de modo que la información suministrada tenga la solidez necesaria para tomar conductas terapéuticas apropiadas1.
Aunque en el ámbito clínico y terapéutico es necesario diferenciar las infecciones urinarias bajas no complicadas, como la cistitis, de las infecciones altas complicadas, como la pielonefritis, en el laboratorio estas enfermedades tienen un contexto diagnóstico similar.
Recomendaciones para la recolección de muestrasUna muestra adecuada constituye la piedra angular para un diagnóstico confiable. Por sus características, la orina es proclive a contaminación con microbiota comensal de la piel y los genitales externos. A continuación se describen brevemente los métodos de recolección de orina más utilizados y algunas sugerencias para la toma de las muestras en cada caso:
- –
Micción espontánea: es el método no invasivo más utilizado. Para evitar la contaminación de la muestra, se recomienda el lavado de los genitales con agua y jabón, y separar los labios externos en la mujer. En hombres no circuncidados se recomienda retraer el prepucio. La primera porción de la orina debe descartarse y se recoge a partir del chorro medio en un frasco estéril de boca ancha de cierre hermético1–3.
- –
Bolsa pediátrica: tiene alto valor predictivo negativo, pero bajo valor predictivo positivo; se utiliza en niños sin control de esfínteres. Se recomienda lavado de genitales externos con agua y jabón, el retiro inmediato de la bolsa al terminar la micción o el recambio cada 20 min cuando esta no ha ocurrido1,2,4,5.
- –
Punción suprapúbica: considerado el «patrón de oro» para la recolección de orina por su mínima probabilidad de contaminación. Se considera un método sensible y específico, y se utiliza principalmente en neonatos y lactantes en quienes se requieren datos confiables y oportunos4,5.
- –
Cateterismo vesical: se emplea en quienes, por sus condiciones, es imposible obtener una muestra apropiada por micción espontánea. Se debe realizar una asepsia rigurosa para evitar introducir bacterias en la vejiga. Deben descartarse los primeros mililitros (mL) de orina para evitar falsos positivos1,2.
- –
Sonda vesical permanente: la muestra debe tomarse del puerto de recolección, limpiando la superficie para evitar contaminación, y nunca tomarla de la bolsa colectora, ya que siempre estará contaminada. Nunca desconectar los puertos y conservar siempre un sistema cerrado.
El transporte al laboratorio se debe realizar de forma inmediata. La orden médica debe contener datos relevantes como método y hora de recolección, así como uso previo de antimicrobianos. Si la muestra no puede ser procesada antes de una hora, se recomienda refrigeración a 4°C o el uso de tubos de transporte de orina con conservantes, generalmente ácido bórico. El volumen mínimo de orina para ser transportado con el conservante debe ser ≥3mL, para evitar la inhibición por ácido bórico. Se recomienda el procesamiento de orinas conservadas en un tiempo máximo de 24h, debido al efecto del ácido bórico sobre patógenos como Enterococcus spp.6–8.
Métodos de tamización para el diagnóstico rápido de las infecciones del tracto urinario- –
Gram de orina sin centrifugar: es un método rápido y económico que orienta la selección del tratamiento antibiótico empírico. La muestra se mezcla muy bien por inmersión y una gota de orina sin centrifugar se extiende sobre una lámina portaobjetos y se realiza coloración de Gram; al observar una bacteria por campo con objetivo de inmersión se presume un recuento de colonias aproximado de 105UFC/mL; y cuando se observa más de una bacteria por campo, se presume un recuento de colonias entre 104 y 105UFC/mL. Si bien técnicamente es fácil de realizar, su sensibilidad disminuye para recuentos de colonias por debajo de 105UFC/mL, que pueden ser importantes en el escenario de la ITU no complicada. En pielonefritis, la prueba tiene un mejor desempeño, porque se asume que la carga bacteriana es mayor. En lactantes menores de 3 meses esta prueba ha sido ampliamente ensayada, considerándose que tiene una sensibilidad del 93% y un porcentaje de falsos positivos del 5%. No se recomienda el reporte de leucocitos, ni células epiteliales en Gram de orina sin centrifugar, ya que no está estandarizado y puede confundir el diagnóstico1,9.
- –
Tira reactiva: la reducción de nitratos a nitritos puede utilizarse como un marcador altamente específico de bacteriuria (97%), con un valor predictivo positivo cercano al 94%. Sin embargo, su sensibilidad es baja por cuanto depende de la retención en la vejiga (mínimo 4 h) y del microorganismo infectante (hay que tener en cuenta que Enterococcus spp. y S. saprophyticus no producen nitrato reductasa). Otro parámetro importante es la detección de esterasa leucocitaria con la tira reactiva, que mide la producción de esta enzima en leucocitos enteros o lisados. Existen condiciones que generan falsos positivos y negativos de la prueba, como contaminación con flujo vaginal, uso de antibióticos, muestras de pacientes diabéticos con glucosuria o proteinuria importante, y el uso de ácido bórico para conservar la muestra2,10.
- –
Analizadores automáticos: estos sistemas permiten la detección rápida de bacteriuria y leucocituria mediante citometría de flujo, uso de imágenes digitales, tinción con colorantes fluorescentes, etc. De acuerdo con el modelo y la tecnología empleada, la sensibilidad oscila entre el 68 y el 95%, y la especificidad se encuentra alrededor del 80%. Una recomendación clave es utilizar puntos de corte de acuerdo con el tipo de paciente que se recibe en la institución, y conocer claramente la linealidad de los equipos empleados2.
- –
Nota: no se recomienda la estrategia de cultivar únicamente muestras de orina positivas para, al menos, un método de tamización. Si bien puede incrementar la probabilidad de un urocultivo positivo, debe considerarse que algunas ITU solo son detectables cultivando la muestra de orina, debido a las variables que influyen en la sensibilidad y especificidad de los métodos de tamización. Por ejemplo, en pacientes con sonda vesical, un recuento de colonias inferior al umbral clásico puede ser significativo2,11.
Como no existen metodologías y flujogramas completamente estandarizados para el manejo de urocultivos, es fundamental que cada institución elabore sus propios protocolos de acuerdo con la epidemiología local (tipo de paciente, edades, formas de recolección de las muestras, etc.) y con las necesidades clínicas, individualizando los casos.
- 1.
Selección de medios de cultivo: el laboratorio debe seleccionar un medio de cultivo que permita el crecimiento apropiado de bacterias grampositivas, gramnegativas y levaduras. Se acepta el uso de agar sangre y un medio selectivo para gramnegativos como agar McConkey o eosin methylene blue. Es importante mencionar que el uso de agar sangre presenta la dificultad de sobrecrecimiento (swarming) por especies de Proteus, para lo cual se propone usar medios como agar colistina-ácido nalidíxico, agar feniletil alcohol o agar sangre+azida. El medio de cultivo cysteine lactose electrolyte deficient permite una recuperación aceptable de los uropatógenos más importantes y tiene la capacidad de inhibir el fenómeno swarming de Proteus1,2,10.
- –
Agares cromogénicos: se basan en la capacidad enzimática de algunas bacterias para asimilar diversos tipos de sustrato presentes en el medio. De esta forma crecen colonias coloreadas características de especie: (rosado: E. coli; azul: grupo Klebsiella/Enterobacter/Serratia y Enterococcus; amarillo: Proteus y S. aureus). Estos medios permiten el crecimiento de los uropatógenos más importantes desde el punto de vista clínico, inhiben el swarming de Proteus spp. y además facilitan la identificación de cultivos mixtos. Sin embargo, se recomienda su uso con precaución, dado que algunas variantes de E. coli pueden dar origen a colonias incoloras y además puede ser difícil la diferenciación entre Proteus spp. y Staphylococcus aureus (S. aureus), cuyas colonias tienen un pigmento similar. Se debe evitar la exposición de estos agares a la luz directa, ya que puede favorecer la degradación de los cromógenos incluidos en el medio. Si bien los medios cromogénicos facilitan la interpretación y lectura de los urocultivos, recomendamos una identificación completa de género y especie del agente etiológico, empleando la metodología usada de manera convencional por cada laboratorio2. Verifique con la casa comercial de su sistema automatizado la posibilidad de montar los paneles de identificación y susceptibilidad directamente del agar cromogénico.
- –
- 2.
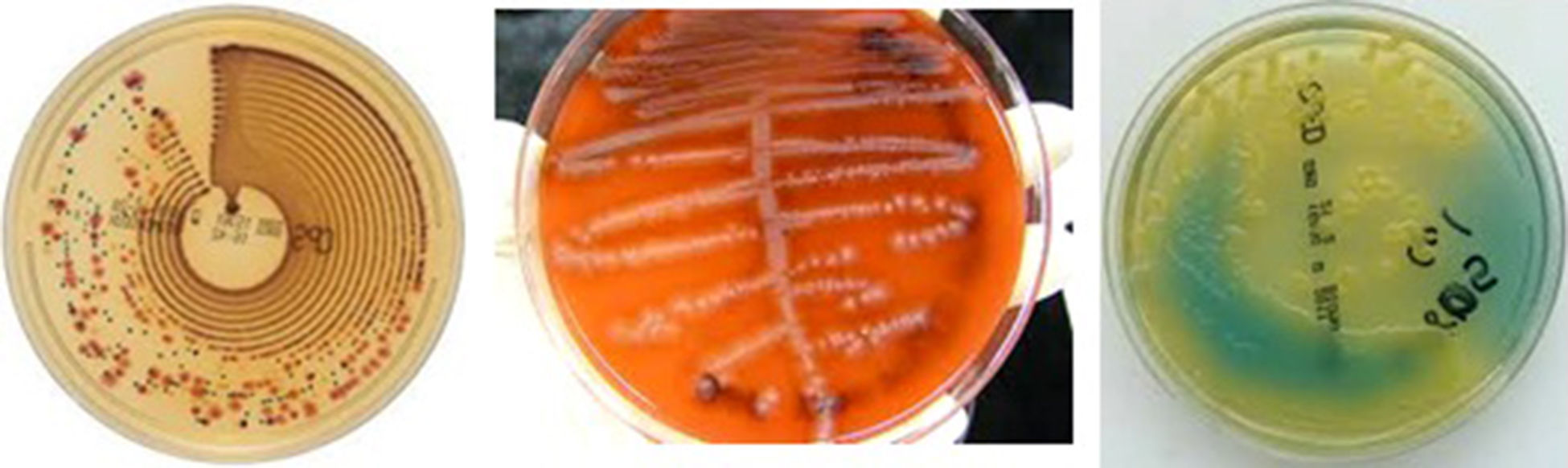
Siembra de las muestras: se propone el uso de asas calibradas de 0,01 y 0,001mL de acuerdo con la forma de recolección de muestras (micción espontánea frente a métodos invasivos). La siembra se realiza por rejilla en los medios de cultivo apropiados. Se consideran válidas las siembras para recuento empleando inoculadores automáticos (Previ-Isola®, WASP®, etc.) No se recomienda la siembra de más de una muestra por placa de agar (fig. 1). Se deben incubar las placas en aerobiosis a 35-37°C, durante un periodo mínimo de 16 y un máximo de 24h, para urocultivos convencionales colectados por micción espontánea. Este tiempo puede extenderse hasta 48h en caso de muestras invasivas o bajo circunstancias específicas, como se describirán más adelante. No se recomienda el uso de incubación con CO21,2,10.
Se propone el siguiente algoritmo de trabajo en urocultivos (tablas 1 y 2):
Tabla 1.Algoritmo de decisión para el procesamiento de cultivos de orina, recolectados por técnica no invasiva: (micción espontánea, sonda Foley, bolsa pediátrica)
N.° de aislamientos Recuento de colonias (UFC/mL) Identificación y antibiograma 1 ≥ 104 Sí, si el microorganismo es uropatógenoa < 104 No, solo permitiría el reporte de la ID descriptiva del microorganismob. Pedir nueva muestra 2 2 con ≥ 104 Sí, si los microorganismos son uropatógenos 2 con<104 No, solo permitiría el reporte de la ID descriptiva de los microorganismos. Pedir nueva muestra 1 con ≥ 104 y 1 con<104 Sí, para el aislamiento que tiene ≥ 104. Para el otro, solo ID descriptiva ≥ 3 1 con ≥ 105 y 2 con<104 Puede realizarse para el aislamiento con ≥ 105 únicamente. Está indicado recolectar nueva muestra mejorando aseo Nota: Utilizar asa calibrada de 0,001mL o su equivalente en inoculadores automatizados. Incubación en ambiente de aire por 16-24h.
ID: identificación; UFC: unidades formadoras de colonias.
Tabla 2.Algoritmo de decisión para el procesamiento de cultivos de orina, recolectados por técnicas invasivas (cateterismo vesical, punción suprapúbica, cistoscopia, nefrostomía)
N.° de aislamientos Recuento de colonias (UFC/mL) Identificación y antibiograma 1 ≥ 103 Sí, si el microorganismo es uropatógenoa < 103 Sí, únicamente para muestras tomadas por punción suprapúbica 2 2 con ≥ 103 Sí, si los microorganismos son uropatógenos 2 con<103 No, solo ID descriptiva de los microorganismosb. Pedir nueva muestra 1 con ≥ 103 y 1 con<103 Sí para el aislamiento que tiene ≥ 103. Para el otro, solo ID descriptiva ≥ 3 1 con ≥ 104 y 2 con<103 Puede realizarse para el aislamiento con ≥ 104 únicamente. Esta indicado colectar nueva muestra mejorando asepsia Nota: Utilizar asa calibrada de 0,01mL o su equivalente en inoculadores automatizados. Incubación en ambiente de aire por 16-24h. Reincubar hasta 48h si no hay crecimiento.
ID: identificación; UFC: unidades formadoras de colonias.
Para empezar, debe mencionarse que no está recomendado el uso de botellas de hemocultivo para la siembra de muestras de orina, por las siguientes razones:
- –
Los componentes del medio de cultivo están diseñados para ser compatibles con muestras de sangre, y los agentes bloqueadores de antibióticos (resinas y carbón activado) han demostrado ser eficaces contra niveles séricos de antimicrobianos. En orina, las concentraciones de antibióticos utilizados en el manejo de la ITU, como betalactámicos, aminoglucósidos, fluoroquinolonas y trimetoprim/sulfametoxazol, pueden ser desde 10 hasta 1.000 veces superiores a las concentraciones séricas respectivas frente a una dosificación estándar.
- –
Algunos sistemas de hemocultivos están validados por FDA para el montaje de líquidos biológicos únicamente (verifique con su casa comercial).
- –
El recuento de colonias es fundamental para un diagnóstico y manejo terapéutico apropiados en las ITU, según las características del paciente (método de recolección, factores de riesgo, etc.).
- –
- 3.
Interpretación de resultados: es importante leer los cultivos al cumplir con el tiempo de incubación recomendado de acuerdo con el método de recolección (16-24 h para micción espontánea y hasta 48h para métodos invasivos) y con la sospecha etiológica presuntiva desde el punto de vista clínico.
- –
Cultivos sin crecimiento: hace referencia a urocultivos en los cuales no se observa crecimiento alguno (recuento de colonias igual a cero). Se reportarán como «Negativos a las 24h de incubación» o como «No se obtuvo crecimiento bacteriano»10.
- –
Cultivos con crecimiento bacteriano: debe tenerse en cuenta el tipo de microorganismo observado y su capacidad uropatógena: Enterobacteriaceae, Pseudomonas, Enterococcus, Streptococcus agalactiae, S. saprophyticus, Aerococcus urinae, etc., y diferenciarlo de no patógenos como Lactobacilos, Difteroides, Streptococcus del grupo viridans, etc.2,10.
- –
Cultivos mixtos: deben tenerse en cuenta las características de los aislamientos (uropatógenos frente a contaminantes) y realizar recuento por cada microorganismo aislado. Se recomienda trabajar máximo 2 aislamientos por urocultivo. El aislamiento de 3 o más especies bacterianas diferentes en orina puede deberse a contaminación y se requiere repetir el urocultivo tomando una muestra con técnica aséptica, y solicitando datos clínicos del paciente. Las tablas 1 y 2 proponen el algoritmo para el procesamiento de urocultivos de acuerdo con el número de microorganismos presentes en el urocultivo, el método de toma y los recuentos de colonias.
- –
Recuentos de colonias: si bien los criterios clásicos para la interpretación de urocultivos consideran un recuento ≥104UFC/mL como significativo en la mayoría de pacientes, existen algunas situaciones especiales que merecen evaluarse y se mencionan en la tabla 3.
Tabla 3.Consideraciones especiales para el recuento de Colonias en muestras de orina
Recuento significativoa Consideración Cualquier recuento de UFC/mL Siempre que la orina sea tomada por punción suprapúbica o directamente del riñón, y cuando se trate de un solo morfotipo microbiano ≥ 102UFC/mL Mujeres jóvenes con síndrome miccional y leucocituria ≥ 103UFC/mL Urocultivos en hombres Fuente: Adaptado de Andreu et al.10.
- –
- 4.
Aislamiento de patógenos infrecuentes:Corynebacterium urealyticum debe sospecharse en pacientes con urolitiasis, manipulación urológica o trasplante renal. Las muestras deben sembrarse en agar sangre. H. influenzae/parainfluenzae debe sospecharse en niños con anormalidades estructurales del árbol urinario, con signos clínicos y paraclínicos sugestivos de ITU, cultivos negativos o fallas terapéuticas. Las muestras deben sembrarse en agar chocolate suplementado. S. aureus puede significar bacteriemia o absceso renal, por lo cual siempre debe realizarse identificación y susceptibilidad completa, y comunicar los hallazgos al clínico12.
- 5.
Piuria estéril: hace referencia a la observación de 5-8 leucocitos por campo en el examen citológico de orina, con urocultivo negativo. Puede deberse a manipulación del tracto urinario (por ejemplo: cuando la muestra es tomada por cateterismo vesical), urolitiasis, etc. Es importante realizar coloración de Gram, pues observar microorganismos en esta tinción y no obtener crecimiento en los cultivos puede hacer sospechar una infección por bacterias anaerobias o microorganismo de crecimiento lento. Si es el caso, se recomienda tomar la muestra por punción suprapúbica y sembrar en medios de enriquecimiento y medios para anaerobios. La piuria estéril también puede significar infección por micobacterias, Chlamydia y Ureaplasma spp.1,2.
- 6.
Estreptococos beta-hemolíticos del grupo B(S. agalactiae): las instituciones que reciben muestras de pacientes embarazadas deben considerar la probabilidad de colonización vaginal por S. agalactiae, en especial durante el tercer trimestre de embarazo. Este hallazgo puede también hacerse evidente en muestras de orina tomadas por micción espontánea. Los Centros para el Control de Enfermedades de Atlanta (CDC, por sus siglas en inglés) recomiendan reportar cualquier crecimiento de S. agalactiae en mujeres embarazadas. Se sugiere además «rotular» las muestras de pacientes gestantes para facilitar que el laboratorio haga la búsqueda de estos microorganismos en los urocultivos. Los medios de cultivo empleados en la siembra de estas muestras deben favorecer el crecimiento de este microorganismo. Los agares cromogénicos tienen un desempeño aceptable, pero proponemos el uso de una placa de agar sangre en pacientes gestantes para facilitar su crecimiento y diferenciación1,13. Los urocultivos no reemplazan la búsqueda activa de portadoras a través de hisopado rectal y vaginal.
- 7.
Aislamiento de especies deCandida: su hallazgo en muestras de orina en pacientes sin factores de riesgo es inusual. Sin embargo, en pacientes hospitalizados recobra importancia y debe ser considerado, especialmente en pacientes con sonda Foley, diabéticos, con neoplasias, antecedente de uso de antibióticos de amplio espectro, esteroides, procedimientos urológicos o vaginitis fúngica, entre quienes se ha observado una mayor frecuencia de candiduria. La interpretación de blastoconidias en orina puede ser complicada para el laboratorio de microbiología1,2,14. Se proponen las siguientes acciones:
- –
Revisar la forma de recolección de la muestra.
- –
Identificar los factores de riesgo (solicitar datos clínicos en la orden médica).
- –
En pacientes con factores de riesgo o visualización de blastoconidias en el sedimento urinario o en el gram de orina sin centrifugar, se propone incubar los urocultivos hasta 48 h y utilizar medios apropiados que faciliten su crecimiento (cromogénicos para hongos, Saboraud, etc.).
- –
Es importante diferenciar al menos entre C. albicans y otras especies, particularmente en pacientes con fallas terapéuticas a los antifúngicos convencionales.
- –
De acuerdo con las recomendaciones del Instituto Nacional de Salud, Organización Panamericana de la Salud y teniendo en cuenta los medicamentos que se emplean en Colombia, la configuración de los equipos automatizados de microbiología y las concentraciones de los sensidiscos empleados en nuestro país, se propone el uso de las guías vigentes del Clinical and Laboratory Standards Institute15 para la selección e interpretación de los antimicrobianos en patógenos aislados en orina. Los laboratorios en consenso con su comité de Infecciones pueden utilizar otras normas internacionales como el EUCAST16, verificando internamente si sus metodologías lo permiten. Sin embargo, se recomienda seguir los lineamientos para la vigilancia de la resistencia bacteriana dispuestos por el Instituto Nacional de Salud. Recomendamos tener en cuenta las siguientes consideraciones, según el tipo de microorganismo implicado13:
- 1.
Enterobacteriaceae: es el grupo de microorganismos aislado con mayor frecuencia en muestras orina en pacientes hospitalizados y ambulatorios. Proponemos las siguientes estrategias de tamización:
- •
Antibióticos betalactámicos: para infecciones de la comunidad recomendamos tamizar con ampicilina/sulbactam, cefazolina (para predecir la actividad de las cefalosporinas orales como cefalexina y cefuroxime), ceftriaxone, ceftazidime y ertapenem. En el caso de infecciones urinarias asociadas a la atención en salud, incluir aztreonam, meropenem, doripenem y piperacilina/tazobactam.
- –
Consideraciones para cefalosporinas orales: el documento M100-S24 publicado por el CLSI en 2014 presenta un nuevo punto de corte para cefazolina en aislamientos urinarios de E. coli, Klebsiella spp. y Proteus mirabilis, con el objetivo de predecir con mayor eficacia la actividad de las cefalosporinas orales utilizadas en el manejo de infección urinaria baja no complicada (tabla 4). Así, un resultado sensible para cefazolina con los puntos de corte descritos en esta tabla predice la sensibilidad a las cefalosporinas orales como cefalexina, cefaclor, cefdinir, cefpodoxime, cefprozil y axetil-cefuroxime y, en caso de resistencia a cefazolina, cefuroxime y cefpodoxime, puede tamizarse de forma independiente porque algunas cepas pueden ser sensibles a estos agentes aun mostrando resistencia a cefazolina17.
Tabla 4.Puntos de corte urinarios para cefazolina
Grupo de reporte Agente CIM (μg/mL) Halo de inhibición (mm) S I R S I R U Cefazolina ≤ 16 N/A ≥ 32 ≥ 15 N/A ≤ 14 CIM: concentración inhibitoria mínima; I: intermedio; R: resistente; S: sensible.
Fuente: Adaptado de CLSI M100 S-2415.
- –
Estrategia de reporte apropiado: en los aislamientos urinarios de E. coli, Klebsiella spp. y Proteus mirabilis provenientes de comunidad que presenten un perfil multisensible, se propone reportar únicamente ampicilina/sulbactam y las cefalosporinas orales, de acuerdo con el resultado de cefazolina con los puntos de corte urinarios descritos arriba. Podrán reportarse otras familias de antimicrobianos de acuerdo con los resultados in vitro y políticas institucionales de uso de antibióticos.
- –
Aplicación del test de betalactamasas de espectro extendido (BLEE): para las especies E. coli, Klebsiella spp. y Proteus mirabilis, que presenten una prueba de tamización sugestiva de la producción BLEE (tabla 5), se recomienda la realización de la prueba confirmatoria por método de microdilución o de difusión de doble disco. De esta manera, en los pacientes provenientes de la comunidad con una prueba confirmatoria positiva de BLEE, se recomienda editar a resistente el resultado de las cefalosporinas, incluyendo las de tercera generación. Revisar los resultados de ciprofloxacina, trimetoprim/sulfa, nitrofurantoína, gentamicina y fosfomicina, ya que podrían ser opciones terapéuticas válidas de acuerdo con el contexto del paciente. En infecciones por E. coli, Klebsiella spp. y Proteus mirabilis, con perfil multifarmacorresistente (especialmente BLEE), se propone reportar siempre ertapenem ya que, de acuerdo con las características del paciente y la estratificación por severidad, podría ser el antibiótico de elección por cubrimiento y características farmacocinéticas y farmacodinámicas.
Tabla 5.Criterios para la realización del test BLEE
Agente CIM (μg/mL) Halo de inhibición (mm) Cefotaxime ≥ 2 ≤ 22 Ceftriaxone ≥ 2 ≤ 25 Ceftazidime ≥ 2 ≤ 22 CIM: concentración inhibitoria mínima.
Fuente: Adaptado de Esparza et al.24.
De acuerdo con las políticas institucionales de uso de antibióticos y la disponibilidad de amoxicilina-ácido clavulánico en los paneles o su equivalente en sensidiscos, los laboratorios de microbiología pueden realizar el tamización de este antibiótico para Enterobacteriaceas (E. coli, Klebsiella pneumoniae, P. mirabilis) en pacientes con ITU baja no complicada, como se muestra en la tabla 616. Sin embargo, debe tenerse en cuenta que esta interpretación se recomienda únicamente en ITU baja no complicada y estará supeditada al criterio del médico infectólogo. Adicionalmente, se recomienda precaución en el manejo de Enterobacteriaceae productoras de BLEE: los estudios no son concluyentes sobre la eficacia de amoxicilina-ácido clavulánico en este escenario comparativamente con otros antibióticos18–20. De esta manera, amoxicilina-ácido clavulánico no debe emplearse en el manejo de organismos productores de AmpC como Enterobacter, Serratia, etc.
Tabla 6.Puntos de corte urinarios para amoxicilina/ácido clavulánico
Agente CIM (μg/mL) Halo de inhibición (mm) Contenido del disco (20/10 μg) S I R S I R Amoxicilina/ácido clavulánico ≤ 32 N/A ≥ 64 ≥ 16 N/A ≤ 15 CIM: concentración inhibitoria mínima; I: intermedio; R: resistente; S: sensible.
Fuente: Adaptado de EUCAST16.
- –
Consideraciones con cefepime: para el año 2014, el CLSI incluyó en el documento M100 S-24 una nueva categoría interpretativa del antibiograma llamada «sensible dosis dependiente (SDD)» la cual aplica en el momento solo para cefepime y Enterobacteriaceae exclusivamente (tabla 7). Estos cambios pretenden optimizar el uso de este antibiótico y disminuir la presión selectiva que puede ocasionar el sobreuso de carbapenems.
La Agencia para la Administración de Drogas y Medicamentos de los EE. UU. (FDA, por sus siglas en inglés) adoptó los nuevos puntos de corte para cefepime en Enterobacteriaceae pero no adoptó la categoría SDD; y estableció algunas modificaciones en los puntos de corte de cefepime (tabla 8).
Teniendo en cuenta el potencial impacto de estos cambios en los reportes del antibiograma en aislamientos urinarios y en el abordaje terapéutico por parte del clínico, proponemos las siguientes acciones, que deben ser discutidas en los comités institucionales de infecciones:
- a)
Revisar las diluciones para el antibiótico cefepime en los sistemas automatizados de microbiología para adoptar los nuevos puntos de corte en Enterobacteriaceae. Recuerde que por ley de los EE. UU., los equipos automatizados de microbiología deben implementar los puntos de corte y categorías interpretativas establecidas en el folleto de producto aprobado por la FDA. Esto significa que la adopción de la categoría SDD en los antibiogramas generados por estos instrumentos puede tomar un tiempo considerable o no darse definitivamente. Los laboratorios que utilizan difusión en gradiente (E-test, MICE, etc.) o difusión en disco pueden adoptar los cambios de forma inmediata.
- b)
Adoptar o no la categoría de interpretación SSD será decisión del comité institucional de infecciones. Puede continuarse con la categoría intermedia de acuerdo con las modificaciones planteadas por FDA.
- c)
Existe mejor evidencia de éxito terapéutico con cefepime para el tratamiento de Enterobacteriaceas del grupo AMPCES (Enterobacter, Serratia, Morganella, Providencia, C. freundii, etc.) cuando la CIM es ≤ 8μg/mL21. Recomendamos evitar el uso de cefepime para Enterobacteriaceae (E. coli, Klebsiella, P. mirabilis) productoras de BLEE, principalmente en infecciones graves no urinarias (bacteriemia, neumonía, infección intraabdominal) aun cuando muestren susceptibilidad in vitro. La decisión del agente antimicrobiano deberá ser tomada con el concepto de infectología o comité institucional de infecciones.
- d)
Si requiriere usar cefepime para aislamientos de Enterobacteriaceae con una CIM entre 4-8μg/mL o una zona de diámetro por disco difusión entre 19-24mm, recomendamos utilizar en adultos la dosis máxima de cefepime (2g c/8h) si la depuración de creatinina es>60mL/min22. Sin embargo, consideramos que el uso de antibióticos con espectro antipseudomonas para Enterobacteriaceae puede generar presión selectiva para P. aeruginosa MDR.
- e)
En pacientes con alteración de la función renal, recomendamos remitirse al folleto de producto para ajustar las dosificaciones.
- f)
En niños (desde los 2 meses hasta los 16 años) se utilizarán las máximas dosis de cefepime, (50mg/kg/dosis) cada 8 h como las dosis utilizadas para infecciones severas o para infecciones para Pseudomonas aeruginosa (P. aeruginosa).
- g)
De acuerdo con la directriz del comité institucional de infecciones, el laboratorio podrá optar por incluir un pie de nota en el reporte del antibiograma para aislamientos de Enterobacteriaceae con CIM de cefepime entre 4-8μg/mL o una zona de diámetro por disco difusión entre 19 y 24mm, indicando la dosis recomendada.
- h)
En infecciones graves por Enterobacteriaceae con CIM de cefepime entre 4 y 8μg/mL o una zona de diámetro por disco difusión entre 19 y 24mm, se deben revisar los datos del antibiograma para considerar el uso de una alternativa terapéutica con mayor sensibilidad.
- i)
Algunas Enterobacteriaceae productoras de carbapenemasas pueden presentar CIM de cefepime ≤ 8μg/mL o zonas de diámetro ≥ 19mm, que son interpretadas como sensibles, SDD o intermedio. Recomendamos editar el informe de cefepime a resistente o bloquear este resultado ya que puede llevar a fallas terapéuticas in vivo.
- j)
Finalmente, sugerimos seguir las recomendaciones FDA para el uso de cefepime en infecciones por P. aeruginosa en adultos (2g c/8h si la depuración de creatinina es>60mL/min), en niños (50mg/kg/dosis c/8h) y utilizar en lo posible infusión prolongada del antibiótico para aumentar el fT>MIC.
- –
- •
Tamizaje de ertapenem: ertapenem ha mostrado eficacia en el tratamiento de infecciones urinarias complicadas por bacterias productoras de BLEE y AmpC, con la ventaja de una menor selección de resistencia contra P. aeruginosa, comparativamente con los carbapenems del grupo 223. En este sentido, sugerimos incorporarlo en un programa de Uso Racional de Antibióticos (Antimicrobial Stewardship Program), teniendo en cuenta que uno de los objetivos principales es evitar el uso de antibióticos con espectro antipseudomonas para el tratamiento de enterobacterias. Sugerimos que a los aislamientos de Enterobacteriaceae que presenten un resultado de ertapenem o meropenem de 2 μg/mL, se les realice la prueba de Hodge modificada y los test con inhibidores de carbapenemasas (ácido borónico y EDTA/SMA)24.
- •
Fluoroquinolonas: este grupo de antibióticos comprende moléculas con actividad bactericida rápida y que alcanzan altas concentraciones en orina. Sin embargo, no deben ser una opción terapéutica empírica, debido a las altas tasas de resistencia en nuestro medio. Sugerimos, en pacientes de la comunidad, la tamización con norfloxacina y ciprofloxacina, para una mejor detección de resistencia y, con base en los resultados de las pruebas in vitro, la selección terapéutica más apropiada.
Buscando optimizar el uso de las fluoroquinolonas en el manejo de la ITU, proponemos estas estrategias de reporte, según el resultado in vitro (tabla 9):
- –
Norfloxacina sensible (S) - ciprofloxacina sensible (S): en pacientes de la comunidad y en pacientes candidatos a terapia secuencial, reportar norfloxacina o ciprofloxacina de acuerdo con el programa de uso apropiado de antibióticos en su institución.
- –
Norfloxacina resistente (R) - ciprofloxacina S: de acuerdo con las características del paciente, ciprofloxacina puede ser utilizada como una opción terapéutica y para terapia secuencial.
- –
Norfloxacina S - ciprofloxacina R: se debe bloquear el resultado de norfloxacina porque puede ser inactivo clínicamente. Esta regla también es aplicable para levofloxacina, la cual deberá reportarse como resistente25.
- –
Nota: teniendo en cuenta las altas tasas de resistencia a quinolonas en nuestro país, recomendamos evitar el uso empírico de ácido nalidíxico para el manejo de infecciones urinarias en niños y adultos. Su uso estará supeditado a la confirmación microbiológica de sensibilidad en el antibiograma con una CIM ≤ 16 μg/mL o un halo de inhibición ≥ 19mm.
Tabla 9.Puntos de corte para ciprofloxacina y norfloxacina
Grupo de Reporte Agente CIM (μg/mL) Halo de inhibición (mm) S I R S I R U Norfloxacina ≤ 4 8 ≥ 16 ≥ 17 13-16 ≤ 12 B Ciprofloxacina ≤ 1 2 ≥ 4 ≥ 21 16-20 ≤ 15 CIM: concentración inhibitoria mínima; I: intermedio; R: resistente; S: sensible; SDD: sensible dosis dependiente.
Fuente: Tomado de CLSI M100-S2415.
- –
- •
Nitrofurantoína: es una opción terapéutica para el manejo de infecciones urinarias bajas no complicadas en pacientes de la comunidad26. Sugerimos considerar las siguientes recomendaciones para su tamización y reporte:
- –
Reportar únicamente en aislamientos de orina; crear una regla de supresión para todos los demás tipos de muestra.
- –
No reportar en las siguientes especies: Morganella, Proteus, Providencia y Serratia, porque son intrínsecamente resistentes.
- –
- •
Aminoglucósidos: sugerimos tamizar simultáneamente gentamicina y amikacina. Tener en cuenta que Providencia es intrínsecamente resistente a gentamicina y, aunque se observe sensibilidad in vitro, no debe reportarse al médico. Igualmente, en Serratia, no reportar amikacina por resistencia natural; de requerirse un aminoglucósido, proponemos reportar gentamicina.
- •
Trimetoprim/sulfa: debe incluirse de rutina en el antibiograma de las infecciones urinarias en pacientes hospitalizados y de la comunidad. No debe ser una opción terapéutica empírica, debido a que las tasas de resistencia son muy elevadas. Debe utilizarse como terapia dirigida cuando el antibiograma demuestra sensibilidad.
- •
Fosfomicina trometamol (oral): es una opción terapéutica para el manejo de UTI baja no complicada y, además, presenta buena actividad contra cepas productoras de BLEE y, en ocasiones, de carbapenemasas. Para su tamización recomendamos:
- –
Utilizar de preferencia métodos con agar (disco difusión o E-test) empleando sensidiscos de 200μg de fosfomicina suplementados con 50μg de glucosa-6-fosfato. El punto de corte de sensibilidad es ≥16mm.
- –
Para Escherichia coli pueden reportarse los resultados obtenidos con métodos automatizados. El punto de corte de sensibilidad es ≤ 64μg/mL.
- –
Para Enterobacteriaceae diferentes de E. coli puede utilizarse microdilución en caldo (automatizados) pero sugerimos reconfirmar los resultados resistentes por difusión en disco o E-test.
- –
Ignorar las colonias que se localizan dentro de los halos de inhibición o dentro de las elipses de E-test cuando se tamiza fosfomicina; estas colonias generalmente corresponden a mutantes en las cuales predomina un defecto en la penetración del antibiótico; sin embargo, dadas las altas concentraciones que puede alcanzar en orina, este fenómeno carece de impacto clínico. Por esta misma razón, algunos aislamientos de E. coli que muestran resistencia in vitro a fosfomicina pueden presentar una respuesta terapéutica favorable.
- –
- •
- 2.
P. aeruginosa resistentes a carbapenémicos, pip/tazo, cefepime, aztreonam y amikacina, pueden ser tratadas con fosfomicina intravenosa (IV) en terapia combinada siempre que se demuestre sensibilidad27,28.
- •
Reportar todos los antibióticos activos contra P. aeruginosa: cefepime, aztreonam, piperacilina/tazobactam, meropenem, doripenem, imipenem, ciprofloxacina, amikacina y gentamicina. En aislamientos resistentes a meropenem, reportar colistina y fosfomicina IV por el método de microdilución en caldo (punto de corte de sensibilidad para fosfomicina IV en Pseudomonas ≤ 128 μg/mL)27.
- •
Utilizar los puntos de corte CLSI vigentes para todos los antibióticos. Idealmente, reportar la CIM, de manera que el clínico pueda escoger la mejor opción terapéutica.
- •
En aislamientos de Pseudomonas con perfil multisensible, incluir un pie de nota que sugiera de-escalonamiento a Pip/tazo, cefepime, o aztreonam; en especial en la UCI y en pacientes en quienes se haya iniciado un carbapenem.
- •
Pseudomonas multirresistente: incluir un pie de nota que proponga aislamiento de contacto y el uso de terapia combinada e infusión prolongada del antibiótico betalactámico.
- •
No debe reportarse tigeciclina en aislamientos urinarios, ya que no alcanza niveles terapéuticos adecuados y puede llevar a selección de resistencia a este antibiótico.
- •
- 3.
Enterococcus spp.: es importante la identificación a nivel de especie (E. faecalis y E. faecium) porque el abordaje terapéutico puede ser diferente. Sugerimos tamizar con ampicilina (sin sulbactam), ciprofloxacina, fosfomicina oral (E. faecalis), nitrofurantoína, vancomicina y gentamicina de alta carga, para determinar sinergia y evaluar su uso en infecciones sistémicas o complicadas (pielonefritis).
- 4.
S. aureus: reportar siempre oxacilina, ciprofloxacina, trimetoprim/sulfa, nitrofurantoína, gentamicina, vancomicina. No se recomienda reportar linezolid, eritromicina, tetraciclina y clindamicina. El hallazgo de S. aureus en orina puede significar absceso renal o bacteriemia. Se sugiere individualizar los casos de acuerdo conl contexto clínico del paciente.
- 5.
Staphylococcus saprophyticus: este microorganismo no requiere antibiograma y es inhibido por todos los antibióticos que alcanzan concentraciones terapéuticas en orina, excepto por fosfomicina oral e iv, para la cual muestra resistencia intrínseca.
- 6.
Streptococcus agalactiae: su presencia en orina significa generalmente colonización vaginal. En embarazadas, se propone reportar cualquier recuento de este microorganismo, aun por debajo del umbral para ITU. En mujeres con alergia o intolerancia a los betalactámicos, tamizar con eritromicina y clindamicina.
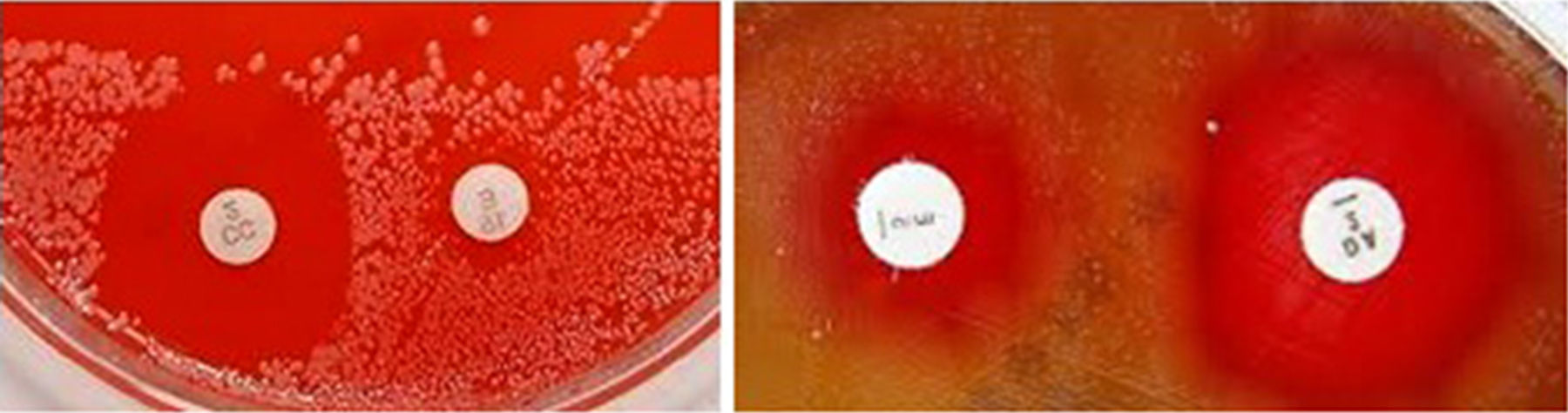
Si se observa resultado intermedio o resistente a eritromicina con sensibilidad a clindamicina debe realizarse el D-test en agar Mueller-Hinton+sangre de cordero al 5%, disminuyendo la distancia entre los bordes de los discos a 12mm y, si el resultado es positivo, suprimir el dato de clindamicina (fig. 2). Si el D-test es negativo, reportar únicamente la sensibilidad a clindamicina que se utilizaría para profilaxis antibiótica intraparto en lugar de vancomicina29, siempre con el aval del ginecólogo tratante. La eritromicina no debe reportarse en mujeres embarazadas bajo ninguna circunstancia y solo se utiliza para tamización in vitro.
Finalmente, sugerimos incluir en todos los urocultivos de pacientes no embarazadas o prequirúrgicos el siguiente pie de nota «descartar bacteriuria asintomática», ya que esto puede disminuir la presión selectiva ejercida por un sobreconsumo de antibióticos para esta condición.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEste artículo surge después de la reunión patrocinada por Zambon Colombia S.A.; sin embargo, dicha compañía no tuvo participación en la elaboración y no intervino en ninguno de los contenidos del presente artículo.
Agradecemos a Zambon Colombia S.A por el apoyo logístico durante el consenso de expertos en infección del tracto urinario no complicada.