La psoriasis es una enfermedad inflamatoria crónica de la piel, de origen autoinmune, en la que diferentes poblaciones de linfocitos T ayudadores (Th1 y Th17), así como los queratinocitos y las citocinas que producen estas poblaciones celulares han sido implicadas en la etiopatología de la enfermedad.
Los mecanismos de regulación epigenéticos son el puente de unión entre la exposición ambiental y los factores genéticos. Actualmente se sabe que los denominados micro-ARN (mi-ARN), ARN no codificantes de cadena simple, participan activamente en la regulación epigenética. Alteraciones en la expresión de miR-125b, miR-424, miR-21 y miR-203, entre otros, han sido implicados en diferentes aspectos de la enfermedad. Estudios globales de la expresión de mi-ARN, tanto por micromatrices como por secuenciamiento directo de ARN, han revelado importantes diferencias en la expresión de mi-ARN en piel de individuos normales y psoriáticos. Estos mi-ARN pueden ser considerados como posibles blancos terapéuticos o biomarcadores de enfermedad.
Psoriasis is a chronic inflammatory disease of the skin, of autoimmune origin, with different cells implicated in the aetiopathology, such as T helper lymphocytes (Th1 and Th17), keratinocytes, and cytokines produced by these cells. The epigenetic regulatory mechanisms are the junction between environmental exposure and genetic factors. It is known that microRNAs (miRNAs), single chain RNAs, are actively involved in epigenetic regulation. Alterations in the miR-125b, miR-424, miR- 21 and miR-203 expression, and others, have been involved in different aspects of the disease. Global studies of miRNA expression performed using microarrays and by direct RNA sequencing revealed important differences in miRNA expression in normal skin and psoriatic individuals. These miRNAs can be considered as potential therapeutic targets or biomarkers of disease.
La psoriasis es una enfermedad inflamatoria autoinmune de la piel, de carácter crónico, con recaídas y remisiones. Su nombre deriva de la palabra griega «psora» que significa «picar»1. Se caracteriza por una proliferación acelerada de queratinocitos, disminución de la apoptosis e infiltración por células inflamatorias, principalmente células dendríticas (DC) y linfocitos T CD4+2. En la psoriasis, el tiempo de tránsito de los queratinocitos desde la capa de células basales hasta la capa córnea es aproximadamente 10 veces más rápido que el de la piel normal, lo cual se ha asociado con trastornos en la diferenciación epidérmica3.
La prevalencia de la psoriasis varía con el origen étnico y la geografía, oscilando entre 0 y 3%. Los hombres y mujeres se afectan por igual. Las primeras manifestaciones ocurren alrededor de la edad de 20 años. Sin embargo es importante enfatizar que la psoriasis se puede manifestar a cualquier edad. Según la edad de aparición se han descrito 2 tipos de psoriasis: tipo i antes de los 40 años, con mayor probabilidad de ser familiar, con un curso clínico más severo y, tipo ii después de los 40 años que tiene menos relación con antecedentes familiares4. Aunque el principal compromiso es cutáneo, se considera una enfermedad sistémica puesto que se puede encontrar además compromiso de uñas y articulaciones, y se ha asociado a comorbilidades como obesidad, síndrome metabólico, enfermedad coronaria y depresión, entre otras5. Las placas psoriásicas se localizan con mayor frecuencia en la cara extensora de las extremidades, la región sacra y la cabeza. La lesión clásica de la psoriasis es una placa roja elevada, bien delimitada, con una superficie con escamas blancas. El tamaño de las lesiones puede variar desde pápulas puntiformes hasta placas que cubren grandes superficies. La psoriasis vulgar es la más frecuente y afecta aproximadamente al 85-90% de los pacientes. Tiene una alta morbilidad tanto por las lesiones como por las comorbilidades y los efectos secundarios de los tratamientos. Afecta significativamente la calidad de vida, impactando la esfera familiar, social y laboral de los pacientes6.
Varios cambios histológicos se pueden observar en las lesiones en desarrollo: acantosis con paraqueratosis que surge de la proliferación rápida de queratinocitos asociada con una disminución de la apoptosis, reducción o ausencia de la capa granular (hipogranulosis), marcada dilatación de los vasos sanguíneos en la dermis papilar que provoca eritema visible y un infiltrado inflamatorio denso compuesto de agrupamientos de células T CD4+ y DC en la dermis, y de células T CD8+ y neutrófilos en la epidermis7.
Inmunopatogénesis de la psoriasisEn la década de 1970 la psoriasis era reconocida como un trastorno hiperproliferativo, por lo que se postuló que la alteración en la proliferación y diferenciación epidérmica era la causa principal de las lesiones psoriásicas. Posteriormente en 1980 se describió la relación de esta enfermedad con los linfocitos Th1 productores de IFN-γ8. En el último decenio, nuevas evidencias implican a los linfocitos Th17, los macrófagos y las DC en la inducción y el mantenimiento de la psoriasis. La aparición de psoriasis en receptores de trasplantes hematopoyéticos de donantes afectados y la efectividad de tratamientos inmunosupresores como la ciclosporina, llevó a proponer el papel central del sistema inmune en la generación de la enfermedad8. Sin embargo, todavía no se ha establecido si la primera anormalidad en la psoriasis está en la piel o en el sistema inmune9,10. Actualmente se acepta que la enfermedad resulta de una anormalidad intrínseca en los queratinocitos epidérmicos y de la activación del sistema inmunológico tanto innato como adaptativo11.
Se reconocen 3 fases en la enfermedad4:
- 1.
Fase de sensibilización: Después de señales innatas recibidas a través de los receptores tipo Toll (toll like receptor [TLR]) o receptores para las proteínas de choque térmico (heat shock proteins [HSP]), las DC maduran y migran a los órganos linfoides secundarios donde presentan el antígeno a las células T CD4+ vírgenes, las activan y determinan el fenotipo Th1 y Th17 efector y de memoria. En esta fase no hay lesiones visibles en piel4.
- 2.
Fase silente: Tiene una duración variable y no hay lesiones visibles en piel. Las células T de memoria recirculan por el compartimento linfoide y los tejidos4.
- 3.
Fase efectora: Esta fase comienza con la infiltración de la piel por varias células inmunes como macrófagos, DC, células T y neutrófilos, generándose mecanismos efectores de la inmunidad innata y adaptativa. En esta fase se presenta inflamación, angiogénesis y una respuesta hiperproliferativa de los queratinocitos4.
El inicio de la enfermedad es mediado a través de DC que presentan antígenos extraños o propios aún no identificados a los linfocitos T12. Algunos estudios han indicado que la queratina 17 (K17) es altamente expresada en lesiones psoriásicas y algunos epítopes de K17 son homólogos de la secuencia de la proteína M de estreptococo13. En este sentido, se conoce que la infección estreptocócica precede a la psoriasis en más del 90% de pacientes con psoriasis tipo I14. Además, las infecciones o daños de la piel pueden promover la formación de lesiones en individuos susceptibles, y se ha demostrado que estos desencadenantes estimulan en los queratinocitos la producción de péptidos antimicrobianos como catelicidina (LL-37) formando complejos con fragmentos de ADN propio reconocidos por TLR-9 en las DC7,15. Se considera entonces, que el ADN del hospedero se convierte en un estímulo proinflamatorio que rompe la tolerancia inmunológica, conduciendo a la psoriasis7.
La activación de la célula T virgen requiere de la producción de IL-12 por las DC, induciéndose una polarización hacia una respuesta tipo Th1, la cual también requiere de la presencia del IFN-γ. A su vez, los linfocitos Th1 (CD4+ y CD8+) producen IFN-γ, TNF-α e IL-216. De otro lado, las citocinas IL-1β, IL-6 e IL-23 inducen el desarrollo de los linfocitos Th17. Estas células producen principalmente IL-17, IL-21 e IL-2217. La IL-23 es producida por DC y macrófagos, y es necesaria para el crecimiento, la supervivencia y las funciones efectoras de las células Th17. Tanto la IL-23 como las células Th17 han sido encontradas de forma abundante en las lesiones psoriásicas6,7. Además, se ha identificado en la epidermis psoriásica la presencia de células T CD8+ que producen IL-17 (Tc17)7. Ambos tipos de linfocitos T (CD4+ y CD8+) están presentes en la piel psoriásica: mientras los CD4+ infiltran principalmente la dermis, los CD8+ están preferencialmente en la epidermis14. Aunque ambos poblaciones de linfocitos están presentes, las células T CD4+ parecen jugar un papel crítico en la patogénesis de la psoriasis18.
Además de los linfocitos T, los macrófagos son predominantes en el infiltrado inflamatorio localizado en la dermis superficial cerca de la papila dérmica. Los macrófagos son una de las fuentes principales de TNF-α. También se pueden encontrar mastocitos que producen grandes cantidades de TNF-α, IFN-γ e IL-8, y pueden liberar mediadores almacenados en cuestión de minutos y crear rápidamente un entorno necesario en la respuesta innata para el reclutamiento de neutrófilos y linfocitos T14.
Además de la activación persistente de células inflamatorias, se ha reportado alteración en los mecanismos reguladores de la respuesta inmunológica. Aunque ciertos estudios han indicado que el número de células T reguladoras no está alterado en las lesiones psoriásicas, parece haber un defecto en su actividad supresora19; además, la IL-10, una importante citocina reguladora, está disminuida en la psoriasis18.
La tabla 1 muestra las principales citocinas que se han implicado en la psoriasis y sus funciones4,12,17,20.
Principales citocinas y sus funciones en la etiopatogénesis de la psoriasis
| Citocina | Función en la patogénesis de la psoriasis |
|---|---|
| IFN-γ | -Induce la producción de quimiocinas proinflamatorias en queratinocitos (CXCL9, 10 y 11), para atraer linfocitos Th1 dentro de las lesiones |
| TNF-α | -Inducción de la expresión de moléculas de adhesión y quimiocinas -Hiperplasia epidérmica y angiogénesis a través de la expresión de EGF y VEGF -Aumenta la sensibilidad a las IL-20, IL-22 e IL-23 |
| IL-6 | -Media la activación de los linfocitos T -Estimula la proliferación de queratinocitos -Media la respuesta de fase aguda |
| IL-8 | -Proporciona una señal quimiotáctica fuerte para los neutrófilos |
| IL-17 | -Estimula a los queratinocitos a producir quimiocinas (CXCL1, 3, 5, 6 y 8) atrayentes de neutrófilos -Induce CCL20 que atrae más linfocitos Th17 y células dendríticas -Induce en los fibroblastos la producción de IL-6, que compromete los linfocitos T vírgenes en el linaje Th17, perpetuando la inflamación |
| IL-20 | -Produce activación y proliferación de queratinocitos |
| IL-22 | -Modula en queratinocitos genes de diferenciación terminal, siendo uno de los principales inductores de hiperplasia epidérmica -Induce respuestas proinflamatorias al estimular la producción de citocinas, quimiocinas y proteínas de fase aguda por varios tipos celulares |
Se ha propuesto que la psoriasis es una enfermedad compleja de naturaleza poligénica. Estudios en gemelos monocigóticos han mostrado una concordancia con la enfermedad del 70-72%, mientras que la concordancia entre gemelos dicigóticos varía del 15 al 23%, indicando la importancia, tanto de la asociación genética como de aspectos ambientales de naturaleza desconocida1.
La naturaleza autoinmune de la psoriasis se sugirió a partir de su asociación con el complejo human leukocyte antigen (HLA) durante los años 1970. Primero se reportó asociación con el HLA-B13. Posteriormente, fuertes asociaciones fueron identificadas con Cw6 y DR7 en las poblaciones finlandesa y alemana1. Sin embargo, solo el 10% de las personas que expresan HLA-Cw6 desarrollan psoriasis, lo que indica un papel importante de los factores ambientales y genes adicionales5. Por otro lado, estudios de asociación utilizando barrido genómico (GWAS) han mostrado al menos 10 regiones cromosómicas con vinculación estadísticamente significativa denominadas regiones de susceptibilidad a psoriasis (PSORS1-PSORS10) (tabla 2). El mayor determinante genético es PSORS1, el cual está localizado en el cromosoma 6 e incluye la región del complejo mayor de histocompatibilidad y representa hasta el 35% de la heredabilidad de la enfermedad5. Los genes candidatos localizados en PSORS1 incluyen genes localizados dentro de la región HLA, dentro de la cual el candidato más fuerte es Cw0602, particularmente en el caso de la psoriasis tipo I. Las personas con HLA-Cw6 tienen un riesgo relativo 10 veces mayor de enfermedad. En esta misma región se encuentra el gen para la corneodesmosina, que codifica para una proteína de adhesión de los queratinocitos, la cual durante la maduración de la capa córnea se somete a una serie de divisiones requeridas para la descamación21. Además de lo anterior, se han reportado polimorfismos de nucleótido único (single nucleotide polymorphism [SNP]) asociados a la psoriasis en genes que codifican citocinas, receptores y moléculas de señalización como IL-23R, IL-23A, IL-12B, ZNF313 y PTPN2218.
Regiones de susceptibilidad a la psoriasis
| Regiones de susceptibilidad | Ubicación | Gen identificado |
|---|---|---|
| PSORS1 | 6p21 | HLA-Cw6, CCHCR1, CDSN |
| PSORS2 | 17q25 | SLC9A3R1, NAT9, RAPTOR |
| PSORS3 | 4q34 | Gen que codifica para una proteína que regula la producción de IFN tipo 1 Se relaciona con aparición temprana de la psoriasis |
| PSORS4 | 1q21 | Complejo de diferenciación epidérmica (epidermal differentiation complex [EDC]) |
| PSORS5 | 3q21 | SLC12A8 |
| PSORS6 | 19p13 | JUNB |
| PSORS9 | 4q31 | Varios genes que codifican para proteínas inmunológicamente relevantes residen en esta región, incluyendo el gen de la IL-15 |
Los cambios cromosómicos que son heredables, pero que no envuelven alteraciones en la secuencia del ADN, son conocidos como modificaciones epigenéticas. El perfil epigenético es altamente dinámico y reversible, y varía entre las células en el mismo organismo y en la misma célula, entre varios estados, tales como la salud versus enfermedad, o en respuesta a las perturbaciones ambientales. La evidencia ha demostrado que los desequilibrios epigenéticos son elementos causales en varias enfermedades importantes, incluyendo el cáncer y las enfermedades autoinmunes22.
Los mecanismos epigenéticos se consideran el puente entre los factores genéticos y ambientales en la patogénesis de la psoriasis23. Los 3 principales mecanismos de modificaciones epigenéticas son: metilación del ADN, modificación postranscripcional de las histonas y regulación por pequeñas moléculas de ARN no codificantes (nc-ARN)24 (tabla 3).
Mecanismos epigenéticos
| Mecanismo epigenético | Definición |
|---|---|
| Metilación del ADN | Transferencia de grupos metilos al carbono 5 de las bases citosinas (C) del ADN situadas previa y contiguamente a una guanina («islas CpG»). Con el efecto de la reducción de la expresión génica, por imposibilidad de la interacción ADN-proteínas Hipermetilación: Silenciamiento de genes. Hipometilación: Sobre expresión de ciertas proteínas |
| Modificación de las histonas | Las histonas que forman parte del nucleosoma sufren modificaciones postraduccionales como acetilación, fosforilación, metilación, glucosilación, ADP-ribosilación, etc. Estas modificaciones alteran las interacciones ADN-histonas, permitiendo o no el acceso de la maquinaria de transcripción al ADN |
| Regulación por ARN no codificante | Los micro-ARN son pequeños ARN endógenos, que impiden la expresión de un determinado gen, bloqueando la traducción o mediante la degradación |
Tabla original de los autores.
Fuente: Información tomada de Stein24.
Los efectos de la metilación del ADN y las modificaciones de las histonas en psoriasis han sido objeto de excelentes revisiones25–27 y no serán abordados aquí. En esta revisión nos centraremos en los nc-ARN, específicamente en los mi-ARN y su papel en la psoriasis con compromiso cutáneo.
ARN reguladoresUno de los avances más importantes para el entendimiento del control de la expresión génica fue el descubrimiento de moléculas de ARN que regulan la expresión de genes. A finales de 1990 los estudios realizados por Andrew Fire y Craig Mello demostraron que la expresión génica podía ser inhibida por la introducción de ARN de doble cadena con secuencias complementarias al gen blanco, un mecanismo que fue denominado ARN de interferencia (ARNi)28. Lin-4 fue el primer ARN de interferencia descubierto en el nemátodo Caenorhabditis elegans29. Desde su descubrimiento en el 2001, más de 1.400 ARNi han sido identificados en humanos30. Se han descrito varias clases de moléculas pequeñas de ARN que desencadenan este proceso de silenciamiento por interferencia. Dentro de estas las más conocidas son los ARN pequeños de interferencia (si-ARN) y los mi-ARN28.
Los si-ARN pueden ser endógenos o exógenos, pueden ser codificados en el genoma o ser introducidos exógenamente a través de infecciones virales o mediante transgénesis. Los si-ARN endógenos pueden ser generados a partir de 2 transcritos separados pero complementarios, por ejemplo, a partir de la transcripción bidireccional del mismo locus, los cuales son posteriormente procesados para formar si-ARN. Aunque sus funciones no se conocen completamente, se han asociado con protección contra infecciones virales28.
Los mi-ARN, aunque presentan mucha similitud con los si-ARN, son producidos en parte por una vía de síntesis diferente y son transcritos a partir de genes celulares31. Los mi-ARN son un grupo de ARN pequeños de aproximadamente 20 a 22 nucleótidos (nt) no codificantes, y median la regulación postranscripcional. Los genes que codifican los mi-ARN pueden ser encontrados dentro de los intrones de genes codificantes y no codificantes, dentro de los exones de genes no codificantes y regiones intergénicas32. Aproximadamente el 50% de todos los mi-ARN conocidos están localizados dentro de los intrones de genes que codifican para proteínas, indicando que un gran número de mi-ARN podrían estar regulados por el promotor de su gen hospedador33. Se ha estimado que los mi-ARN regulan aproximadamente el 30% de los genes humanos. Un mi-ARN puede regular muchos diferentes ARNm (promedio 200) y un ARNm puede ser regulado por más de un mi-ARN29. Muchos de los mi-ARN conocidos están localizados dentro o cerca de sitios cromosómicos frágiles, en regiones de pérdida de heterocigocidad, en regiones de amplificación génica o en puntos de rotura habitualmente asociados a tumores34.
Los mi-ARN participan en casi todos los aspectos de la fisiología celular35. La evidencia acumulada hasta la fecha indica que los mi-ARN participan en la diferenciación celular, apoptosis, defensa antiviral y son cruciales en el desarrollo y función de las células del sistema inmunológico; además, participan en procesos como la secreción de insulina y el metabolismo del colesterol29. Dada la importancia de su función, su expresión anormal puede permitir la aparición de enfermedades neoplásicas, autoinmunes, cardiovasculares, musculoesqueléticas, pulmonares y del desarrollo30. Esta expresión anormal se ha podido explicar por mutaciones, inactivación mediada por procesos epigenéticos y por amplificación génica. Además, mutaciones en la región 3’ no traducida (3’ UTR) de un ARNm puede generar un nuevo sitio de unión de mi-ARN o afectar la habilidad de unión del mi-ARN36.
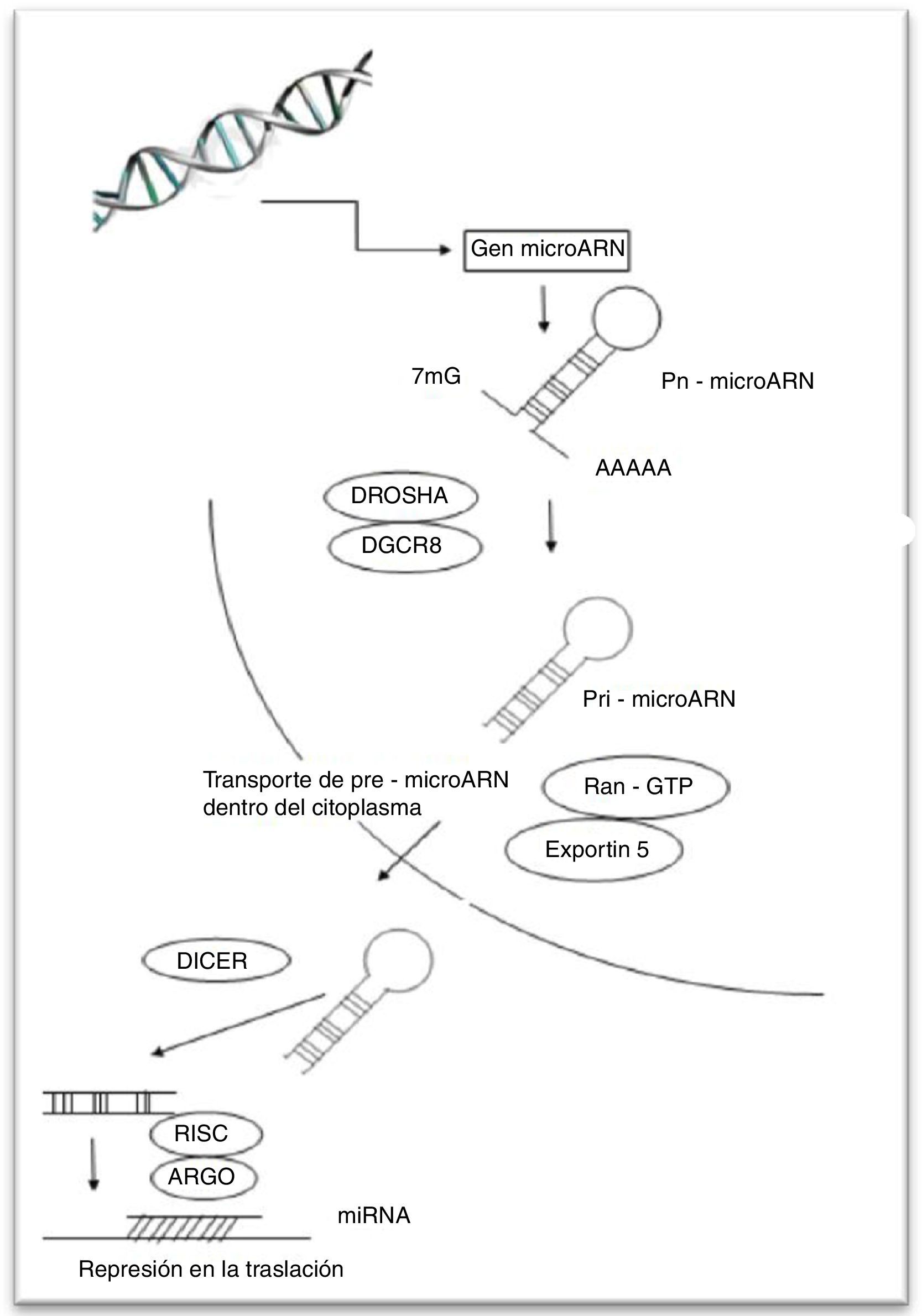
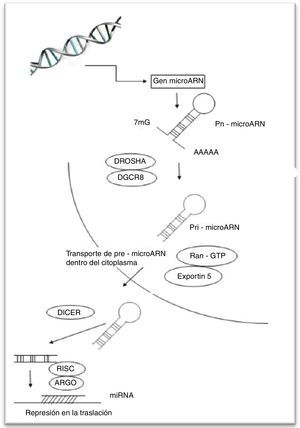
Generación de los mi-ARNLos genes de mi-ARN son transcritos por la ARN polimerasa II, generan un transcrito primario de ARN que puede tener varios kilobases de longitud con regiones de complementariedad parcial, y dan lugar a una estructura secundaria conocida como tallo asa u horquilla (stem loop o hairpine)28, poliadenilada en su extremo 3’ y con una 7-metilguanocina en su extremo 5’2. Esta estructura se denomina un mi-ARN primario o pri-mi-ARN. Luego, el tallo asa es procesado por un complejo enzimático que comprende Drosha (una ribonucleasa tipo III) y su cofactor DGCR8, generando un mi-ARN precursor (pre-mi-ARN) de aproximadamente 60 nt. Un pre-mi-ARN típico contiene un asa imperfectamente apareada de aproximadamente 33 pares de bases (pb). Dos nucleótidos sobresalientes en el extremo 3’ del pre-mi-ARN son reconocidos por exportina 5, que lo transporta desde el núcleo al citoplasma11. En el citoplasma, Dicer (otra RNasa tipo III) asociada con su cofactor TRBP, digiere ambas cadenas del pre-mi-ARN, retirando su estructura asa y produciendo una corta molécula de doble cadena de aproximadamente 22 nt32. Este mi-ARN de doble cadena se asocia con un complejo proteínico llamado inductor de silenciamiento RISC (RNA induced silencing complex). En este complejo las 2 hebras son separadas. La denominada hebra guía permanece unida a RISC, mientras que la complementaria es degradada. Un importante componente de RISC es una proteína llamada argonauta 2 (AGO2)28,37. Los mi-ARN interactúan con la familia de proteínas argonauta y las guían hacia blancos específicos localizados en la región 3’ UTR de los mARN blancos, resultando en represión translacional y degradación del mARN10. El mi-ARN en su región 5’ tiene una región de 2 a 7 nucleótidos, conocida como la región semilla (seed), la cual es muy importante para la interacción entre mi-ARN y ARNm11. Se ha propuesto que el grado de complementariedad entre el ARNm diana y el mi-ARN determina el mecanismo por el cual la regulación de la expresión génica se lleva a cabo; si la complementariedad es muy alta, el ARNm es degradado. Alternativamente, si la complementariedad es insuficiente, la regulación es ejecutada a través de la traducción38,39. El silenciamiento es mediado por miembros de la familia AGO, los cuales inducen deadenilación, degradación o inhibición transcripcional del ARNm40,41. En humanos, la mayoría de los mi-ARN tienen complementariedad insuficiente, mientras que los si-ARN tienen una alta complementariedad28 (fig. 1).
Formación de micro-ARN.
El mi-ARN es transcrito por la ARN polimerasa II a partir del ADN, generando un transcrito primario (pri-mi-ARN) que es cortado por la ribonucleasa DROSHA/DGCR8 y que lo convierte en una molécula de menor tamaño llamada pre-mi-ARN. Esta es trasportada por exportin 5 al citoplasma, y allí otra ribonucleasa, Dicer iii, retira la estructura asa, produciendo una molécula de doble cadena, la cual se une a RISC y solo la hebra guía permanece unida. El mi-ARN interactúa con AGO2 un componente de RISC, guiándolo a blancos específicos, resultando en la represión traslacional o degradación del mARN.
Los mi-ARN se han encontrado en diferentes tejidos, suero, orina, y plasma, entre otros. En la sangre son incorporados dentro de micropartículas y exosomas (vesículas de membrana de 50 a 90nm), previniendo su degradación enzimática42.
La función de los mi-ARN en la pielLa piel representa el órgano más grande del cuerpo humano. Los mi-ARN juegan un papel fundamental en el desarrollo normal de la piel. Evidencias en el modelo experimental del ratón han mostrado que la deficiencia de Dicer resulta en alteraciones en el desarrollo de la epidermis28,43. Actualmente, un creciente número de reportes han identificado a los mi-ARN como reguladores de la morfogénesis y homeostasis de la piel y sus apéndices32. Por ejemplo, miR-203 estimula la diferenciación de las células madre epidérmicas, al suprimir la producción de p63, una proteína que induce la estratificación epitelial durante la embriogénesis y mantiene el potencial proliferativo de los queratinocitos maduros en la membrana basal de la epidermis2,44. Otro mi-ARN, miR-31 es altamente expresado durante la fase catágeno y es necesario para un crecimiento óptimo del folículo y la formación del pelo. Además, miR-125b, altamente expresado en células madres, actúa como un represor de la diferenciación de las células tallo32.
Psoriasis y mi-ARNEn un estudio reciente utilizando la técnica de secuenciamiento de última generación ARNseq, se comparó la expresión de mi-ARN entre piel sana y piel proveniente de individuos con psoriasis. Este estudio reveló la expresión diferencial (2-42 veces) de 98 mi-ARN entre piel sana y piel psoriásica. Entre los mi-ARN diferencialmente expresados se encontraron algunos que juegan un papel en la diferenciación epidérmica (miR-135b, miR-205, miR-203), inflamación (miR-142-3p y miR-223/223*) y angiogénesis (como miR-21, miR-31 miR-378, miR-100 y miR-31), entre otros, lo que indica que estos mi-ARN podrían estar asociados con el fenotipo inflamatorio e hiperproliferativo característico de las lesiones psoriásicas45.
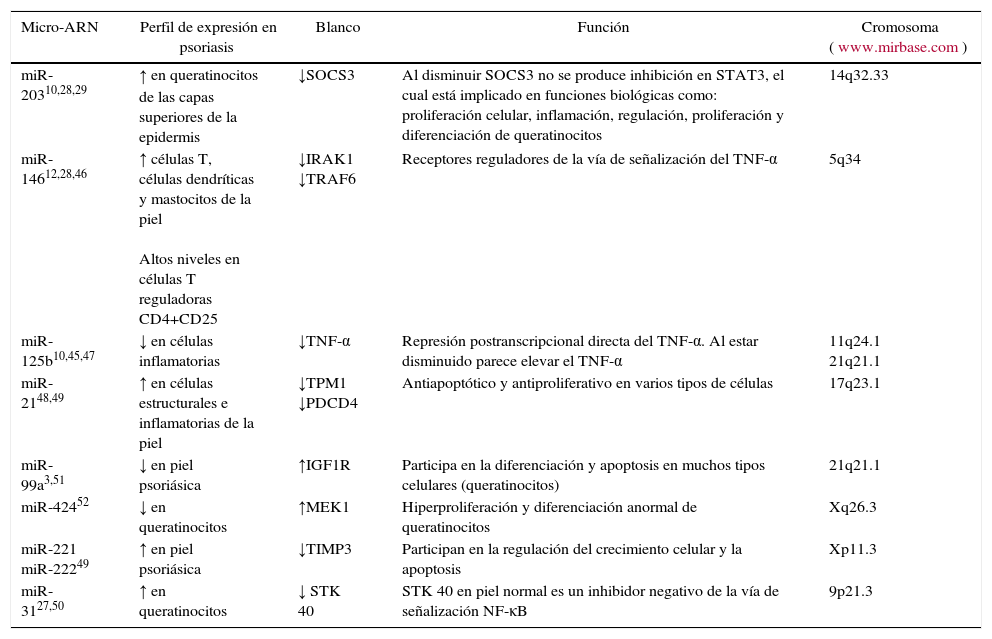
A continuación, se describirán las funciones de aquellos mi-ARN que potencialmente podrían jugar un papel predominante en la enfermedad psoriásica (tabla 4).
Micro-ARN y psoriasis
| Micro-ARN | Perfil de expresión en psoriasis | Blanco | Función | Cromosoma (www.mirbase.com) |
|---|---|---|---|---|
| miR-20310,28,29 | ↑ en queratinocitos de las capas superiores de la epidermis | ↓SOCS3 | Al disminuir SOCS3 no se produce inhibición en STAT3, el cual está implicado en funciones biológicas como: proliferación celular, inflamación, regulación, proliferación y diferenciación de queratinocitos | 14q32.33 |
| miR-14612,28,46 | ↑ células T, células dendríticas y mastocitos de la piel Altos niveles en células T reguladoras CD4+CD25 | ↓IRAK1 ↓TRAF6 | Receptores reguladores de la vía de señalización del TNF-α | 5q34 |
| miR-125b10,45,47 | ↓ en células inflamatorias | ↓TNF-α | Represión postranscripcional directa del TNF-α. Al estar disminuido parece elevar el TNF-α | 11q24.1 21q21.1 |
| miR-2148,49 | ↑ en células estructurales e inflamatorias de la piel | ↓TPM1 ↓PDCD4 | Antiapoptótico y antiproliferativo en varios tipos de células | 17q23.1 |
| miR-99a3,51 | ↓ en piel psoriásica | ↑IGF1R | Participa en la diferenciación y apoptosis en muchos tipos celulares (queratinocitos) | 21q21.1 |
| miR-42452 | ↓ en queratinocitos | ↑MEK1 | Hiperproliferación y diferenciación anormal de queratinocitos | Xq26.3 |
| miR-221 miR-22249 | ↑ en piel psoriásica | ↓TIMP3 | Participan en la regulación del crecimiento celular y la apoptosis | Xp11.3 |
| miR-3127,50 | ↑ en queratinocitos | ↓ STK 40 | STK 40 en piel normal es un inhibidor negativo de la vía de señalización NF-κB | 9p21.3 |
Tabla original de los autores. Se indica la referencia bibliográfica de los diferentes mi-ARN.
Fue el primero en conocerse en la piel normal46. Se expresa en altos niveles en piel y en bajos niveles en órganos que también contienen epitelio escamoso, que indica una función específica en la formación o función del epitelio escamoso. Dentro de la piel, miR-203 se expresa en queratinocitos pero no en otras células como melanocitos, fibroblastos o DC28. No se expresa en la capa basal proliferativa pero es detectado en las capas superiores29. Se cree que uno de sus blancos es la supresión de suppressor of cytokine signaling 3 (SOCS-3), el cual es un regulador negativo de la vía de signal transducer and activator of transcription 3 (STAT-3) que es activado por citocinas inflamatorias como IL-6 e IFN-γ. El aumento en la expresión de miR-203 en la psoriasis permite la disminución de los niveles de SOCS-3, resultando en la activación sostenida de la vía de STAT-3 por citocinas proinflamatorias10. STAT-3 juega un papel fundamental en muchas actividades biológicas tales como la proliferación celular, migración, inflamación, oncogénesis y regulación inmune2. La activación constitutiva de esta vía ha sido reportada en ratones transgénicos con fenotipo similar a psoriasis, destacando su relevancia en esta enfermedad10. Además de la modulación de las respuestas inflamatorias, SOCS-3 también ha sido implicado en la regulación de la proliferación y diferenciación de los queratinocitos29.
miR-146aLa expresión de miR-146a se encuentra anormalmente elevada en piel de pacientes con psoriasis11. Aunque su expresión es ubicua, es altamente expresado en órganos como el timo y el bazo; en células T, DC y mastocitos en la piel, pero no en queratinocitos o fibroblastos, demostrándose baja expresión en piel sana28,46. Está envuelto en la regulación de la respuesta inmune innata y la vía del TNF-α. Se ha demostrado que inhibe la expresión de interleukin-1 receptor-associated kinase 1 (IRAK-1) y TNF receptor-associated factor 6 (TRAF-6), receptores reguladores de la vía de señalización del TNF-α. Dada su alta expresión en células T reguladoras CD4+ CD25+, se ha indicado que este mi-ARN puede influir en la función de las células T reguladoras en psoriasis46.
miR-125bEs expresado en bajo niveles en células inflamatorias en comparación con células estructurales (fibroblastos, queratinocitos y melanocitos). Participa en la represión postranscripcional directa del TNF-α y su expresión se encuentra disminuida en piel psoriásica45, en comparación con la piel sana, lo que parece contribuir en la producción elevada de TNF-α durante la inflamación de la piel10. También han encontrado que miR-125b modula la proliferación y diferenciación de queratinocitos a través de la regulación del receptor del factor de crecimiento de fibroblasto (fibroblast growth factor receptor [FGFR2])47.
miR-21Es conocido como un oncogén y se ha demostrado en cánceres de órganos sólidos y en leucemia. Actúa como un agente antiapoptótico en varios tipos celulares. Meisgen et al. encontraron sobreexpresión de miR-21 en piel comprometida de pacientes con psoriasis en comparación con piel sana. El aumento de la expresión en células epidérmicas y en linfocitos T infiltrantes activados puede contribuir a la inflamación por suprimir la apoptosis de las células T48. Además 2 de los blancos de miR-21 son tumor suppressor protein tropomyosin 1 (TPM1) y programmed cell death 4 (PDCD4), que se han encontrado subregulados en pacientes con psoriasis, lo que permitiría mayor proliferación de los queratinocitos49.
miR-31También se ha encontrado altamente expresado en queratinocitos de piel con psoriasis; contribuye a la inflamación en las lesiones de psoriasis, regulando la producción de citocinas inflamatorias y quimocinas, al bloquear la expresión del gen de la cinasa serina/treonina 40 (STK 40), el cual es un regulador negativo de la vía de señalización NF-κB. En un estudio se encontró que la interferencia de miR-31 disminuye la habilidad de los queratinocitos para activar las células endoteliales y la atracción de leucocitos27,50.
miR-99aEstá envuelto en la diferenciación de queratinocitos a través de la regulación del receptor del factor de crecimiento insulínico tipo 1 (insulin-like growth factor 1 receptor [IGF-1R]). En piel psoriásica miR-99a se encuentra disminuido3. El IGF-1R juega un papel importante en el crecimiento celular, diferenciación y apoptosis en muchos tipos celulares (queratinocitos). Los queratinocitos de pacientes con psoriasis son más susceptibles a la proliferación por estimulación de IGF-1R comparados con queratinocitos normales. IGF-1R es expresado por queratinocitos basales y suprabasales y es más abundante en lesiones psoriásicas51.
miR-424En un estudio realizado por Ichihara et al.52 se encontró disminución de miR-424, permitiendo la sobreexpresión de mitogen-activated protein kinase 1 (MEK1) o ciclina E1 en queratinocitos. MEK1 es conocida en la activación de la cascada de las proteínas cinasa activadas por mitógenos (mitogen-activated protein kinases [MAPK]) y media la hiperproliferación y diferenciación anormal de queratinocitos humanos. La ciclina E1 participa en la proliferación celular y oncogénesis. Por inmunohistoquímica se encontró que la expresión de MEK1 o ciclina E1 estaba incrementada en psoriasis en comparación con piel normal52.
El psoriasis susceptibility related rna gene induced by stress (PRINS) un ARN no codificante (nc-RNA) sobreexpresado en piel comprometida y no comprometida de piel psoriásica e inducido por estrés fue recientemente descrito por Sonkoly et al.53. El bloqueo de la expresión de PRINS resultó en la disminución de la expresión de G1P3, la cual es expresada predominantemente en las capas suprabasales de la epidermis y es sobreexpresada en la psoriasis. PRINS es expresado en mayor cantidad en la epidermis no comprometida de pacientes psoriásicos en comparación con lesiones psoriásicas y epidermis normal, que indica que PRINS podría ser un factor de susceptibilidad a psoriasis. Señales de estrés, tales como radiación UV o infecciones por Herpes simplex, resultaron en un incremento en los niveles de ARN de PRINS. Se ha propuesto que PRINS podría jugar un papel protector en células expuestas a estrés y que el incremento de su expresión en la epidermis puede contribuir a la susceptibilidad a la psoriasis. Previamente se conocía que G1P3 antagoniza a tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) mediador de apoptosis. Sus datos indican entonces que G1P3 inhibe la apoptosis espontánea de queratinocitos y por tanto su alta expresión en piel psoriásica podría contribuir al incremento de la velocidad de producción celular y el grosor de la epidermis53.
miR-122Está subregulado en psoriasis al igual que miR-99b33.
miR-221/222Se encuentran sobrerregulados en psoriasis, actúan en la reducción de los niveles de tissue inhibitor of metalloproteinase-3 (TIMP3) y participan en la regulación del crecimiento celular y la apoptosis en psoriasis49.
Otros tipos de mi-ARN, denominados no canónicos y ARN de interferencia pequeños endógenos (endo-si-ARN) también se han detectado en piel psoriásica. Los mi-ARN no canónicos son aquellos que no se procesan por la vía regular y se originan de loci genómicos que codifican para ARN nucleolares pequeños (sno-ARN), t-ARN e intrones, mientras que los endo-si-ARN se originan en elementos repetitivos, incluyendo algunos transposones. La comparación entre piel sana y psoriásica identificó 15 mi-ARN no canónicos y endo-si-ARN diferencialmente expresados, sugiriendo que estos ARN también pueden jugar un papel patológico en la psoriasis54.
El futuroLos resultados actuales sugieren que mi-ARN pueden jugar un papel crítico en el control de la diferenciación celular en la piel normal, y alteraciones en su expresión han sido correlacionadas con cambios en piel psoriásica. Por consiguiente, algunos mi-ARN o patrones de expresión de mi-ARN podrían ser utilizados como biomarcadores o bioperfiles para enfermedad o tratamiento36.
Los mi-ARN pueden servir como blancos terapéuticos en el futuro. Están envueltos en el desarrollo normal del sistema inmunológico y en la patogénesis de los desórdenes inflamatorios crónicos, tales como la psoriasis10. Las primeras investigaciones se han enfocado en degeneración macular, infección por virus sincitial respiratorio, terapia antiviral, enfermedades neurodegenerativas y cáncer, silenciando la sobrerregulación de genes en células tumorales o genes envueltos en la división celular29. Para mi-ARN que están subexpresados, la reintroducción de mi-ARN maduro dentro de los tejidos afectados podría restaurar la regulación del gen blanco55.
Un área clave de investigación en el uso de ARNi para aplicación clínica es el desarrollo de un método seguro de entrega, el cual envuelve el sistema de vectores virales (lentivirus, adenovirus) y no virales tales como nanopartículas y aptámeros. Estos últimos son oligonucleótidos de cadena sencilla capaces de reconocer de forma específica y con alta afinidad a varios tipos de moléculas diana. Otra estrategia para tumores sólidos es la entrega del si-ARN por electroporación55.
El suministro local tiene la ventaja evidente de que las dosis de mi-ARN requeridas para un efecto son considerablemente más bajas. Además la administración tópica también permite una entrega más localizada, evitando cualquier efecto secundario no deseado potencialmente asociado con la administración sistémica. La entrega exitosa de si-ARN de forma localizada, de uso pertinente para dermatología, se ha descrito en ratones empleando electroporación en la piel in vivo32.
ConclusiónEn la revisión se presentan los aspectos inmunopatogénicos de la psoriasis y se realiza un enfoque en el ARN de interferencia, como mecanismo epigenético, capaz de controlar la expresión génica, con un patrón específico de presentación en la psoriasis. La mejor compresión de estos mecanismos podría permitir en un futuro desarrollar herramientas de tratamiento más eficaces y orientadas a puntos clave de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.