Revisamos los anticuerpos neuronales descritos en las enfermedades del SNC con el fin de clarificar su valor diagnóstico. En este estudio los anticuerpos neuronales asociados con los síndromes resultantes de la disfunción neuronal del SNC se clasifican en 2 grupos en función de la localización del antígeno dentro de la neurona o en la membrana celular. El grupo i incluye los anticuerpos cuya diana son antígenos intracelulares y probablemente no son patogénicos. Estos incluyen anticuerpos onconeurales (Hu [ANNA1], Yo [PCA1], Ri [ANNA2], CV2 [CRMP5], amphiphysin, Ma2, Tr, SOX1) que son útiles para el diagnóstico de los síndromes neurológicos paraneoplásicos (SNP). Otros anticuerpos de este grupo, principalmente anticuerpos anti-descarboxilasa del ácido glutámico (GAD), identifican otros síndromes no paraneoplásicos como el síndrome de la persona rígida (SPS), la ataxia cerebelar y la encefalitis límbica (LE). Los anticuerpos del grupo ii reconocen antígenos de la superficie neuronal. Los anticuerpos de este grupo se asocian con síndromes característicos del SNC, pero su detección no indica que el trastorno sea paraneoplásico. Los más frecuentes son los anticuerpos anti-receptor NMDA, seguidos de los anticuerpos contra la proteína LGl1 asociada al canal de potasio. Otros anticuerpos menos comunes incluyen aquellos contra los receptores de AMPA, GABAb, mGluR 1 y 5 y contra CASPR2. Se sugiere un papel patogénico de los anticuerpos debido a la respuesta de los síntomas a la terapia inmunológica y la correlación entre la titulación del anticuerpo y los resultados neurológicos.
We review the neuronal antibodies described in CNS disorders in order to clarify their diagnostic value. In this work, the neuronal antibodies associated with syndromes resulting from CNS neuronal dysfunction were classified into two groups according to the location of the antigen inside the neuron or in the cell membrane. Group I includes antibodies that target intracellular antigens and are probably not pathogenic. They include onconeural antibodies (Hu [ANNA1], Yo [PCA1], Ri [ANNA2], CV2 [CRMP5], amphiphysin, Ma2, Tr, SOX1), which are useful for the diagnosis of paraneoplastic neurological syndromes (PNS). Other antibodies of this group, mainly anti-glutamic acid decarboxylase (GAD) antibodies, identify non-paraneoplastic syndromes (PNS), such as stiff-person syndrome (SPS), cerebellar ataxia, and limbic encephalitis (LE). Group II antibodies recognize neuronal surface antigens. Antibodies in this group are associated with characteristic CNS syndromes, but their detection does not indicate that the disorder is paraneoplastic. The most frequent are the anti-receptor NMDA antibodies, followed by the antibodies against the protein LGI1 associated with the potassium channel. Other less common antibodies include those against the receptors of AMPA, GABAb, mGluR 1 and 5, and against CASPR2. A pathogenic role of the antibodies is suggested by the response of symptoms to immunotherapy, and the correlation between antibody titers and neurological outcome.
La identificación y detección de anticuerpos ha sido muy útil para la valoración de enfermedades autoinmunes, tanto sistémicas como órgano específicas. En esta última década se han detectado también asociados a manifestaciones neurológicas complejas, con o sin presencia de un tumor asociado a los autoanticuerpos antineuronales (AAN).
Una respuesta inflamatoria no específica respondería a inmunidad innata, mientras que la respuesta específica de linfocitos y anticuerpos frente al antígeno correspondería a la inmunidad adaptativa. La presencia de anticuerpos nos ayuda, en mayor o menor grado, al diagnóstico y posible tratamiento de las diferentes enfermedades relacionadas. Por tanto, el manejo de los anticuerpos como marcadores inmunológicos en las enfermedades neurológicas es actualmente imprescindible1.
Cuando utilizamos el termino «síndrome neurológico paraneoplásico» (SNP), que también se denomina «efectos remotos del cáncer sobre el sistema nervioso», se hace referencia a un grupo heterogéneo de trastornos neurológicos que constituyen menos del 1% de las complicaciones neurológicas del cáncer, generalmente mediadas por un mecanismo inmunopatogenético. Las manifestaciones derivadas de la invasión directa del tumor al sistema nervioso no se consideran como un SNP, ni tampoco las complicaciones no metastásicas, como son los efectos secundarios del tratamiento, infecciones, coagulopatías y déficits metabólicos o nutricionales.
El cuadro neurológico se presenta, generalmente, hasta un año antes de la detección del cáncer asociado, por lo que un correcto y adecuado diagnóstico puede permitir la detección precoz del mismo y, por tanto, ser potencialmente tratable2.
Los SNP pueden afectar a cualquier parte del sistema nervioso desde la corteza cerebral hasta la unión neuromuscular y el músculo. Los síntomas pueden estar relacionados con una alteración aislada de un área del sistema nervioso (encefalitis límbica) o únicamente con un tipo celular (células de Purkinje del cerebelo), aunque también pueden afectar a múltiples niveles del sistema nervioso. Los SNP no tienen una clínica específica, y cuadros idénticos pueden manifestarse en pacientes que no tienen ni desarrollaran cáncer.
Muchos de estos SNP se asocian a mecanismos inmunológicos y a una respuesta inmunológica frente a antígenos compartidos por el tumor y tejido neuronal, y la detección serológica de los anticuerpos específicos puede facilitar su diagnóstico. Por lo que, ante la sospecha de un SNP debemos realizar el estudio de los anticuerpos onconeuronales.
La relación entre déficit neurológico, autoinmunidad y cáncer es complicada. No todos los pacientes con SNP presentan anticuerpos circulantes (esto no descarta que la causa del SNP sea autoinmune), también nos podemos encontrar pacientes neurológicamente asintomáticos con cáncer y presencia de estos anticuerpos.
En el SNP «clásico», especialmente degeneración cerebelar paraneoplásica (DCP), encefalomielitis, encefalitis límbica (EL) y encefalitis del tronco del encéfalo, existe una alta probabilidad de que dicho síndrome esté asociado a un tumor. Sin embargo, a pesar de presentar anticuerpos y síntomas neurológicos evidentes, en algunos pacientes no se encuentra el tumor asociado a pesar de un seguimiento exhaustivo y prolongado durante varios años.
El tumor expresa proteínas normalmente restringidas a las neuronas y se produce una reacción inmune contra epítopos compartidos como un «efecto secundario» del sistema inmunológico para intentar reducir el tumor. El antígeno tumoral es idéntico al antígeno neuronal, lo que desencadena una respuesta autoinmune que puede controlar el crecimiento tumoral de forma parcial, o en algunos casos, incluso puede llegar a destruir por completo el tumor. Hay evidencia clínica de que la inmunidad antitumoral que se genera en estos síndromes puede eliminar las células neoplásicas3.
La teoría inmunológica se basa en mecanismos inmunopatogénicos. El anticuerpo reacciona con un antígeno localizado en el interior de la célula; se han descrito infiltrados inflamatorios, lo que implica una disfunción de las células T reguladoras. Los tumores asociados con el SNP son histológicamente idénticos a cualquier otro, excepto por la infiltración de mediadores inmunológicos como las células T4.
La presencia de anticuerpos frente antígenos de superficie está mediada por «mecanismos de inmunidad humoral». Se produce sobre todo en la EL de origen paraneoplásico o idiopática y predice un pronóstico más favorable con buena respuesta a inmunoterapia, corticoides y plasmaféresis. Los tumores asociados pueden ser teratoma, timoma o ninguno, como en el caso de anticuerpos anti-LGI1.
Si lo que detectamos son los anticuerpos frente a antígenos intracelulares son «mecanismos de inmunidad celular» linfocitos T citotóxicos (CD4+ y CD8+). Son los denominados SNP clásicos de peor pronóstico y pobre respuesta a inmunoterapia y corticoides. Se relacionan con tumores asociados con cáncer de pulmón, de mama y seminoma, entre otros.
La presencia de estos anticuerpos en los SNP tiene un interés diagnóstico y pronóstico. Son marcadores de actividad y pronóstico de la enfermedad.
Es importante en estos casos descartar previamente la existencia de enfermedad autoinmune sistémica con afectación neurológica como LES, vasculitis, síndrome antifosfolípido, crioglobulinemia o neuropatía infecciosa5.
En pacientes con síntomas neurológicos de causa incierta la detección de estos anticuerpos es indicativa de que el proceso tiene un origen paraneoplásico y prácticamente diagnóstico. En estos casos es preciso dirigir la búsqueda del tumor a diferentes órganos en función del tipo de anticuerpo, y el estudio debe completarse con pruebas de neuroimagen con el fin de descartar otros diagnósticos.
Existen anticuerpos asociados a otras enfermedades neurológicas. En enfermedades desmielinizantes, como la neuromilitis óptica (NMO), los marcadores inmunológicos serian los anticuerpos anti-aquoporina-4. La determinación de los anticuerpos anti-gangliósidos es importante en neuropatías como el síndrome de Guillain-Barré (SGB), los anti-glutamato-descarboxilasa (GAD) en el síndrome de persona rígida y la determinación de anticuerpos anti-receptor de acetilcolina (AChR) y anticuerpos contra canales de calcio dependientes de voltaje (VGCC) en las enfermedades neuromusculares como la miastenia gravis (MG) o el síndrome miasténico de Lambert-Eaton (LEMS)6,7.
Principales autoanticuerpos antineuronalesLos AAN pueden clasificarse en intracelulares y extracelulares según la localización de su diana antigénica con o sin SPN1.
Anticuerpos anineuronales intracelularesA-1) anticuerpos onconeuronales clásicos que van dirigidos contra Ag intracelulares; se ha demostrado síntesis intratecal y papel secundario en el proceso inflamatorio. Se presentan frecuentemente asociados a neoplasias y síndromes neurológicos. «Anticuerpos neurológicos paraneoplásicos»: anti-Hu (ANNA-1), anti-Yo (PCA-1), anti-CV2 (CRMP5), anti-anfifisina, anti-Ri (ANNA-2), anti-Ma2 (PMNA2) y anti-Tr (PCA-Tr)7.
A-2) Anticuerpos onconeuronales que se expresan en el SNC con cáncer de pulmón asociado y sin clara evidencia de que la respuesta inmune contra el antígeno sea la causa del cuadro neurológico asociado: anti-Zic4 y anti-SOX8.
A-3) Anticuerpos intracelulares no relacionados con el cáncer asociados a diferentes síndromes del SNC: anti-GAD.
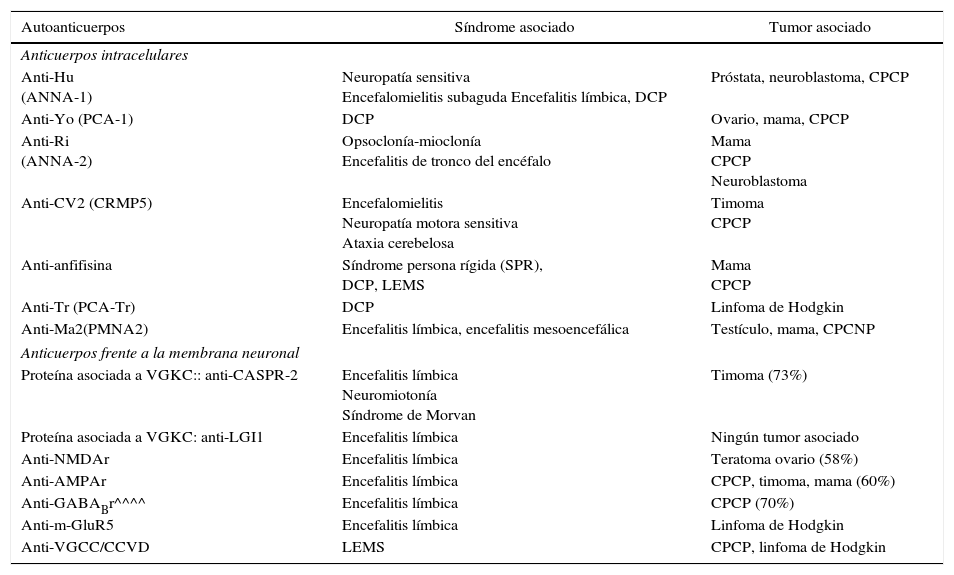
1.1Anticuerpos onconeuronales clásicos (tabla 1)1.1.1Anticuerpos anti-Hu (ANNA-1)Su antígeno se localiza en los núcleos y el citoplasma de todas las neuronas y también en las células tumorales. Son anticuerpos frente a una familia de proteínas de unión al ARN (Hu-D, Hu-C y Hel N1), de tamaño molecular de 35-40kDa. Se expresan en los núcleos de las neuronas del sistema nervioso central (SNC) y periférico (SNP) Tienen una importante función en el desarrollo y mantenimiento de las neuronas. Se postula su implicación en la estabilidad del mARN9. tabla 1.
Anticuerpos onconeuronales en síndromes neurológicos paraneoplásicos (SNP)
| Autoanticuerpos | Síndrome asociado | Tumor asociado |
|---|---|---|
| Anticuerpos intracelulares | ||
| Anti-Hu (ANNA-1) | Neuropatía sensitiva Encefalomielitis subaguda Encefalitis límbica, DCP | Próstata, neuroblastoma, CPCP |
| Anti-Yo (PCA-1) | DCP | Ovario, mama, CPCP |
| Anti-Ri (ANNA-2) | Opsoclonía-mioclonía Encefalitis de tronco del encéfalo | Mama CPCP Neuroblastoma |
| Anti-CV2 (CRMP5) | Encefalomielitis Neuropatía motora sensitiva Ataxia cerebelosa | Timoma CPCP |
| Anti-anfifisina | Síndrome persona rígida (SPR), DCP, LEMS | Mama CPCP |
| Anti-Tr (PCA-Tr) | DCP | Linfoma de Hodgkin |
| Anti-Ma2(PMNA2) | Encefalitis límbica, encefalitis mesoencefálica | Testículo, mama, CPCNP |
| Anticuerpos frente a la membrana neuronal | ||
| Proteína asociada a VGKC:: anti-CASPR-2 | Encefalitis límbica Neuromiotonía Síndrome de Morvan | Timoma (73%) |
| Proteína asociada a VGKC: anti-LGI1 | Encefalitis límbica | Ningún tumor asociado |
| Anti-NMDAr | Encefalitis límbica | Teratoma ovario (58%) |
| Anti-AMPAr | Encefalitis límbica | CPCP, timoma, mama (60%) |
| Anti-GABABr^^^^ | Encefalitis límbica | CPCP (70%) |
| Anti-m-GluR5 | Encefalitis límbica | Linfoma de Hodgkin |
| Anti-VGCC/CCVD | LEMS | CPCP, linfoma de Hodgkin |
AMPAr: receptor del ácido α-amino-3-hidroxi-5-metil-4-isoxazolepropiónico; CASPR-2: proteína asociada a contactina-2; CPCNP: carcinoma de pulmón de células no pequeñas; CPCP: carcinoma de pulmón de células pequeñas; DCP: degeneración cerebelosa paraneoplásica; GABABr: receptor de ácido gamma-aminobutírico; LEMS: síndrome de Lambert-Eaton; LGI1-VGKC: canales de potasio dependientes de voltaje; NAMDr: receptor de N-metil D-aspartato; m-GluR5: receptor metabotrópico de glutamato subtipo 5; VGCC/CCVD: canales de calcio dependientes de voltaje.
Fuente: modificada de Dalmau J, et al.19..
Graus F, et al. 11.
Son anticuerpos asociados a neuropatía sensitiva, encefalomielitis y degeneración cerebelosa con disfunción autónoma y también con EL10. Tienen una sensibilidad del 80% para SNP con neuropatía periférica y carcinoma pulmonar de células pequeñas (CPCP). Otros tumores asociados pueden ser carcinoma de próstata, neuroblastoma, cáncer de mama y sarcoma. Los pacientes con anticuerpos anti-Hu son en su mayoría varones con un mal pronóstico y con una severa e irreversible discapacidad debida a los problemas neurológicos. Este anticuerpo puede estar presente en niveles bajos en pacientes con cáncer que no tienen síntomas neurológicos, y hasta un 16% en pacientes con cáncer de pulmón11.
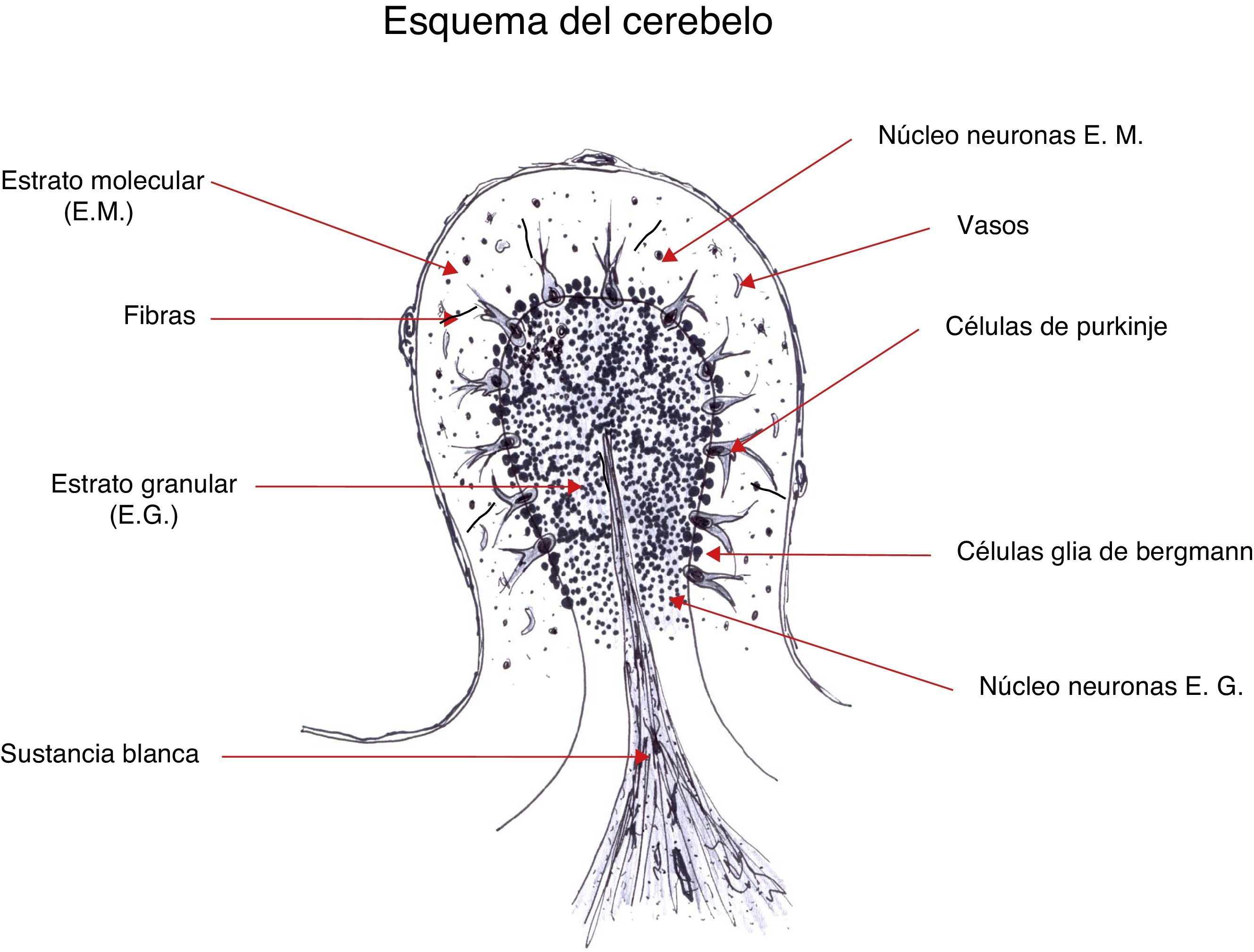
Por inmunofluorescencia indirecta (IFI) marcan el núcleo de las neuronas del SNC y SNP; también se puede observar en el núcleo de neuronas del plexo mientérico en estómago de rata (fig. 1). Se realizará la confirmación mediante inmunotransferencia (IT) para evitar la posible interferencia de los anticuerpos antinucleares (ANA) si estuvieran presentes.
1.2Anticuerpos anti-Yo (PCA-1)Son anticuerpos dirigidos frente a proteínas del citoplasma de las células de Purkinje del cerebelo de 34 y 62kDa, y en menor grado en neuronas de la capa molecular, así como en grandes neuronas del tronco encefálico. Su función es desconocida; se atribuye a estos antígenos (CDR62/CDR34) un papel en la regulación de la expresión génica, debido a su estructura tipo leucine zipper12. También se denominan anti-PCA1.
La presencia de este anticuerpo muestra una fuerte correlación con el sexo del paciente y el tipo de cáncer. En un 99% los encontramos en mujeres y se han descrito tan solo unos pocos casos aislados en hombres.
Se consideran específicos y marcadores de la DLP. Los tumores que se asocian con este anticuerpo son de ovario y mama (90%), y con menos frecuencia con otros tumores ginecológicos (trompas de Falopio o útero), de pulmón y de vejiga13 La resonancia magnética cerebral puede mostrar una atrofia cerebelosa. En ocasiones se han encontrado bandas oligoclonales en el líquido cefalorraquídeo (LCR).
A diferencia de los anti-Hu y anti-Ri estos anticuerpos casi siempre se detectan solos, sin ningún otro tipo de AAN.
Por IFI se observa una distribución característica que se corresponde con la tinción moteada gruesa del citoplasma de células de Purkinje debido a su unión a ribosomas, retículo endoplásmico y de las vesículas del complejo de Golgi, «patrón granular» (fig. 1). Es importante no confundir el anti-Yo con otros anticuerpos paraneoplásicos citoplasmáticos poco frecuentes, como son los anti-Tr (PCA-Tr) o frente a células de Purkinje tipo 2 (PCA-2), pues tanto su clínica como el tumor asociado son diferentes. Por ello, es necesario realizar la confirmación por IT, diferenciándolos así de los anti-Tr (PCA-Tr) y anti-PCA-2.
Anticuerpos anti-CV2 (CRMP5)El antígeno diana es una proteína citosólica de peso molecular de 66kDa denominada «proteína mediadora en la respuesta a colapsina» que se corresponde con la CV2 (CRMP5)14. Este anticuerpo presenta algunas características comunes con los ANNA-1 en cuanto al cuadro clínico y la neoplasia asociada. Los anti-CV2 están vinculados a una amplia gama de síndromes neurológicos, siendo la alteración más frecuente la neuropatía periférica con un CPCP subyacente en aproximadamente el 80% de los casos15. La supervivencia de los pacientes es considerablemente más larga (48 meses) en relación con los ANNA-1 (11 meses). Si hay coexistencia de anti-CV2 (CRMP5) y ANNA-1 en un mismo paciente la supervivencia media es alrededor de 18 meses16.
La presencia de este anticuerpo se asocia igualmente a encefalomielitis paraneoplásica, degeneración cerebelosa y neuropatía sensitivomotora y a CPCP y timoma.
Por IFI tiñen el citoplasma de oligodendrocitos de la capa granular y la sustancia blanca del cerebelo (fig. 1). Sin embargo, es relativamente difícil de detectar, ya que puede ser confundido con una tinción no específica de los astrocitos que se ve a menudo en la mayoría de las muestras, por ello se debe recurrir a su confirmación por IT.
1.3Anticuerpos anti-anfifisinaEl antígeno, una proteína de peso molecular es de 128kDa denominada anfifisina 1 ubicada en las vesículas sinápticas, se expresa a altas concentraciones en el sistema nervioso, donde realiza su función, relacionada con la endocitosis de las vesículas sinápticas17. También se encuentra en otras células endocrinas en la retina y en los espermatocitos.
La presencia de este antígeno en pacientes con síndromes neurológicos de origen desconocido sugiere un origen paraneoplásico. Los tumores habitualmente asociados son cáncer de mama y CPCP.
Es el antígeno más frecuente en pacientes con síndrome de la persona rígida (Stiff-Man) y también se asocia a neuropatía sensitiva, encefalomielitis paraneoplásica y DCP18. En pacientes sin cáncer el síndrome de la persona rígida se asocia a otro anticuerpo contra la glutamato descarboxilasa (anti-GAD), que en un alto porcentaje se asocia a diabetes mellitus tipo 119.
Por IFI tiñen el neuropilo de la capa molecular del cerebelo y presentan una intensa tinción en la zona granular «botón sináptico» y zona molecular positiva (fig. 1). El neuropilo es la porción del tejido nervioso que contiene una trama de procesos entremezclados e interconectados de células neuronales y gliales donde ocurren la mayoría de las interacciones sinápticas.
1.4Anticuerpos anti-Tr (PCA-Tr)Este anticuerpo anti-Tr (también llamado PCA-Tr) se asocia sobre todo en hombres con DCP y enfermedad de Hodgkin20. Ha sido incluido recientemente por algunos autores entre los anticuerpos bien caracterizados y asociados a los SNP21.
El antígeno se expresa en el citoplasma de células de Purkinje, así como en axones y dendritas.
Por IFI se observa un patrón moteado fino en la zona molecular y citoplasma de las células de Purkinje que hay que diferenciarlo del anti-Yo (fig. 1) y se puede confirmar con células transfectadas.
Este anticuerpo se evidencia en el LCR y puede desaparecer espontáneamente durante el seguimiento de la enfermedad.
1.5Anticuerpos anti-Ri (ANNA-2)La distribución antigénica de este anticuerpo es similar a la de los anti-Hu (núcleos y el citoplasma de las neuronas) pero se limita al SNC. Las secciones del estómago e intestino que contienen plexo mientérico se utilizan para distinguir entre las especificidades anti-Ri y el anti-Hu.
Este anticuerpo reconoce 2 proteínas con un peso molecular de 55 y 80kDa que se denominan Nova-1 y Nova-2. Su función parece estar relacionada con la regulación del pre-ARNm9.
Este anticuerpo puede coexistir con otros como los anti-anfifisina, CV2 (CRMP5) y anti-Hu. Los anticuerpos anti-Ri se encuentran en la encefalopatía cerebelosa y del tronco cerebral, caracterizada por opsoclono con anomalías de la motilidad ocular. Una manifestación característica de estos anticuerpos es el síndrome opsoclonus-mioclonus. Se pueden encontrar en el CPCP, en el cáncer de vejiga y en cánceres ginecológicos, y también se han asociado a neuroblastoma en niños22.
Por IFI tiñen el núcleo de las neuronas, y a diferencia del anti-Hu estos no tiñen el núcleo de las neuronas del plexo mientérico de Auerbach en el estómago de rata, y se confirma por IT.
1.6Anticuerpos anti-Ma2 (PMNA2)El antígeno es una fosfoproteína citoplasmática implicada en la síntesis de ARN del cerebro y los testículos, entre las que se incluyen la Ma1, Ma2 y otras no caracterizadas23 de peso molecular de 37 y 40kDa que se expresan en el núcleo y el nucléolo de neuronas del SNC, y aunque son altamente homólogas son codificadas por genes diferentes. En este sentido, la proteína Ma1 se expresa en el cerebro y el testículo, mientras que Ma2 solo lo hace en el cerebro.
Estos anticuerpos se han asociado a encefalitis límbica y encefalitis mesodienencefálica, y en un 80% de los pacientes se desarrollan tumores de células germinales24.
Recientemente se ha detectado anti-Ma2 en casi el 50% de pacientes con tumores neuroendocrinos intestinales, sin que exista evidencia de SNP, y se han asociado a mayor riesgo de recaída tumoral temprana25.
Por IFI estos anticuerpos se observan en núcleo dentado, con puntos en el nucléolo neuronal y débil tinción citoplasmática y en las células germinales testiculares (anti-Ma1) (fig. 1).
Al igual que el resto, estos anticuerpos intracelulares se pueden confirmar por IT.
1.7Anticuerpos onconeuronales con cáncer asociado y sin evidencia de respuesta inmuneLos anticuerpos anti-Zic4 son anticuerpos dirigidos frente a las proteínas Zic4 de los núcleos de la capa granular, perteneciente a una familia de cinc-proteínas (Zic1, Zic2, Zic3, Zic4 y Zic5) codificada por la familia de genes Zic, que tienen un papel importante en el desarrollo del sistema nervioso.
La principal alteración neurológica asociada con los anticuerpos anti-Zic4 es la DCP en el contexto del CPCP, y estos anticuerpos también pueden encontrarse en la encefalomielitis paraneoplásica8.
Al igual que otros procesos paraneoplásicos los anticuerpos anti-Zic4 se pueden encontrar junto a otros AON asociados al CPCP, como son los anti-Hu, anti-CV2/CRMP5 y menos frecuentemente con anti-Ri. La frecuencia de los anticuerpos anti-Zic4 en pacientes con CPCP sin trastornos paraneoplásicos es del 16%.
Los anticuerpos anti-Zic4 muestran por inmunohistoquímica una tinción en el núcleo de las neuronas de la capa granular del cerebelo sobre secciones de cerebro humano, de conejo, rata o ratón y reactividad menos intensa con otras neuronas, incluidas las células de Purkinje y las neuronas de los núcleos cerebelosos profundos del tronco cerebral y el cerebro. La detección de estos anticuerpos puede ser compleja por la frecuente asociación con otros AON (Hu, Ri, CV2/CRMP5) que pueden interferir su visualización. La confirmación de los anticuerpos anti-Zic4 se realiza mediante IT.
En los casos en que es identificado específicamente el anticuerpo anti-Zic4, este predice la presencia de una neoplasia, generalmente un CPCP (92%), y sugiere que la alteración neurológica sea probablemente un SNP1.
Los anticuerpos anti-SOX1 o anti-glial nuclear (AGNA) difieren de otros anticuerpos paraneoplásicos en que no son específicos, ya que pueden darse en síndromes neurológicos o en tumores aisladamente.
El antígeno SOX1 se ha identificado como el antígeno localizado en los núcleos de las células gliales de Bergmann del cerebelo adulto. El antígeno SOX1 pertenece a una familia de ADN vinculada a factores de transcripción. Las proteínas SOX1, SOX2 y SOX3 se expresan en el desarrollo del sistema nervioso y también en el CPCP6. Los anticuerpos reaccionan habitualmente con las 3 proteínas y la reactividad se dirige contra epítopos compartidos; algunos pacientes poseen anticuerpos que reaccionan exclusivamente con SOX1. Por ello, la sensibilidad de los ensayos se eleva cuando llevan la proteína SOX1 como antígeno26.
La presencia de anti-SOX1 de forma aislada no parece ser específica de cáncer. Sin embargo, cuando coexiste con el anticuerpo VGCC, causando LEMS, predice la presencia de un CPCP. En un reciente estudio se ha visto que los anticuerpos anti-SOX1 se encuentran con mayor frecuencia en pacientes con LEMS paraneoplásicos causados por VGCC (64%) que en LEMS idiopático o con CPCP aislado (2%)3.
La utilidad del anticuerpo-SOX1 es evidente en la distinción entre la forma idiopática y la paraneoplásica, donde está presente el CPCP, ya que estas alteraciones neurológicas no son fácilmente diferenciadas clínicamente.
Por IFI se identifica por la tinción de fluorescencia en los núcleos de las neuronas de la glía de Bergman, y en la actualidad existe la posibilidad de determinarlos por IT.
1.8Anticuerpos relacionados con síndromes no paraneoplásicos1.8.1Anticuerpos anti-glutamato descarboxilasaLa enzima glutamato descarboxilasa (GAD) posee 2 formas isoméricas (65 y 67kDa). Los anticuerpos anti-GAD65 se asocian a diabetes mellitus tipo 1 y los anti-GAD67 a alteraciones neurológicas de origen fundamentalmente no paraneoplásico.
Los anti-GAD por fluorescencia presentan patrón granular en capa molecular del cerebelo (fig. 1) que solo se detecta en títulos elevados de GAD. Cuando afectan al sistema nervioso las concentraciones séricas son mucho más elevadas que las encontradas en la diabetes mellitus tipo 1 (>2.000). Se asocian a ataxia cerebelosa, al síndrome de la persona rígida y a encefalitis límbica no paraneoplásica. En la mayoría de los casos su origen es no-paraneoplásico, aunque se han descrito ocasionalmente en unos pocos pacientes con encefalomielitis límbica o DCP paraneoplásicas. En general, se puede considerar que en pacientes sin diabetes tipo 1 que desarrollan alteraciones neurológicas que sugieren un SNP la detección de anti-GAD no excluye una etiología no paraneoplásica11.
Se detecta síntesis intratecal en el 100% de los pacientes con ataxia cerebelosa y en el 85% de los pacientes con el síndrome de la persona rígida con anti-GAD27.
Anticuerpos antineuronales contra antígenos de la membrana celular y sinapsisEste grupo esta constituido fundamentalmente por anticuerpos dirigidos frente a antígenos extracelulares que pueden encontrarse tanto asociados al SNP como en síndromes neurológicos no paraneoplásicos. Estos anticuerpos incluyen anti-LG1, anti-CASPR-2, anti-NMDAr, anti-AMPAr, anti-GABAr, anti-mGluR1, mGluR5 y anti- VGCC.
1.9Complejo de anticuerpos de canales de potasio dependientes de voltaje: anti-LGI1, anti-CASPR-2Estos anticuerpos forman parte del complejo de canales de potasio dependientes de voltaje (VGKC) y en un 80% puede encontrarse en el suero de pacientes con EL, síndrome de Morvan o neuromiotonía28. Van dirigidos frente a complejos de proteínas asociados a los VGKC tales como proteína asociada a contactina-2 (CASPR-2) localizada en la superficie de la neurona y la proteína-1 inactivada del glioma rica en leucina (LG-1), involucrada en el control de la excitabilidad sináptica.
Los pacientes con anticuerpos CASPR-2 se asocian a encefalitis neuromiotonía y al síndrome de Morvan. También parece que los anticuerpos CASPR-2 indican, con mayor probabilidad, una neoplasia oculta y peor pronóstico.
Algunos estudios recientes han demostrado que los pacientes con anticuerpos dirigidos contra LG-1 tienen, predominantemente, un fenotipo de EL no paraneoplásico29, y es la segunda encefalitis autoinmune en orden de frecuencia. Habitualmente se presenta en adultos varones y no se asocia a cáncer30.
En la caracterización por fluorescencia se observa un patrón en la zona molecular del hipocampo y del cerebelo (fig. 1). Se debe siempre confirmar con células HEK 293 transfectadas que expresan estas proteínas.
Anticuerpos frente a receptores de glutamato: anti-NMDAr y AMPArEl ácido glutámico, uno de los aminoácidos neurotransmisores excitatorios, conocido como glutamato, se encuentra en el SNC y participa en numerosas funciones del cerebro tales como la cognición, la memoria, el aprendizaje, el movimiento y el desarrollo. Como neurotransmisor funciona mediante la unión postsináptica a receptores de glutamato (GluR), lo que facilita la propagación del impulso nervioso a través de la sinapsis entre las 2 terminales nerviosas. Aproximadamente el 50% de la transmisión sináptica en el SNC está mediada por el glutamato a través de 2 tipos de receptores de glutamato, los ionotrópicos (iGluR) y los metabotrópicos (mGluR), que se encuentran tanto en la membrana presináptica como postsináptica.
1.10Receptores de glutamato ionotrópicos (iGluR): N-metil D-aspartato, (NMDA) y A-aminohidroxi-5-metil-4-isoxazolepropionico (AMPAR)Estos receptores son canales iónicos que permiten la afluencia de iones de sodio y despolarización de la membrana por la estimulación con glutamato. La hiperactividad se considera la causa de neurotoxicidad (excitotoxicidad) que puede dar lugar al daño neuronal severo y ser responsable de la patogénesis de la lesión aguda y crónica del SNC.
Los anticuerpos frente a estos receptores de NMDA (NMDAr) y AMPA (AMPAr) comparten características comunes y se consideran patogénicos. Ambos se asocian a procesos con malignidad y los títulos de estos anticuerpos en el LCR se correlacionan con la evolución neurológica, con la respuesta a la inmunoterapia y tratamiento de la neoplasia. La presencia de estos anticuerpos indica una posibilidad de neoplasia oculta, de pulmón, de mama o de timo. También pueden encontrarse en ausencia de neoplasia.
1.11Anticuerpos anti-NMDArEl NMDAr es un heterotetrámero que se compone de 4 subunidades NR, cada subunidad con un peso molecular de aproximadamente de 100kDa, que forman un canal ión/receptor. Las 2 unidades NR1 forman un enlace para la glicina, mientras que las otras 2 subunidades NR2 (A, B, C o D) se unen al glutamato. La activación del receptor de NMDA facilita un aumento de iones Ca2+ intracelular, iniciando una cascada de eventos celulares, importante en el proceso de plasticidad sináptica, involucrado en el aprendizaje y la memoria. Los anticuerpos NMDAr inhiben los receptores sobre las ínter-neuronas presinápticas GABAérgicas31.
El anticuerpo frente al NMDAr se une al neuropilo y su caracterización por fluorescencia es en la zona molecular del hipocampo y el extracto granuloso del cerebelo (fig. 1). Confirmar con células HEK293 transfectadas con subunidad NR1 del receptor del glutamato
Este anticuerpo se ha identificado en pacientes con encefalitis severa con presentación psiquiátrica, y es el tipo más común de encefalitis autoinmune21. Este síndrome se describió, inicialmente, en mujeres jóvenes con teratoma de ovario (prevalencia del 55% en mayores de 12 años)32.
Los niveles de anticuerpos NMDAr en los pacientes no paraneoplásicos son significativamente menores que los encontrados en el SNP32.
El tratamiento, por inmunoterapia o la eliminación del tumor, es eficaz en las etapas más tempranas.
1.12Anticuerpos anti-AMPArLos receptores AMPA son los receptores de ácido alfa-amino-3-hidroxi-5-metil-4-isoxazolpropiónico (AMPAr). Al igual que NMDAr, es un receptor de membrana ionotrópico de glutamato que actúa como canal y se sitúa en la membrana postsináptica. Está formado por 4 subunidades que presentan 4 tipos (GluR1, GluR2, GluR3 y GluR4). En respuesta a la estimulación del AMPAr por el glutamato (es la entrada de sodio) permite que la transmisión sináptica sea muy activa y contribuye a la rápida transmisión sináptica observada en el SNC. Las responsables de esta situación son las subunidades GluR1 y GluR2.
En presencia del anticuerpo AMPAr la combinación o la unión de GluR2-AMPAr en la sinapsis está reducida y conduce a las manifestaciones clínicas. Los anticuerpos anti-GluR1/2 subunidades de la AMPAr se han descrito en mujeres con encefalitis límbica autoinmune; estas pacientes podían tener una enfermedad maligna subyacente en el timo, la mama o el pulmón.
Puede presentarse con síntomas psiquiátricos prominentes o con síntomas que no cumplen totalmente los criterios de encefalitis límbica. No obstante, se han descrito anticuerpos anti-subunidad GLuR1/2 de AMPAr en pacientes con CPCP y encefalitis límbica previamente consideradas seronegativas31.
En la identificación de estos anticuerpos por IFI se observa un patrón fluorescente en la zona molecular del hipocampo y el cerebelo, y se confirman en muestras de suero o LCR mediante las células HEK293 que expresan receptores GluR1/GluR2.
Otros anticuerpos detectados en encefalitis autoinmunesAnticuerpos anti-receptor de ácido gamma-aminobutíricoBEl ácido gamma-aminobutírico es un aminoácido que está presente en el tejido cerebral y actúa como neurotransmisor inhibitorio en varios de sus circuitos. Se encuentra en grandes concentraciones en el cerebelo. Las alteraciones en estos circuitos GABAérgicos están asociadas con la corea de Huntington, enfermedad de Parkinson, demencia senil, enfermedad de Alzheimer y la esquizofrenia. Existen 2 tipos de receptores de GABA, los de acción rápida o ionotrópicos: GABAA y GABAC y los de acción lenta o metabotrópicos GABAB que se consideran inhibitorios.
Los anticuerpos contra GABAB se han asociado a convulsiones y cambios cognitivos en los pacientes con EL y algunos están asociados a un tumor subyacente, generalmente CPCP.
En su identificación por IFI se observa un patrón de fluorescencia en la zona molecular del hipocampo y del cerebelo (fig. 1)33; también se utilizan para su estudio subunidades B1 y B2 del receptor GABAB en células transfectadas HEK293.
Anticuerpos anti-mGluR1 y mGluR5Los anticuerpos anti-mGluR1 y anti-mGluR5 son anticuerpos frente al receptor metabotrópico de glutamato de los subtipos 1 y 5. Solo se han descrito en un pequeño grupo de pacientes y con ataxia cerebelosa o encefalitis límbica en presencia de linfoma de Hodgkin34.
Anticuerpos anti-canales de calcio dependientes de voltajeLos anticuerpos anti- VGCC, junto con los mGluR5, se relacionan más estrechamente con el SNP que el resto de los anticuerpos contra la membrana celular y sinapsis, ya que se asocian a este síndrome con una frecuencia superior al 70%21.
Los anticuerpos anti- VGCC están dirigidos frente a los canales del calcio de alto voltaje y se han asociado a DCP y al LEMS en los pacientes con CPCP.
Los anticuerpos VGCC se unen a los antígenos extracelulares y están dirigidos contra el tipo P/Q de los canales de calcio, expresado en la estructura molecular del cerebelo, citoplasma de las células Purkinje y capa granular.
La cuantificación se realiza con neurotoxina marcada con yodo radiactivo (125I-conotoxina) que se une y marca los canales P/Q dependientes de voltaje. El complejo radiomarcado que se forma es precipitado y cuantificado.
La alteración autoinmune frente a los canales P/Q de VGCC es responsable de la disminución en la liberación de acetilcolina llevando a la debilidad del músculo esquelético y síntomas de la enfermedad neuromuscular conocida como LEMS.
Aproximadamente, la mitad de estos pacientes tienen un SNP en forma de LEMS, la mayoría son hombres, fumadores habituales y por lo general con un CPCP como neoplasia oculta asociada. En estos casos pueden asociarse a anti-Hu hasta en un 23% de los casos. Estos pacientes tienden a responder bien cuando el cáncer es tratado, lo que lleva a un mejor pronóstico que en aquellos casos de LEMS sin cáncer. Si no se encuentra el tumor se recomienda el control regular de la neoplasia oculta, sobre todo en pacientes mayores de 50 años con larga historia de fumador y/o evidencia de la coexistencia de una enfermedad autoinmune35.
Detección e identificación de anticuerpos antineuronalesLos AAN se identifican por patrón de inmunohistoquímico o por IFI sobre un sustrato de cerebelo, cerebro y nervio periférico de primate o rata. En cualquier muestra de suero donde se ha detectado un patrón específico de estos AAN deben realizarse pruebas adicionales para confirmar la especificidad de cada anticuerpo, utilizando un método alternativo como inmunotransferencia en línea (LIA) con antígenos purificados o recombinantes. Esto nos permite identificar varios anticuerpos cuando coexisten al mismo tiempo, o evitar la interferencia de los anticuerpos antinucleares en la correcta identificación de los ANNA-1 (Hu) y ANNA-2 (Ri).
Un resultado positivo siempre deberá ser confirmado por 2 técnicas diferentes, dado el impacto que supone su presencia para el diagnóstico del paciente. Estos anticuerpos se detectan en muestras de suero o LCR. Los títulos de dilución recomendados para la semicuantificación de los anticuerpos son 1/10, 1/40 y 1/100.
El corte de hipocampo es para el análisis de los anticuerpos contra antígenos extracelulares de la superficie neuronal, que van a originar una fluorescencia en la zona molecular del hipocampo. En ocasiones el tejido cerebral carece de sensibilidad para la detección de ciertos anticuerpos, por lo que se han utilizado técnicas moleculares. El ADN complementario para diversos antígenos se inserta en vectores de expresión eucarióticos (plásmido) y se transfectan en líneas de células adecuadas.
La mayor parte de los AAN son de tipo IgG y se pueden encontrar a títulos altos en LCR y suero de pacientes con SNP. Los títulos no se correlacionan con la severidad de la enfermedad, se presentan con más frecuencia en pacientes con neoplasias y alteración neurológica que en los pacientes con cáncer sin alteración del sistema nervioso. A pesar de que los AAN son marcadores sensibles del SNP, pueden no ser detectados hasta en el 50% de los pacientes con SNP; por el contrario, se pueden detectar hasta en un 16% en pacientes con cáncer y neurológicamente asintomáticos. En aproximadamente el 30% de los pacientes con SNP se puede identificar más de un AAN concurrente.
En 2012 se publicó un atlas/guía para el diagnóstico de los AAN, en esta obra se considera que para el estudio de estos anticuerpos se emplee un método de cribado, inmunohistoquímica o IFI seguido de un método de confirmación mediante inmunotransferencia o células transfectadas. En el caso de AAN intracelulares en IFI se emplea como sustrato cerebelo de roedores y nervio de primate; el método de confirmación en general es la inmunotransferencia. Cuando se trata de AAN extracelulares se recomienda preferiblemente LCR.
El método de cribado es la IFI sobre un corte de hipocampo de roedor y se confirma en ensayos de células transfectadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.