La artritis reumatoide es una patología autoinmune caracterizada por inflamación poliarticular, tumefacción e inflamación que afecta a más del 1% de la población mundial. La patobiología de la artritis reumatoide involucra varias poblaciones celulares como linfocitos T, B, macrófagos y fibroblastos, así como una compleja interacción de citoquinas proinflamatorias. Las actuales terapias convencionales y biológicas no siempre funcionan o producen solo una mejora parcial. La tolerancia inmunológica es un mecanismo por el cual el sistema inmune previene la autorreactividad. El objetivo de este estudio piloto fue evaluar la eficacia de péptidos provenientes de un hidrolizado enzimático de cartílago articular extraído del tarso bovino (HCA) para el tratamiento de artritis reumatoide en un modelo de artritis reumatoide (AAE) en conejos. Los animales AAE presentaron inflamación y dolor dentro del primer mes de la inmunización primaria que fue revertida en el grupo AAE+HCA. El grupo control mostró un tejido sinovial normal sin afecciones de ningún tipo. El grupo AAE reveló un proceso inflamatorio severo con hiperplasia sinovial, infiltrado de linfocitos y proliferación vascular. El grupo tratado redujo la inflamación, proliferación linfocítica y neoangiogénesis significativamente. Los conejos artríticos incrementaron significativamente los niveles marcadores inflamatorios como óxido nítrico, interferon γ (INF-γ) y factor de necrosis tumoral α (TNF- α) respecto del control y redujeron significativamente los niveles de interleukina 4 (IL-4). El tratamiento mostró una reducción significativa de óxido nítrico, IFN-γ y TNF-α y un aumento de IL-4. Este trabajo sugiere que esta terapia podría resultar útil en el aspecto clínico y en los parámetros bioquímicos y podría inhibir específicamente la respuesta inmune. Futuros estudios con mayor número de animales y otros parámetros de laboratorio complementarios podrán brindar evidencias en este sentido.
Rheumatoid arthritis is an autoimmune disease characterized by polyarticular inflammation, swelling and inflammation that affects more than 1% of the world population. The pathobiology of rheumatoid arthritis involves several cell populations as T lymphocytes, B, macrófagosy fibroblasts, and a complex proinflammatory cytokines interactions. Conventional and biologic therapies do not always work or produce only a partial improvement. Immunological tolerance is a mechanism by which the immune system prevents autoreactivity. The aim of this pilot study was to evaluate the efficacy of peptides from an from articular cartilage hydrolysate extracted of tarsus (HCA) for the treatment of rheumatoid arthritis in a model of rheumatoid arthritis (AAE) in rabbits. AAE animals showed inflammation and pain within de first month of the primary immunization that was reversed in the AAE + HCA group. The control group showed a normal unnaffected synovial tissue. The AAE group revealed an inflamatory process whith synovial hyperplasia, filtering in lymphocytes and vascular proliferation. The treated group decreased significantly inflammation, lymphocyte proliferation and angiogenesis. Arthritic rabbits increased the levels in flammatory markers as nitric oxide, interferon gamma (INF-¿) and tumor necrosis factor alpha (TNF-α) compared to control and significantly reduced levels of interleukin 4 (IL-4). The treatment showed a significant reduction of nitricoxide, IFN-gamma and TNF-alpha and an increase in IL-4. This work suggests that this therapy may be useful in the clinical aspect and the biochemical and immune parameters. Future studies with larger numbers of animals and other laboratory parameters may provide additional evidence in this regard.
La artritis reumatoide (AR) es una patología autoinmune caracterizada por inflamación poliarticular, dolor y tumefacción que afecta hasta el 1% de la población mundial1. El curso clínico de la AR es extremadamente variable, mostrando un amplio espectro de manifestaciones clínicas desde una enfermedad leve y autolimitada hasta una rápidamente progresiva con inflamación, destrucción de la articulación y discapacidad física severa2. La patobiología de la AR involucra varias poblaciones celulares como linfocitos T, B, macrófagos y fibroblastos, así como una compleja interacción de citoquinas proinflamatorias, que incluye óxido nítrico (NO) y, más específicamente, interferón γ (INF- γ), interleukina 2 (IL-2) y factor de necrosis tumoral α (TNF-α) y genera a nivel histológico un infiltrado muy importante de linfocitos y plasmocitos, con angiogénesis importante3–6.
Las actuales terapias convencionales y biológicas no siempre funcionan o producen solo una mejora parcial7. La terapéutica convencional consiste en corticoides o las llamadas fármacos modificadoras de la artritis reumatoide, como el metrotexate o, más recientemente, la leflunamida, que tienen una respuesta limitada y ciertos efectos secundarios8. Últimamente se han desarrollado nuevos agentes terapéuticos llamados biológicos que, combinados con las drogas modificadoras de la artritis reumatoide, mejoran la respuesta clínica. Los agentes biológicos incluyen drogas como anti-TNF (infliximab, etanercept, adalimumab, certolizumab y golimumab), anti-CD20 (rituximab), una proteína de fusión anti-CTLA-4 (abatacept) y un anti-IL-6Rt (tocilizumab). A pesar disponer de este amplio arsenal terapéutico, el resultado del tratamiento no es óptimo. Aproximadamente un 50% de los pacientes que recibe este tipo de tratamiento no manifiesta una respuesta clínica sustancial y solo una pequeña proporción tiene remisión de la enfermedad9,10.
La tolerancia inmunológica es un mecanismo por el cual el sistema inmune previene la autorreactividad. El fenómeno de tolerancia oral es definido como la supresión de la autorreactividad a un antígeno determinado por la administración oral del mismo antígeno8. Se inicia en el tejido linfoide asociado al intestino que comprende el epitelio de las mucosas, la lámina propia, las placas de Peyer y los ganglios linfáticos mesentéricos11–14. Existen muchas evidencias que sugieren que las placas de Peyer son esenciales para respuesta inmune de las mucosas intestinales y la tolerancia oral a antígenos solubles11–14. Se ha reportado que dosis altas de antígeno por vía oral inducen anergia o deleción de un clon de linfocitos T específicos de antígeno, mientras que dosis bajas y repetidas favorecen la inducción de regulación activa involucrando linfocitos T reguladores incluyendo linfocitos Th3 que secretan factor de crecimiento transformante beta (TGF-β), linfocitos Tr1 que producen interleukina 4 y 10 (IL-4 y IL-10) y linfocitos CD4+,CD25+8,11-14.
La eficacia de la tolerancia oral en seres humanos ha sido estudiada con resultados controvertidos15–18. Hay múltiples factores que puede influir sobre la capacidad de un antígeno para inducir tolerancia oral en la práctica clínica. Esto incluye la naturaleza del antígeno, la dosis, procesos que coexisten en la mucosa (ej. permeabilidad, inflamación), y la carga genética y edad del huésped8,19. Se ha propuesto que la efectividad de la digestión proteica en pequeños fragmentos es un factor muy importante para mejorar la respuesta inmunólogica al tratamiento20. El objetivo de este estudio piloto fue evaluar la eficacia de péptidos provenientes de un hidrolizado enzimático de cartílago articular extraído del tarso bovino (HCA) para el tratamiento de artritis autoinmune en un modelo experimental (AAE) inducido en conejos. Este modelo fue seleccionado pues presenta muchas similitudes con la artritis reumatoide en humanos21.
Materiales y métodosAnimalesPara este estudio piloto se seleccionaron 15 conejos hembra de la línea New Zealand (peso aproximado 3kg) mantenidos en jaulas individuales, con una dieta estándar para conejos (provista gentilmente por la Asociación de Cooperativas Argentinas y agua ad-libitum. Todos los procedimientos experimentales fueron aprobados por el Comité de Bioética de la Facultad de Ciencias Médicas de la Universidad Nacional de Rosario, Argentina.
Preparación del hidrolizado de cartílago articularEl hidrolizado de cartílago articular (HCA) fue provisto gentilmente por el «Instituto Sucesores Alfredo Villar S.A.» (Rosario, Argentina). El HCA fue obtenido por hidrólisis enzimática de cartílago articular sin desnaturalizar extraído del tarso de ganado bovino de aproximadamente 2 años de edad, según procedimiento descripto previamente21.
Inducción de la artritis autoimmune experimental en la articulación de conejosLa AAE fue inducida por un método ya descrito en la literatura21 con algunas modificaciones. Brevemente, se aplicaron 2 inyecciones intradérmicas de 1ml ovoalbúmina (5mg/ml; Sigma, St. Louis, MO) en coadyuvante completo de Freund (Difco, Detroit, MI) a 10 animales. Cinco días después, se inyectaron 1ml de ovoalbúmina (5mg/ml en NaCI 0,9%) en sus rodillas, para inducir la fase aguda de la enfermedad. Después de tres meses se verificó la inflamación y el grupo fue dividido en dos subgrupos: grupo AAE+HCA (5 animales), que recibió 0,500mg/día/conejo de HCA o grupo AAE (5 animales) que recibió placebo21. El grupo control (5 animales) recibió una inyección de 1ml vehículo (NaCI 0,9%). El tratamiento se extendió durante tres meses, al final de los cuales se sacrificaron los animales para efectuar el estudio histológico.
Análisis de la evolución de la enfermedad a nivel clínicoEl proceso inflamatorio y la presencia de dolor a la palpación al comienzo y al final del tratamiento antes del sacrificio de los animales fueron monitorizados por tres observadores diferentes. La severidad de la artritis fue evaluada por un índice de artritis previamente validado11 en una escala de 0-4 como sigue:
0 – no presenta edema o inflamación.
1 – ligero edema y dolor limitado al pie o el tobillo.
2 – ligero edema y el dolor desde el tobillo hasta el hueso tarsal.
3 – edema moderado y dolor desde el tobillo hasta el hueso.
Sobre la base de la cantidad de las articulaciones afectadas la puntuación tomó valores de 0 a 16. Los valores finales se presentan en la sección de resultados que representan un promedio de los índices de enfermedad registrados por tres observadores independientes.
Resonancia magnéticaLos estudios de resonancia magnética nuclear fueron llevados a cabo con un scanner General Electric «Vectra» 0,5 Te con bovina coronal, con la siguiente secuencia: recuperación de la inversión TR 2000, TE 60, NEX 3, el tiempo de adquisición de 6 minutos. Una puntuación se estableció teniendo en cuenta si las rodillas de los animales estudiados presentaron hidroartrosis en el espacio articular (puntuación de 1 a 4, si es nulo, leve, moderada o grave) alteraciones en el hueso subcondral, detectado como hiperintensidad (puntuaciones del 1 al 4) y alteraciones en el tejido blando periarticular, las puntuaciones de 0 a III21.
Estudios anatomopatológicos de los tejidos sinovialesLas cortes histopatológicos de la rodilla, obtenidos de los animales sacrificados, fueron fijados en formaldehído al 10% en PBS. Después de la inmersión en agua desionizada y deshidratación, se sumergieron en parafina y se cortaron secciones de 5μm, en un soporte de vidrio previamente tratado con polilisina para ser teñidas con hematoxilina-eosina22. Las secciones histológicas fueron estudiadas bajo el microscopio óptico con un aumento de 10 x y 40 x.
Determinación de los parámetros de laboratorioEl óxido nítrico en suero se evaluó mediante la reducción de nitrato a nitrito con nitrato reductasa, seguido por la reacción de Griess23. La concentración de nitrito fue cuantificada usando diversas concentraciones NaNO2 como estándar y los datos se expresaron en mM. La determinación sérica de los niveles de citoquinas proinflamatorias como el IFN-γ y TNF-α y citoquinas antiinflamatorias como la interleuquina 4 (IL-4) se llevaron a cabo mediante la técnica de enzimoinmunoensayo (EIA, Quantikine de R & D Systems).
Análisis estadísticoLas diferencias entre grupos se analizaron mediante ANOVA y el nivel de significación estadística se estableció en p<0,0524.
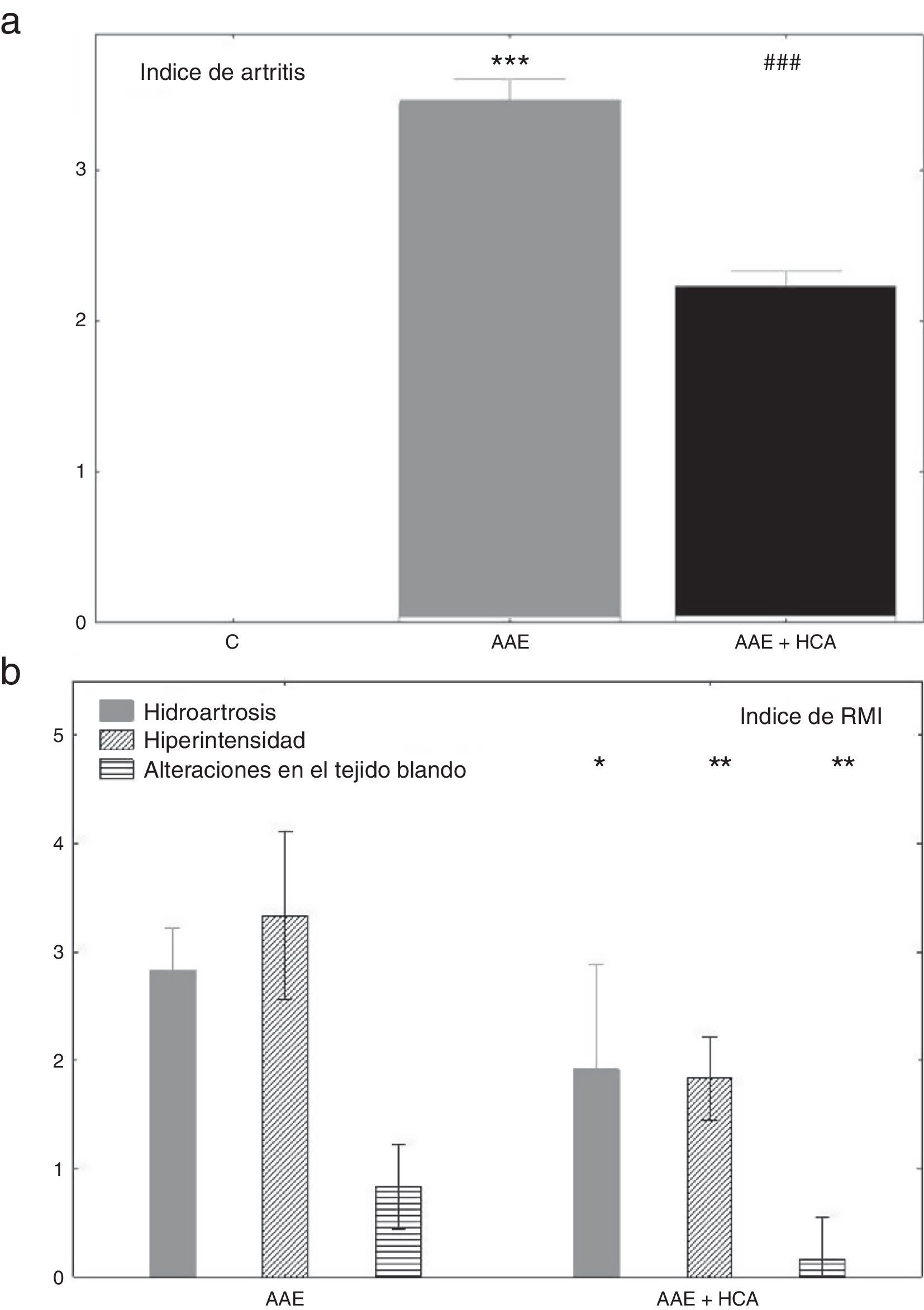
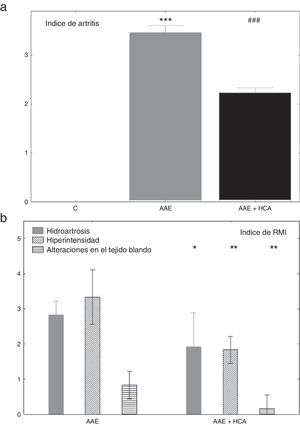
ResultadosEvolución de la enfermedad y tratamientoLos animales AAE comenzaron con inflamación y dolor dentro del primer mes de la inmunización primaria mientras que el grupo control mostró una articulación de la rodilla sana. El tratamiento con HCA indujo una inhibición parcial el índice artrítico (fig. 1a). La resonancia magnética mostró un score de cero en todos los indicadores para el grupo control mientras que en los conejos AAE se observaron valores altos en hidroartrosis, hiperintensidad y alteraciones de tejidos blandos, que se redujeron significativamente después de tres meses de tratamiento (fig. 1 b).
a) Severidad de la artritis estimada por un índice clínico descrito en el texto, al principio y a los tres meses de tratamiento. *** p<0,001 respecto del control. ### p<0,001 respecto del AAE.
b) Índice de resonancia magnética por imágenes al principio y a los tres meses de tratamiento. * p<0,05, **<0,01 y ***<p 0,001.
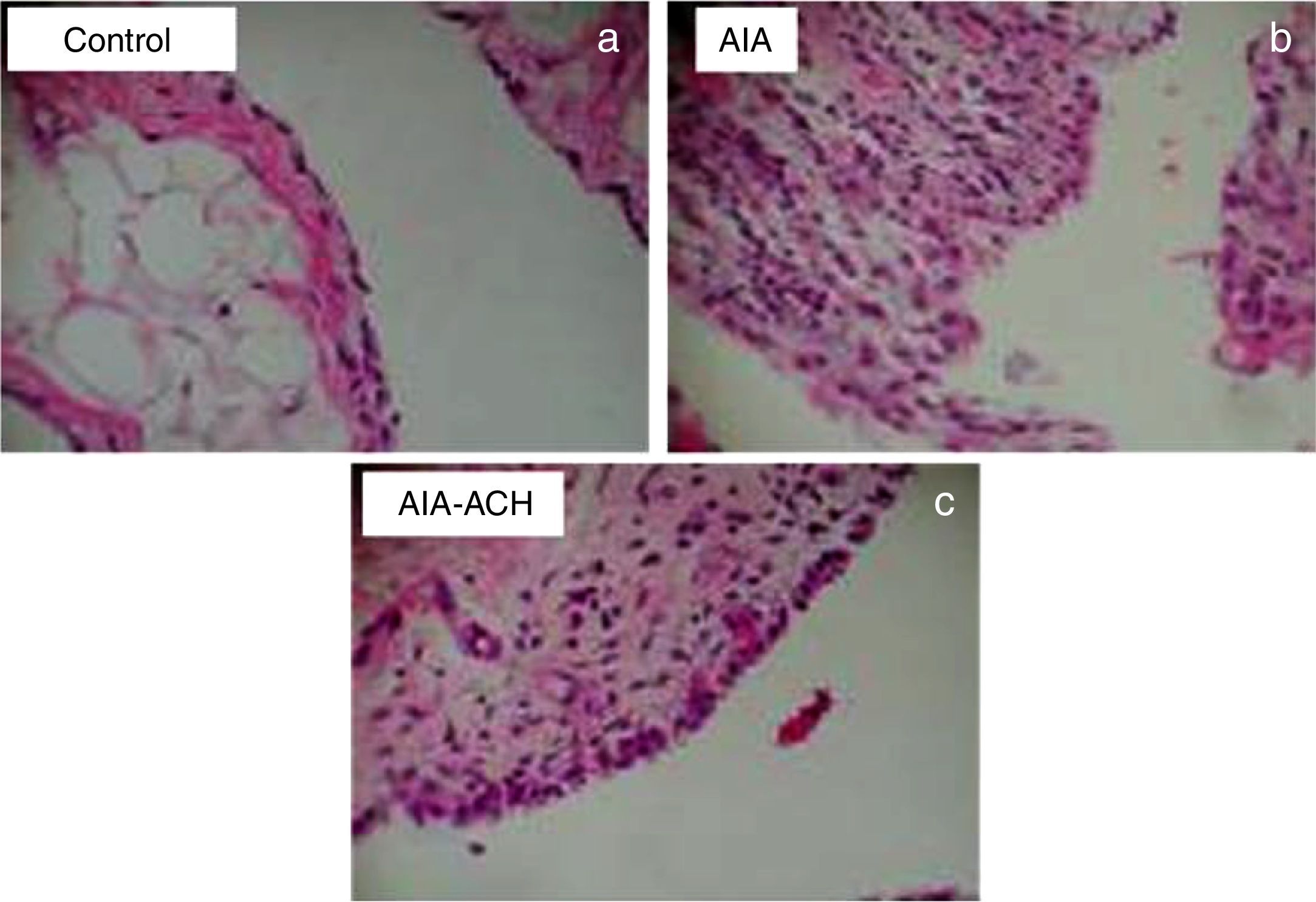
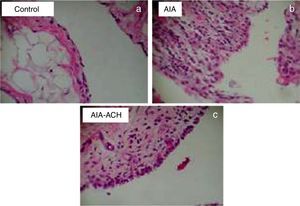
El grupo control mostró un tejido sinovial normal sin afecciones de ningún tipo (fig. 2a). El grupo AAE reveló un proceso inflamatorio severo con hiperplasia sinovial, infiltrado de linfocitos y proliferación vascular. (fig. 2b). El grupo tratado redujo la inflamación, proliferación linfocítica y neoangiogénesis significativamente (fig. 2c).
Imágenes histológicas de cortes sinoviales teñidos con hematoxilina-eosina, aumento 10x. a) Tejido de animales grupo control sin afectación sinovial. b) Grupo AAE con infiltración de linfocitos y células plasmáticas, hiperplasia y proliferación vascular. c) Grupo AAE + HCA, muestra disminución del infiltrado celular y menor neoangiogénesis respecto del AAE.
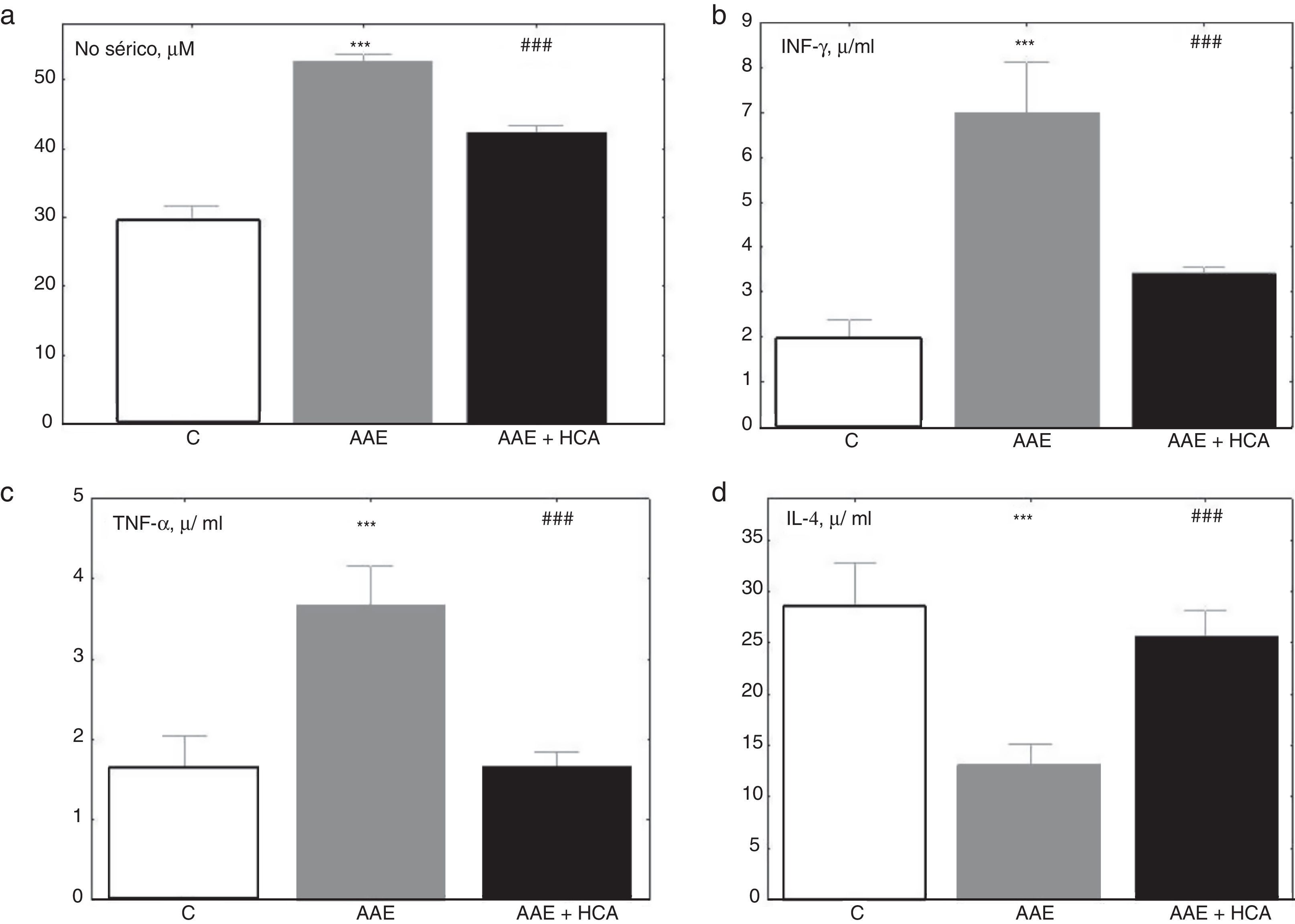
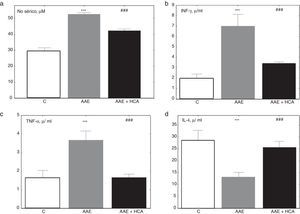
Los conejos artríticos incrementaron significativamente los niveles marcadores inflamatorios como NO, IFN-γ y TNF-α (fig. 3 a, b, c) respecto del control y redujeron significativamente los niveles de IL-4 (fig. 3 d). El tratamiento mostró una reducción significativa de NO, IFN-γ y TNF-α un aumento de IL-4 (fig. 3 d).
Valores de citoquinas al final del tratamiento. Se nota un incremento de marcadores inflamatorios en suero de animales AAE respecto del control, que se reduce en el grupo AAE+HCA mientras que la IL-4 se reduce significativamente en AAE y aumenta en AAE + HCA. a) Óxido nítrico sérico. b) Interferón γ sérico (INF-γ). c) Factor de necrosis tumoral α sérico (TNF-α). d) Interleuquina 4 sérica (IL-4). *** p<0,001 respecto del control; ### p<0,001 respecto de AAE.
El proceso de presentar péptidos alimenticios y suprimir la respuesta inmunológica a ellos ha sido denominada «tolerancia oral»25,26. Se ha demostrado en ensayos con animales y estudios con seres humanos que la inducción de tolerancia oral puede ser eficaz para el tratamiento de patologías autoinmunes8,10,26. Los estudios realizados en modelos animales con colágeno tipo II bovino o fracciones inmunógenas del mismo indujeron tolerancia oral27. El objetivo de este estudio piloto fue evaluar el uso de HCA para inducir tolerancia oral en conejos AAE. Encontramos que el tratamiento con HCA inhibe parcialmente el fenómeno inflamatorio en los preparados sinoviales y redujo marcadores inflamatorios como NO, INF-γ, TNF-β e incrementó citoquinas inhibitorias como IL-4. También los estudios de resonancia magnética nuclear confirmaron la mejora que el tratamiento indujo en los animales enfermos.
Estos hallazgos son congruentes con estudios previos que mostraron que la administración oral de colágeno tipo II (CII) suprimió el desarrollo de AAE en ratas Lewis y que esta supresión puede ser transferida por linfocitos T procedentes de animales alimentados con CII28. Min et al. encontraron que la administración de CII indujo tolerancia en ratones con artritis inducida por colágeno14. También observaron que los animales que lo toleraron redujeron el índice de artritis y elevaron IL-4 y TGF-β en bazo y placas de Peyer. Diferentes dosis de CII redujeron significativamente hiperplasia sinovial y el infiltrado linfocitario en ganglios linfáticos mesentéricos en ratas con artritis inducida por colágeno29. Un trabajo reciente demostró en ratones BALB/c que la administración de CII indujo tolerancia periférica por inducción de linfocitos T reguladores CD830.
En pacientes con AR los resultados son controvertidos. Un estudio doble ciego fase II con 280 pacientes con AR con dosis de 20 a 2.500mg por día durante 6 meses mostró mejoría significativa en dosis más baja16. Otro estudio que aplicó diferentes dosis de CII ejerció efectos benéficos, especialmente con 60mg por día. Sin embargo, no se observaron diferencias respecto del placebo19. Un estudio controlado contra placebo administrando colágeno bovino mostró efectos significativos en dosis de 0,5mg diarios, pero no a 0,05 ni 5mg31. Un trabajo multicéntrico encontró que CII mejora significativamente la función articular y exhibe eficacia terapéutica, además de ser seguro para el consumo humano32. Por otro lado, Cazzola et al. no encontraron diferencias entre el placebo y el grupo que recibió CII18.
Lipkowski propuso que la proteína predigerida en pequeños fragmentos puede ser más eficaz para mejorar la respuesta clínica en humanos que la proteína intacta20. Un estudio piloto de nuestro grupo mostró efectos positivos con HCA en 20 pacientes con AR refractaria a metrotexate y/o corticoides comparado con un grupo similar que siguió recibiendo tratamiento convencional33. Este trabajo muestra una mejora en el estado clínico y en los parámetros bioquímicos evaluados lo que sugiere inhibición específica de la respuesta inmune. Estos resultados son promisorios para evaluar el tratamiento con HCA como una alternativa terapéutica con buena efectividad, de bajo costo y sin efectos secundarios y/o colaterales.
Limitaciones del estudioPor tratarse de un estudio piloto con bajo número de animales por grupo y determinar solo algunas variables bioquímicas relacionadas con la tolerancia inmunológica, los resultados obtenidos deben considerarse preliminares. Para confirmar estos hallazgos se deben realizar estudios con mayor número de animales, determinar otras citoquinas antiinflamatorias como IL-10 y TGF-β y/o estudiar poblaciones de linfocitos T efectores a nivel ganglionar. Esto permitiría no solo confirmar la inducción de tolerancia sino también obtener información sobre el posible mecanismo implicado en este proceso.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl trabajo ha recibido financiación de la Universidad Nacional de Rosario.
Conflicto de interesesSF es Investigadora del Consejo de Investigaciones de la Universidad Nacional de Rosario (CIUNR) e Investigadora en Salud del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) y GRC es Investigador del CONICET.
Le agradecemos al Instituto Sucesores Alfredo Villar S.A. (Rosario, Argentina) la gentil provisión de hidrolizado de cartílago articular.