La prostatitis crónica/síndrome de dolor pélvico crónico (CP/CPPS) se presenta como una inflamación de la próstata sin evidencia de infección del tracto urinario. Algunos autores postulan a la respuesta autoinmune como causa de esta patología. Aunque se ha demostrado la presencia de respuesta inmune celular específica contra antígenos prostáticos, poco se conoce acerca de la respuesta inmune humoral. Es por ello que decidimos estudiar la presencia de autoanticuerpos séricos específicos de antígenos prostáticos, expresados en la línea celular prostática humana DU-145, y de otros autoanticuerpos séricos marcadores de diferentes patologías autoinmunes en un grupo de pacientes con diagnóstico clínico de CP/CPPS.
Materiales y métodosSe estudiaron 25 pacientes con CP/CPPS y 13 controles normales a los que se les realizó la determinación de anticuerpos anti-células DU-145, Factor Reumatoideo, anticuerpos anti-Tiroperoxidasa, anti-Tiroglobulina, anti-células de los islotes, anti-nucleares, anti-mitocondriales, anti-músculo liso, anti-microsomas de hígado y riñón, y anti-células parietales a partir de muestras de suero.
Resultadosno hubo diferencias estadísticamente significativas entre pacientes y controles para los anticuerpos anti-DU-145 (p=0,71). Factor Reumatoideo fue positivo en 36% de los pacientes y en 0% de los controles (p=0,016). Anticuerpos anti-Tiroperoxidasa se detectaron en 3 pacientes y en ningún control normal (p=0,54). Un paciente y 1 control normal presentaron anticuerpos anti-células de los islotes pancreáticos (p=0,99). Para los demás auto-anticuerpos ensayados ni pacientes ni controles normales arrojaron resultados positivos.
ConclusiónEstos resultados demuestran una asociación entre un marcador inflamatorio autoinmunitario como el Factor Reumatoideo con la CP/CPPS. Para el resto de los autoanticuerpos estudiados no se observaron diferencias significativas, aunque sí una tendencia a una mayor incidencia positiva en los pacientes con respecto a los controles. Estudios adicionales y con mayor número de pacientes son necesarios para dilucidar el rol de la inmunidad humoral en esta patología.
Chronic prostatitis/chronic pelvic pain syndrome (CP/CPPS) is an inflammatory condition that affects the prostate gland without evidence of infection in the urinary tract. Evidence reported during last decade supports a role for an autoimmune response to prostate antigens as a cause of this pathology. In fact, the presence of a specific cellular immune response against prostate antigens was demonstrated in CP/CPPS patients, but little is known about the humoral immune response. Therefore, we decided to study the presence of serum specific antibodies to prostate antigens, expressed in the human prostatic cell line DU- 145, and other serum autoantibodies that are markers of different autoimmune diseases.
Materials and Methods25 patients with CP/CPPS and 13 normal controls were studied and underwent the determination of serum antibodies anti-DU-145 cells, Rheumatoid Factor, anti-Thyroperoxidase, anti- Thyroglobuline, anti-islet cells, anti-nuclear, anti-smooth muscle, antiliver and kidney microsomes, and anti-parietal cell antibodies.
ResultsThere were non significant differences between controls and patients for anti-DU-145 antibodies (p=0,71). Thirty-six percent of the patients and 0% of the controls showed positive levels of Rheumatoid Factor (p=0,016). Three patients but none of the normal controls were positive for anti-Tyroperoxidase antibodies (p=0,54). One patient and one normal control presented anti-islet cell antibodies (p=0,99). No positive results were observed, either in patients or in controls, for the remaining autoantibodies assayed.
ConclusionThese results show an association between the inflammatory autoimmune marker Rheumatoid Factor and CP/CPPS. Although no significant differences in the remaining assayed autoantibodies were observed, a tendency to higher positive incidence in patients compared with controls was seen. Additional studies with an enlarged population of patients are needed to elucidate the exact role of the humoral autoimmune response in CP/CPPS.
El término prostatitis indica un estado de inflamación de la glándula prostática y comprende varios síndromes(1). Los Institutos Nacionales de Salud de Estados Unidos (National Institutes of Health, NIH) han propuesto una clasificación de síndromes de prostatitis en cuatro categorías: prostatitis bacteriana aguda (categoría I), prostatitis bacteriana crónica (categoría II), prostatitis crónica/síndrome de dolor pélvico crónico o CP/CPPS (categoría III), la cual a su vez se subdivide en inflamatoria (categoría IIIA) y no-inflamatoria (categoría IIIB); y prostatitis inflamatoria asintomática (categoría IV)(2). Desde la década pasada ha habido un resurgimiento del interés y nuevas investigaciones sobre prostatitis crónica y síndromes relacionados, principalmente debido a que estos síndromes han sido reconocidos como un importante problema de salud en todo el mundo(3). La CP/CPPS afecta principalmente a hombres jóvenes, activos, menores de 50 años de edad y la misma se presenta como una inflamación de la próstata con síntomas locales de dolor pélvico, suprapúbico, perineal, peneano, testicular y rectal, sin evidencia de infección del tracto urinario. Además, este dolor se acompaña de disuria, poliaquiuria, nicturia y alteraciones en la eyaculación(2). Los síntomas usualmente son crónicos, con leves mejorías y recaídas a lo largo del tiempo, pero algunos hombres tienen grandes fluctuaciones en la severidad de los mismos que afectan notablemente su calidad de vida(3).
Mientras que la prostatitis aguda es comúnmente causada por una infección bacteriana, la CP/CPPS se caracteriza por presentarse como una inflamación prostática en ausencia de infección. Además, en muchos pacientes asintomáticos se detecta prostatitis crónica no infecciosa al realizarles una biopsia, como consecuencia de la detección de niveles séricos elevados de PSA y un probable diagnóstico de cáncer prostático(2). Los pacientes presentan inflamación prostática, con signos y síntomas localizados, sin una causa aparente. Los factores que complican aún más el manejo de esta condición incluyen su etio-patogénesis [probablemente multifactorial(4,5)], la falta de un ensayo diagnóstico estándar confiable(4), y las limitaciones metodológicas de muchos estudios sobre eficacia de tratamiento. En consecuencia, las estrategias para el tratamiento son empíricas y se han enfocado principalmente en el alivio de los síntomas más que a atacar la causa subyacente, resultando ineficaces en la mayoría de los casos(4,5). Dentro de las causas de este síndrome se proponen una serie de hipótesis(6-9); algunos investigadores sostienen que microorganismos clásicamente no cultivables podrían cumplir un rol en la patogénesis(9,10). Esta hipótesis puede ser aplicada sólo a una cierta fracción de pacientes que comprende entre el 6 y 30% para algunos autores(11). No obstante, la porción restante de pacientes representa una fracción significativa donde no se encuentra ningún agente infeccioso como responsable de la patología. Es interesante destacar que el análisis de células en secreción prostática obtenida luego de masaje prostático en estos pacientes, ha evidenciado la presencia de granulocitos, macrófagos, linfocitos T y linfocitos B(12); además, se detectaron niveles elevados de citocinas en plasma seminal y secreciones prostáticas de los mismos, lo que sugiere la presencia de un proceso inflamatorio activo en el tracto genital masculino en ausencia de infección(13-15). Estos hallazgos apoyan la hipótesis que sostiene que esta inflamación sería mediada por una respuesta inmune adaptativa, contra antígenos propios del tracto genital, en el marco de un proceso autoinmune. Ciertamente, resultados reportados por otros autores y por nuestro grupo de trabajo han demostrado la presencia de linfocitos T específicos contra antígenos prostáticos en un importante número de pacientes con CP/CPPS(16-18).
Es bien conocido que múltiples factores están involucrados en el desencadenamiento de una enfermedad autoinmune, entre los que podemos citar factores genéticos, ambientales y hormonales(19). Tanto en pacientes que presentan enfermedades autoinmunes órgano-específicas como en modelos animales de estas enfermedades, se han descrito asociaciones de enfermedades autoinmunes(20-26). Este es el caso de la alta frecuencia de tiroiditis de Hashimoto en pacientes con diabetes autoinmune(22) o la mayor susceptibilidad a desarrollar distintas enfermedades autoinmunes órgano-específicas que presenta la cepa de ratones no obesos diabéticos que espontáneamente desarrolla diabetes autoinmune(24). Estos hallazgos sugieren la existencia de un fondo genético que predispone al desarrollo de autoinmunidad.
Una característica de esta asociación es el hecho de que diferentes enfermedades autoinmunes frecuentemente comparten o tienen elementos (autoanticuerpos y/o células autorreactivas) en común. En el presente trabajo, además de estudiar los anticuerpos anti-células DU-145 (una línea de células prostáticas humanas), se compararon pacientes con CP/CPPS y controles normales en cuanto a la presencia de diferentes autoanticuerpos típicos de distintas enfermedades autoinmunes, con el objetivo de avanzar en el estudio de una posible causa autoinmune en esta patología. Estos anticuerpos incluyen: Factor Reumatoideo (FR), anticuerpos anti-nucleares (ANA), anti-microsomas de hígado y riñón (LKM), anti-músculo liso (ASMA), antimitocondriales (AMA), anti-peroxidasa tiroidea (TPO), anti-tiroglobulina (Tg), y anti-células de los islotes pancreáticos (ICA).
MATERIALES Y MÉTODOSPacientes y controlesPrevio a comenzar el trabajo, el comité de ética institucional aprobó este estudio y se obtuvieron los consentimientos por escrito de todos los pacientes y controles, quienes estuvieron de acuerdo en donar muestras de sangre y semen y no recibieron tratamiento de antibióticos o anti-inflamatorios durante 4 semanas previas a la toma de muestras. Se incluyeron 25 pacientes (mediana= 42, P25-75=35-47) y 13 controles voluntarios (mediana= 30, P25-75=28-32). El diagnóstico de prostatitis crónica no infecciosa se realizó en individuos con historia sintomática característica de esta enfermedad de 3 meses o más de duración y ausencia de microorganismos convencionales y no convencionales (Ureaplasma spp, Chlamydia trachomatis, Micoplasma spp.) en muestras de semen y orina. Pacientes con prostatitis crónica infecciosa o voluntarios que hubieran sido sometidos a vasectomía fueron excluidos de este estudio. Los controles normales fueron sometidos a los mismos estudios que los pacientes, respondieron un cuestionario y no presentaron historia previa de síntomas genitourinarios.
Todas las determinaciones que se detallan a continuación fueron realizadas a ciegas por el mismo operador para evitar subjetividad en la lectura de los resultados.
Determinación de anticuerpos anti-células DU-145Se realizó inmunofluorescencia indirecta (IFI) sobre células DU-145 que fueron cultivadas en medio RPMI-1640 suplementado con suero fetal bovino inactivado al 10%, L-glutamina 2 mM y penicilina/estreptomicina 100 U/ml, en estufa de cultivo a 37°C en una atmósfera de CO2 al 5% en placa de poliestireno de 24 reservorios. En cada reservorio fue colocado un cubreobjetos de vidrio circular (impronta) sobre el cual crecieron las células hasta una confluencia del 60%. Luego, se retiró el medio de cultivo y se congeló la placa por un período inferior a dos semanas. Se probaron las improntas sin fijador, con etanol y con metanol. Se decidió no utilizar fijador para evitar la desnaturalización de cualquier antígeno cuya detección pudiera ser relevante en nuestros estudios, puesto que las células se encontraban en estado óptimo. Para establecer la dilución óptima con la que se debían ensayar los sueros, se utilizaron sueros de dos controles normales de 23 y 43 años sin signos ni síntomas compatibles con prostatitis de ninguna índole y no relacionados a los controles del estudio. La dilución 1/20 en tampón fosfato salino (PBS, pH= 7,2-7,4) fue considerada la óptima por poseer mínimo fondo de fluorescencia inespecífica y mayor sensibilidad. Todos los pacientes y controles fueron ensayados por duplicado y en caso de hallar discordancia en los resultados, los sueros fueron reensayados. Simultáneamente se procesaron los dos controles negativos utilizados para determinar el título de corte. La primera incubación con los sueros diluidos 1/20 en PBS se realizó durante 1 hora a temperatura ambiente. Se realizaron 3 lavados de 5 minutos cada uno con PBS y se procedió a colocar el antisuero de cabra anti-IgG humano marcado con isotiocianato de fluoresceína diluido 1/150 (Biocientífica S.A, Buenos Aires, Argentina). Se incubó 1 hora a temperatura ambiente y en oscuridad y se volvió a lavar 3 veces. Se montaron los vidrios, se observó el patrón de fluorescencia y se utilizó una valoración cualitativa para medir la intensidad de la misma, a saber: fluorescencia leve, moderada y fuerte [Microscopio de fluorescencia Olympus (BH-2), Japón].
Determinación de Factor Reumatoideo (FR)La determinación de FR se realizó mediante aglutinación indirecta de partículas inertes de látex sensibilizadas con la fracción II de Cohn (γ globulina humana) (Artritest directo Wiener laboratorios S.A.I.C., Rosario, Argentina). El "screening" se realizó con los sueros sin diluir, y para aquellas muestras que daban positivas se procedió a la determinación del título final partiendo de una dilución 1/10 y siguiendo con diluciones seriadas al medio.
Determinación de anticuerpos anti-tiroideos (ATA), anti-peroxidasa tiroidea (anti-TPO) y anti-tiroglobulina (anti-Tg)Se realizó mediante IFI sobre cortes de tiroides de conejo fijados (Biocientífica S.A.). Las muestras se ensayaron diluidas 1/20 siguiendo especificaciones del fabricante. Se consideraron positivas para anti-TPO (anteriormente conocidos como microsomas tiroideos) aquellas muestras que mostraron tinción fluorescente en el citoplasma de las células epiteliales del folículo tiroideo y para anti-Tg las que mostraron fluorescencia en forma de flóculos en la sustancia coloide del folículo. Conjuntamente se procesó un control anti-TPO positivo y un control negativo.
Determinación de anticuerpos anti-células de los islotes pancreáticos (ICA)Se realizó por IFI sobre improntas sensibilizadas con cortes de páncreas de mono (BioSystems S.A., Barcelona, España). Los sueros de 13 pacientes y 7 controles normales, y los controles positivo y negativo diluidos 1/5, se sembraron e incubaron toda la noche (18 hs) a 37ºC. Este tiempo de incubación, comparado a 30 minutos, aumenta la sensibilidad aproximadamente 8 veces(27). Se lavó 3 veces con PBS, se colocó antisuero anti-IgG humano marcado con isotiocianato de fluoresceína diluido 1/100 (Biocientífica S.A) y se volvió a incubar 1 hora a 37°C. Se realizaron los últimos 3 lavados con PBS, se montó y se observó en microscopio de fluorescencia. Se consideraron positivas las muestras que presentaron tinción fluorescente de los islotes pancreáticos.
Determinación de anticuerpos anti-nucleares (ANA)Se realizó mediante IFI sobre improntas sensibilizadas con células Hep-2 (BioSystems S.A.). Los sueros fueron diluidos 1/10 en PBS e incubados 30 minutos a 37°C. Se practicaron 3 lavados con PBS y se incubó otros 30 minutos a 37°C con el anticuerpo de cabra anti-IgG humano marcado con isotiocianato de fluoresceína (Biocientífica S.A.). Se lavaron las improntas, se montaron y se observaron en microscopio de fluorescencia.
Se consideraron positivas las muestras que presentaron algún patrón de fluorescencia a la dilución practicada la cual fue elegida para aumentar la sensibilidad de la técnica.
Determinación de anticuerpos anti-músculo liso (ASMA), anti-mitocondriales (AMA), anti-microsomas de hígado y riñón (anti-LKM) y anti-células parietales gástricas (APCA)La determinación de estos autoanticuepros se realizó por IFI sobre cortes de hígado, estómago y riñón de rata (Biocientífica S.A.). Las muestras se ensayaron diluidas 1/20 siguiendo especificaciones del fabricante. Conjuntamente se procesó un control AMA positivo y un control negativo. Positivas para AMA fueron consideradas aquellas muestras que mostraron fluorescencia granular en las mitocondrias del citoplasma de las células gástricas, células de Kupffer, hepatocitos y las células de los túbulos renales. Los ASMA tiñen las capas musculares del estómago; los ASMA F-actina tiñen las muscularis mucosa interglandulares, fibras de actina y la capa muscular de los vasos sanguíneos. Con los LKM se observa tinción homogénea del citoplasma de los hepatocitos y de los túbulos renales proximales; los túbulos distales no se tiñen. Los APCA tiñen el citoplasma de las células en las glándulas mucosas del estómago de rata.
Análisis estadísticoEl análisis estadístico se realizó utilizando el programa Graph Pad Instat. El análisis de las variables categóricas se realizó mediante los Tests Chi cuadrado (χ2) o Exacto de Fisher, según corresponda. En todos los casos se consideró estadísticamente significativo un P<0.05.
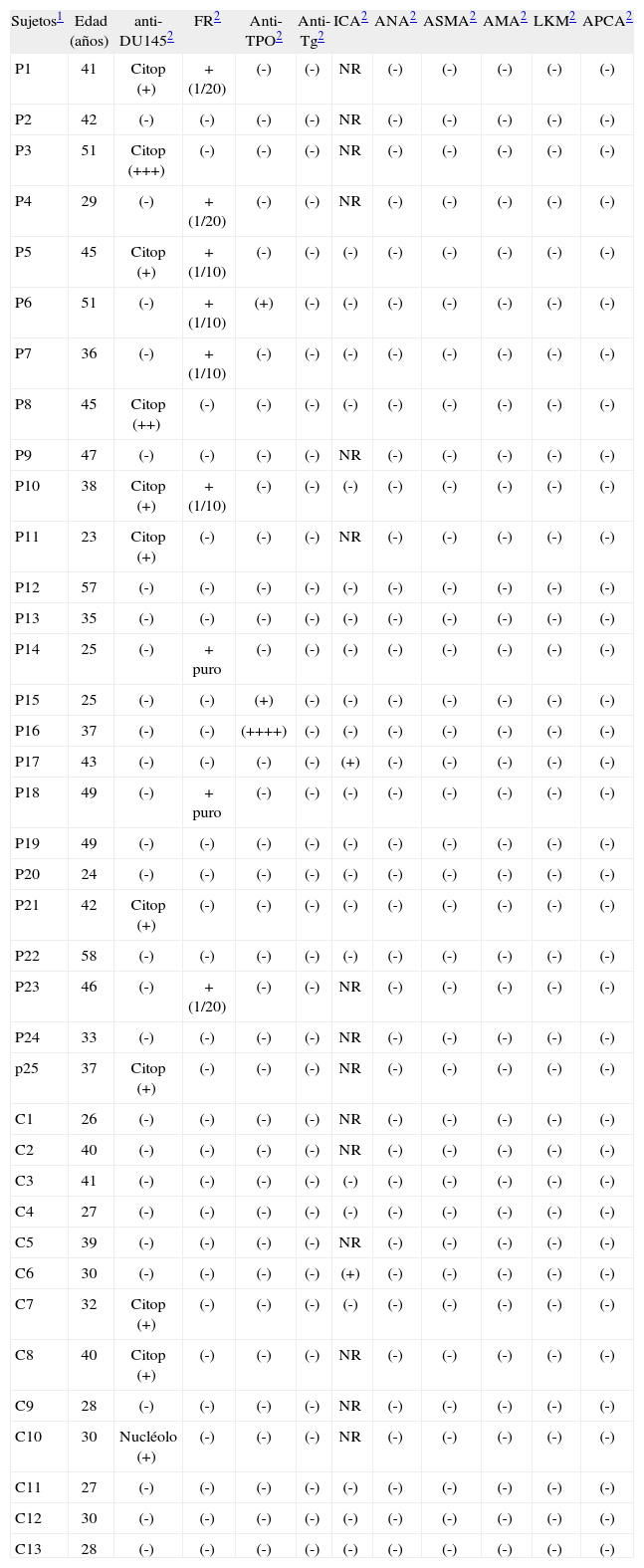
RESULTADOSLa determinación de anticuerpos anti-células prostáticas humanas, mediante IFI sobre células DU-145, no arrojó diferencias estadísticamente significativas cuando se compararon los pacientes con CP/CPPS y los controles normales (p=0,71). La mayoría de los sueros que arrojaron resultados positivos lo hicieron con fluorescencia débil y tinción granular citoplasmática. Hubo excepciones, como un paciente que presentó moderada fluorescencia citoplasmática, otro paciente con fuerte fluorescencia citoplasmática y 1 control normal con débil tinción en el nucleolo de las células (Tabla I).
Hallazgos de laboratorio de 25 pacientes con CP/CPPS y 13 controles normales
| Sujetos1 | Edad (años) | anti-DU1452 | FR2 | Anti-TPO2 | Anti-Tg2 | ICA2 | ANA2 | ASMA2 | AMA2 | LKM2 | APCA2 |
| P1 | 41 | Citop (+) | + (1/20) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P2 | 42 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P3 | 51 | Citop (+++) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P4 | 29 | (-) | + (1/20) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P5 | 45 | Citop (+) | + (1/10) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P6 | 51 | (-) | + (1/10) | (+) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P7 | 36 | (-) | + (1/10) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P8 | 45 | Citop (++) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P9 | 47 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P10 | 38 | Citop (+) | + (1/10) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P11 | 23 | Citop (+) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P12 | 57 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P13 | 35 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P14 | 25 | (-) | + puro | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P15 | 25 | (-) | (-) | (+) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P16 | 37 | (-) | (-) | (++++) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P17 | 43 | (-) | (-) | (-) | (-) | (+) | (-) | (-) | (-) | (-) | (-) |
| P18 | 49 | (-) | + puro | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P19 | 49 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P20 | 24 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P21 | 42 | Citop (+) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P22 | 58 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| P23 | 46 | (-) | + (1/20) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| P24 | 33 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| p25 | 37 | Citop (+) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C1 | 26 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C2 | 40 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C3 | 41 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| C4 | 27 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| C5 | 39 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C6 | 30 | (-) | (-) | (-) | (-) | (+) | (-) | (-) | (-) | (-) | (-) |
| C7 | 32 | Citop (+) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| C8 | 40 | Citop (+) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C9 | 28 | (-) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C10 | 30 | Nucléolo (+) | (-) | (-) | (-) | NR | (-) | (-) | (-) | (-) | (-) |
| C11 | 27 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| C12 | 30 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
| C13 | 28 | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) | (-) |
Al realizar la determinación de FR, se observó un resultado positivo en 9/25 pacientes (36,0%) con CCPS y en 0/13 (0%) controles normales, encontrándose diferencias estadísticamente significativas, p=0,016 (Tabla I).
En la determinación de anticuerpos anti-TPO y anti-Tg, 3 pacientes con CP/CPPS resultaron positivos para antiTPO y ninguno para anti-Tg. Ningún individuo del grupo control evidenció resultado positivo para estos dos anticuerpos anti-tiroideos. Para los anti-TPO el p fue de 0,54, y en consecuencia no hubo diferencia estadísticamente significativa entre los grupos en estudio (Tabla I).
En el caso de la determinación de ICA, la prueba resultó positiva para 1 paciente con CP/CPPS y para uno de los individuos control (p=0,99) (Tabla I).
Para ANA, ASMA, AMA, LKM, APCA ninguno de los pacientes analizados y ningún control normal, arrojaron valores positivos a la dilución ensayada en el estudio (Tabla I).
DISCUSIÓNLa prostatitis es una patología muy común en el consultorio urológico que muchos facultativos encuentran difícil de tratar. A su vez, representa el 10% de las consultas urológicas, y se ha estimado que más de la mitad de los hombres sufren síntomas de prostatitis en algún momento de sus vidas(1,2). El diagnóstico de prostatitis bacteriana aguda por métodos microbiológicos es reproducible y fácil de llevar a cabo en el laboratorio. Por el contrario, el diagnóstico microbiológico de CP/CPPS representa un desafío importante. La mayoría de las CP/CPPS, que da cuenta del 90% de los casos totales de prostatitis, son determinadas fundamentalmente de acuerdo a un diagnóstico clínico, y por ende la terapia instaurada es empírica, resultando en un fracaso terapéutico en la mayoría de los casos(1,4).
Para explicar la etiología de la CP/CPPS se han propuesto numerosas hipótesis como infecciones crípticas de difícil identificación o cultivo(9, 10, 28). Ciertos hallazgos sustentan esta hipótesis: algunos pacientes relacionan el comienzo de los síntomas con la actividad sexual, asociada en algunos casos a episodios de uretritis, mientras que otros no indican relación alguna entre el comienzo de la sintomatología y la actividad sexual. El uso de antimicrobianos puede o no producir un alivio transitorio de los síntomas. Un número importante de microorganismos han sido postulados como causales de este síndrome: Trichomonas vaginalis, Chlamydia trachomatis, micoplasmas genitales, estafilococos, bacterias corineformes y virus genitales(9). Estos datos son muy controvertidos debido a que muchos otros investigadores, o bien fallaron en demostrar su presencia, o solamente los encontraron en raras circunstancias(9,10).
Otra de las hipótesis que han sido propuestas durante los últimos años, postula a la autoinmunidad contra antígenos prostáticos como responsable de la inflamación prostática presentada por los pacientes con CP/CPPS(16-18). El sistema inmune ha generado, a lo largo de la evolución, una serie de mecanismos complejos para mantener la tolerancia a lo propio, o "autotolerancia", y prevenir la autoinmunidad. Últimamente, se ha evidenciado que el repertorio de linfocitos T periféricos específicos hacia algunas secuencias de proteínas propias de cada individuo se encuentra intacto y funcionalmente activo pero mantenidos bajo control por los mecanismos periféricos de autotolerancia(29). No obstante, información aportada por varias investigaciones demuestran que el repertorio de linfocitos T específicos hacia autoantígenos particulares pueden ser potencialmente activados y luego desencadenar una enfermedad autoinmune(30). Aunque las respuestas autoinmunes hacia la mayoría de los tejidos en el organismo han sido extensamente descritas desde décadas atrás, se conoce muy poco respecto a la respuesta autoinmune dirigida contra la próstata. Al respecto, Corman y cols. estudiaron el repertorio de linfocitos T CD4+ y CD8+ específicos contra antígenos prostáticos típicos en hombres adultos normales. Mediante el uso de líneas celulares de linfocitos T a corto tiempo, estos investigadores demostraron la existencia de linfocitos T específicos contra antígenos prostáticos en individuos normales(31). Estos clones de linfocitos T autorreactivos podrían ser potencialmente activados quebrando el estado fisiológico de autotolerancia y llevando al desarrollo de una prostatitis autoinmune. Recientemente, hemos reportado la presencia de linfocitos capaces de activarse, proliferar y secretar IFN-γ de manera específica en respuesta al estímulo con antígenos prostáticos [como Antígeno Prostático Específico (PSA), Fosfatasa Ácida Prostática (FAP), y otros)] en un grupo de pacientes con CP/CPPS(18). En este trabajo, se evaluaron antígenos presentes en el plasma seminal (PS), extracto prostático humano normal (EP), PSA y FAP como potenciales antígenos reconocidos por el sistema inmune de los pacientes y se demostró que PS y FAP fueron capaces de inducir una respuesta linfoproliferativa significativa con alta secreción específica de IFN-γ en un grupo de pacientes con CP/CPPS. Asimismo, Alexander y cols. reportaron resultados interesantes que demuestran la presencia de una respuesta autoinmune, mediada por células T, hacia antígenos prostáticos en pacientes con prostatitis crónica(16). Ellos presentaron evidencia de la actividad específica de linfocitos T hacia antígenos del plasma seminal en algunos pacientes con CP/CPPS, pero no en individuos controles. Posteriormente, y con el objetivo de definir los antígenos potencialmente reconocidos por esta respuesta, encontraron que algunos pacientes con CP/CPPS evidenciaron una respuesta proliferativa específica por parte de linfocitos T CD4+ hacia PSA(32). Batstone y cols. también analizaron la proliferación de células T en respuesta al estímulo con proteínas de plasma seminal autólogo o heterólogo, y evidenciaron respuestas positivas en 13 de 20 pacientes con prostatitis crónica y en 3 de 20 individuos controles(17). Además, en estos mismos trabajos se demostró que pacientes con CP/CPPS presentaban elevados niveles de citocinas proinflamatorias, como IFN-γ, IL-1β y TNF-α, en muestras de plasma seminal, lo que evidenciaba la presencia de inflamación local en ausencia de infección(14,33,34).
Con respecto al estudio de la respuesta autoinmune humoral, en trabajos previos en los que analizamos la presencia de anticuerpos específicos contra antígenos prostáticos(18), no se detectaron diferencias significativas en los niveles encontrados entre pacientes y controles en las muestras de suero y plasma seminal estudiadas. De igual manera, en el presente trabajo no se encontraron diferencias significativas cuando se evaluó la presencia de anticuerpos anti-células prostáticas humanas DU-145 en la población de pacientes y controles en estudio. Este resultado fue sorprendente, aunque también fue llamativa la casi inexistencia de reportes en literatura científica que aborden este aspecto(16,17,35). No obstante, ha sido reportada la presencia de niveles incrementados de IgA e IgG total sin especificidad hacia ningún microorganismo en secreciones prostáticas de pacientes con prostatitis crónica no infecciosa(35). Además, también se demostraron depósitos de IgM en tejido periglandular prostático en 34 de 60 pacientes con prostatitis crónica y en 1 de 21 controles(35). Una posibilidad para explicar el hecho de que no se hayan reportado respuestas autoinmunes humorales positivas en estos pacientes, es que se deba a un problema metodológico, ya sea porque la sensibilidad de las metodologías empleadas no son adecuadas para su determinación, o bien podría deberse a una elección equívoca del antígeno a evaluar, lo que estaría impidiendo la detección de autoanticuerpos contra antígenos prostáticos en estos pacientes. No obstante, recientemente se ha reportado la presencia de IgG específica en pacientes con prostatitis crónica(36); estos autores demostraron la presencia de IgG específica contra MAD-PRO-34 en 6 de 67 pacientes con prostatitis crónica y en ninguno de los 71 controles normales utilizando la metodología SEREX (identificación serológica de antígenos por clonado de expresión recombinante). El antígeno MAD-PRO-34, reconocido preferentemente por la respuesta inmune humoral de los pacientes con prostatitis crónica comparado con controles normales, es un autoantígeno nucleolar que previamente fue identificado como una proteína potencialmente sobreexpresada en carcinoma prostático y reconocido por la respuesta inmune de pacientes con cáncer de próstata(37) y cistitis intersticial(38), una patología altamente relacionada con la CP/CPPS. Es importante aclarar que las muestras de suero de los pacientes analizados en el presente estudio fueron previamente analizadas para determinar la presencia de autoanticuerpos anti MAD-PRO-34 y se demostró la presencia de los mismos en 4/40 (10%) pacientes con CP/CPPS y en 0/40 (0%) de los controles normales (observaciones no publicadas). Este resultado concuerda con los previamente reportados por Dunphy y cols.(36).
La autoinmunidad ha sido tradicionalmente dividida en autoinmunidad órgano-especifica (anti-páncreas, tiroides, cerebro, tracto gastrointestinal) o no órgano-específica (lupus eritematoso sistémico, artritis reumatoidea), dependiendo de que la respuesta inmune esté dirigida contra un antígeno confinado en un órgano en particular o contra un antígeno distribuido de manera ubicua en el organismo. No obstante, tanto en pacientes como en modelos animales, una enfermedad órgano-específica está frecuentemente asociada con otra (por ej. diabetes, gastritis, y tiroiditis) y una característica de esta asociación es el hecho de que diferentes enfermedades autoinmunes frecuentemente comparten o tienen elementos (autoanticuerpos y/o células autorreactivas) en común(20-23,25,26). Debido a esto, en el presente trabajo se investigó si los pacientes con CP/CPPS presentaban autoanticuerpos típicos de diferentes enfermedades autoinmunes. En la población de individuos en estudio, se analizó la presencia de: FR presente en altos títulos en pacientes con artritis reumatoidea (AR) y síndrome de Sjogren; anticuerpos antitiroideos: anti-TPO y anti-Tg presentes en pacientes con enfermedades autoinmunes tiroideas; ICA que se detectan en pacientes con diabetes mellitus insulino-dependiente (DMID) de diagnóstico reciente y que aparecen años antes de la presentación de la DMID en un porcentaje importante de parientes de primer grado de pacientes con DMID; ANA presentes en pacientes con enfermedades del tejido conectivo; ASMA que aparecen en la hepatitis autoinmune de tipo I; AMA característicos de pacientes con cirrosis biliar primaria; anti-LKM marcadores de hepatitis autoinmune de tipo II; o APCA presentes en pacientes con gastritis autoinmune y anemia perniciosa. Se halló una diferencia estadísticamente significativa entre pacientes y controles solamente para FR. Debido a que los títulos hallados fueron bajos y sumado a que los pacientes no presentaban manifestaciones clínicas relacionadas a AR o síndrome de
Sjogren, es muy improbable que estos pacientes tengan asociada otra enfermedad autoinmune(39,40). No encontramos diferencias significativas entre pacientes y controles para el resto de los autoanticuerpos analizados. Sin embargo, para el caso de los anti-TPO 3 pacientes presentaron estos autoanticuerpos y ningún control normal, lo que sugiere que quizás aumentando el número de pacientes y controles (n) se podría llegar a detectar una diferencia estadísticamente significativa. Si bien estos resultados ponen de manifiesto una mayor incidencia de un marcador autoinmunitario inflamatorio como lo es el FR en el grupo de pacientes con CP/CPPS, no se observó una diferencia significativa para el resto de los autoanticuerpos estudiados. Esto último concuerda con la falta de reportes en literatura que demuestren la presencia de respuestas autoinmunes humorales en pacientes con CP/CPPS. No obstante, la asociación de un nuevo marcador inflamatorio (FR) a esta enfermedad que constituye una inflamación crónica en ausencia de infección y, sumado a las evidencias previas reportadas en literatura, aporta mayor información que sustenta la hipótesis de la inflamación de origen autoinmune como causa de la misma en un grupo de pacientes con CP/CPPS. Esta respuesta autoinmune sería mediada fundamentalmente por un mecanismo de tipo celular o hipersensibilidad retardada, con un perfil de respuesta de tipo Th1. Los anticuerpos podrían no estar cumpliendo un rol clave en la patogénesis de esta enfermedad, sino que serían secundarios a la generación de la misma, o bien dicho rol podría estar enmascarado por la imposibilidad de demostrarlos debido a un problema metodológico o de una elección errónea del antígeno.
Es necesaria mayor investigación en esta patología que ayude a dilucidar los mecanismos etiopatogénicos involucrados en la misma con el objetivo de lograr, a futuro, terapias más eficientes que ayuden a paliar el importante problema sanitario que esta enfermedad constituye en la actualidad.
AGRADECIMIENTOSLos autores agradecen a la Dra Emilia M. Menso de Ezcurra por la lectura crítica y desinteresada del manuscrito. Este trabajo ha sido realizado con subsidios de la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyTFONCyT) PICT 05-38069.
CONFLICTO DE INTERÉSLos autores declaran no tener ningún conflicto de interés financiero.