Comparar la capacidad predictiva de la herramienta trigger y del Conjunto Mínimo de Datos Básicos (CMBD) en la detección de eventos adversos (EA) en tiroidectomías y paratiroidectomías.
MétodosEstudio descriptivo, observacional de corte transversal, con análisis retrospectivo y transversal de los datos de pacientes sometidos a tiroidectomía o paratiroidectomía entre mayo de 2014 y abril de 2015. La detección de EA se realizó mediante la identificación de triggers (situación asociada frecuentemente con evento adverso) y el CMBD. Los triggers y los EA se identificaron mediante la revisión sistemática de la documentación clínica. El CMBD se obtuvo de la base de datos clínico-administrativa del hospital. Una vez detectado un EA, se procedió a su caracterización.
ResultadosSe identificaron 203 EA en 251 pacientes, siendo el 94,09% detectado por la herramienta trigger y el 10,34% por el CMBD; 123 pacientes tuvieron al menos un EA (50,2%). Si exceptuamos el mal control del dolor como único EA (29 pacientes), la prevalencia fue del 38,65%; 187 EA se consideraron evitables (92,11%) y 16 inevitables. La herramienta trigger y el CMBD mostraron una sensibilidad del 91,27 y 13,49%, una especificidad del 4,8 y 100%, un valor predictivo positivo del 49,15 y 100%, y un valor predictivo negativo del 35,29 y 53,42%, respectivamente. Los triggers con mayor poder predictivo en la detección de EA fueron: «administración de antiemético» y «administración de calcio».
ConclusionesLa herramienta trigger es más sensible que el CMBD en la detección de EA. Todos los eventos adversos produjeron daño temporal y la mayoría fueron evitables.
To compare the ability of the trigger tool) and the Minimum Basic Data Set (MBDS) in detecting adverse events (AE) in hospitalized surgical patients with thyroid and parathyroid disease.
MethodsA descriptive, cross-sectional observational study, retrospective and cross-sectional study was conducted from May 2014 to April 2015 analysing retrospectively data on of patients submitted to thyroidectomy and parathyroidectomy in order to detect AE through the identification of triggers (an event often associated to an AE) and the MBDS. triggers and AE were located by systematic review of clinical documentation. The MBDS was got from the data base. Once an AE was detected, it was characterized.
Results203 AE were identified in 251 patients, being the 90.04% detected by trigger tool and 10.34% by MBDS. 126 patients had at least one AE (50.2%). Without the cases in which uncontrolled pain was the only AE, the percentage of patients that suffering AE was 38.65%. 187 AE were considered preventable and 16 AE were considered unpreventable. The trigger tool and the MBDS demonstrated a sensitivity of 91.27 and 13.49%, a specificity of 4.8 and 100%, a positive predictive value of 49,15 and 100%, and a negative predictive value of 35.29 and 53.42%, respectively. The triggers with more predictive power in AE detection were «antiemetic administration» and «calcium administration».
ConclusionsTrigger tool shows higher sensitivity for detecting AE than the MBDS. All the detected AE were considered low severity and most of them were preventable.
La identificación de eventos adversos (EA) y su prevención han sido fundamentales en la seguridad del paciente, tal como declaró la OMS en 19851. El estudio ENEAS2, desarrollado en hospitales españoles, demostró una incidencia de EA del 8,4%.
De entre todos los EA, los más frecuentes y graves son los asociados a las intervenciones quirúrgicas, donde se han registrado tasas de EA del 7-30% a nivel internacional3,4, y de un 10,3% en Cirugía General2.
Para la identificación de estos EA se han empleado varias herramientas5-7: notificación de incidentes, revisión de historias clínicas, observación directa, debriefing, base para la codificación de los informes de alta, o lo que es lo mismo, el Conjunto Mínimo de Datos Básicos (CMBD) y, más recientemente, la herramienta trigger (HT).
Hasta el momento, no existe una herramienta que haya demostrado claramente su superioridad en este campo5,8. Dada la escasa eficiencia de los métodos tradicionales, en 1974 surgió la primera aproximación al concepto actual de HT9.
La HT, que significa «gatillo» o «palabra centinela», se basa en la búsqueda en las historias clínicas de parámetros, situaciones o eventos (trigger), que tienen una fuerte asociación con la aparición de EA10,11.
El Institute for Healthcare Improvement (IHI) desarrolló el método Global Trigger Tool (GTT) en 2007, publicando la segunda edición en 200912. Basado en la búsqueda e identificación de triggers en las historias clínicas. Una vez identificados, aquellas historias clínicas que los contenían eran seleccionadas para una segunda fase en la que se realizaba una revisión exhaustiva para la detección de EA.
El objetivo principal del presente estudio fue comparar la capacidad predictiva de la HT y del CMBD en la detección de EA.
Material y métodosEstudio observacional, descriptivo de corte transversal para la detección de EA mediante un análisis retrospectivo de los datos del CMBD y el cribado de historias clínicas empleando un conjunto de triggers.
El periodo de estudio comprendió desde mayo de 2014 hasta abril de 2015.
Criterios de inclusión y exclusión
Se incluyeron los datos de pacientes ≥ 18 años, intervenidos de patología tiroidea y paratiroidea en Cirugía General, con ingreso de más de 24 horas e historias completas y cerradas (alta hospitalaria).
El criterio de exclusión fue cuando hubo intervención quirúrgica en otros órganos.
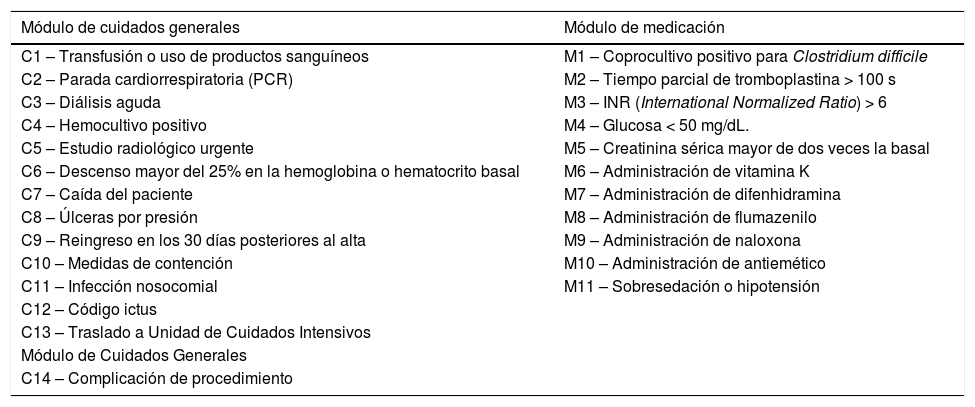
Análisis de efectos adversosSe realizó una adaptación del listado de triggers propuesto por el IHI12, añadiendo otros tras una revisión sistemática de la literatura (tabla 1).
Listado completo de los triggers analizados
| Módulo de cuidados generales | Módulo de medicación |
|---|---|
| C1 – Transfusión o uso de productos sanguíneos | M1 – Coprocultivo positivo para Clostridium difficile |
| C2 – Parada cardiorrespiratoria (PCR) | M2 – Tiempo parcial de tromboplastina > 100 s |
| C3 – Diálisis aguda | M3 – INR (International Normalized Ratio) > 6 |
| C4 – Hemocultivo positivo | M4 – Glucosa < 50 mg/dL. |
| C5 – Estudio radiológico urgente | M5 – Creatinina sérica mayor de dos veces la basal |
| C6 – Descenso mayor del 25% en la hemoglobina o hematocrito basal | M6 – Administración de vitamina K |
| C7 – Caída del paciente | M7 – Administración de difenhidramina |
| C8 – Úlceras por presión | M8 – Administración de flumazenilo |
| C9 – Reingreso en los 30 días posteriores al alta | M9 – Administración de naloxona |
| C10 – Medidas de contención | M10 – Administración de antiemético |
| C11 – Infección nosocomial | M11 – Sobresedación o hipotensión |
| C12 – Código ictus | |
| C13 – Traslado a Unidad de Cuidados Intensivos | |
| Módulo de Cuidados Generales | |
| C14 – Complicación de procedimiento |
| Módulo quirúrgico | Módulo de Cuidados Intensivos |
|---|---|
| S1 – Reintervención quirúrgica | I2 – Readmisión en Unidad de Cuidados Intensivos |
| S2 – Cambio en el procedimiento. | I3 – Intubación o reintubación |
| S5 – Pruebas de imagen radiológica | |
| S6 – Muerte intra o postoperatoria | |
| S7 – Ventilación mecánica > 24 h postoperatoria | |
| S8 – Administración intraoperatoria de epinefrina, norepinefrina, naloxona o romazicon | |
| S9 – Niveles de troponinas postoperatorias > 1,5 ng/mL | |
| S10 – Daño, reparación o extirpación de órgano no prevista | |
| S11 – Complicación quirúrgica |
| Añadidos propios |
|---|
| - Admisión en Urgencias en los 30 días posteriores al alta |
| - Reingreso en Cirugía General en los tres meses posteriores al alta |
| - Realización de endoscopia |
| - Necesidad de nutrición parenteral |
| - Administración de calcio |
| - Administración de antibioterapia |
| - Administración de corticoides |
| - Estancia en Reanimación > 24 h |
| - Anatomía patológica no relacionada con el diagnóstico |
Todas las historias fueron analizadas por un revisor con formación previa en metodología trigger y seguridad del paciente, habiendo participado en estudios previos sobre la herramienta2,3. El análisis sistemático de la historia clínica electrónica para la identificación de triggers y EA se realizó utilizando una guía de revisión secuencial de documentos empleados en otros trabajos relacionados con HT en cirugía general11,13,14. Tanto las historias con trigger positivo como aquellas en las que no se identificó ningún trigger fueron revisadas posteriormente para la detección de eventos adversos. En caso de encontrarse algún EA se caracterizaron, según «evitabilidad» y gravedad.
La categoría de estimación de «evitabilidad» de EA se estableció, según la clasificación del estudio ENEAS2:
Grado 1. Ausencia de «evitabilidad».
Grado 2. Mínima posibilidad de prevención.
Grado 3. Ligera posibilidad de prevención.
Grado 4. Moderada posibilidad de prevención.
Grado 5. Elevada posibilidad de prevención.
Grado 6. Total posibilidad de prevención.
Para la categorización del daño de cada EA se empleó la clasificación de la National Coordinating Council for Medication Error Reporting and Prevention15 (E: daño que requiere algún tipo de atención sanitaria, hasta I: muerte del paciente).
En los casos de duda sobre la existencia o no de EA o la caracterización de este, el revisor consultó con dos cirujanos seniors.
Se consideró EA todo «suceso nocivo e inintencionado no relacionado con la enfermedad, que le ocurre al paciente como consecuencia de la atención sanitaria»16.
El CMBD se obtuvo de la base de datos del hospital (codificación CIE-9). Se procedió a una revisión de los códigos para identificar únicamente aquellos relacionados con EA.
Aspectos éticosEl estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital 12 de octubre. Se siguieron las normas de protección de datos de pacientes y profesionales.
Análisis estadísticoPara la descripción de los resultados descriptivos se utilizaron medidas de centralización (media, mediana y porcentajes) y dispersión (desviación estándar e IC 95%).
Para la comparación entre variables se realizó el test de la χ2 o el test de Fisher para variables categóricas.
Para la validez de HT y CMBD para la detección de EA: sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN).
Modelo de predicción: regresión logística binaria, con el método Backward. Mediante el método del índice de Wald, se analizó la permanencia o exclusión de las variables. El poder discriminatorio del modelo se evaluó mediante el área bajo la curva ROC obtenida analizando la probabilidad del valor pronosticado por el modelo multivariable. Los resultados del modelo se presentan en forma de odds ratio (intervalo de confianza del 95%).
Se utilizó el programa estadístico SAS, v9.3. Se consideraron estadísticamente significativos aquellos valores de p < 0.05.
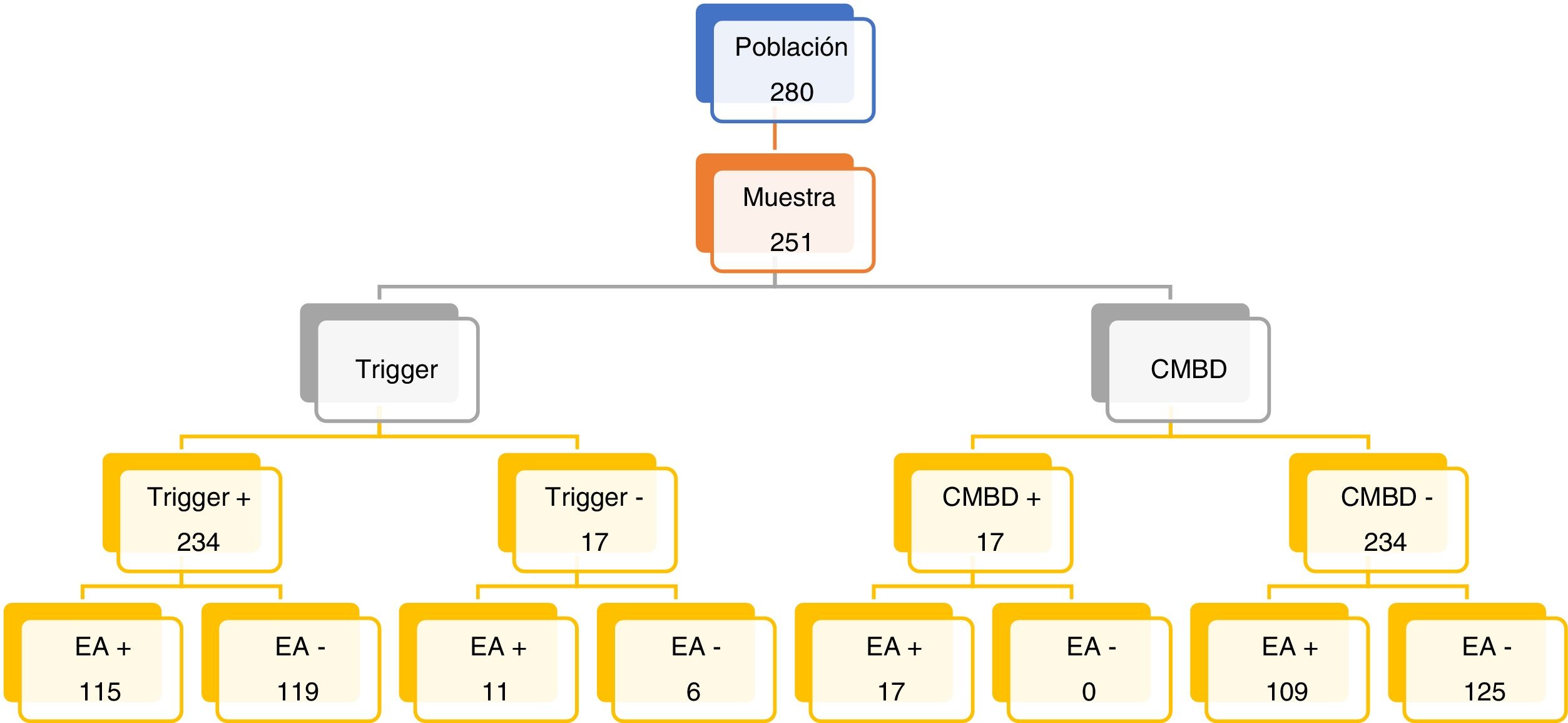
ResultadosDe 280 pacientes intervenidos, 29 fueron excluidos por no cumplir los criterios de inclusión. Se cribaron un total de 251 historias (fig. 1).
La edad media fue de 55,8 años (mediana 57), 201 fueron mujeres y 50 varones. La estancia media fue de 3,65 días (mediana 3) y la estancia preoperatoria media de un día.
Sobre los procedimientos quirúrgicos se realizaron: tiroidectomía total (73,71%), hemitiroidectomía (14,34%) y paratiroidectomía (9,96%), siendo el resto de los procedimientos menos del 2%.
Se identificaron 476 triggers. En el 93,23% de las historias se identificó al menos un trigger. En 115 de los 234 pacientes (49,15%) trigger +, se encontró al menos un EA. Si exceptuamos el mal control del dolor como único EA (29 pacientes), la prevalencia de pacientes con EA fue del 38,65%. Hubo 50,85% de falsos positivos.
En las historias en las que no se identificaron triggers (17), se detectaron 11 con EA.
En total hubo 126 pacientes con EA (50,2%), registrándose un total 203 EA (tabla 2), pues algún paciente tenía más de un EA. El 60,59% de EA fue de gravedad E y el 39,41% fueron de gravedad F. El 92,12% de los EA se consideró evitables.
EA detectados por las herramientas trigger y CMBD; gravedad y «evitabilidad»
| EA | Frecuencia | % | Trigger positivo | CMBD | Trigger negativo | Gravedad | «Evitabilidad» |
|---|---|---|---|---|---|---|---|
| Flebitis | 5 | 2,46 | 5 | 0 | 0 | E | Sí |
| Deterioro cognitivo del paciente | 5 | 2,46 | 5 | 1 | 0 | E | No |
| Infección herida quirúrgica | 7 | 3,45 | 7 | 1 | 0 | F | Sí |
| Neumonía | 1 | 0,49 | 1 | 1 | 0 | F | Sí |
| Complicaciones anestésicas | 1 | 0,49 | 1 | 1 | 0 | E | No |
| Hipocalcemia postoperatoria | 57 | 28,08 | 57 | 11 | 0 | F | Sí |
| Modificación de la programación quirúrgica(retraso) | 2 | 0,99 | 2 | 0 | 0 | F | Sí |
| Reintervención quirúgica | 2 | 0,99 | 2 | 1 | 0 | F | Sí |
| Hematuria tras sondaje vesical | 1 | 0,49 | 1 | 0 | 0 | E | No |
| Hematoma herida quirúrgica | 11 | 5,42 | 9 | 1 | 2 | F | Sí |
| Seroma herida quirúrgica | 1 | 0,49 | 1 | 0 | 0 | E | No |
| Disfonía-afonía | 31 | 15,27 | 30 | 3 | 1 | E | Sí |
| Disfagia | 7 | 3,45 | 6 | 0 | 1 | E | Sí |
| Glucemia no controlada durante la hospitalización | 3 | 1,48 | 3 | 0 | 0 | E | Sí |
| Reacción alérgica (exantema) | 2 | 0,99 | 2 | 0 | 0 | E | No |
| Mal abordaje del dolor | 60 | 29,56 | 53 | 1 | 7 | E | Sí |
| Retención urinaria | 6 | 2,96 | 5 | 0 | 1 | E | No |
| Caída casual en paciente vulnerable | 1 | 0,49 | 1 | 0 | 0 | E | Sí |
| Total | 203 | 100 | 191 | 21 | 12 |
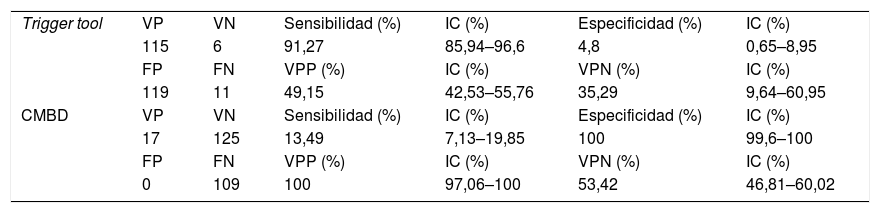
El CMBD detectó 17 pacientes con al menos un EA (6,77%). Todos ellos habían sido detectados con HT. La validez de las herramientas se recoge en la tabla 3.
Validez de las herramientas trigger y CMBD
| Trigger tool | VP | VN | Sensibilidad (%) | IC (%) | Especificidad (%) | IC (%) |
| 115 | 6 | 91,27 | 85,94–96,6 | 4,8 | 0,65–8,95 | |
| FP | FN | VPP (%) | IC (%) | VPN (%) | IC (%) | |
| 119 | 11 | 49,15 | 42,53–55,76 | 35,29 | 9,64–60,95 | |
| CMBD | VP | VN | Sensibilidad (%) | IC (%) | Especificidad (%) | IC (%) |
| 17 | 125 | 13,49 | 7,13–19,85 | 100 | 99,6–100 | |
| FP | FN | VPP (%) | IC (%) | VPN (%) | IC (%) | |
| 0 | 109 | 100 | 97,06–100 | 53,42 | 46,81–60,02 |
De los 251 pacientes, 17 (6,77%) tenían EA detectados por trigger y CMBD; 98 pacientes (39,04%) tenían EA detectado por trigger y no por CMBD. Once (11) pacientes (4,38%) tuvieron EA sin ser detectados por trigger ni por CMBD.Los triggers que mostraron asociación estadísticamente significativa con la presencia de EA fueron el «administración de antiemético», «administración de calcio» y «anatomía patológica no relacionada con el diagnóstico», con una OR de 2,225 (IC 95% 1,074-4,607), 7,714 (IC 95% 3,974-14,975) y 0,355 (IC 95% 0,145-0,868), respectivamente. En conjunto, los tres mostraron diferencia en la detección de EA, con una OR de 2,461 (IC 95% 1,093-5,541), 8,139 (IC 95% 4,094-16,180) y 0,342 (IC 95% 0,128-0,912), respectivamente. «Administración de antiemético» y «administración de calcio», en conjunto, mostraron una sensibilidad del 87,3%, especificidad del 11,2%, VPP del 49,77% y VPN del 46,67%, mientras que los tres triggers juntos mostraron una sensibilidad del 87,3%, especificidad del 8,8%, VPP del 49,11% y VPN del 40,74%.
En la regresión logística binaria para detectar los EA más graves (gravedad F), mostraron significación estadística «daño, reparación o extirpación de órgano no prevista» y «administración de calcio», con una OR de 2,786 (IC 95% 1,025-7,573) y 17,454 (IC 95% 6,060-50,270), respectivamente. En conjunto, sólo «administración de calcio» mostró significación estadística, con una OR de 17,454 (IC 95% 6,060-50,270). Mostró una sensibilidad del 66,67%, especificidad del 88,83%, VPP del 70,59% y VPN del 86,89%.
DiscusiónLa HT parece un método sencillo, eficaz y eficiente para la identificación de EA. En nuestro país, hasta donde sabemos, este es el primer estudio que valora la detección de trigger y EA en cirugía tiroidea y paratiroidea.
Sin embargo, el estudio muestra algunas limitaciones: 1) posible falta de exhaustividad de datos en el contenido de las historias clínicas, 2) dificultad para establecer objetivamente la gradación en la clasificación tanto de «evitabilidad» como de gravedad, si bien esta circunstancia se intentó soslayar mediante la valoración y el consenso de los cirujanos consultores.
3) En la HT, a nivel general, el mismo revisor que identificó triggers fue quien realizó la revisión para la detección de EA, lo que pudiera elevar el componente subjetivo para la identificación de los mismos. En este sentido, dos consultores con experiencia en la herramienta resolvieron las dudas surgidas para decidir si finalmente era EA o no.
La prevalencia de EA en este trabajo fue del 50,2%, superior al 30-40% descrito en otros trabajos prospectivos sobre cirugía que también han utilizado la HT4,17,18. Asimismo, es mayor que otros estudios nacionales, en los que no usan la HT16. Sin embargo, la inclusión del EA «mal abordaje del dolor», no considerado en otros estudios4,11,16, y que en este supone el 29,56% de los EA totales influye en el cómputo total. No obstante, algunos estudios muestran una proporción más elevada de EA19.
El número de EA no detectados por la herramienta fue bajo (12), dos de ellos de gravedad F y 10 de gravedad E, si bien es cierto que la cantidad de historias clínicas seleccionadas por la herramienta también lo es (93%).
Como en otros trabajos con la HT, la sensibilidad es alta, de 91,27%. Sin embargo, su VPP y VPN son del 49,15% y 35,29%, respectivamente. La especificidad es muy baja (4,8%). El número total de historias seleccionadas por la herramienta es alto, lo que podría resultar ineficiente. Esto puede deberse al elevado número de triggers empleados y que han presentado un buen comportamiento en estudios previos. A pesar de ello, el VPP se muestra superior al descrito en algunos estudios internacionales y similar a algunos nacionales16.
Asimismo, la baja especificidad mostrada podría deberse al elevado número de triggers empleado y a su variabilidad en la capacidad predictiva.
Las posibilidades del análisis de lenguaje natural para la identificación automática en la historia clínica podrían ser una opción para mejorar este aspecto.
En cambio, el CMBD tuvo una especificidad y un VPP del 100%, pero una sensibilidad del 13,49% y un VPN del 53,42%, en consonancia con otros estudios20.
Recientemente se ha publicado un estudio que mide EA en pacientes quirúrgicos mediante CMBD (CIE-10) y el GTT. La concordancia entre los dos métodos alcanzó el 83,3%21. La sensibilidad de la HT y del CMBD se ha mostrado similar a otras series6.
Los EA evitables (92%) son significativamente mayores que en otros estudios de pacientes de cirugía general, en los que el índice está próximo al 50%2,4. Estas diferencias pueden deberse a una estricta consideración de evitables, ya que los EA más frecuentes del estudio, dolor e hipocalcemia, se consideraron evitables, además de la inclusión del «mal abordaje del dolor» como EA, que en otras series no alcanza el 5% de los EA17 y en otras no es siquiera considerado. Así como el tipo de cirugía
A pesar de lo anteriormente comentado, por la elevada proporción y el tipo de EA detectado, en su mayoría evitable, consideramos que, quizás, una mayor estandarización de la técnica quirúrgica y un mayor seguimiento de protocolos de prevención de hipocalcemia postoperatoria, así como analgesia adecuada podrían mejorar el índice de EA.
Se observó que todos los EA eran de baja gravedad, incluso los asociados a tiroidectomía total en pacientes con ASA alto.
Los triggers que presentaron mayor asociación con EA fueron «administración de calcio» y «anatomía patológica no relacionada con el diagnóstico», siendo «administración de calcio» el que más se correlaciona (OR = 8,139) y «anatomía patológica no relacionada con el diagnóstico» el que menos (OR = 0,342), siendo factor protector. Respecto a la validez de «administración de antiemético» (S = 81,75%, E = 13,6%, VPP = 48,82% y VPN = VPN = 42,5%), la adición de «administración de calcio» aumenta levemente la sensibilidad a 87,3% y el VPP a 49,77%, disminuyendo la especificidad y el VPN. Dado que la adición de «anatomía patológica no relacionada con el diagnóstico» sólo disminuye la especificidad y el VPN, los dos triggers más rentables para esta serie fueron «administración de antiemético» y «administración de calcio», con un VPP conjunto del 49,77%. Además, la «administración de calcio» mostró elevada asociación con los EA de gravedad F (OR = 17,454). Aunque dicho valor tan alto haría dudar de su validez, debemos entender que la «hipocalcemia postoperatoria», que es el EA asociado a dicho trigger, supone el 71,25% de los EA de gravedad F. Mostrando un VPP del 70,59%, es el mejor trigger en esta serie para la detección de EA graves. Por tanto, los dos triggers más importantes para la detección de EA en pacientes intervenidos de patología tiroidea y paratiroidea fueron «administración de antiemético» y «administración de calcio».
En conclusión, la herramienta trigger aplicada en el estudio presenta alta sensibilidad, siendo esta superior al CMBD en la detección de EA en cirugía tiroidea y paratiroidea. Todos los EA detectados se consideraron de gravedad baja y la mayoría eran evitables. Los triggers con mayor poder predictivo en la detección de EA fueron «administración de antiemético» y «administración de calcio».
La gravedad de los EA fue baja y un porcentaje elevado de EA se consideró evitables.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Cristina Martín-Arriscado Arroba, estadístico de la Unidad de Soporte Científico y apoyo a la Investigación.
A D. José Luis Bernal Sobrino, del Servicio de Información y Control de Gestión.
A la Dra. María José Gallego Cereceda, del Servicio de Codificación.