La hipertensión pulmonar tromboembólica crónica (HPTEC) es una forma potencialmente curable de hipertensión pulmonar (HP) que aparece hasta en 3% de los pacientes tras una embolia pulmonar (EP). En estos pacientes, la EP no se resuelve, dando paso a coágulos fibróticos organizados, con el desarrollo de HP precapilar debido a la obstrucción proximal de las arterias pulmonares. También puede desarrollarse una microvasculopatía distal que contribuye al aumento de la resistencia vascular pulmonar (RVP). La ecocardiografía transtorácica (ETT) es la exploración que permite establecer la sospecha de HP. La gammagrafía pulmonar de ventilación-perfusión (V/Q) es la herramienta fundamental en el estudio de los pacientes con sospecha de HPTEC; si es normal, prácticamente la descarta. El cateterismo cardiaco derecho es obligatorio para el diagnóstico. La HPTEC se define como la existencia de síntomas, defectos de perfusión residuales e HP precapilar tras un periodo mínimo de tres meses de anticoagulación. La angiografía pulmonar ayuda a determinar la extensión y la accesibilidad quirúrgica de las lesiones tromboembólicas. Las personas con HPTEC son candidatas a anticoagulación indefinida. La endarterectomía pulmonar es el tratamiento de elección, resultando en una mejoría clínica y hemodinámica significativa. Aproximadamente un 25% de los pacientes presentan HP residual postendarterectomía. La angioplastia pulmonar con balón (APB) es una técnica endovascular dirigida a lesiones más distales, de utilidad para sujetos con HPTEC inoperable o HP persistente/recidivante postendarterectomía. Ambos tipos de pacientes también se pueden beneficiar de tratamiento farmacológico para la HP. Las tres terapias constituyen los pilares de la terapia, que ha evolucionado hacia un enfoque multimodal.
Chronic thrombo-embolic pulmonary hypertension (CTEPH) is a potentially curable form of pulmonary hypertension (PH) that develops in up to 3% of patients after pulmonary embolism (PE). In these patients, PE does not resolve, leading to organized fibrotic clots, with the development of precapillary PH as a result of the proximal obstruction of the pulmonary arteries. In addition, a distal microvasculopathy may also develop, contributing to the increase of pulmonary vascular resistance. Transthoracic echocardiography is the diagnostic tool that allows to establish the suspicion of PH. Ventilation-perfusion lung scintigraphy is the fundamental tool in the study of patients with suspected CTEPH; if it is normal, virtually rules out the diagnosis. Right heart catheterization is mandatory for the diagnosis of these patients. CTEPH is defined as the existence of symptoms, residual perfusion defects and precapillary PH after a minimum period of three months of anticoagulation. Pulmonary angiography helps determine the extent and surgical accessibility of thromboembolic lesions. CTEPH patients are candidates for long-term anticoagulation. Pulmonary endarterectomy is the treatment of choice, resulting in significant clinical and hemodynamic improvement. About 25% of patients have residual PH post-endarterectomy. Balloon pulmonary angioplasty is an endovascular technique that targets more distal lesions, being potentially useful for patients with inoperable CTEPH or persistent/recurrent PH post-endarterectomy. Both types of patients may also benefit from pharmacological treatment for PH. These three therapies are the cornerstone of CTEPH treatment, which has evolved towards a multimodal approach.
La hipertensión pulmonar tromboembólica crónica (HPTEC) es una forma de hipertensión pulmonar (HP) causada por la obstrucción y el remodelado de las arterias pulmonares tras un episodio de embolia pulmonar (EP). Estas alteraciones ocasionan un aumento mantenido de la resistencia vascular pulmonar (RVP), con el consiguiente desarrollo de HP y evolución a fallo del ventrículo derecho (VD) en las fases finales de la enfermedad. La HPTEC se engloba dentro del grupo 4 de la clasificación clínica de la HP, desarrollándose tras un episodio de EP aguda que no se resuelve de manera adecuada1. Aunque la HPTEC suele considerarse una complicación de la EP aguda sintomática, únicamente entre 50 y 75% de los pacientes tienen el antecedente de EP aguda2,3.
Aunque los defectos de perfusión persistentes después de una EP aguda son comunes4, su relevancia clínica es muy variable, pudiendo ir desde la ausencia total de síntomas hasta formas floridas de HPTEC. El concepto de enfermedad pulmonar tromboembólica crónica (EPTEC) describe pacientes sintomáticos con defectos de perfusión con ventilación preservada en la gammagrafía de ventilación/perfusión (V/Q) y coágulos fibróticos organizados en la tomografía computarizada con contraste (angio-TC) o en la angiografía pulmonar, después de un mínimo de tres meses de anticoagulación terapéutica1. Los pacientes con EPTEC pueden tener o no HP en reposo. El término HPTEC sigue siendo el más adecuado para definir a aquellos pacientes con EPTEC que presentan HP en reposo1.
El diagnóstico de HPTEC se establece con base en tres criterios fundamentales: la existencia de manifestaciones clínicas (disnea de esfuerzo, fatiga o síncope), la detección de lesiones trombóticas residuales mediante técnicas de imagen y la demostración de HP precapilar mediante cateterismo cardiaco derecho.
Se estima que la incidencia acumulada de HPTEC oscila entre 0,1-11,8% en los primeros dos años después de una EP sintomática5. Un metaanálisis reciente que incluye 10.249 pacientes con EP sugeriría que la incidencia de HPTEC en aquellos que sobreviven a una EP aguda sería de 2,7%6. En los sujetos con antecedente de EP, los casos incidentes de HPTEC suelen aparecer dentro de los dos primeros años después del episodio de EP7,8.
FisiopatologíaEstudios de seguimiento de tres a 12 meses, realizados fundamentalmente con gammagrafía de V/Q, ponen de manifiesto que entre 23-50% de los pacientes siguen presentando defectos de perfusión9–12. El sello distintivo de la HPTEC es la resolución incompleta y la transformación fibrótica del trombo arterial pulmonar, con una endotelización y organización del mismo, lo que lleva a la obstrucción mecánica de las arterias pulmonares de mayor calibre. Además de esta obstrucción fibrótica proximal, existe una microvasculopatía en pequeños vasos pulmonares (arterias pulmonares de tipo muscular de diámetro entre 50-500 μm)5. Esta microvasculopatía presenta lesiones histológicas similares a otras formas de HP (hipertrofia de la media, proliferación de la íntima, fenómenos trombóticos y lesiones plexiformes), afectando tanto a zonas dependientes de vasos con obstrucción trombótica como a zonas dependientes de vasos sanos13. La combinación de la obstrucción macrovascular persistente y de la microvasculopatía, junto a fenómenos de vasoconstricción, origina como resultado el desarrollo de HP y una sobrecarga de presión del VD, que con frecuencia excede a la esperable si consideramos únicamente el grado de obstrucción macrovascular13. La contribución relativa de cada mecanismo al incremento de la RVP es diferente en cada paciente y tiene una importancia capital a la hora de planificar el tratamiento.
Factores de riesgoAlgunas características del episodio inicial de EP se han identificado como factores de riesgo para el desarrollo posterior de HPTEC (tabla 1)6,14–17. Entre ellos, merece destacarse la presencia de signos radiológicos sugestivos de HPTEC en la angio-TC de tórax que se realiza para el diagnóstico de la EP aguda18. La presencia de uno o más de estos signos puede hacer sospechar, ya durante el episodio agudo, la existencia de una HPTEC de base. Estas alteraciones son:
- •
Trombos excéntricos adheridos a la pared vascular, que pueden estar calcificados. (diferentes de los defectos de repleción centrales, característicos de la EP aguda).
- •
Hipertrofia de la circulación bronquial.
- •
Patrón pulmonar de perfusión «en mosaico».
- •
Estenosis finas en banda con dilatación postestenótica.
- •
Membranas o «webs» intravasculares.
- •
Obstrucciones completas de vasos con terminación en fondo de saco.
- •
Bandas atelectásicas, infartos antiguos, lesiones cavitadas y opacidades lineales periféricas (indicativas de cicatrices parenquimatosas).
Factores asociados al desarrollo de hipertensión pulmonar tromboembólica crónica en el momento del diagnóstico de embolia pulmonar
| EP sin factor de riesgo identificable |
| Gran carga trombótica en la angio-TC de tórax |
| Signos ecocardiográficos de disfunción del VD |
| PAPs ≥ 60 mmHg en ecocardiografía |
| Signos sugestivos de HPTEC en la angio-TC |
| Duración de los síntomas > 2 semanas en el momento del diagnóstico |
EP: embolia pulmonar; HPTEC: hipertensión pulmonar tromboembólica crónica; PAPs: presión arterial pulmonar sistólica; TC: tomografía computarizada; VD: ventrículo derecho.
En un estudio reciente, la presencia de tres o más de los siguientes signos en el angio-TC diagnóstico de EP aguda se ha asociado al diagnóstico posterior de HPTEC con una sensibilidad de 70% (intervalo de confianza [IC] 95% 55-82%) y una especificidad de 96% (IC 95% 86-100%): retracción o dilatación de arterias pulmonares; hipertrofia de la circulación bronquial; hipertrofia del VD; y aplanamiento del tabique interventricular19. El empleo de terapia fibrinolítica sistémica no parece reducir la probabilidad de desarrollar HPTEC tras un episodio de EP aguda20.
Con respecto a los estados protrombóticos, una elevación de los niveles de factor VIII se ha identificado como un factor de riesgo para HPTEC21,22. Varios estudios han descrito una frecuencia elevada de anticuerpos antifosfolípido en pacientes con HPTEC, que en algunas series alcanzaría hasta 20%23,24. Más recientemente se ha descrito que el eje ADAMTS13-factor de von Willebrand está desregulado en sujetos con HPTEC25. Se ha publicado una prevalencia elevada de disfibrinogenemia en estos y una mayor resistencia del fibrinógeno de pacientes con HPTEC a la lisis que controles sanos26,27. También se ha documentado la existencia de disfunción del endotelio de las arterias pulmonares en personas con HPTEC, que podría estar involucrada en la patogénesis y progresión de la enfermedad28.
Se han identificado diversas condiciones médicas asociadas que incrementarían el riesgo de presentar HPTEC2,5,6,13–17,24,29–31 (tabla 2). De todas ellas, las que de forma más constante se han vinculado con un mayor riesgo de desarrollar de HPTEC son: la enfermedad tromboembólica venosa (ETV) recidivante (odds ratio [OR] 15), la esplenectomía (OR 18), la infección de marcapasos o de catéteres venosos permanentes (OR 76), el antecedente de cáncer (OR 3,8) y el hipotiroidismo en tratamiento sustitutivo (OR 6,1)5.
Antecedentes y procesos médicos que se asocian al desarrollo de hipertensión pulmonar tromboembólica crónica
| Enfermedad tromboembólica recidivante |
| Edad > 60 años |
| Derivación ventrículo-auricular |
| Dispositivos de acceso venoso central totalmente implantables |
| Esplenectomía |
| Infección de marcapasos o de catéteres venosos permanentes |
| Antecedente de cáncer |
| Osteomielitis crónica |
| Enfermedad inflamatoria intestinal |
| Síndromes mieloproliferativos |
| Grupos sanguíneos no 0 |
No existen signos o síntomas específicos de la HPTEC, estando estos relacionados principalmente con la disfunción del VD y con el esfuerzo en la fase inicial de la enfermedad. Igual que en otras formas de HP, los pacientes suelen referir disnea de esfuerzo progresiva, fatiga, dolor torácico y palpitaciones32. En fases más avanzadas pueden presentar síncope, hemoptisis y signos de insuficiencia cardiaca derecha. Los síntomas son el resultado de la combinación de alteraciones hemodinámicas (imposibilidad de incrementar de forma adecuada el gasto cardiaco durante el esfuerzo) y ventilatorias (incremento de la ventilación del espacio muerto)33.
La inespecificidad de los síntomas suele conducir a demoras en el diagnóstico. Según datos del Registro Internacional, el tiempo medio transcurrido desde el inicio de los síntomas hasta el diagnóstico de HPTEC es de 14 meses2. El hecho de que una proporción importante de pacientes carezca del antecedente de EP sintomática y de que con frecuencia exista en estos sujetos un periodo paucisintomático tras el episodio de EP complica todavía más las cosas13. La enfermedad tromboembólica recidivante y la obesidad se asocian a un retraso diagnóstico de la enfermedad, con un impacto negativo sobre el pronóstico de estas personas34.
La escala de clase funcional de la Organización Mundial de la Salud (OMS) es muy útil para definir la limitación en las actividades de la vida diaria de los pacientes con HPTEC y tiene implicaciones pronósticas. La medición objetiva de la tolerancia al esfuerzo puede realizarse con pruebas sencillas (prueba de marcha de 6 min) o complejas (prueba de esfuerzo cardiopulmonar). La más utilizada es la primera, cuyos resultados se correlacionan con el pronóstico, el estado hemodinámico y la clase funcional. En la prueba de esfuerzo cardiopulmonar se observa reducción de la carga tolerada, del consumo pico de oxígeno, del umbral láctico, del pulso de oxígeno y de la eficiencia ventilatoria (elevación del equivalente ventilatorio de CO2)1.
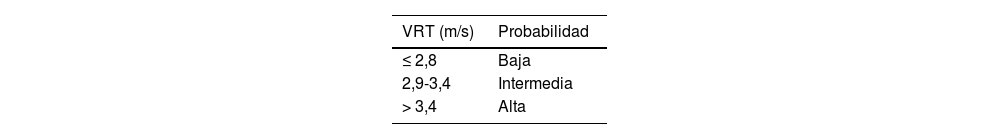
La ecocardiografía transtorácica (ETT) es fundamental como herramienta de cribado, ya que permite estratificar la probabilidad ecocardiográfica de HP. Para determinar esta probabilidad el parámetro básico es la velocidad de regurgitación tricuspídea (VRT), cuya medición requiere que exista insuficiencia tricuspídea (presente en 80-90% de la población general). Una VRT > 2,8 m/s sugiere la existencia de HP, y junto con otros signos ecocardiográficos permite estratificar la probabilidad de HP1 (tabla 3). En los pacientes con antecedente de EP, a los tres a seis meses después del inicio del tratamiento anticoagulante, en función de la existencia de disnea y de la presencia de factores de riesgo para el desarrollo de HPTEC, se valorará la indicación de realizar una ETT para determinar la probabilidad ecocardiográfica de HP15.
Estimación de la probabilidad ecocardiográfica de hipertensión pulmonar
| VRT (m/s) | Probabilidad |
|---|---|
| ≤ 2,8 | Baja |
| 2,9-3,4 | Intermedia |
| > 3,4 | Alta |
| Otros signos ecocardiográficos de HP* | ||
|---|---|---|
| Ventrículos | Arteria pulmonar | VCI y AD |
| VD/VI > 1 | TAP<105 ms y/o muesca mesosistólica | Diámetro VCI > 21 mm con colapso inspiratorio reducido |
| Aplanamiento del TIV | VRP protodiastólica >2,2 m/s | Área AD > 18 cm2 |
| TAPSE/PAPs < 0,55 mm/mmHg | Diámetro AP > Diámetro RADiámetro AP > 25 mm | |
Adaptada de Humbert et al.1
AD: aurícula derecha; AP: arteria pulmonar; HP: hipertensión pulmonar; PAPs: presión arterial pulmonar sistólica; RA: raíz aórtica; TAP: tiempo de aceleración pulmonar; TAPSE: excursión sistólica del anillo tricuspídeo; TIV: tabique interventricular; VCI: vena cava inferior; VD: diámetro del ventrículo derecho; VI: diámetro del ventrículo izquierdo; VRP: velocidad de regurgitación pulmonar; VRT: velocidad de regurgitación tricuspídea.
En los pacientes con probabilidad ecocardiográfica elevada de HP y en aquellos con probabilidad intermedia que presenten elevación del propéptido natriurético cerebral N-terminal (NT-proBNP) y/o factores de riesgo para HPTEC se solicitará una gammagrafía pulmonar de V/Q, que es la técnica de elección para descartar este proceso. Una gammagrafía pulmonar de V/Q normal o de baja probabilidad en un paciente con HP tiene una alta especificidad para descartar la HPTEC. Según datos del Registro Internacional, 98,7% de los sujetos tienen una gammagrafía de V/Q alterada2. Los hallazgos más característicos son defectos de perfusión segmentarios o de mayor tamaño con ventilación preservada. Hay una tendencia creciente en la práctica clínica a sustituir las imágenes planares clásicas de la gammagrafía de V/Q por las imágenes tridimensionales obtenidas mediante el single photon emission tomography (SPECT) de V/Q pulmonar. La adición de la tomografía computarizada de baja radiación al SPECT de V/Q (SPECT-TC) permite cuantificar la gravedad de la HPTEC y mejora la especificidad de la exploración permitiendo identificar enfermedades concomitantes del parénquima pulmonar35.
La angio-TC torácica es una técnica complementaria a la gammagrafía de V/Q en el estudio de estos pacientes, permite evaluar el grado de obstrucción de las arterias pulmonares principales, lobares y segmentarias, así como la localización de dichas lesiones. La angio-TC de tórax es adecuada para el diagnóstico de la HPTEC proximal, pero una exploración negativa no excluye la HPTEC, ya que se puede pasar por alto la enfermedad distal5. La TC de energía dual permite disponer de un mapa de la perfusión pulmonar basado en la distribución parenquimatosa del yodo, proporcionando imágenes similares a las obtenidas con la gammagrafía, aunque su complejidad técnica, el coste elevado y la poca disponibilidad hacen que no pueda sustituir a la gammagrafía como cribado5. La resonancia magnética (RM) tiene la ventaja potencial de poder proporcionar información tanto anatómica sobre la obstrucción vascular (angio-RM), como hemodinámica (tamaño y funcionalidad del VD). Aunque la angio-RM tiene numerosas ventajas teóricas sobre la gammagrafía de V/Q, es técnicamente más desafiante y costosa, con disponibilidad limitada y sin validación multicéntrica, por lo que actualmente tampoco reemplaza a la gammagrafía en la práctica clínica habitual5.
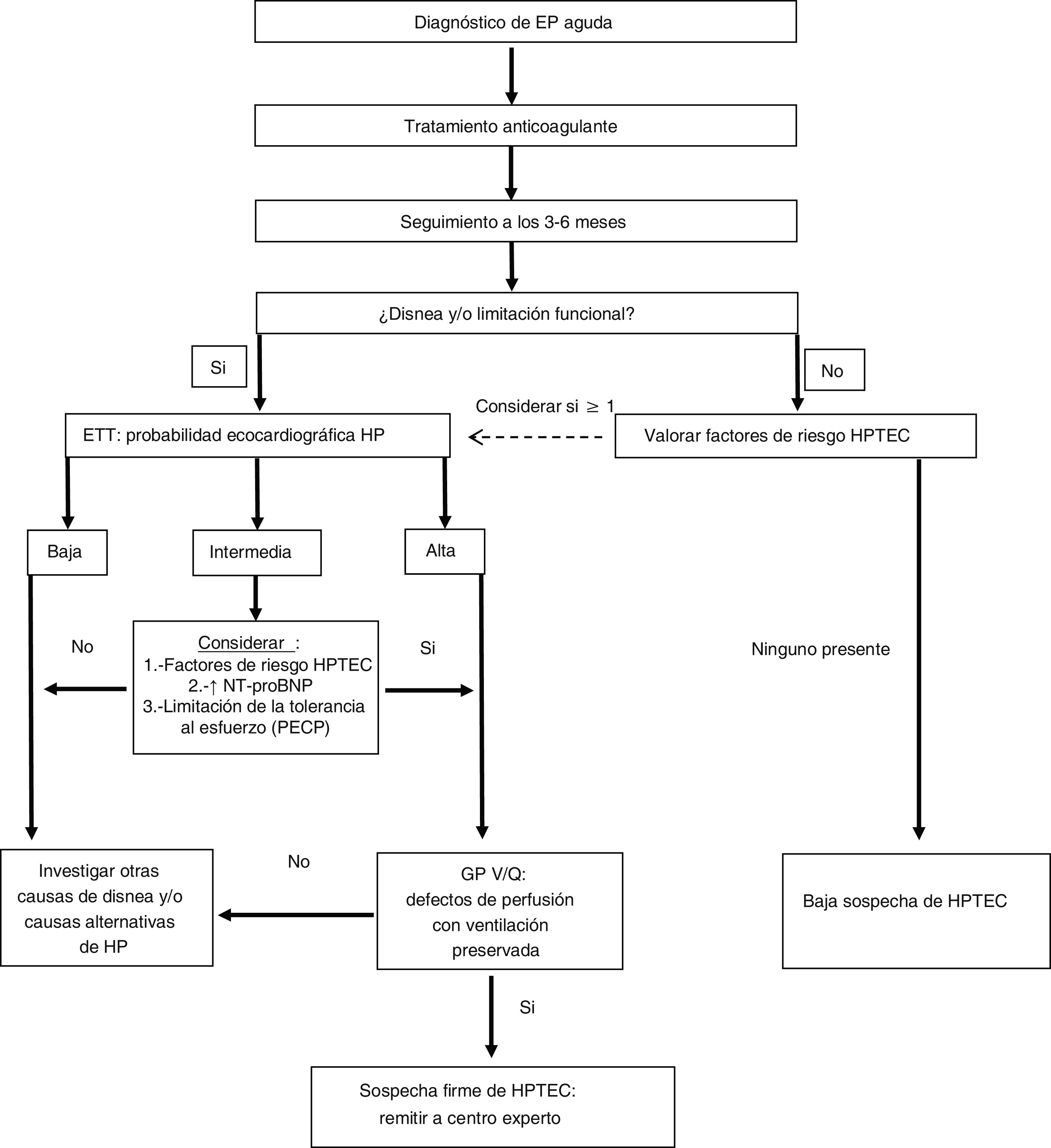
Cateterismo cardiaco derecho y arteriografía pulmonarUna vez que, con base en los datos clínicos (y después de un mínimo de tres meses de anticoagulación), una ETT con probabilidad intermedia o alta de HP y una gammagrafía pulmonar de V/Q alterada, se establezca la sospecha diagnóstica de HPTEC, el paciente debe remitirse a un centro experto en HP para completar el proceso diagnóstico (fig. 1). En esta última fase se confirmará mediante cateterismo derecho la existencia de HP precapilar y, con la realización de una arteriografía pulmonar, se determinará la accesibilidad quirúrgica de las lesiones trombóticas. Se han descrito cinco patrones angiográficos característicos de la HPTEC36:
- •
Terminaciones en forma sacular de ramas arteriales pulmonares por trombos parcial o totalmente obstructivos.
- •
Existencia de membranas o bandas.
- •
Irregularidades de la íntima con apariencia dentada de la pared vascular.
- •
Estrechamiento abrupto de los vasos pulmonares de mayor calibre.
- •
Obstrucción vascular completa de las arterias pulmonares principales, lobares o segmentarias en su punto de origen.
Algoritmo diagnóstico de la hipertensión pulmonar tromboembólica crónica en pacientes con antecedente de embolia pulmonar.
Adaptada de Konstantinides et al.15
EP: embolia pulmonar; ETT: ecocardiografía transtorácica; GP V/Q: gammagrafía pulmonar de ventilación/perfusión; HP: hipertensión pulmonar; HPTEC: hipertensión pulmonar tromboembólica crónica; PECP: prueba de esfuerzo cardiopulmonar.
En la mayoría de los pacientes con HPTEC existen dos o más de estos patrones, y de forma típica la afectación es bilateral33. La definición hemodinámica de HP ha sido modificada recientemente, definiéndose como HP precapilar la combinación de: presión arterial pulmonar (PAP) media > 20 mmHg + presión capilar pulmonar ≤ 15 mmHg + RVP > dos unidades Wood1.
TratamientoEl tratamiento de la HPTEC se plantea desde una perspectiva multimodal, mediante la combinación de diversas opciones terapéuticas dirigidas a tratar las diferentes lesiones anatómicas de esta enfermedad1. Disponemos de tres tratamientos para la HPTEC:
- •
La endarterectomía pulmonar
- •
La angioplastia pulmonar con balón (APB)
- •
Tratamiento farmacológico
Como medidas generales, los pacientes con HPTEC deben recibir tratamiento anticoagulante a largo plazo para prevenir la trombosis in situ de la circulación pulmonar y la recidiva de la EP1,5. Los antagonistas de la vitamina K (AVK) son los anticoagulantes que se han usado tradicionalmente en estos pacientes, aunque cada vez más se emplean los anticoagulantes orales de acción directa (ACOD)5. Sin embargo, de igual forma que en el resto de sujetos sin HPTEC, los ACOD no estarían recomendados en aquellos con síndrome antifosfolípido y determinación de anticuerpos triple positivos37. A pesar de la falta de ensayos clínicos, un registro internacional en el que se incluyeron pacientes con HTPEC tratados con AVK (n = 683) y ACOD (n = 198) mostró tasas de sangrado similares en ambos grupos, mientras que la tasa de recidiva de ETV en los tratados con ACOD fue ligeramente más alta que en los tratados con AVK (3,0 y 2,2%, respectivamente)38. El entrenamiento físico supervisado es eficaz y seguro en personas con HPTEC inoperables o con HP residual posendarterectomía39. También se han demostrado la seguridad y la viabilidad del entrenamiento físico supervisado postendarterectomía, con un programa iniciado en el hospital y continuado ambulatoriamente tras el alta hospitalaria40. Actualmente se considera como estándar de atención después de la endarterectomía pulmonar la realización de un programa supervisado de rehabilitación de baja intensidad5.
Endarterectomía pulmonarSi el paciente es operable, la endarterectomía pulmonar es el tratamiento de elección1,5. Esta es una técnica quirúrgica compleja que requiere de esternotomía media, circulación extracorpórea y periodos de paro circulatorio con hipotermia profunda, permitiendo la extracción del material trombótico obstructivo más proximal (hasta nivel de vasos subsegmentarios)41. Según datos de registros internacionales, entre 57-59% de pacientes con HPTEC son tratados mediante endarterectomía pulmonar2,42. En España, según datos del Registro Español de Pacientes con Hipertensión Arterial Pulmonar (REHAP), la proporción de sujetos tratados con endarterectomía es menor (34%)43. Las razones más frecuentes de no operabilidad son: inaccesibilidad de las oclusiones trombóticas, poca correlación entre la gravedad hemodinámica y la cantidad de oclusiones vasculares accesibles (este dato sugiere predominio del componente de microvasculopatía), perfil hemodinámico de riesgo elevado (RVP > 15 unidades Wood), existencia de comorbilidades o rechazo del paciente2,42. La edad, como único criterio, no excluye que un individuo pueda beneficiarse de este tipo de cirugía44. La mortalidad perioperatoria publicada en los registros oscila entre 3,5-4,7%2,42,43.
Algunos estudios sugieren que la existencia de una RVP preoperatoria > 12,5 unidades Wood incrementaría la mortalidad posoperatoria45. En consecuencia, la indicación de tratamiento farmacológico para mejorar la hemodinámica pulmonar antes de la cirugía en pacientes con RVP preoperatoria elevada es una práctica común, aunque no disponemos de evidencias sólidas que la avalen1. En ningún caso la indicación de terapia farmacológica debería impedir o retardar un tratamiento quirúrgico potencialmente curativo.
Las cifras de supervivencia publicadas postendarterectomía son de 91-93% al año del procedimiento y de 89-90% a los tres años46,47. Los factores asociados a una mayor mortalidad postendarterectomía son: clase funcional IV, presión de aurícula derecha elevada, historia de cáncer, terapia «puente» con fármacos para HP antes de la cirugía, HP postoperatoria, complicaciones quirúrgicas y necesidad de procedimientos cardiacos adicionales46. Una PAP media ≥ 38 mmHg y una RVP ≥ 5,3 unidades Wood durante el seguimiento poscirugía se asocian a una supervivencia más baja a largo plazo47.
Aunque el objetivo de la endarterectomía pulmonar es la normalización hemodinámica, no es infrecuente la existencia de HP residual poscirugía13. Un metaanálisis con 4.868 pacientes tratados con endarterectomía describe la existencia de HP residual en 25% de los casos45. En este estudio, la endarterectomía consiguió un descenso de 21 mmHg de las cifras de PAP media y de 65% de la RVP, con un incremento significativo en la distancia recorrida en la prueba de marcha de 6 min45. A pesar de esta mejoría hemodinámica, algunos sujetos siguen presentando limitación de la tolerancia al esfuerzo tras la endarterectomía. Un estudio que incluye 68 personas postendarterectomía describe la existencia de una capacidad de esfuerzo disminuida en 66% a los seis meses de la cirugía, siendo la limitación de tipo cardiovascular en 44% de las mismas48. Merece destacarse que 60% de los pacientes (27/45) con limitación de la tolerancia al esfuerzo no tenían HP residual poscirugía48.
Aunque la indicación universalmente aceptada para la realización de una endarterectomía pulmonar es la HPTEC, algunos pacientes muy seleccionados con EPTEC (sin HP en reposo), pero sintomáticos, con evidencia objetiva de limitación de la tolerancia al esfuerzo, pueden ser tratados con éxito mediante endarterectomía pulmonar. En una serie de 42 sujetos con EPTEC (PAP media 21 mmHg, RVP dos unidades Wood) tratados con endarterectomía, la mortalidad intrahospitalaria fue de 0%, con mejoría significativa de la clase funcional (95% de los pacientes en clases funcionales I-II a los seis meses) y de la calidad de vida49.
Angioplastia pulmonar con balónDurante la última década, la APB se ha convertido en una opción de tratamiento endovascular adicional para pacientes seleccionados con HPTEC inoperable o HP persistente/recidivante postendarterectomía, mejorando la hemodinámica, la función del VD y la capacidad de esfuerzo1. No reemplaza a la endarterectomía ni al tratamiento farmacológico dirigido para la HPTEC, pudiendo ser considerada junto con cualquiera de las dos terapias como tratamiento complementario, ya que se dirige a lesiones más distales (vasos subsegmentarios de diámetro 0,5-5 mm), no tratables con cirugía ni con fármacos5. La APB es un procedimiento por etapas en el que en cada sesión se dilata un número limitado de segmentos pulmonares1. El número de sesiones necesarias para obtener un buen resultado hemodinámico es variable, siendo lo más habitual que a cada paciente se le realicen cuatro a cinco sesiones42,43. Según datos de un registro internacional, 19% de los sujetos con HPTEC se consideraron candidatos a APB42. En España, según datos del registro REHAP, 9,6% de los individuos se consideraron para APB43.
En una serie prospectiva se trataron con APB 56 pacientes con HPTEC inoperables. Se realizaron cinco procedimientos por persona, observándose una mejoría hemodinámica (descensos de la PAP media de 18% y de la RVP de 26%), de la clase funcional y de la distancia recorrida en la prueba de marcha (+ 33 m). La mayoría (93%) recibieron tratamiento farmacológico para HP antes del procedimiento, que se mantuvo durante el estudio. Se produjeron eventos adversos relacionados con el procedimiento en 32% de ellos, la mayoría de los cuales estuvieron relacionados con lesión vascular por perforación, incluyendo uno (1,8%) que falleció por hemorragia pulmonar mortal50. En otra serie, 184 pacientes con HPTEC inoperables se trataron con APB (5,2 sesiones por persona). Se observó una mejoría hemodinámica (descensos de la PAP media de 26% y de la RVP de 43%), de la clase funcional y de la distancia recorrida en la prueba de marcha (+ 45 m). Se produjeron eventos adversos relacionados con el procedimiento en 46% de ellos, siendo los más frecuentes: daño pulmonar (9% de las sesiones), hemoptisis (7% de las sesiones) y perforación de arteria pulmonar (3% de las sesiones). La supervivencia a los tres años fue excelente (95,1%)51.
Tratamiento farmacológicoNo es un tratamiento curativo y su efecto suele ser modesto, dirigiéndose al componente de microvasculopatía que se puede presentar en la HPTEC. Las indicaciones de terapia farmacológica en la HPTEC son: pacientes inoperables o con HP residual o recidivante postendarterectomía1. Se ha sugerido un umbral de PAP media ≥ 30 mmHg postendarterectomía para plantear la indicación de terapia farmacológica47. También puede indicarse en pacientes que rechazan la cirugía y como tratamiento de acondicionamiento pre-cirugía en sujetos con perfil hemodinámico de riesgo (RVP > 12,5 unidades Wood). En los registros, la proporción de personas no candidatas a endarterectomía tratadas con fármacos para HP oscila entre 54-61%42,43,46. La proporción de candidatos a endarterectomía tratados con estos fármacos es claramente más baja (26-29%)42,46. La retirada de estos fármacos generalmente se considera después de APB y/o endarterectomía exitosas5.
En las Guías de 2022 sobre diagnóstico y tratamiento de la HP se recomienda el tratamiento con riociguat en pacientes con HPTEC sintomáticos no operables o con HP residual postendarterectomía (recomendación de clase I, nivel de evidencia B)1. Riociguat es un fármaco que actúa sobre la vía del óxido nítrico (NO) y que se administra por vía oral. Su indicación se sustenta en un ensayo clínico fase 3 de 16 semanas de duración realizado en 261 personas con HPTEC inoperable o con HP residual postendarterectomía. Riociguat, respecto al placebo, demostró un aumento significativo en la distancia recorrida en la prueba de marcha (objetivo primario). También se consiguieron mejoría de la clase funcional y descensos significativos de la RVP y del NT-proBNP52. Estos efectos beneficiosos se mantuvieron en el estudio de extensión de un año de duración53. En pacientes más graves (clase funcional III-IV) con HPTEC inoperable o HP persistente postendarterectomía puede considerarse la indicación de treprostinil subcutáneo (recomendación de clase IIb, nivel de evidencia B)1,54. Con un nivel menor de evidencia (recomendación de clase IIb, nivel de evidencia C), en aquellos con HPTEC inoperable, se pueden considerar combinaciones de fármacos: estimulador de la guanilato ciclasa soluble/inhibidor de fosfodiesterasa 5, antagonista de los receptores de la endotelina (macitentan) o análogos de prostaciclina parenterales1,54,55.
Un ensayo clínico reciente (RACE, en inglés Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension) ha comparado la eficacia y seguridad de la APB versus riociguat en pacientes con HPTEC inoperable sin ningún tratamiento previo. Se incluyeron 105 sujetos (53 tratados con riociguat; 52 con APB). El objetivo primario fue el cambio en la RVP a las 26 semanas de tratamiento. Los participantes sintomáticos que a las 26 semanas tenían una RVP > 4 unidades Wood se beneficiaron de un periodo adicional de 26 semanas durante el cual aquellos tratados inicialmente con APB recibieron riociguat y los abordados en primera instancia con riociguat fueron tratados con APB56. Después de las primeras 26 semanas de tratamiento, el descenso de la RVP fue significativamente mayor en los pacientes con APB (39,9% de la RVP basal) que en los que recibieron riociguat (66,7% de la RVP basal). De los sujetos, 42% de los tratados con APB presentaron eventos adversos severos relacionados con el tratamiento, mientras que en los tratados con riociguat esta cifra fue únicamente de 9%. Merece destacarse que la incidencia de eventos adversos relacionados con la APB fue más baja en los pacientes pretratados con riociguat (14%) que en los manejados en primera instancia con APB (42%), lo que podría sugerir un efecto beneficioso de esta modalidad de abordaje multimodal56.
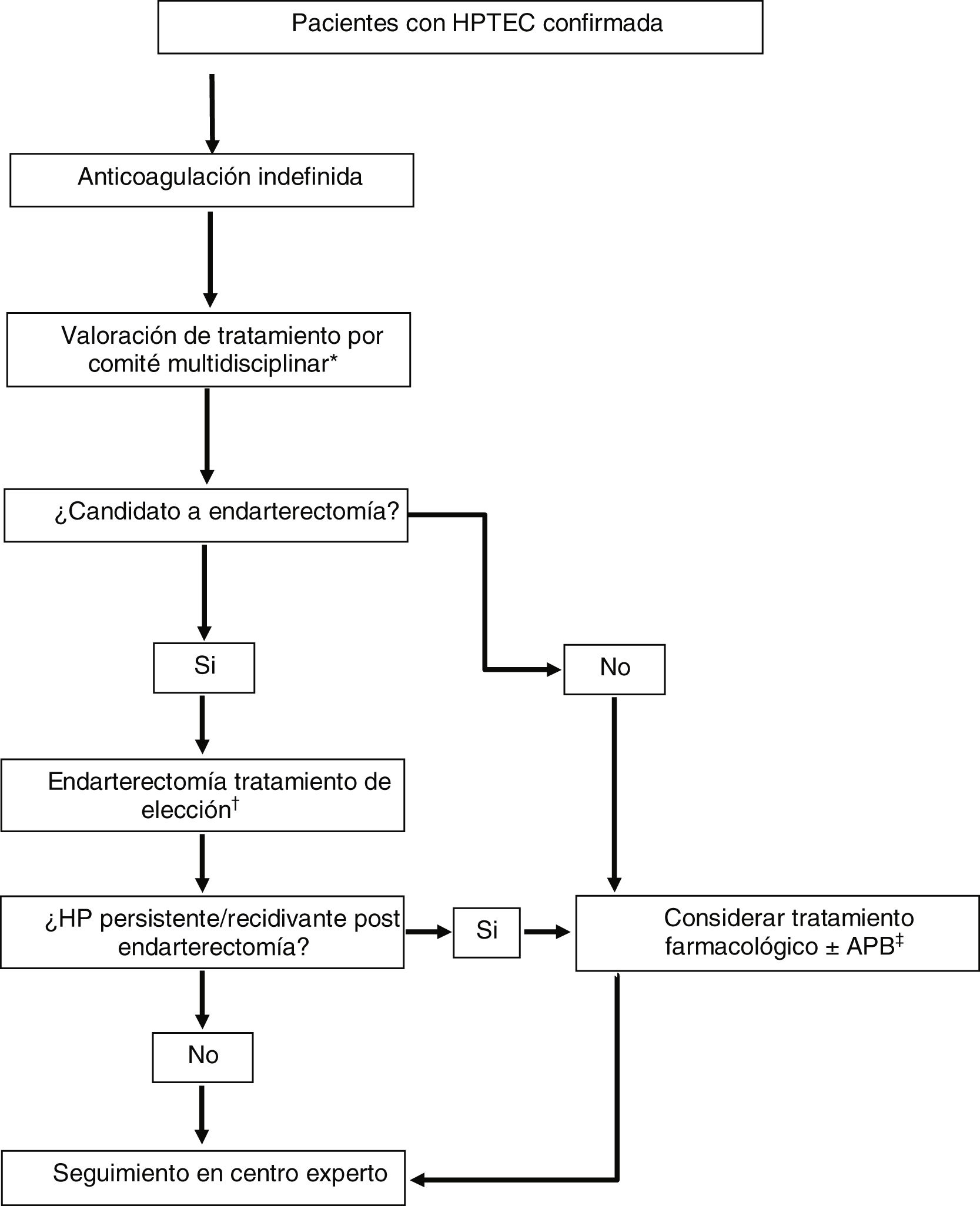
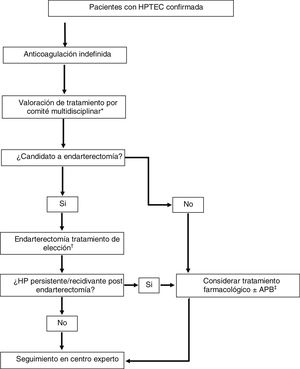
Tratamiento multimodal y trasplante pulmonarMuchos pacientes con HPTEC tienen lesiones anatómicas mixtas con afectación de arterias pulmonares principales y lobares, arterias segmentarias y subsegmentarias y microvasculopatía. La disponibilidad de tres tratamientos efectivos que se dirigen a cada una de estas lesiones anatómicas ha hecho variar el paradigma de tratamiento de esta enfermedad, que ha evolucionado hacia un enfoque multimodal (fig. 2)1,5. Este enfoque implica el empleo de combinaciones de endarterectomía, APB y terapia farmacológica para atacar lesiones proximales, lesiones más distales y microvasculopatía, respectivamente. Actualmente, no existe una guía clara que establezca unos criterios para indicar un tratamiento multimodal, realizándose la selección de pacientes caso por caso en centros expertos mediante un enfoque multidisciplinar.
Estrategia terapéutica en pacientes con hipertensión pulmonar tromboembólica crónica.Adaptada de Humbert et al.1
APB: angioplastia pulmonar con balón; HP: hipertensión pulmonar; HPTEC: hipertensión pulmonar tromboembólica crónica; RVP: resistencia vascular pulmonar.
*Formado por: cirujano cardiovascular, radiólogo intervencionista experto en APB, especialista en HP, radiólogo torácico y anestesiólogo con experiencia en HPTEC.
†En pacientes candidatos a endarterectomía con RVP > 12,5 unidades Wood considerar tratamiento farmacológico de acondicionamiento antes del procedimiento (riociguat ± macitentan).
‡En pacientes candidatos a APB con RVP > 4 unidades Wood considerar tratamiento con riociguat antes del procedimiento.
Las diferentes situaciones en las que se puede plantear el tratamiento multimodal son1:
- •
Tratamiento farmacológico de acondicionamiento preendarterectomía en pacientes con perfil hemodinámico de riesgo. Algunos estudios sugieren que una RVP preoperatoria > 12,5 unidades Wood incrementaría la mortalidad postoperatoria45. En este perfil de paciente se puede indicar tratamiento con riociguat±macitentan para disminuir la RVP y mejorar el pronóstico de la cirugía.
- •
Pacientes sintomáticos con HP persistente/recidivante postendarterectomía. En estos casos se puede plantear la indicación de tratamiento farmacológico y/o APB.
- •
Pacientes con lesiones anatómicas mixtas (lesiones accesibles a la cirugía en un pulmón y lesiones inoperables en el pulmón contralateral). En estos casos se pueden planificar procedimientos híbridos: APB de las lesiones no quirúrgicas en un primer tiempo y endarterectomía del pulmón operable en un segundo tiempo.
- •
Tratamiento farmacológico previo a APB. Tomando en cuenta los resultados del ensayo clínico RACE, en pacientes con HPTEC candidatos a APB, se debe considerar el tratamiento con riociguat antes del procedimiento (recomendación condicional, muy baja calidad de evidencia)1,56.
Debido a la disponibilidad de estas opciones terapéuticas para la HPTEC, la indicación de trasplante pulmonar es anecdótica. En los registros sobre HPTEC, la proporción oscila entre 0,15-0,7%2,43. El trasplante bipulmonar para pacientes con HPTEC podría considerarse como una opción de rescate, solo en casos muy seleccionados, como alternativa a una endarterectomía pulmonar fallida o como tratamiento potencialmente curativo en sujetos con un marcado predominio de enfermedad distal no susceptible de tratamiento quirúrgico o con APB y sin respuesta al tratamiento farmacológico33,57.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Consideraciones éticasEste trabajo no ha implicado el uso de sujetos humanos, por lo que no le aplican consideraciones éticas (obtención de consentimiento informado).
Agradecemos el apoyo institucional de CERCA Programme/Generalitat de Catalunya.