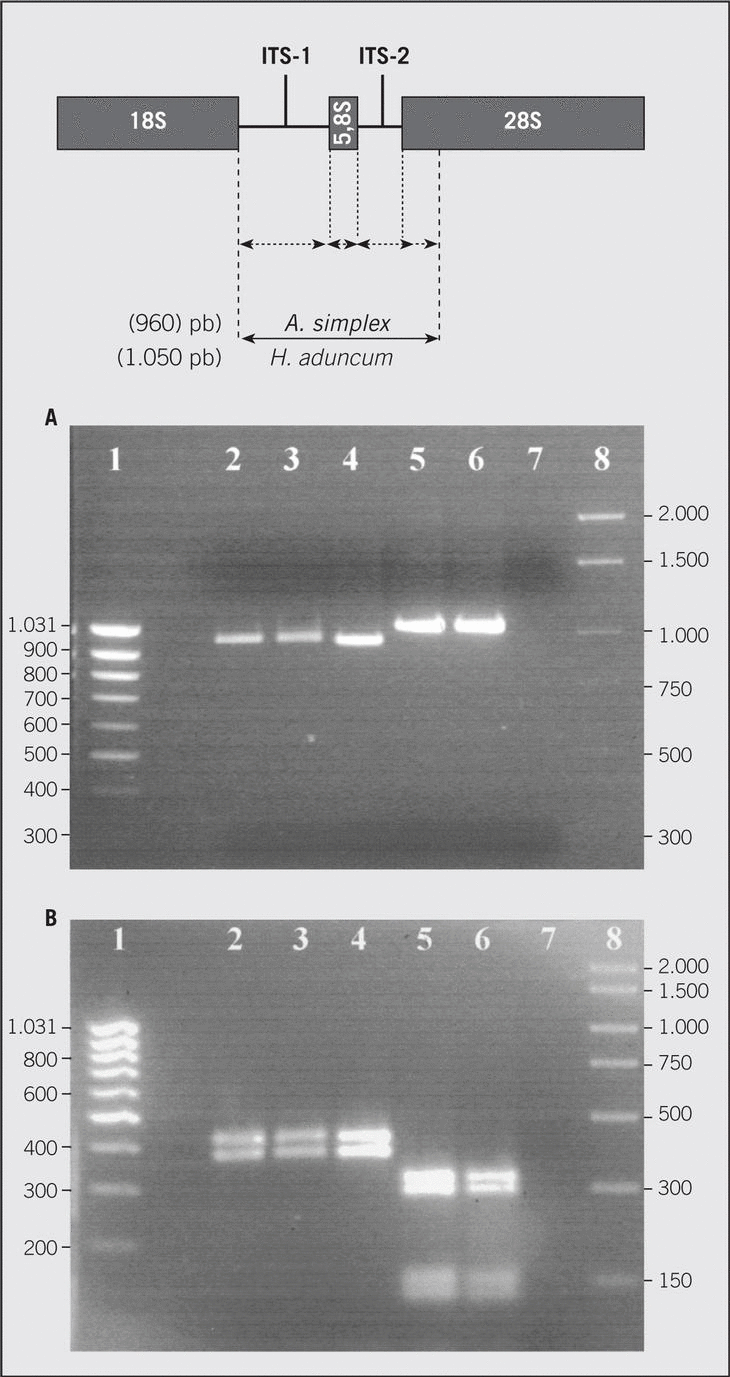
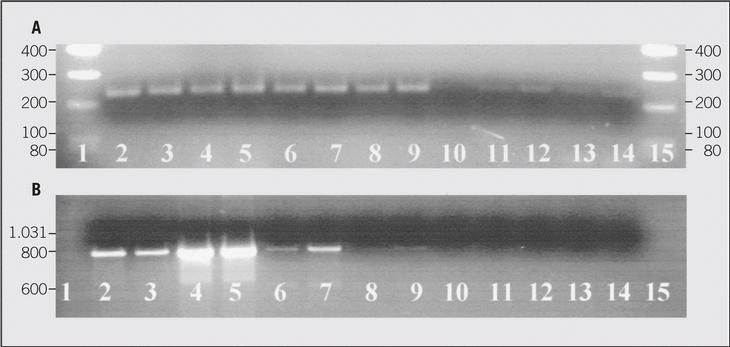
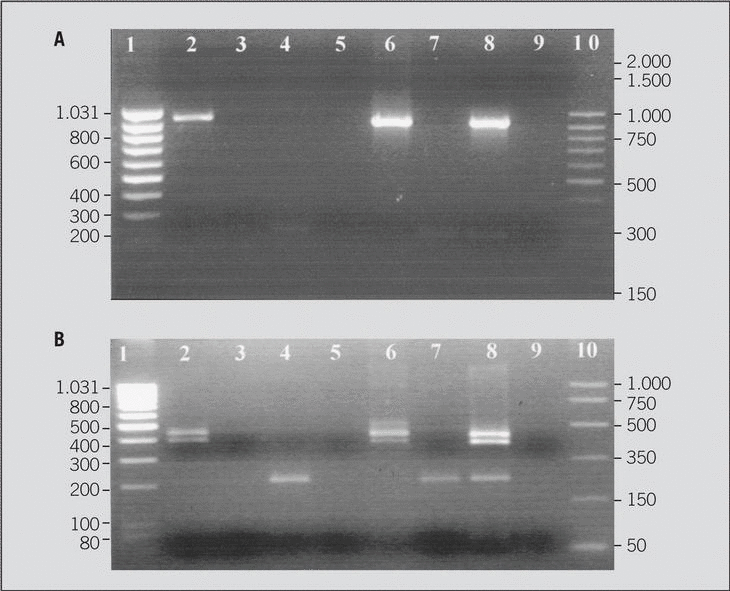
Medicina Clínica, fundada en 1943, es la única publicación semanal de contenido clínico que se edita en España y constituye el máximo exponente de la calidad y pujanza de la medicina española. Son características fundamentales de esta publicación el rigor científico y metodológico de sus artículos, la actualidad de los temas y, sobre todo, su sentido práctico, buscando siempre que la información sea de la mayor utilidad en la práctica clínica.
Los contenidos de Medicina Clínica abarcan dos frentes: trabajos de investigación original rigurosamente seleccionados atendiendo a su calidad, originalidad e interés, y trabajos orientados a la formación continuada, encomendados por la revista a autores relevantes (Editoriales, Revisiones, Conferencias clínicas y clínico-patológicas, Diagnóstico y Tratamiento). En estos artículos se ponen al día aspectos de destacado interés clínico o conceptual en la medicina actual. Medicina Clínica es un vehículo de información científica de reconocida calidad, como demuestra su inclusión en los más prestigiosos y selectivos índices bibliográficos del mundo.