Determinar la prevalencia de insuficiencia renal crónica (IRC) oculta y las variables clínicas asociadas en pacientes con diabetes mellitus de tipo 2 (DM2).
Pacientes y métodoEstudio observacional, analítico y transversal en pacientes con DM2 ambulatorios de atención primaria. De la historia clínica electrónica se registraron datos demográficos y antropométricos, antecedentes patológicos y medidas de riesgo cardiovascular y de función renal. Se determinó la prevalencia de IRC oculta, definida en pacientes con valores de creatinina (Cr) plasmática normales (Cr ≤1,4mg/dl en las mujeres y Cr ≤1,5mg/dl en los varones), y la estimación del filtrado glomerular (eFG) reducida (<60ml/min/1,73m2). La eFG se determinó mediante la fórmula Modification of Diet in Renal Disease (MDRD).
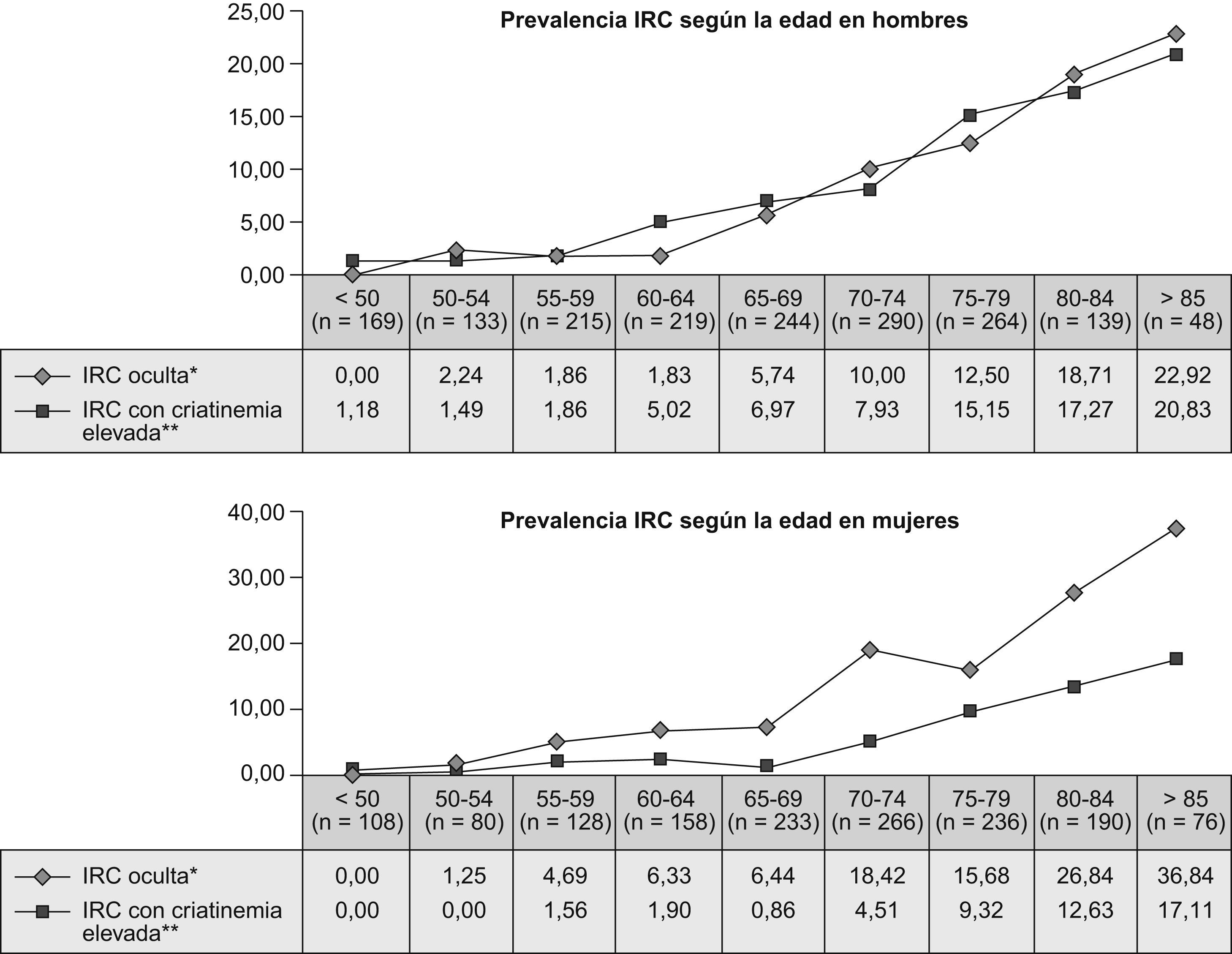
ResultadosLa muestra estuvo formada por 3.197 pacientes, con una media (DE) de edad de 67,7 años (11,7); el 53,9% eran varones. La prevalencia de IRC según los valores de la MDRD fue del 16,6% (n=532), de los que el 60,3% (n=321) fue IRC oculta. El 6,6% (n=211) de los sujetos presentó IRC con valores de Cr elevados. El análisis multivariante mostró una asociación del sexo femenino con la IRC oculta (odds ratio: 2,7; intervalo de confianza del 95%: 1,83–3,99). La IRC se asoció a la edad, a la presión arterial superior a 150/100mmHg, a la dislipidemia y a los antecedentes de cardiopatía isquémica, insuficiencia cardíaca y arteriopatía periférica.
ConclusiónLa prevalencia de IRC según la fórmula MDRD fue del 16,6%, del que el 60,3% presentaba IRC oculta. El sexo femenino se asoció directamente a la presencia de IRC oculta.
To determine the prevalence of occult chronic kidney disease (CKD) and the associated clinical variables in patients with type 2 diabetes mellitus (DM-2).
Patients and methodObservational, laboratory and cross-sectional study of patients with DM-2 from primary care settings. Demographic and anthropometric data, previous illnesses and measures of cardiovascular risk and kidney function were collected from electronic medical records. We determined the prevalence of occult CKD defined as patients with normal values of plasma creatinine (Cr) and reduced glomerular filtration rate (GFr) (<60ml/min/1,73m2). The GFr was determined by the Modification of Diet in Renal Disease (MDRD) equation.
ResultsThe sample consisted of 3,197 patients, the mean age was 67.7 years (SD=11.7) and 53.9% were men. The prevalence of CKD according to the MDMR values was 16.6% (n=532), of which 60.3% (n=321) corresponded to occult CKD. 6.6% (n=211) of the participants had CKD with high Cr values. Multivariate analysis showed an association of occult CKD with female sex (OR=2.7; CI 95%=1,83–3,99). Occult CKD was associated with age, blood pressure higher than 150/100mm/Hg and with a history of ischemic heart disease, heart failure, peripheral arterial disease and dyslipemia.
ConclusionsThe prevalence of CKD is 16.6%, of which 60.3% (n=321) corresponds to occult CKD. Female sex is associated with the presence of occult CKD.
Aproximadamente entre el 25 y el 40% de los pacientes diabéticos puede presentar una nefropatía diabética, que es la principal causa de enfermedad renal terminal en los países desarrollados. Los pacientes diabéticos con oligoalbuminuria persistente tienen un riesgo entre 10 y 20 veces superior de desarrollar una nefropatía diabética en comparación con los diabéticos con normoalbuminuria1,2. Los pacientes diabéticos con nefropatía presentan una tasa de mortalidad cardiovascular 3 veces superior a los diabéticos sin nefropatía3,4. La American Diabetes Association (ADA) y la National Kidney Foundation (NFK) recomiendan solicitar la oligoalbuminuria a todos los pacientes con diabetes mellitus de tipo 2 (DM2) en el momento del diagnóstico y anualmente si el resultado es negativo5,6.
Sin embargo, en la definición de nefropatía diabética no se incluye la función renal propiamente dicha, sino únicamente la presencia de albuminuria o de oligoalbuminuria junto con la presencia de retinopatía diabética o los años de evolución de la diabetes7. Por este motivo, y dado que un número importante de diabéticos con insuficiencia renal crónica (IRC) (filtrado glomerular<60ml/min/1,73m2) no presentan un incremento de la excreción urinaria de albúmina (EUA)8,9, el NKF recomienda, además, la determinación de creatinina (Cr) plasmática para realizar una estimación del filtrado glomerular (eFG). Independientemente de si el paciente presenta o no nefropatía diabética, la determinación de la EUA y la eFG se utilizan para el diagnóstico y la clasificación de la enfermedad renal crónica en todos los pacientes, incluidos los diabéticos. La enfermedad renal crónica incluye otros criterios añadidos a los anteriores (EUA y eFG), como son la presencia de hematuria de origen no urológico y la existencia de lesiones renales a la exploración radiológica. Para el cálculo del eFG, la NKF recomienda la utilización de ecuaciones de predicción a partir de la determinación de la Cr, las variables sociodemográficas y el área de superficie corporal corregida para el diagnóstico y la clasificación de la IRC10. Las fórmulas más utilizadas son la de Cockcroft-Gault11 y la ecuación Modification of Diet in Renal Disease (MDRD)12. Algunos estudios indican que la ecuación modificada MDRD es la más apropiada para el diagnóstico y la clasificación de la IRC en los pacientes diabéticos13–15.
Al calcular el eFG mediante las ecuaciones de predicción, existe un número de pacientes diabéticos que presentan valores de Cr plasmática dentro de los límites de la normalidad, pero con un eFG disminuido. Esta situación se conoce como IRC oculta y su presencia también determina un mayor riesgo de presentar alguna enfermedad cardiovascular (ECV) y obliga a una especial atención en el tratamiento y el seguimiento de estos pacientes17–20. El objetivo del presente estudio fue determinar la prevalencia de IRC oculta y las variables asociadas en pacientes con DM2 atendidos en las consultas de Atención Primaria (AP).
Pacientes y métodoDiseño del estudio y pacientesSe diseñó un estudio observacional, analítico y transversal basado en la información disponible en la historia clínica electrónica de los dispositivos de AP del Institut Català de la Salut (ICS) de la Región Sanitaria de Girona (RSG). La historia clínica electrónica está implantada en los dispositivos de AP del ICS desde el año 1999 y en ella se registra la información clínica de cerca de 500.000 usuarios de la RSG (el 70% de la población total). Se ha incluido en el estudio la información procedente de los profesionales que presentaban una adecuada calidad de registro de los datos clínicos (en relación con la distribución por edad y sexo de su población asignada) sobre la base de los indicadores de calidad de registro del Adjusted Clinical Groups21. Un total de 245 profesionales cumplieron los criterios mínimos de calidad del registro, que supuso el 71,4% del total.
Criterios de selección de los sujetosSe incluyó en el estudio a todos los pacientes con diagnóstico de DM2 en la historia clínica (códigos CIE-10: E11-E12), de los que se encontraba disponible la información completa de las variables del estudio. Los datos corresponden a pacientes atendidos en los dispositivos de AP entre el 1 de enero de 2007 y el 31 de diciembre de 2007.
VariablesSe obtuvo información de las siguientes variables disponibles en la historia clínica electrónica de cada sujeto.
Variables demográficas y antropométricasSe registró el sexo, la edad, la medida del peso y la talla y se calculó el índice de masa corporal al dividir el peso (kg) entre la altura (m) al cuadrado.
Antecedentes patológicosSe registró la presencia de factores de riesgo cardiovascular (FRCV) y ECV si estaba registrado el diagnóstico en la historia clínica. Se utilizaron las siguientes definiciones y códigos CIE-10: dislipidemia (colesterol total>250mg/dl o triglicéridos>200mg/dl; colesterol ligado a lipoproteínas de baja densidad>130mg/dl o colesterol ligado a lipoproteínas de alta densidad<35/45mg/dl en varones/mujeres; código E78), consumo de tabaco (código F17), obesidad (índice de masa corporal≥30kg/m2; código E66), cardiopatía isquémica (códigos I20-I25), ictus (códigos I60–I67), insuficiencia cardíaca (código I50) y arteriopatía periférica (códigos I73, I74.3).
Medidas clínicas de factores de riesgo cardiovascularSe registró la medida de la presión arterial sistólica (PAS) y la presión arterial diastólica de cada participante así como la presencia del diagnóstico de hipertensión arterial (códigos CIE-10: I10, I15). Se definió mal control de la presión arterial si la PAS ≥130mmHg o si la presión arterial diastólica ≥80mmHg. Se obtuvieron medidas de laboratorio (extraídas directamente de la base de datos del laboratorio de referencia) de Cr, cociente albúmina/Cr (CAC), colesterol total, colesterol ligado a lipoproteínas de baja densidad, colesterol ligado a lipoproteínas de alta densidad, triglicéridos y hemoglobina glucosilada.
Medidas clínicas de función renalPara determinar la función renal se estimó el eFG, según la fórmula MDRD. Se consideró la presencia de IRC si el eFG era inferior a 60ml/min/1,73m2. Se clasificó el grado de IRC según las recomendaciones de la guía de la NFK10. Se definió la presencia de IRC oculta como aquellos casos en los que la Cr fue normal y el eFG fue inferior a 60ml/min/1,73m2. Se consideraron como valores normales de Cr cifras inferiores o iguales a 1,4mg/dl en las mujeres e inferiores o iguales a 1,5mg/dl en los varones.
Criterios de confección de los gruposSe confeccionaron 3 grupos según las cifras de Cr y de eFG y se compararon las diferentes variables entre ellos: a) sujetos con Cr normal y eFG normal; b) sujetos con Cr normal y eFG reducida, y c) sujetos con Cr elevada y eFG reducida.
Análisis estadísticoSe realizó un análisis estadístico descriptivo de las variables del estudio mediante técnicas de tendencia central y dispersión para las variables cuantitativas y mediante frecuencias relativas y absolutas e intervalos de confianza (IC) del 95% para las variables cualitativas. Se aplicaron técnicas de contraste de hipótesis bivariantes paramétricas y no paramétricas, según la distribución de los datos para determinar el grado de asociación entre la IRC oculta y diversas variables clínicas y demográficas. La normalidad de las variables se determinó mediante el test de Shapiro-Wilks. Para la comparación de la prevalencia de los FRCV y las ECV, según la IRC estimada a partir de la fórmula MDRD, se utilizó la corrección de Bonferroni para comparaciones múltiples. Esta corrección se utilizó considerando que se analizaban 8 variables, de manera que se aceptaron como estadísticamente significativos los valores de p<0,006.
Se ajustó un modelo de regresión lineal mediante la utilización de la presencia o la ausencia de IRC como variable dependiente (0=no IRC/1=IRC) para estimar la odds ratio de presentar IRC, y se ajustó otro modelo al utilizar como variable dependiente el tipo de IRC (0=manifiesta/1=oculta) con el objetivo de determinar las variables asociadas a la IRC oculta. Ambos modelos de regresión se construyeron siguiendo un procedimiento por pasos sucesivos. El procesamiento y el análisis de los datos se realizaron mediante el programa estadístico SPSS versión 13.0 para Windows.
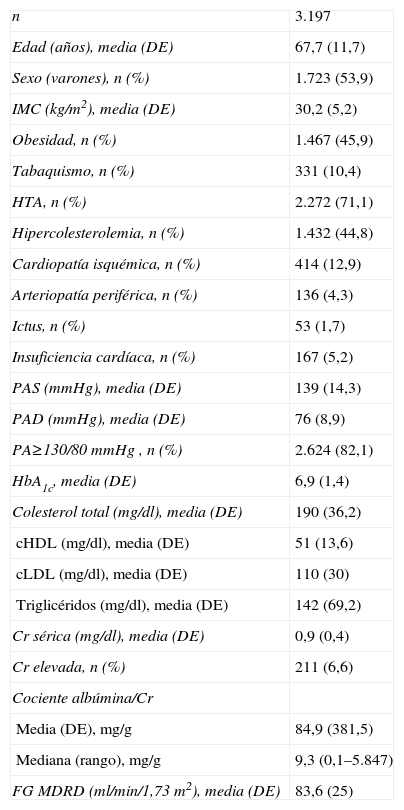
ResultadosCaracterísticas de la muestraSe incluyó a 3.197 pacientes con DM2 procedentes de las consultas de AP del ICS de la RSG que cumplieron los criterios de selección. La edad media (DE) fue de 67,7 años (11,7) y el 53,9% fueron varones. La media de Cr fue de 0,9 mg/dl (0,4) y la media del eFG fue de 83,6 ml/min/1,73m2 (25), según la fórmula MDRD. En la tabla 1 se presentan las características demográficas y clínicas de la muestra.
Descripción de las características clínicas de los participantes
| n | 3.197 |
| Edad (años), media (DE) | 67,7 (11,7) |
| Sexo (varones), n (%) | 1.723 (53,9) |
| IMC (kg/m2), media (DE) | 30,2 (5,2) |
| Obesidad, n (%) | 1.467 (45,9) |
| Tabaquismo, n (%) | 331 (10,4) |
| HTA, n (%) | 2.272 (71,1) |
| Hipercolesterolemia, n (%) | 1.432 (44,8) |
| Cardiopatía isquémica, n (%) | 414 (12,9) |
| Arteriopatía periférica, n (%) | 136 (4,3) |
| Ictus, n (%) | 53 (1,7) |
| Insuficiencia cardíaca, n (%) | 167 (5,2) |
| PAS (mmHg), media (DE) | 139 (14,3) |
| PAD (mmHg), media (DE) | 76 (8,9) |
| PA≥130/80mmHg , n (%) | 2.624 (82,1) |
| HbA1c, media (DE) | 6,9 (1,4) |
| Colesterol total (mg/dl), media (DE) | 190 (36,2) |
| cHDL (mg/dl), media (DE) | 51 (13,6) |
| cLDL (mg/dl), media (DE) | 110 (30) |
| Triglicéridos (mg/dl), media (DE) | 142 (69,2) |
| Cr sérica (mg/dl), media (DE) | 0,9 (0,4) |
| Cr elevada, n (%) | 211 (6,6) |
| Cociente albúmina/Cr | |
| Media (DE), mg/g | 84,9 (381,5) |
| Mediana (rango), mg/g | 9,3 (0,1–5.847) |
| FG MDRD (ml/min/1,73m2), media (DE) | 83,6 (25) |
cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; Cr: creatinina; DE: desviación estándar; FG: filtrado glomerular; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
De acuerdo con el tamaño muestral alcanzado, la precisión para estimar la prevalencia de IRC oculta, al asumir una proporción del 50% y un IC del 95%, fue del 1,73%.
El 6,6% de los sujetos presentó IRC con valores de Cr elevados (IC del 95%: 5,7–7,5). La prevalencia de IRC según los valores de la MDRD fue del 16,6% (IC del 95%: 15,3–17,9), y el 60,3% era IRC oculta. En la figura 1 se presentan las distintas prevalencias de IRC e IRC oculta estratificadas según la edad y el sexo de los participantes.
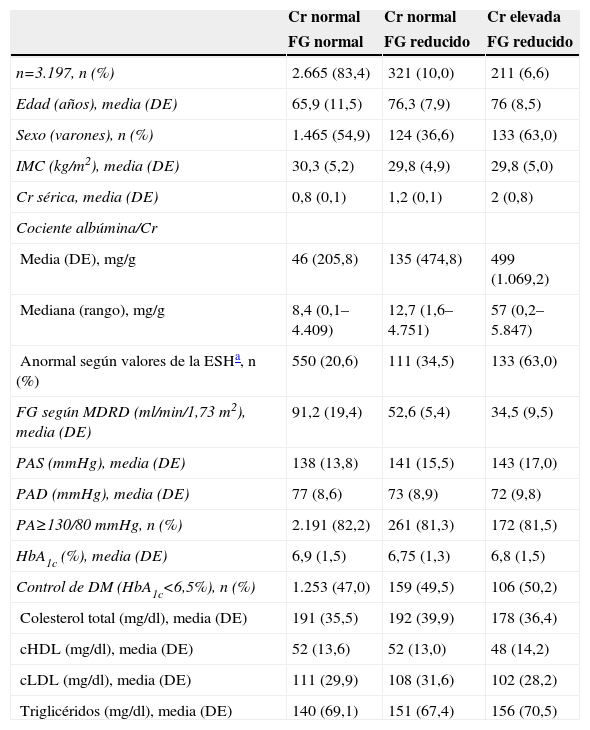
Características clínicas según la función renalEn la tabla 2 se presentan las características clínicas de los pacientes estratificadas según los 3 grupos creados a partir de los valores de Cr y del eFG.
Características de los participantes según los valores de creatinina plasmática y el filtrado glomerular estimado según la fórmula de Modification of Diet in Renal Disease
| Cr normal | Cr normal | Cr elevada | |
| FG normal | FG reducido | FG reducido | |
| n=3.197, n (%) | 2.665 (83,4) | 321 (10,0) | 211 (6,6) |
| Edad (años), media (DE) | 65,9 (11,5) | 76,3 (7,9) | 76 (8,5) |
| Sexo (varones), n (%) | 1.465 (54,9) | 124 (36,6) | 133 (63,0) |
| IMC (kg/m2), media (DE) | 30,3 (5,2) | 29,8 (4,9) | 29,8 (5,0) |
| Cr sérica, media (DE) | 0,8 (0,1) | 1,2 (0,1) | 2 (0,8) |
| Cociente albúmina/Cr | |||
| Media (DE), mg/g | 46 (205,8) | 135 (474,8) | 499 (1.069,2) |
| Mediana (rango), mg/g | 8,4 (0,1–4.409) | 12,7 (1,6–4.751) | 57 (0,2–5.847) |
| Anormal según valores de la ESHa, n (%) | 550 (20,6) | 111 (34,5) | 133 (63,0) |
| FG según MDRD (ml/min/1,73m2), media (DE) | 91,2 (19,4) | 52,6 (5,4) | 34,5 (9,5) |
| PAS (mmHg), media (DE) | 138 (13,8) | 141 (15,5) | 143 (17,0) |
| PAD (mmHg), media (DE) | 77 (8,6) | 73 (8,9) | 72 (9,8) |
| PA≥130/80mmHg, n (%) | 2.191 (82,2) | 261 (81,3) | 172 (81,5) |
| HbA1c (%), media (DE) | 6,9 (1,5) | 6,75 (1,3) | 6,8 (1,5) |
| Control de DM (HbA1c<6,5%), n (%) | 1.253 (47,0) | 159 (49,5) | 106 (50,2) |
| Colesterol total (mg/dl), media (DE) | 191 (35,5) | 192 (39,9) | 178 (36,4) |
| cHDL (mg/dl), media (DE) | 52 (13,6) | 52 (13,0) | 48 (14,2) |
| cLDL (mg/dl), media (DE) | 111 (29,9) | 108 (31,6) | 102 (28,2) |
| Triglicéridos (mg/dl), media (DE) | 140 (69,1) | 151 (67,4) | 156 (70,5) |
cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; Cr: creatinina; DE: desviación estándar; DM: diabetes mellitus; ESH: European Society of Hypertension; FG: filtrado glomerular; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
El grupo con Cr normal y eFG reducido, comparado con el grupo con Cr normal y eFG normal, presentó una edad más avanzada, mayor frecuencia de mujeres y valores de Cr y CAC más elevados. El grupo con Cr elevada y eFG reducido, comparado con el grupo sin IRC, presentó también una edad más avanzada, mayor frecuencia de varones, valores de Cr y CAC más elevados y cifras de PAS mayores. Se observó que la PAS aumentaba progresivamente a medida que empeoraba la función renal y que los pacientes con IRC oculta presentaron un valor intermedio entre los que presentaban función renal normal y los que presentaban una función renal alterada con valores de Cr elevados. No se observaron diferencias entre los distintos grupos en los valores de hemoglobina glucosilada y lípidos séricos.
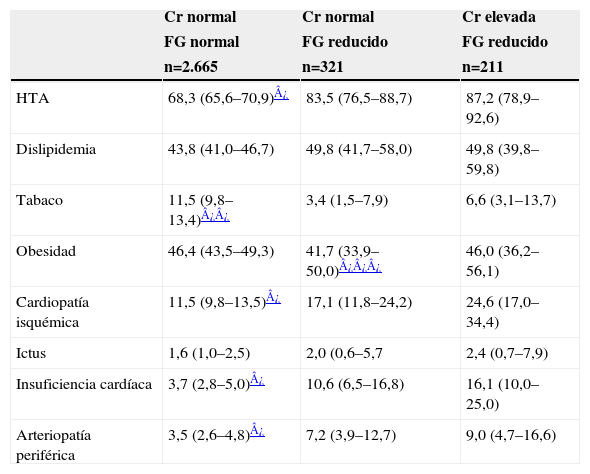
Factores de riesgo y enfermedad cardiovascular según la función renalEn la tabla 3 se presentan los indicadores de frecuencia de los FRCV y ECV estratificados según los grupos creados a partir de los valores de Cr y de la eFG.
Prevalencia de factores de riesgo y enfermedad cardiovascular, expresada en porcentaje (intervalo de confianza del 99,7%), según las categorías definidas por el valor de creatinina plasmática y el filtrado glomerular estimado según la fórmula Modification of Diet in Renal Disease
| Cr normal | Cr normal | Cr elevada | |
| FG normal | FG reducido | FG reducido | |
| n=2.665 | n=321 | n=211 | |
| HTA | 68,3 (65,6–70,9)¿ | 83,5 (76,5–88,7) | 87,2 (78,9–92,6) |
| Dislipidemia | 43,8 (41,0–46,7) | 49,8 (41,7–58,0) | 49,8 (39,8–59,8) |
| Tabaco | 11,5 (9,8–13,4)¿¿ | 3,4 (1,5–7,9) | 6,6 (3,1–13,7) |
| Obesidad | 46,4 (43,5–49,3) | 41,7 (33,9–50,0)¿¿¿ | 46,0 (36,2–56,1) |
| Cardiopatía isquémica | 11,5 (9,8–13,5)¿ | 17,1 (11,8–24,2) | 24,6 (17,0–34,4) |
| Ictus | 1,6 (1,0–2,5) | 2,0 (0,6–5,7 | 2,4 (0,7–7,9) |
| Insuficiencia cardíaca | 3,7 (2,8–5,0)¿ | 10,6 (6,5–16,8) | 16,1 (10,0–25,0) |
| Arteriopatía periférica | 3,5 (2,6–4,8)¿ | 7,2 (3,9–12,7) | 9,0 (4,7–16,6) |
Cr: creatinina; FG: filtrado glomerular; HTA: hipertensión arterial.
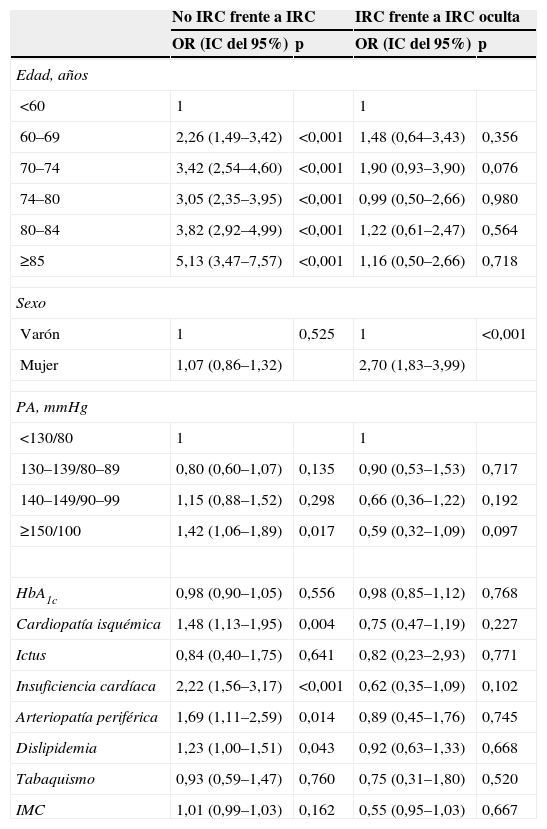
Las variables que se asociaron de forma significativa con la IRC fueron la edad, la presión arterial superior a 150/100mmHg, la dislipidemia y los antecedentes patológicos de cardiopatía isquémica, de insuficiencia cardíaca y de arteriopatía periférica (tabla 4). En relación con las variables asociadas a la IRC oculta frente a la IRC manifiesta, el sexo fue la única variable asociada a su presencia.
Modelos de regresión logística. Variables asociadas a la insuficiencia renal crónica y a la insuficiencia renal crónica oculta determinada con la fórmula Modification of Diet in Renal Disease de estimación del filtrado glomerular
| No IRC frente a IRC | IRC frente a IRC oculta | |||
| OR (IC del 95%) | p | OR (IC del 95%) | p | |
| Edad, años | ||||
| <60 | 1 | 1 | ||
| 60–69 | 2,26 (1,49–3,42) | <0,001 | 1,48 (0,64–3,43) | 0,356 |
| 70–74 | 3,42 (2,54–4,60) | <0,001 | 1,90 (0,93–3,90) | 0,076 |
| 74–80 | 3,05 (2,35–3,95) | <0,001 | 0,99 (0,50–2,66) | 0,980 |
| 80–84 | 3,82 (2,92–4,99) | <0,001 | 1,22 (0,61–2,47) | 0,564 |
| ≥85 | 5,13 (3,47–7,57) | <0,001 | 1,16 (0,50–2,66) | 0,718 |
| Sexo | ||||
| Varón | 1 | 0,525 | 1 | <0,001 |
| Mujer | 1,07 (0,86–1,32) | 2,70 (1,83–3,99) | ||
| PA, mmHg | ||||
| <130/80 | 1 | 1 | ||
| 130–139/80–89 | 0,80 (0,60–1,07) | 0,135 | 0,90 (0,53–1,53) | 0,717 |
| 140–149/90–99 | 1,15 (0,88–1,52) | 0,298 | 0,66 (0,36–1,22) | 0,192 |
| ≥150/100 | 1,42 (1,06–1,89) | 0,017 | 0,59 (0,32–1,09) | 0,097 |
| HbA1c | 0,98 (0,90–1,05) | 0,556 | 0,98 (0,85–1,12) | 0,768 |
| Cardiopatía isquémica | 1,48 (1,13–1,95) | 0,004 | 0,75 (0,47–1,19) | 0,227 |
| Ictus | 0,84 (0,40–1,75) | 0,641 | 0,82 (0,23–2,93) | 0,771 |
| Insuficiencia cardíaca | 2,22 (1,56–3,17) | <0,001 | 0,62 (0,35–1,09) | 0,102 |
| Arteriopatía periférica | 1,69 (1,11–2,59) | 0,014 | 0,89 (0,45–1,76) | 0,745 |
| Dislipidemia | 1,23 (1,00–1,51) | 0,043 | 0,92 (0,63–1,33) | 0,668 |
| Tabaquismo | 0,93 (0,59–1,47) | 0,760 | 0,75 (0,31–1,80) | 0,520 |
| IMC | 1,01 (0,99–1,03) | 0,162 | 0,55 (0,95–1,03) | 0,667 |
HbA1c: hemoglobina glucosilada; IC: intervalo de confianza; IMC: índice de masa corporal; IRC: insuficiencia renal crónica; OR: odds ratio; PA: presión arterial.
Los resultados de este estudio muestran una elevada prevalencia de IRC en los pacientes con DM2 atendidos en las consultas de AP. El 16,6%, según la fórmula derivada del MDRD, presentó un eFG inferior a 60ml/min/1,73m2. El 6,6% de los pacientes presentó IRC con valores de Cr elevados. La determinación del eFG permitió detectar la presencia de IRC oculta en el 10,0% del total de la muestra, según la MDRD (el 60,3% de los diabéticos con IRC). Estos pacientes no se habrían diagnosticado de no haber realizado el eFG.
La prevalencia de IRC en pacientes con DM2 en este trabajo fue del 16,6%, unos valores ligeramente inferiores a los obtenidos por Cea-Calvo et al22, que en una muestra poblacional de mayores de 60 años estimaron una prevalencia de IRC en pacientes diabéticos del 29,9%. Una posible explicación para la diferencia en la prevalencia entre ambos estudios puede ser la edad de los participantes, ya que en el trabajo de Cea-Calvo et al la media de edad de los participantes fue de 71 años, mientras que en nuestro trabajo fue de 67 años. Otros estudios internacionales han estimado una prevalencia de IRC en pacientes diabéticos que oscila entre el 21,923 y el 27,6%24.
La prevalencia de IRC oculta varía de acuerdo con el tipo de muestra. Nuestros resultados son inferiores a los mostrados por otro estudio, en el que el 31,3% de los pacientes con DM2 presentó IRC oculta25. Es posible que la diferencia de prevalencia se deba a la menor proporción de mujeres en nuestra muestra, ya que, como se ha detectado de forma reiterada, las mujeres tienen mayor prevalencia de IRC oculta que los varones26,27. La prevalencia de IRC oculta en otras ECV es similar a la obtenida en este trabajo. Así, Lahoz et al28 describieron una prevalencia de IRC oculta del 15,2% en pacientes con enfermedad coronaria estable y Llisterri et al29 estimaron una prevalencia de IRC oculta del 16,2% en una población de pacientes con dislipidemia.
La detección de la IRC oculta tiene importantes repercusiones clínicas. La disminución del eFG se ha asociado a un aumento de la mortalidad total, de los episodios cardiovasculares y de las hospitalizaciones, independientemente de la presencia de otros FRCV16–20. Incluso ligeros descensos del eFG se asocian a un incremento de la morbimortalidad por episodios ateroscleróticos16–20. El riesgo aumenta con un eFG inferior a 60ml/min/1,73m2 y se incrementa notablemente si el eFG es inferior a 45ml/min/1,73m25. En pacientes con enfermedad vascular previa o DM2 con algún FRCV añadido, la presencia de IRC ligera incrementa el riesgo de presentar ECV17. La presencia de IRC es un factor de riesgo independiente en todas las situaciones clínicas4,16–20. A pesar de que solo un porcentaje muy bajo de los pacientes con IRC progresarán a estadios en los que es necesario el tratamiento renal sustitutivo, la mayoría de los pacientes presentarán alguna ECV19. El conocimiento precoz de la IRC oculta puede orientar al clínico hacia un mejor control de los FRCV, intensificar el control de la glucemia, de la hipertensión arterial y de la dislipidemia, y a evitar la prescripción de fármacos que puedan afectar a la función renal. De forma consistente con otros estudios, los resultados de la regresión logística indican que las mujeres tienen un mayor riesgo de presentar IRC oculta26,27. Los motivos de esta mayor prevalencia pueden ser diversos: en primer lugar, las mujeres tienen menos masa muscular que los varones, por lo que, a igualdad de condiciones, presentan valores más bajos de Cr. En este sentido, para una misma edad, los varones necesitan valores de Cr superiores para presentar un eFG disminuido. Es posible que el factor de corrección en función del sexo introducido en las fórmulas para calcular el eFG sea insuficiente; en segundo lugar, también se debe considerar que las mujeres toman más diuréticos y antiinflamatorios que los varones, como se pudo observar en el estudio EROCAP27 y, como es conocido, estos fármacos alteran la función renal.
Los mecanismos por los que la presencia de IRC incrementa la morbimortalidad cardiovascular no son bien conocidos. Los diabéticos tienen una mayor prevalencia de FRCV que la población no diabética; además, se produce una serie de cambios a nivel vascular que favorecen la aterosclerosis. Entre los cambios que se producen, destaca la presencia de un estado proinflamatorio, prooxidante y protrombótico y la acumulación de sustancias que alteran la función endotelial, entre ellas, los productos avanzados de la glucosilación. Es probable que el daño vascular comience ya en estadios iniciales de la IRC.
Se deben considerar diversos aspectos relacionados con la validez de los resultados obtenidos. En términos de validez interna, es preciso destacar que se realizó una sola medición del eFG y no es posible distinguir entre los pacientes con una alteración transitoria del eFG de aquellos que presentan una alteración persistente. En este sentido, hubiera sido necesario realizar una nueva valoración del eFG a los 3 meses. En segundo lugar, el carácter transversal del estudio no nos ha permitido establecer la dirección de las asociaciones detectadas y realizar una valoración apropiada de las relaciones de causa-efecto. Una fortaleza del trabajo ha sido la medición de la Cr plasmática, que se llevó a cabo en todos los casos en el mismo laboratorio de referencia y garantizó la ausencia de pequeñas variaciones en la estimación del FG debido a problemas de calibración de los instrumentos. En términos de validez externa, la muestra estuvo formada por todos los pacientes con DM2 atendidos en las consultas de AP del ICS por facultativos con un adecuado cumplimiento de registro. Es posible que se haya producido algún sesgo de selección en la medida que desconocemos cómo habría afectado a los resultados la inclusión de los pacientes pertenecientes a facultativos con un bajo nivel de registro.
En conclusión, los resultados sobre una muestra de 3.197 pacientes con DM2 atendidos en las consultas de AP muestran una prevalencia de IRC oculta del 10,0% al calcular el eFG por la fórmula de MDRD. El cálculo del eFG mediante el uso de las fórmulas de eFG permite un diagnóstico precoz de la insuficiencia renal en los pacientes diabéticos que no se diagnosticarían con el uso exclusivo de la Cr en plasma y, por tanto, debe recomendarse su incorporación a la práctica clínica habitual. En futuros seguimientos de la cohorte se podrá evaluar si la identificación de la IRC oculta modificará el nivel de riesgo y los objetivos por alcanzar en el control de los factores de riesgo vascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.